广东省汕头市世贸实验学校2023-2024学年九年级下学期开学考试化学试题(含答案)
文档属性
| 名称 | 广东省汕头市世贸实验学校2023-2024学年九年级下学期开学考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 340.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 20:13:02 | ||
图片预览


文档简介
广东省汕头市世贸实验学校2023-2024学年九年级下学期开学考试化学试题
可能用到的相对原子质量:H1 C12 O16 S 32 Cu64 Ca 40
一、选择题:本大题共15小题,每小题4分,共60分,在每小题列出的四个选项中,只有一个是符合题目要求的。
1.下列自行车构件及配件所用的材料中,属于金属材料的是( )
A·塑料车筐 B.橡胶车胎 C.钢制车圈 D.棉布座套
2.制作出世界上第一张元素周期表的科学家是( )
A.拉瓦锡 B.门捷列夫 C.侯德榜 D.道尔顿
3.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符的是( )
A.1个铁离子Fe2+ B.2个氢原子2H C.3个硫酸根离子3SO4- D.高锰酸钾K2MnO4
4.储存硫的药品柜张贴的标识是( )
A易燃气体 B.易燃液体 C.腐蚀品 D. 易燃固体
5.广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、湖汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是( )
A.剪纸可剪成花果走兽,说明分子可以分为原子
B.冲泡工夫茶时茶秀四溢,体现了分子是运动的
C.铁棒可用于制造绣花针,证明金属具有延展性
D.染整时用于除去丝胶的纯碱水溶液固于混合物
碳元素是人类接触和利用最早的元素之一。由碳元素组成的单质有很多,部分结构如图,完成下面 6-9 小题。
金刚石 石墨 C60 石墨烯
6.关于碳单质的说法错误的是( )
A.石墨和金刚石由不同种原子构成 B.金刚石是天然存在的最硬的物质
C.石墨很软且有滑腻感 D.活性炭可用作冰箱除臭
7.关于C60的说法错误的是( )
A.C60分子很稳定 B.每个C60分子中含有60个碳原子
C.相对分子质量为60 D.可应用于超导、催化等领域
8.石墨烯是最薄、传导电子速度最快的材料,关于石墨烯的说法错误的是( )
A.完全燃烧的产物为CO2 B.常温下化学性质稳定
C.具有导电性 D.碳元素的化合价为+4
9.下列劳动项目所涉及的化学知识,不正确的是( )
选项 劳动项目 化学知识
A 湿衣服晾在太阳下干的快 加快分子运动速率
B 水壶底部有较多的水垢 水的硬度较大
C 油锅着火时用锅盖盖灭 降低油的着火点
D 铜丝常用作导线 铜有良好导电性
10.“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,“题10图”为镓在元素周期表中的信息及原子结构示意图。下列说法正确的是( )
A.属于金属元素,图中 x=18 B.镓原子的核内中子数为 31
C.你元素的相对原子质量为69.72g D.镓化学性质比较活泼,易形成阳离子Ga+2
11.我队空间站实现了水的循环使用,其原理如下图所示。装置X为电解水,装置Y为氢氧燃料电池。下列有关说法不正确的是( )
A.太阳能电池能将太阳能转化为电能 B.裝置Y的工作原理为2H2+O22H2O
C.装置X的正极反应时,可以产生氢气 D.装置X的正极和负极产生气体的体积之比为1:2
项目学习小组在学习了实验室制氧气之后,查阅了相关资料,利用塑料瓶、注射器、吸管等设计并制作简易供氧器(右图),其中药品A是过碳酸钠和二氧化锰的混合物(过碳酸钠遇水会生成H2O2),回答下面12-13题
12.生活用品可以代替一些化学仪器、本实验利用了塑料瓶、注射器、吸管等进行实验,在该实验中相关说法错误的是( )
A.塑料瓶相当于锥形瓶 B.吸管相当于导管
C. 注射器相当于长颈漏斗 D.该装置可控制反应速率
13.有关氧气性质的叙述错误的是( )
A.氧气是一种无色无味的气体 B.硫在氧气中燃烧,生成有刺激性气味的气体
C.红磷在空气中燃烧,产生大量白烟 D.水中的鱼虾能自由生活说明氧气易溶于水
14.将少量锌粒放入盛有过量稀硫酸的密闭容器中,容器内气体压强与时间关系如图。下列说法不正确的是( )
15.下列实验能达到实验目的的是( )
Λ.探究蜡烛燃烧是否有二氧化碳生成 B.验证质量守恒定律 C.探究燃烧需要温度达到着火点 D.测定空气中氧气的含量
二、非选择题:本大题共 4 小题,第 16~19 小题各 10分,共 40分。
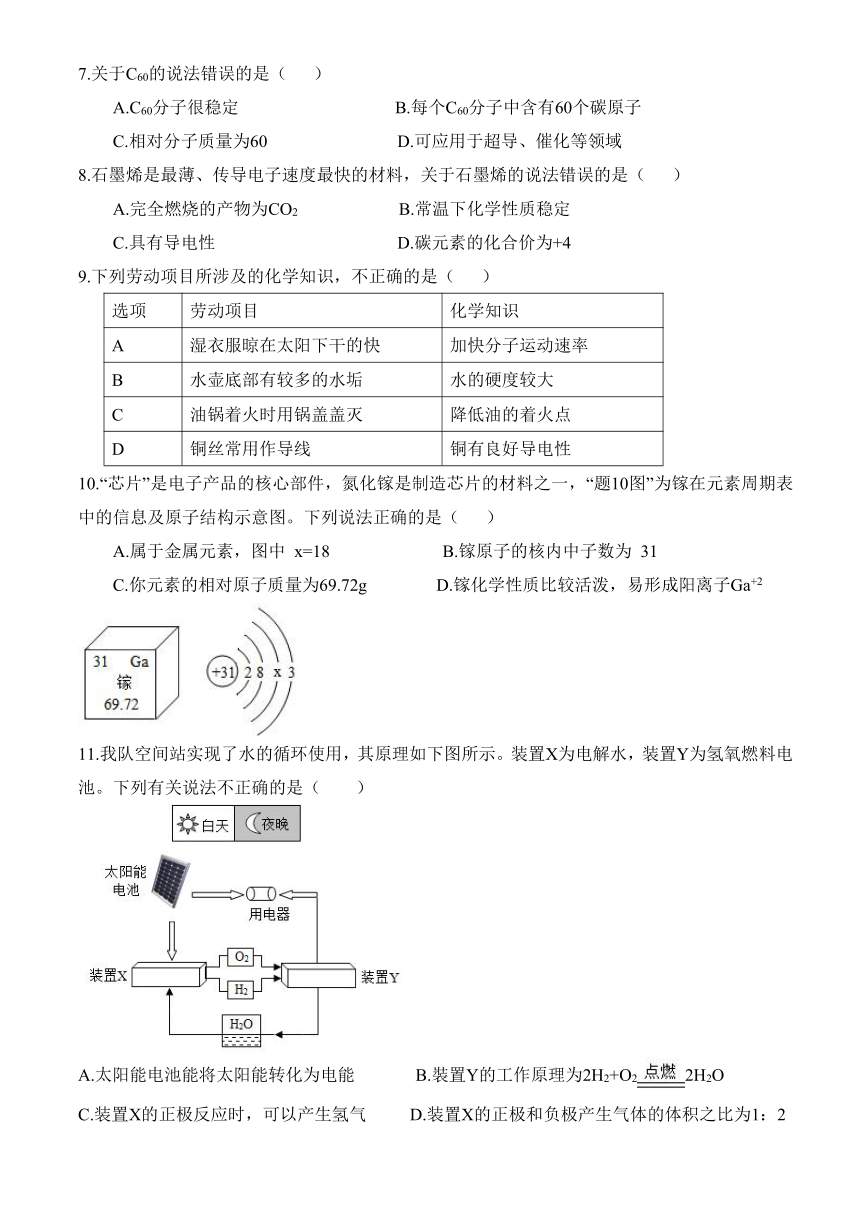
16.【基础实验与跨学科实践】实验室制取 O2和 CO2性质实验
A B
(1) ①仪器 a 的名称是_______
②氯酸钾制取O2,发生装置应选择图中的_______(填字母),化学方程式为___________,
B装置制取气体的优点是_________________________。
③CO2性质实验.
操作 现象 结论
蜡烛_____________________________ CO2具有________的性质(填字母)a.密度小于空气b.密度大于空气c.不支持燃烧,不能燃烧
为避免火焰同时熄灭。操作时,需将集气瓶紧挨烧杯,_______________________。
(2)空间站制O2
①补给制O2:中国空间站会将航天员的生活污水净化后,部分电解补给O2,此过程将电能转化成_______能.
②紧急制O2:国际空间站会携带烛状高氯酸锂(LiClO4)紧急产生O2.反应原理为:
LiClO4X+2O2,则X的化学式为____________________________。
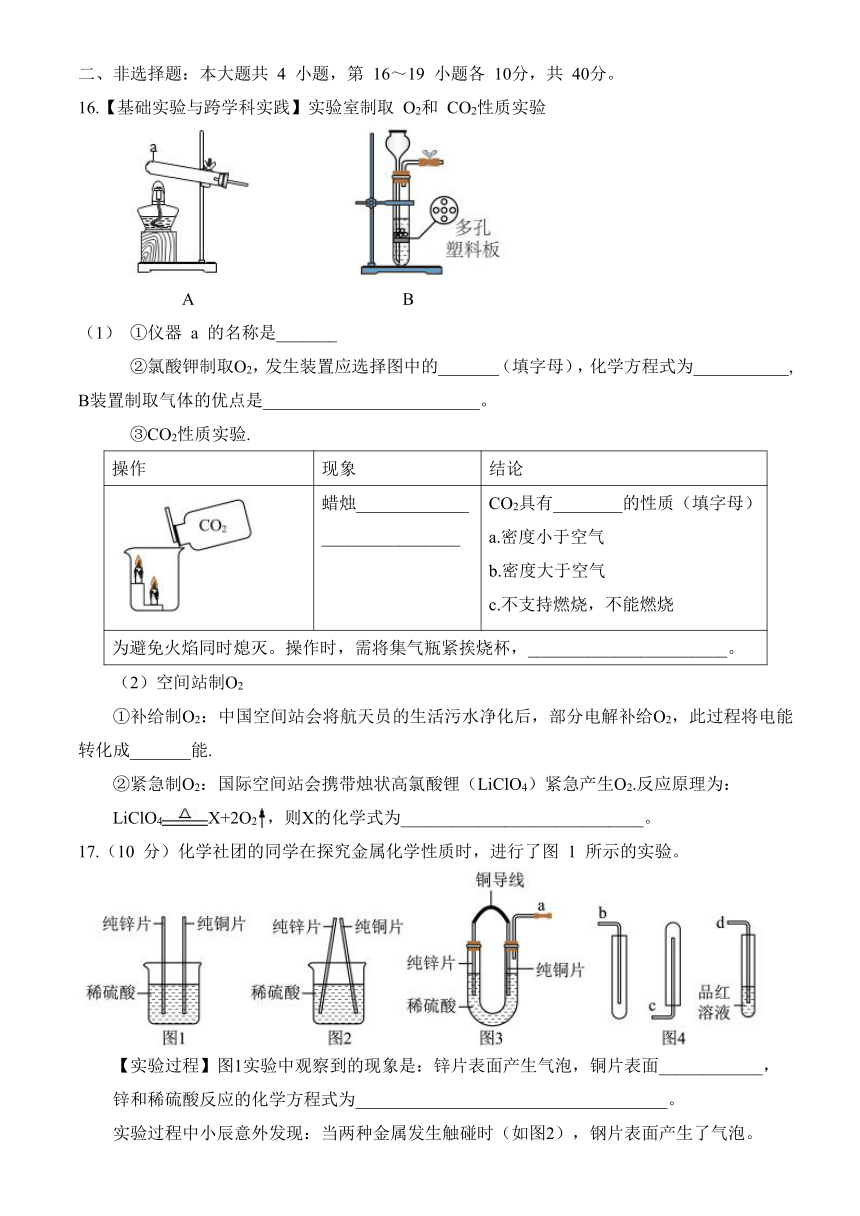
17.(10 分)化学社团的同学在探究金属化学性质时,进行了图 1 所示的实验。
【实验过程】图1实验中观察到的现象是:锌片表面产生气泡,铜片表面____________,
锌和稀硫酸反应的化学方程式为____________________________________。
实验过程中小辰意外发现:当两种金属发生触碰时(如图2),钢片表面产生了气泡。
【提出问题】图2中铜是否发生了化学反应?产生的气体是什么?
【作出猜想】同学们对产生的气体进行了以下猜想:
小知猜想是二氧化硫:小辰猜想是氧气:小彬猜想是氢气。
他们作出猜想的理论依据是_____________________。
【查阅资料】①将锌片、钢片用导线连接后平行插入稀硫酸中,钢片表面产生气体.该反应过程中金属失去的电子通过导线发生了转移。②二氧化硫能使品红溶液褪色。
【设计并进行实验】他们设计了图3装置进行实验,将产生的气体分别通过导管与图4中的装置连接,验证自己的猜想。
实验操作 实验现象 实验结论
小知 (1)连接导管a与导管d,向品红溶液中通入气体一段时间 _______________ 小彬的猜想正确
小辰 (2)选用正确方法收集气体一段时间后,向试管内伸入带火显的木条 _______________
小彬 (3)连接导管 a 与导管______(填序号),收集气体后用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火 气体燃烧,听到轻微的“喷”声
【教师释疑】图1实验中,锌与稀硫酸反应,锌失去电子,酸溶液中氢离子在锌片表面获得电子生成氢气
【学生感悟】图3实验中,酸溶液中的氢离子从铜片表面获得______(填“锌”或“铜”)失去的电子生成了氢气。
【得出结论】图2中两种金风触碰后铜______(填“有”或“没有”)发生化学反应。
【延伸应用】制造钢制船闸门时,为防止铁被腐蚀,常在钢闸门表面安装比铁更活泼的金属·这种金属可以是_____(填序号)。
A.锌 B.铜 C.银
18.(10分)我因古代就掌握炼铜技术,青铜是铜冶铸史上最早得到的合金
I.用孔雀石【主要成分Cu2(OH)2CO3】炼铜。高温煅烧孔雀石,可得黑色固体和两种非金属氧化物。部分含铜元素的物质类别及化合价转化关系如图所示。
(1)图中Cu2(OH)2CO3位于A点,黑色固体位于____(选填B、C 或D)点.
AB的反应属于_________(填基本反应类型).
(2)加入木炭,高温下可实现 BD 的转化,同时产生可使澄清石灰水变浑浊的气体。该过程体现了木炭具有_______性。反应的化学方程式为____________________________.
II.《大治赋》记载由磁化铜矿(主要成分Cu2S)制取CuSO4溶液,再用铁片浸取铜的方法。硫化铜矿中Cu2S转化的流程如下:
(3)硫化钢矿焙烧前要进行粉碎处理,这样做的目的是__________________
(4)Cu2S中Cu与S 的质量比为________________。写出“铁浸”过程中反应的化学方程式:
______________________________
(5)在冶炼中加入锡等金属可得到青铜,下列说法正确的是________。
A.青铜是金属材料 B.纯铜比青铜的硬度大 C.青铜比纯铜的熔点低
19.(10分)某化学兴趣小组为了探究块状和粉末状碳酸钙与足量稀盐酸反应的快慢,按如图1装置进行实验。倾斜锥形瓶,使10mL稀盐酸与固体充分接触,并利用数据传感器测得瓶内气压随时间变化的坐标曲线如图2所示。回答下列问题:
(1)推断图1中m的数值为___________,主要原因是___________
(2)由图2中的两条曲线,可得出的实验结论是_________________________________。
(3)2.5 g碳酸钙恰好完全反应时所产生二氧化碳气体的质量。(写出具体计算过程)
参考答案
一、选择题:本大题共15小题,每小题4分,共60分,在每小题列出的四个选项中,只有一个是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C B B D A A C D C A C C D B C
二、非选择题:本大题共 4 小题,第 16~19 小题各 10分,共 40分。
16. (1)①试管
②A ;2КClO3 2KCl+3O2;可以控制反应的发生与停止
③从低到高依次熄灭 ; bc; 将瓶中气体沿着烧杯壁缓慢倒入
(2)①化学
②LiCl
17. 【实验过程】:无明显现象 ; Zn+H2SO4=ZnSO4+H2
【作出猜想】:化学反应前后,元素种类不变(质量守恒定律)
【设计并进行实验】:(1)品红溶液无明显现象
(2)木条不复燃
(3)c
【学生感悟】:锌
【得出结论】:没有
【延伸应用】:A
18. I. (1)B ;分解反应
(2)还原; C+2CuO2Cu+CO2
II. (3) 增大接触面积,使反应更充分
(4)4:1;CuSO4+Fe FeSO4+Cu
(5)АС
19. (1)2.5; 控制质量的相等
(2)其他条件相同时,碳酸钙的颗粒越小,反应速率越快
(3)所产生二氧化碳气体的质量为x
CaCO3+2HCl CaCl2+H2O +CO2
100 44
2.5 x
=
x=1.1g
答:2.5 g碳酸钙恰好完全反应时所产生二氧化碳气体的质量为1.1g。
可能用到的相对原子质量:H1 C12 O16 S 32 Cu64 Ca 40
一、选择题:本大题共15小题,每小题4分,共60分,在每小题列出的四个选项中,只有一个是符合题目要求的。
1.下列自行车构件及配件所用的材料中,属于金属材料的是( )
A·塑料车筐 B.橡胶车胎 C.钢制车圈 D.棉布座套
2.制作出世界上第一张元素周期表的科学家是( )
A.拉瓦锡 B.门捷列夫 C.侯德榜 D.道尔顿
3.掌握化学用语是学好化学的关键。下列化学用语与所表述的意义相符的是( )
A.1个铁离子Fe2+ B.2个氢原子2H C.3个硫酸根离子3SO4- D.高锰酸钾K2MnO4
4.储存硫的药品柜张贴的标识是( )
A易燃气体 B.易燃液体 C.腐蚀品 D. 易燃固体
5.广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、湖汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是( )
A.剪纸可剪成花果走兽,说明分子可以分为原子
B.冲泡工夫茶时茶秀四溢,体现了分子是运动的
C.铁棒可用于制造绣花针,证明金属具有延展性
D.染整时用于除去丝胶的纯碱水溶液固于混合物
碳元素是人类接触和利用最早的元素之一。由碳元素组成的单质有很多,部分结构如图,完成下面 6-9 小题。
金刚石 石墨 C60 石墨烯
6.关于碳单质的说法错误的是( )
A.石墨和金刚石由不同种原子构成 B.金刚石是天然存在的最硬的物质
C.石墨很软且有滑腻感 D.活性炭可用作冰箱除臭
7.关于C60的说法错误的是( )
A.C60分子很稳定 B.每个C60分子中含有60个碳原子
C.相对分子质量为60 D.可应用于超导、催化等领域
8.石墨烯是最薄、传导电子速度最快的材料,关于石墨烯的说法错误的是( )
A.完全燃烧的产物为CO2 B.常温下化学性质稳定
C.具有导电性 D.碳元素的化合价为+4
9.下列劳动项目所涉及的化学知识,不正确的是( )
选项 劳动项目 化学知识
A 湿衣服晾在太阳下干的快 加快分子运动速率
B 水壶底部有较多的水垢 水的硬度较大
C 油锅着火时用锅盖盖灭 降低油的着火点
D 铜丝常用作导线 铜有良好导电性
10.“芯片”是电子产品的核心部件,氮化镓是制造芯片的材料之一,“题10图”为镓在元素周期表中的信息及原子结构示意图。下列说法正确的是( )
A.属于金属元素,图中 x=18 B.镓原子的核内中子数为 31
C.你元素的相对原子质量为69.72g D.镓化学性质比较活泼,易形成阳离子Ga+2
11.我队空间站实现了水的循环使用,其原理如下图所示。装置X为电解水,装置Y为氢氧燃料电池。下列有关说法不正确的是( )
A.太阳能电池能将太阳能转化为电能 B.裝置Y的工作原理为2H2+O22H2O
C.装置X的正极反应时,可以产生氢气 D.装置X的正极和负极产生气体的体积之比为1:2
项目学习小组在学习了实验室制氧气之后,查阅了相关资料,利用塑料瓶、注射器、吸管等设计并制作简易供氧器(右图),其中药品A是过碳酸钠和二氧化锰的混合物(过碳酸钠遇水会生成H2O2),回答下面12-13题
12.生活用品可以代替一些化学仪器、本实验利用了塑料瓶、注射器、吸管等进行实验,在该实验中相关说法错误的是( )
A.塑料瓶相当于锥形瓶 B.吸管相当于导管
C. 注射器相当于长颈漏斗 D.该装置可控制反应速率
13.有关氧气性质的叙述错误的是( )
A.氧气是一种无色无味的气体 B.硫在氧气中燃烧,生成有刺激性气味的气体
C.红磷在空气中燃烧,产生大量白烟 D.水中的鱼虾能自由生活说明氧气易溶于水
14.将少量锌粒放入盛有过量稀硫酸的密闭容器中,容器内气体压强与时间关系如图。下列说法不正确的是( )
15.下列实验能达到实验目的的是( )
Λ.探究蜡烛燃烧是否有二氧化碳生成 B.验证质量守恒定律 C.探究燃烧需要温度达到着火点 D.测定空气中氧气的含量
二、非选择题:本大题共 4 小题,第 16~19 小题各 10分,共 40分。
16.【基础实验与跨学科实践】实验室制取 O2和 CO2性质实验
A B
(1) ①仪器 a 的名称是_______
②氯酸钾制取O2,发生装置应选择图中的_______(填字母),化学方程式为___________,
B装置制取气体的优点是_________________________。
③CO2性质实验.
操作 现象 结论
蜡烛_____________________________ CO2具有________的性质(填字母)a.密度小于空气b.密度大于空气c.不支持燃烧,不能燃烧
为避免火焰同时熄灭。操作时,需将集气瓶紧挨烧杯,_______________________。
(2)空间站制O2
①补给制O2:中国空间站会将航天员的生活污水净化后,部分电解补给O2,此过程将电能转化成_______能.
②紧急制O2:国际空间站会携带烛状高氯酸锂(LiClO4)紧急产生O2.反应原理为:
LiClO4X+2O2,则X的化学式为____________________________。
17.(10 分)化学社团的同学在探究金属化学性质时,进行了图 1 所示的实验。
【实验过程】图1实验中观察到的现象是:锌片表面产生气泡,铜片表面____________,
锌和稀硫酸反应的化学方程式为____________________________________。
实验过程中小辰意外发现:当两种金属发生触碰时(如图2),钢片表面产生了气泡。
【提出问题】图2中铜是否发生了化学反应?产生的气体是什么?
【作出猜想】同学们对产生的气体进行了以下猜想:
小知猜想是二氧化硫:小辰猜想是氧气:小彬猜想是氢气。
他们作出猜想的理论依据是_____________________。
【查阅资料】①将锌片、钢片用导线连接后平行插入稀硫酸中,钢片表面产生气体.该反应过程中金属失去的电子通过导线发生了转移。②二氧化硫能使品红溶液褪色。
【设计并进行实验】他们设计了图3装置进行实验,将产生的气体分别通过导管与图4中的装置连接,验证自己的猜想。
实验操作 实验现象 实验结论
小知 (1)连接导管a与导管d,向品红溶液中通入气体一段时间 _______________ 小彬的猜想正确
小辰 (2)选用正确方法收集气体一段时间后,向试管内伸入带火显的木条 _______________
小彬 (3)连接导管 a 与导管______(填序号),收集气体后用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火 气体燃烧,听到轻微的“喷”声
【教师释疑】图1实验中,锌与稀硫酸反应,锌失去电子,酸溶液中氢离子在锌片表面获得电子生成氢气
【学生感悟】图3实验中,酸溶液中的氢离子从铜片表面获得______(填“锌”或“铜”)失去的电子生成了氢气。
【得出结论】图2中两种金风触碰后铜______(填“有”或“没有”)发生化学反应。
【延伸应用】制造钢制船闸门时,为防止铁被腐蚀,常在钢闸门表面安装比铁更活泼的金属·这种金属可以是_____(填序号)。
A.锌 B.铜 C.银
18.(10分)我因古代就掌握炼铜技术,青铜是铜冶铸史上最早得到的合金
I.用孔雀石【主要成分Cu2(OH)2CO3】炼铜。高温煅烧孔雀石,可得黑色固体和两种非金属氧化物。部分含铜元素的物质类别及化合价转化关系如图所示。
(1)图中Cu2(OH)2CO3位于A点,黑色固体位于____(选填B、C 或D)点.
AB的反应属于_________(填基本反应类型).
(2)加入木炭,高温下可实现 BD 的转化,同时产生可使澄清石灰水变浑浊的气体。该过程体现了木炭具有_______性。反应的化学方程式为____________________________.
II.《大治赋》记载由磁化铜矿(主要成分Cu2S)制取CuSO4溶液,再用铁片浸取铜的方法。硫化铜矿中Cu2S转化的流程如下:
(3)硫化钢矿焙烧前要进行粉碎处理,这样做的目的是__________________
(4)Cu2S中Cu与S 的质量比为________________。写出“铁浸”过程中反应的化学方程式:
______________________________
(5)在冶炼中加入锡等金属可得到青铜,下列说法正确的是________。
A.青铜是金属材料 B.纯铜比青铜的硬度大 C.青铜比纯铜的熔点低
19.(10分)某化学兴趣小组为了探究块状和粉末状碳酸钙与足量稀盐酸反应的快慢,按如图1装置进行实验。倾斜锥形瓶,使10mL稀盐酸与固体充分接触,并利用数据传感器测得瓶内气压随时间变化的坐标曲线如图2所示。回答下列问题:
(1)推断图1中m的数值为___________,主要原因是___________
(2)由图2中的两条曲线,可得出的实验结论是_________________________________。
(3)2.5 g碳酸钙恰好完全反应时所产生二氧化碳气体的质量。(写出具体计算过程)
参考答案
一、选择题:本大题共15小题,每小题4分,共60分,在每小题列出的四个选项中,只有一个是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C B B D A A C D C A C C D B C
二、非选择题:本大题共 4 小题,第 16~19 小题各 10分,共 40分。
16. (1)①试管
②A ;2КClO3 2KCl+3O2;可以控制反应的发生与停止
③从低到高依次熄灭 ; bc; 将瓶中气体沿着烧杯壁缓慢倒入
(2)①化学
②LiCl
17. 【实验过程】:无明显现象 ; Zn+H2SO4=ZnSO4+H2
【作出猜想】:化学反应前后,元素种类不变(质量守恒定律)
【设计并进行实验】:(1)品红溶液无明显现象
(2)木条不复燃
(3)c
【学生感悟】:锌
【得出结论】:没有
【延伸应用】:A
18. I. (1)B ;分解反应
(2)还原; C+2CuO2Cu+CO2
II. (3) 增大接触面积,使反应更充分
(4)4:1;CuSO4+Fe FeSO4+Cu
(5)АС
19. (1)2.5; 控制质量的相等
(2)其他条件相同时,碳酸钙的颗粒越小,反应速率越快
(3)所产生二氧化碳气体的质量为x
CaCO3+2HCl CaCl2+H2O +CO2
100 44
2.5 x
=
x=1.1g
答:2.5 g碳酸钙恰好完全反应时所产生二氧化碳气体的质量为1.1g。
同课章节目录
