5.2.1氮与氮的固定 一氧化氮和二氧化氮 课件 (共22张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.1氮与氮的固定 一氧化氮和二氧化氮 课件 (共22张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 23:33:11 | ||
图片预览




文档简介
(共22张PPT)
高中化学人教版必修第二册
第五章 第二节 第一课时
《氮与氮的固定 一氧化氮和二氧化氮》
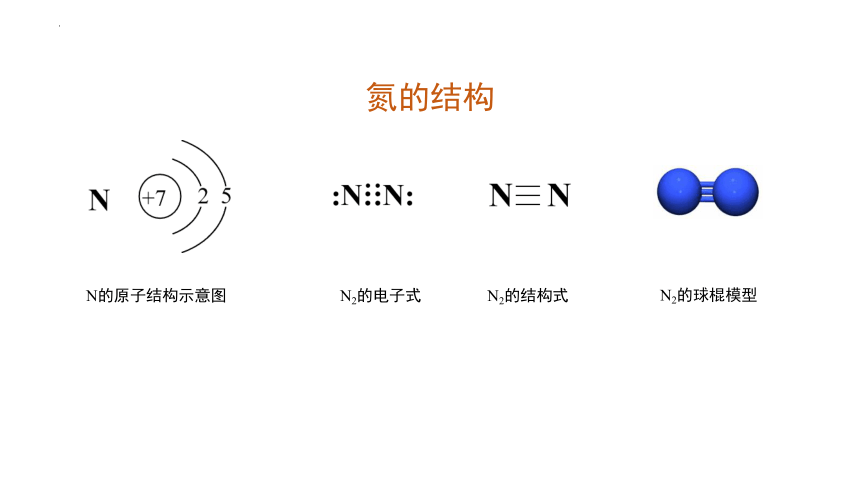
氮的结构
N的原子结构示意图
N2的电子式
N2的结构式
N2的球棍模型
N2
含“N”物质
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
在新疆与青海交界处有一山谷,经常电闪雷鸣,把人畜击毙。当地的农民把它称为“魔鬼谷”,可奇怪的是这里却牧草茂盛,四季常青。
人工固氮——工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
卡尔·博施
格哈德·埃特尔
改进了高压合成氨的催化方法,实现了合成氨的工业化生产,并在发展高压化学方面取得成就。因此获得1931年诺贝尔化学奖。
发现了哈伯-博施合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。因此获得2007年诺贝尔化学奖。
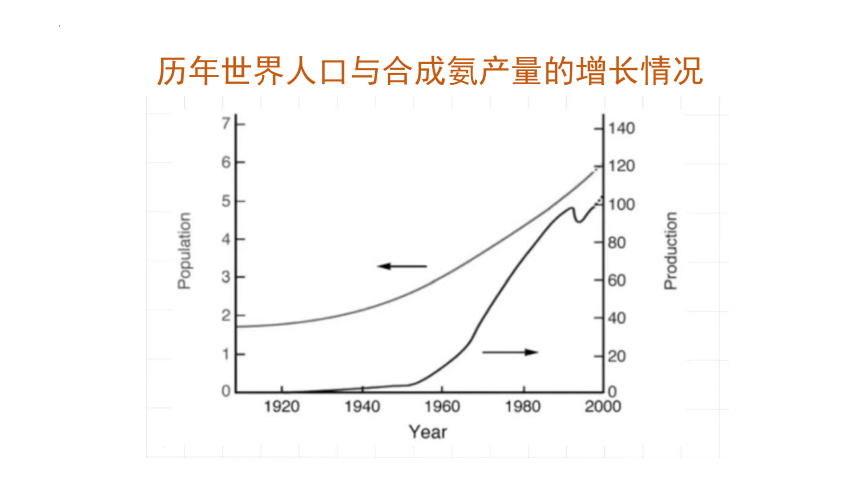
历年世界人口与合成氨产量的增长情况
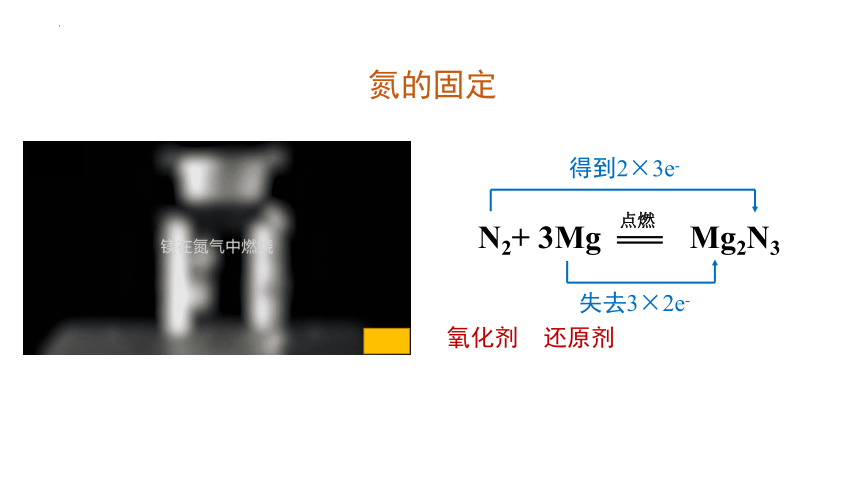
氮的固定
N2+ 3Mg Mg2N3
点燃
失去3×2e-
得到2×3e-
氧化剂
还原剂
一氧化氮和二氧化氮
N2O
NO
N2O3
NO2
N2O4
N2O5
N2
NH3
+l
+2
+3
+4
+4
+5
-3
0
不同价态的氮的化合物
(笑气)
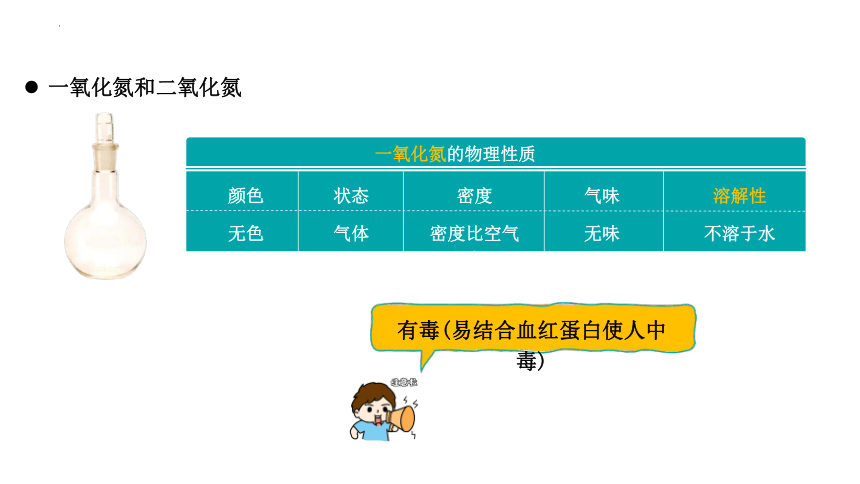
一氧化氮的物理性质
颜色
状态
密度
气味
溶解性
无色
气体
密度比空气大
一氧化氮和二氧化氮
无味
不溶于水
有毒(易结合血红蛋白使人中毒)
一氧化氮和二氧化氮
二氧化氮的物理性质
颜色
状态
密度
气味
溶解性
红棕色
气体
密度比空气大
刺激性气味
易溶于水
有毒(刺激腐蚀呼吸道黏膜)
N2+ O2 2NO
放电或高温
NO使人中毒原理与CO相似,被人体吸收后与血红蛋白结合,使血红蛋白失去携带氧的能力导致中毒。燃油汽车发动机中会进行该反应,产生的NO是汽车尾气中的一种污染气体。
信使分子——NO
1998年的诺贝尔生理学和医学奖颁给了发现“NO是心血管系统的信号分子”的三位美国科学家。
心脏急救药硝酸甘油的主要作用就是通过释放NO,可使血管平滑肌松弛,周围血管舒张,外周阻力减小,回心血量减少等,从而使心绞痛得到缓解。
世上没有绝对有害的物质
三、NO和NO2的性质
NO不溶于水,且不与水反应。
【实验5-5】P13
三、NO和NO2的性质
2NO + O2 = 2NO2
【实验5-5】P13
得到2×2e-
失去2×2e-
还原剂
氧化剂
三、NO和NO2的性质
NO2 + H2O = HNO3 + NO
【实验5-5】P13
得到 2e-
失去 e-
NO2既是氧化剂,又是还原剂。
+4 +5 +2
2×
2
1×
1
3
思考与讨论P13
如果要将注射器中的NO充分转化,可以采取什么措施?
可以用注射器不断吸入空气,然后使注射器里的气体充分与水反应。
这对工业生产硝酸有什么启示?
工业生产硝酸
×2
+)
4NO2 + O2 + 2H2O 4HNO3
可知:NO2与O2以4:1的体积比(物质的量比)混合,与足量的水反应就可以使NO2完全转变成硝酸。
工业生产硝酸
×3
+)
4NO + 3O2 + 2H2O 4HNO3
可知:NO与O2以4:3的体积比(物质的量比)混合,与足量的水反应就可以使NO完全转变成硝酸。
×2
现在你可以解释“魔鬼谷”草木茂盛的原因吗?
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收 。
2NO + O2 = 2NO2
3NO2 + H2O =2HNO3 + NO
N2+ O2 2NO
放电或高温
光化学烟雾
光化学烟雾
NO和NO2的化学性质小结
物质 NO NO2
是否与O2反应
——
是否与水反应
——
是否为酸性氧化物
否
否
是否具有氧化性、还原性
还原性
氧化性+还原性
两者之间可以相互转化
例.下列反应必须加入氧化剂且一步反应就能完成的是( )
①N2→NO2 ②NO2→NO ③NO2→HNO3
④N2→NO ⑤N2→NH3
A.① B.②⑤ C.④ D.③④
C
×
√
×
×
×
高中化学人教版必修第二册
第五章 第二节 第一课时
《氮与氮的固定 一氧化氮和二氧化氮》
氮的结构
N的原子结构示意图
N2的电子式
N2的结构式
N2的球棍模型
N2
含“N”物质
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
在新疆与青海交界处有一山谷,经常电闪雷鸣,把人畜击毙。当地的农民把它称为“魔鬼谷”,可奇怪的是这里却牧草茂盛,四季常青。
人工固氮——工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
卡尔·博施
格哈德·埃特尔
改进了高压合成氨的催化方法,实现了合成氨的工业化生产,并在发展高压化学方面取得成就。因此获得1931年诺贝尔化学奖。
发现了哈伯-博施合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。因此获得2007年诺贝尔化学奖。
历年世界人口与合成氨产量的增长情况
氮的固定
N2+ 3Mg Mg2N3
点燃
失去3×2e-
得到2×3e-
氧化剂
还原剂
一氧化氮和二氧化氮
N2O
NO
N2O3
NO2
N2O4
N2O5
N2
NH3
+l
+2
+3
+4
+4
+5
-3
0
不同价态的氮的化合物
(笑气)
一氧化氮的物理性质
颜色
状态
密度
气味
溶解性
无色
气体
密度比空气大
一氧化氮和二氧化氮
无味
不溶于水
有毒(易结合血红蛋白使人中毒)
一氧化氮和二氧化氮
二氧化氮的物理性质
颜色
状态
密度
气味
溶解性
红棕色
气体
密度比空气大
刺激性气味
易溶于水
有毒(刺激腐蚀呼吸道黏膜)
N2+ O2 2NO
放电或高温
NO使人中毒原理与CO相似,被人体吸收后与血红蛋白结合,使血红蛋白失去携带氧的能力导致中毒。燃油汽车发动机中会进行该反应,产生的NO是汽车尾气中的一种污染气体。
信使分子——NO
1998年的诺贝尔生理学和医学奖颁给了发现“NO是心血管系统的信号分子”的三位美国科学家。
心脏急救药硝酸甘油的主要作用就是通过释放NO,可使血管平滑肌松弛,周围血管舒张,外周阻力减小,回心血量减少等,从而使心绞痛得到缓解。
世上没有绝对有害的物质
三、NO和NO2的性质
NO不溶于水,且不与水反应。
【实验5-5】P13
三、NO和NO2的性质
2NO + O2 = 2NO2
【实验5-5】P13
得到2×2e-
失去2×2e-
还原剂
氧化剂
三、NO和NO2的性质
NO2 + H2O = HNO3 + NO
【实验5-5】P13
得到 2e-
失去 e-
NO2既是氧化剂,又是还原剂。
+4 +5 +2
2×
2
1×
1
3
思考与讨论P13
如果要将注射器中的NO充分转化,可以采取什么措施?
可以用注射器不断吸入空气,然后使注射器里的气体充分与水反应。
这对工业生产硝酸有什么启示?
工业生产硝酸
×2
+)
4NO2 + O2 + 2H2O 4HNO3
可知:NO2与O2以4:1的体积比(物质的量比)混合,与足量的水反应就可以使NO2完全转变成硝酸。
工业生产硝酸
×3
+)
4NO + 3O2 + 2H2O 4HNO3
可知:NO与O2以4:3的体积比(物质的量比)混合,与足量的水反应就可以使NO完全转变成硝酸。
×2
现在你可以解释“魔鬼谷”草木茂盛的原因吗?
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收 。
2NO + O2 = 2NO2
3NO2 + H2O =2HNO3 + NO
N2+ O2 2NO
放电或高温
光化学烟雾
光化学烟雾
NO和NO2的化学性质小结
物质 NO NO2
是否与O2反应
——
是否与水反应
——
是否为酸性氧化物
否
否
是否具有氧化性、还原性
还原性
氧化性+还原性
两者之间可以相互转化
例.下列反应必须加入氧化剂且一步反应就能完成的是( )
①N2→NO2 ②NO2→NO ③NO2→HNO3
④N2→NO ⑤N2→NH3
A.① B.②⑤ C.④ D.③④
C
×
√
×
×
×
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
