湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷试卷(含答案)
文档属性
| 名称 | 湖北省武汉市第二中学2023-2024学年高一下学期化学周练A卷试卷(含答案) |  | |
| 格式 | |||
| 文件大小 | 391.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 08:29:23 | ||
图片预览



文档简介
武汉二中 2026 届高一下化学周练(一)A 卷
试卷满分:100分
考试时间:2024年 3月 9日下午 14:15-15:45
可能用到的相对原子质量:O-16 N-14 C-12 S-32 Na-23 Ca-40 Mg-24 Al-27
Cl-35.5 Fe-56 Cu-64
一、选择题(每小题只有 1 个正确答案,共 48 分)
1.2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域
都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )
A.中国自主研发的首个5G微基站射频芯片的主要材料是Si
B.高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料
C.国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料
D.歼 20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料
2.实验室中下列做法正确的是( )
A.氢氟酸保存在棕色玻璃试剂瓶中 B.用剩的白磷放回盛有水的广口瓶中
C.烧碱溶液保存在玻璃塞试剂瓶中 D.浓硝酸保存在带橡胶塞的棕色细口瓶中
3.下列说法中正确的有( )
①碳化硅的硬度高,可用作砂纸和砂轮的磨料
②二氧化硫具有抗氧化性,可用作葡萄酒的食品添加剂
③液氨汽化时吸热,可用作制冷剂
④富勒烯、碳纳米管、石墨烯等碳纳米材料都属于新型无机非金属材料
⑤单质硫易溶于CS2,实验室可用CS2清洗沾有硫单质的试管
⑥ pH在5.6 ~ 7.0之间的降水通常称为酸雨;
⑦二氧化硅与氢氧化钠溶液、氢氟酸均反应,属两性氧化物
⑧陶瓷、普通玻璃、水泥、金刚砂(SiC)都属于硅酸盐材料
⑨加入Ba NO 2 3 溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO4 存在2
⑩SO2 通入紫色石蕊试液,溶液先变红后褪色
A.2个 B.3个 C.4个 D.5个
4. NA为阿伏加德罗常数的值。下列说法正确的是( )
A.50mL、18.4mol / L浓硫酸与足量铜加热反应,生成SO2 分子的数目为0.46NA
B.0.2molCu和0.2molS充分反应转移电子数为0.2NA
C.常温下,将 2.7g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA
D.标准状况下, 22.4LSO2 与足量O2的反应,生成的SO3分子数为 NA
5.下列离子方程式正确的是( )
A.少量SO 通入Ca ClO 溶液:Ca2 2 2 ClO
SO2 H2O CaSO4 Cl
2H
B.Fel2 溶于过量的硝酸溶液中:Fe
2 4H NO Fe3 3 NO 2H2O
△
C.用热NaOH溶液洗涤试管内壁的硫黄:3S 6OH SO2 2 3 2S 3H2O
D.向Na2S溶液通入足量SO :S
2
2 2SO2 2H2O H2S 2HSO
3
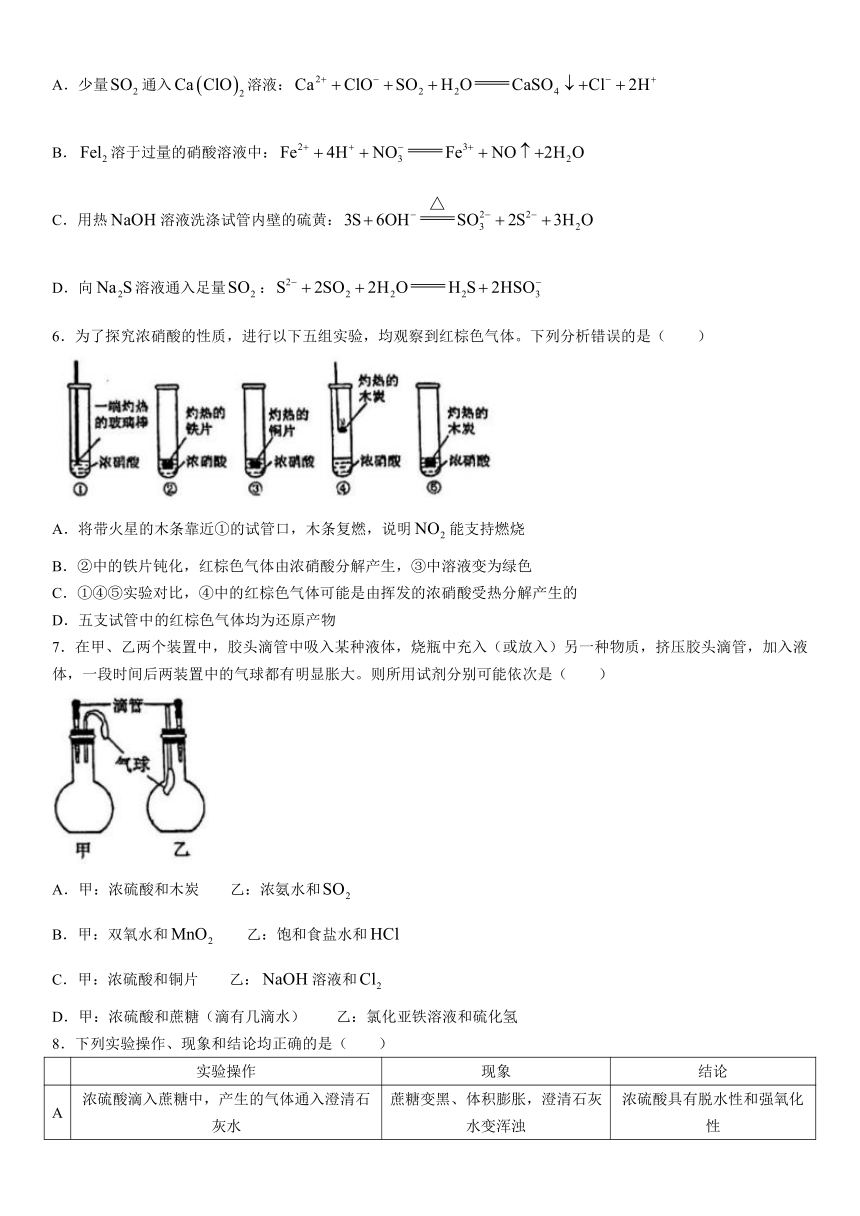
6.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明NO2 能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
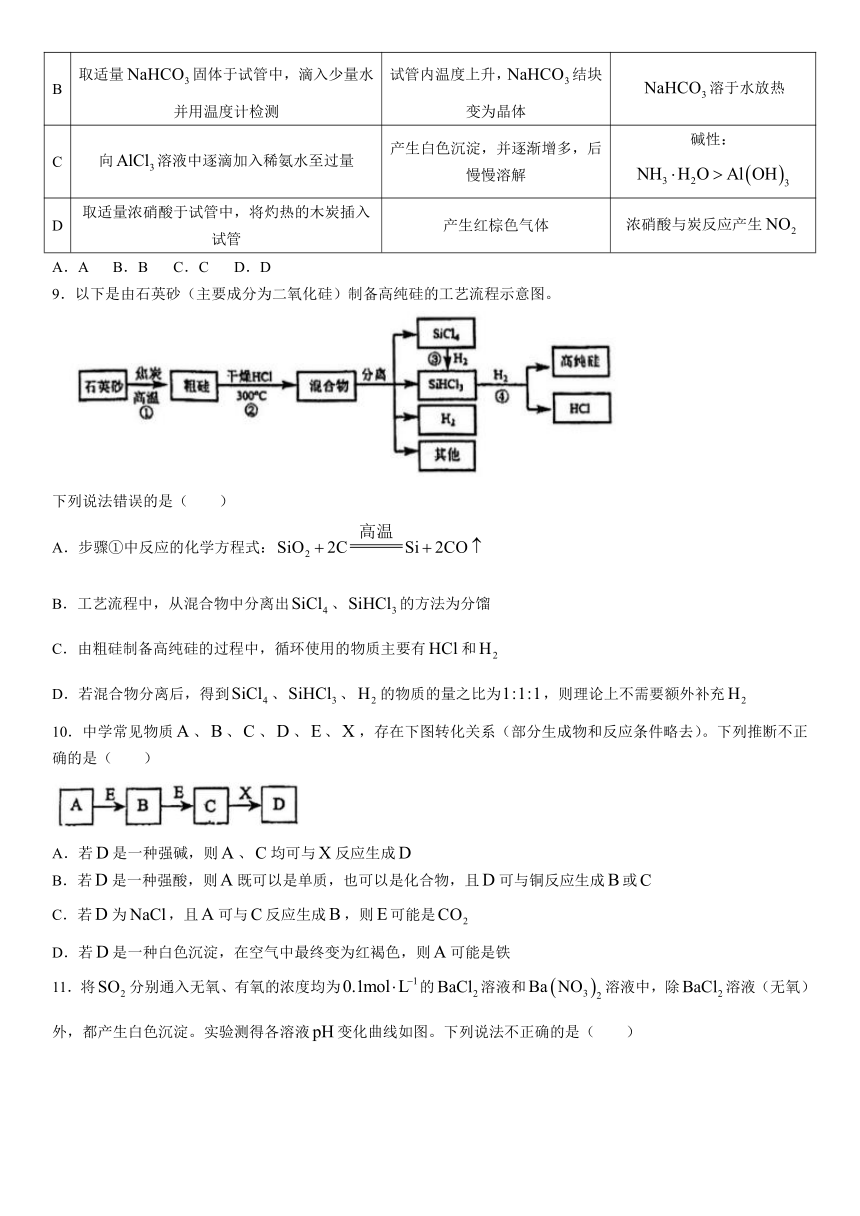
7.在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液
体,一段时间后两装置中的气球都有明显胀大。则所用试剂分别可能依次是( )
A.甲:浓硫酸和木炭 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:饱和食盐水和HCl
C.甲:浓硫酸和铜片 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢
8.下列实验操作、现象和结论均正确的是( )
实验操作 现象 结论
浓硫酸滴入蔗糖中,产生的气体通入澄清石 蔗糖变黑、体积膨胀,澄清石灰 浓硫酸具有脱水性和强氧化
A
灰水 水变浑浊 性
取适量NaHCO3固体于试管中,滴入少量水 试管内温度上升,NaHCO3结块B NaHCO3溶于水放热
并用温度计检测 变为晶体
碱性:
产生白色沉淀,并逐渐增多,后
C 向AlCl3溶液中逐滴加入稀氨水至过量
慢慢溶解 NH3 H2O Al OH 3
取适量浓硝酸于试管中,将灼热的木炭插入
D 产生红棕色气体 浓硝酸与炭反应产生NO2
试管
A.A B.B C.C D.D
9.以下是由石英砂(主要成分为二氧化硅)制备高纯硅的工艺流程示意图。
下列说法错误的是( )
高温
A.步骤①中反应的化学方程式:SiO2 2C Si 2CO
B.工艺流程中,从混合物中分离出SiCl4 、SiHCl3的方法为分馏
C.由粗硅制备高纯硅的过程中,循环使用的物质主要有HCl和H2
D.若混合物分离后,得到SiCl4 、SiHCl3、H2 的物质的量之比为1:1:1,则理论上不需要额外补充H2
10.中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正
确的是( )
A.若D是一种强碱,则A、C均可与X反应生成D
B.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
11 SO 0.1mol L 1.将 2 分别通入无氧、有氧的浓度均为 的BaCl2溶液和Ba NO3 溶液中,除2 BaCl2溶液(无氧)
外,都产生白色沉淀。实验测得各溶液 pH变化曲线如图。下列说法不正确的是( )
A.曲线 a所示溶液 pH降低的原因:SO2 H2O H2SO3 H
HSO 3
B 1.依据曲线 b可推知0.2mol L KNO3溶液(无氧)能氧化SO2
C.曲线 c所示溶液中发生反应的离子方程式为: 2Ba2 2SO2 O2 2H2O 2BaSO
4 4H
D .曲线d所表示的过程中NO3 是氧化SO2 的主要微粒
12.已知R 、W、X、Y、Z均为短周期主族元素,其中K元素所在的周期数是其族序数的一半,且对应的两
种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质形成的合金可用作原子
反应堆导热剂,Y元素原子最外层电子数为m ,次外层电子数为 n ,Z元素原子L层电子数为m n,M层电子
数为m n,下列叙述中错误的是( )
A.R 、X、Y对应的简单离子半径: r X r Y r R
B.相同温度下,同浓度的R 、W、Z的最高价含氧酸的酸性:R W Z
C.将WY2 与RY2分别通入Ba NO3 2 溶液中,现象不同
D.Y的简单氢化物的熔、沸点比R 的简单氢化物的熔、沸点低
13 . 硫 酸 亚 铁 在 高 温 条 件 下 分 解 可 生 成 Fe2O3 、 SO3 、 SO2 , 反 应 方 程 式 为 :
高温
2FeSO4 Fe2O3 SO2 SO3 ,为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置 a中,打
开 K1和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )
A.反应管中残留固体红色粉末是Fe3O4
B.装置 b中的试剂为Ba NO3 溶液,反应后有白色沉淀生成2
C.装置 c中的试剂为酸性KMnO4 溶液,作用是除去混合气体中的SO2
D.分解的气体产物中有SO3、SO2 ,应该先检验SO3
14.沸石分子筛选择性催化还原NO的循环过程如图所示。下列说法正确的是( )
A.反应过程中催化剂Cu 未参与电子得失
B.步骤一中O2与H2O的物质的量之比为 2 :1
C.每生成1molN2理论上消耗0.25molO2
D.所有步骤均有氧化还原反应发生
15.38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和
NaNO2的混合溶液,反应过程及有关数据如图所示
下列有关判断不正确的是( )
A.硝酸在反应中既体现氧化性又体现酸性
B.氮的氧化物和NaOH溶液反应时,NO作还原剂
C.混合气体中N2O4的物质的量是0.1mol,生成NaNO30.6mol
D.若浓硝酸体积为 200mL,则其物质的量浓度为11mol / L
16 .某稀溶液中含有 4molKNO3和 2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3 被还原为NO),
最终溶液体积为1L。下列说法正确的是( )
A.所得溶液中 c NO 3 2.75mol L 1
B.所得溶液中 c Fe2 : c Fe3 1: 2
C.反应后生成NO的体积为33.6L(标准状况)
D.所得溶液中的溶质只有FeSO4
二、非选择题(本部分共含 5 大题,共 52 分)
17.(10分)
硫元素是动植物生长不可缺少的元素,图 1是自然界中硫元素的存在示意图。图 2是硫元素的常见化合价与部分物
质类别的对应关系,回答下列问题。
(1)图 1中与图 2中M、N对应的物质分别是______、______。
(2)Na2SO3 溶液易变质,实验室检验Na2SO3 溶液是否变质的基本操作是______。
( 3 ) 已 知 Na2SO3 能 被 酸 性 K2Cr2O7 氧 化 为 Na2SO4 , 则 24mL0.05mol L
1
的 Na2SO3 溶 液 与
20mL0.02mol L 1的K2Cr2O7溶液恰好反应时,发生的离子方程式为:______。
(4)过二硫酸钠(Na2S2O3)有强氧化性,在碱性条件下Na2S2O I
IO 8溶液能将 氧化成 3 ,且反应后的溶液滴入
BaCl2溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为______________________________。
(5)雌黄(As2S3)和雄黄(As4S4)在自然界中共生且可以相互转化(两者的硫元素价态均为 2价)。
①As2S3和SnCl2在盐酸中恰好完全反应转化为As4S4和SnCl4并放出H2S气体。则参加反应的As2S3和SnCl2的
物质的量之比为______。
②As2S3和As4S4可以相互转化,转化过程中存在如图所示的步骤。若1molAsS4 参加反应时,转移 28mol电子,
则物质 a为______。
18.(10分)
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,写出实验室制备C的化学反应方程式:
________________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气
的主要成分,写出反应③的化学方程式:______________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。写出
反应④的离子方程式:______________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱
性。写出②反应的化学方程式:__________________________________________。D的化学式是______。
19.(12分)
某研究性学习小组学生根据氧化还原反应规律,探究NO2 、NO与Na 2O2 反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析Na 2O2 和NO2 都既有氧化性又有还原性,于是提出如下假设:
假设 1:Na 2O2 氧化NO2 ;假设 2:NO2 氧化Na 2O2 。
(1)甲同学设计如图装置进行实验:
①试管A中反应的离子方程式是______________________________。
②待试管B中充满红棕色气体,关闭旋塞 a和 b;取下试管B,向其中加入适量Na 2O2 粉末,塞上塞子,轻轻振
荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
结论:甲同学认为假设 2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带
火星的木条未复燃,得出结论:假设Ⅰ正确。则NO2 和Na 2O2 反应的化学方程式是__________________。
Ⅱ.该研究性学习小组同学还认为 NO 易与 O2 发生反应,应该更易被 Na 2O2 氧化。查阅资料:
2NO Na2O2 2NaNO2 ; 2NaNO2 2HCl 2NaCl NO2 NO H2O;酸性条件下,NO能与
MnO NO Mn2 4 反应生成 3 和 。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na 2O2 的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是________________________。
②B中观察到的主要现象的是______(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________,则产物是NaNO2。
20.(10分)
为消除燃煤烟气中含有的SO2 、NOx ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2 气体转化为CaSO4的化学方程式是______。
(2)选择性催化还原法(SCR )“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3
还原NO的化学方程式是______________________________。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的 pH 5.5,将烟气中的SO2 、NO转化
为SO2 4 、NO3 。
①NaClO溶液吸收烟气中SO2 的离子方程式是______________________________。
②一定时间内,温度对硫、硝脱除率的影响曲线如图, SO2 的脱除率高于 NO ,可能的原因是
______________________________________________________________________________(1种即可)
③烟气中SO2 和NO的体积比为 4 :1,50℃
时的脱除率见图,则此吸收液中烟气转化生成的NO3 和Cl 的物质的
量之比为____________。
21.(10分)
(1)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6molHNO3
溶液恰好使混合物完全溶解,同时收集到 224mLNO气体(标况)。则产物中硝酸铜的物质的量为______。如原混
合物中有0.01molCu,则其中Cu2O与CuO的质量之比为______。
(2)将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO
气体 560mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 m2g,则
m1 m2 为______。
(3)将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的
体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。
编号 ① ② ③ ④
硝酸体积 /mL 100 200 300 400
剩余金属 /g 18.6 9.6 0 0
NO体积 /L 2.24 4.48 6.72 V
①稀硝酸的物质的量的浓度为______mol / L。
②V ______。
武汉二中 2026 届高一下化学周练(一)A 卷
参考答案
一、选择题(每小题只有 1 个正确答案,共 48 分)
题号 1 2 3 4 5 6 7 8
答案 D B D B C B B A
题号 9 10 11 12 13 14 15 16
答案 D D D D D C C A
二、非选择题(本部分共含 5 大题,共 52 分)
17、(共 11分)
(1)CaSO4 2H2O、Na 2SO4 10H2O(2分) CuFeS2
(2)取少量溶液于试管中,向其中加入过量稀盐酸,再滴加BaCl2溶液,如果产生白色沉淀,证明混有Na2SO4(2
分)
(3)3SO2 3 8H Cr O
2 3SO2 4H O 2Cr3 2 7 4 2 (2分)
(4)3S2O
2 I 6OH 6SO2 IO 8 4 3 3H2O(2分)
(5)1:1 SO2
18、(共 10分)
(1)Na2SO3 H2SO4 浓 Na2SO4 SO2 H2O
催化剂
(2) 4NH3 5O2 4NO 6H2O
(3) Al OH CO
4 2
HCO3 Al OH 3
(4)Si 2NaOH H2O Na2SiO3 2H2 Na 2CO3
19、(共 11分)
(1)Cu 4H 2NO Cu2 3 2NO2 2H2O
(2)除去NO2 中混有的水蒸气(2分) Na2O2 2NO2 2NaNO3(2分)
(3)将装置中的空气排出 ac(2分) a 加入稀盐酸,产生红棕色气体(2分)
20、(共 10分)
高温
(1) 2CaCO3 2SO2 O2 2CaSO4 2CO2
催化剂
(2) 4NH3 6NO 5N2 6H2O
(3)SO2 ClO
H2O SO
2 Cl 4 2H
SO2 在水中的溶解度大于NO,SO2 在溶液中的还原性强于
NO,因此SO2 与NaClO溶液的反应速率大于NO 2 :13(2分)
21、(共 10分)
(1)0.025 9 :5 (2)7.2 (3)①4 ②8.4
试卷满分:100分
考试时间:2024年 3月 9日下午 14:15-15:45
可能用到的相对原子质量:O-16 N-14 C-12 S-32 Na-23 Ca-40 Mg-24 Al-27
Cl-35.5 Fe-56 Cu-64
一、选择题(每小题只有 1 个正确答案,共 48 分)
1.2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域
都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )
A.中国自主研发的首个5G微基站射频芯片的主要材料是Si
B.高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料
C.国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料
D.歼 20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料
2.实验室中下列做法正确的是( )
A.氢氟酸保存在棕色玻璃试剂瓶中 B.用剩的白磷放回盛有水的广口瓶中
C.烧碱溶液保存在玻璃塞试剂瓶中 D.浓硝酸保存在带橡胶塞的棕色细口瓶中
3.下列说法中正确的有( )
①碳化硅的硬度高,可用作砂纸和砂轮的磨料
②二氧化硫具有抗氧化性,可用作葡萄酒的食品添加剂
③液氨汽化时吸热,可用作制冷剂
④富勒烯、碳纳米管、石墨烯等碳纳米材料都属于新型无机非金属材料
⑤单质硫易溶于CS2,实验室可用CS2清洗沾有硫单质的试管
⑥ pH在5.6 ~ 7.0之间的降水通常称为酸雨;
⑦二氧化硅与氢氧化钠溶液、氢氟酸均反应,属两性氧化物
⑧陶瓷、普通玻璃、水泥、金刚砂(SiC)都属于硅酸盐材料
⑨加入Ba NO 2 3 溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO4 存在2
⑩SO2 通入紫色石蕊试液,溶液先变红后褪色
A.2个 B.3个 C.4个 D.5个
4. NA为阿伏加德罗常数的值。下列说法正确的是( )
A.50mL、18.4mol / L浓硫酸与足量铜加热反应,生成SO2 分子的数目为0.46NA
B.0.2molCu和0.2molS充分反应转移电子数为0.2NA
C.常温下,将 2.7g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA
D.标准状况下, 22.4LSO2 与足量O2的反应,生成的SO3分子数为 NA
5.下列离子方程式正确的是( )
A.少量SO 通入Ca ClO 溶液:Ca2 2 2 ClO
SO2 H2O CaSO4 Cl
2H
B.Fel2 溶于过量的硝酸溶液中:Fe
2 4H NO Fe3 3 NO 2H2O
△
C.用热NaOH溶液洗涤试管内壁的硫黄:3S 6OH SO2 2 3 2S 3H2O
D.向Na2S溶液通入足量SO :S
2
2 2SO2 2H2O H2S 2HSO
3
6.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明NO2 能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
7.在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液
体,一段时间后两装置中的气球都有明显胀大。则所用试剂分别可能依次是( )
A.甲:浓硫酸和木炭 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:饱和食盐水和HCl
C.甲:浓硫酸和铜片 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢
8.下列实验操作、现象和结论均正确的是( )
实验操作 现象 结论
浓硫酸滴入蔗糖中,产生的气体通入澄清石 蔗糖变黑、体积膨胀,澄清石灰 浓硫酸具有脱水性和强氧化
A
灰水 水变浑浊 性
取适量NaHCO3固体于试管中,滴入少量水 试管内温度上升,NaHCO3结块B NaHCO3溶于水放热
并用温度计检测 变为晶体
碱性:
产生白色沉淀,并逐渐增多,后
C 向AlCl3溶液中逐滴加入稀氨水至过量
慢慢溶解 NH3 H2O Al OH 3
取适量浓硝酸于试管中,将灼热的木炭插入
D 产生红棕色气体 浓硝酸与炭反应产生NO2
试管
A.A B.B C.C D.D
9.以下是由石英砂(主要成分为二氧化硅)制备高纯硅的工艺流程示意图。
下列说法错误的是( )
高温
A.步骤①中反应的化学方程式:SiO2 2C Si 2CO
B.工艺流程中,从混合物中分离出SiCl4 、SiHCl3的方法为分馏
C.由粗硅制备高纯硅的过程中,循环使用的物质主要有HCl和H2
D.若混合物分离后,得到SiCl4 、SiHCl3、H2 的物质的量之比为1:1:1,则理论上不需要额外补充H2
10.中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正
确的是( )
A.若D是一种强碱,则A、C均可与X反应生成D
B.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
11 SO 0.1mol L 1.将 2 分别通入无氧、有氧的浓度均为 的BaCl2溶液和Ba NO3 溶液中,除2 BaCl2溶液(无氧)
外,都产生白色沉淀。实验测得各溶液 pH变化曲线如图。下列说法不正确的是( )
A.曲线 a所示溶液 pH降低的原因:SO2 H2O H2SO3 H
HSO 3
B 1.依据曲线 b可推知0.2mol L KNO3溶液(无氧)能氧化SO2
C.曲线 c所示溶液中发生反应的离子方程式为: 2Ba2 2SO2 O2 2H2O 2BaSO
4 4H
D .曲线d所表示的过程中NO3 是氧化SO2 的主要微粒
12.已知R 、W、X、Y、Z均为短周期主族元素,其中K元素所在的周期数是其族序数的一半,且对应的两
种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质形成的合金可用作原子
反应堆导热剂,Y元素原子最外层电子数为m ,次外层电子数为 n ,Z元素原子L层电子数为m n,M层电子
数为m n,下列叙述中错误的是( )
A.R 、X、Y对应的简单离子半径: r X r Y r R
B.相同温度下,同浓度的R 、W、Z的最高价含氧酸的酸性:R W Z
C.将WY2 与RY2分别通入Ba NO3 2 溶液中,现象不同
D.Y的简单氢化物的熔、沸点比R 的简单氢化物的熔、沸点低
13 . 硫 酸 亚 铁 在 高 温 条 件 下 分 解 可 生 成 Fe2O3 、 SO3 、 SO2 , 反 应 方 程 式 为 :
高温
2FeSO4 Fe2O3 SO2 SO3 ,为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置 a中,打
开 K1和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )
A.反应管中残留固体红色粉末是Fe3O4
B.装置 b中的试剂为Ba NO3 溶液,反应后有白色沉淀生成2
C.装置 c中的试剂为酸性KMnO4 溶液,作用是除去混合气体中的SO2
D.分解的气体产物中有SO3、SO2 ,应该先检验SO3
14.沸石分子筛选择性催化还原NO的循环过程如图所示。下列说法正确的是( )
A.反应过程中催化剂Cu 未参与电子得失
B.步骤一中O2与H2O的物质的量之比为 2 :1
C.每生成1molN2理论上消耗0.25molO2
D.所有步骤均有氧化还原反应发生
15.38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和
NaNO2的混合溶液,反应过程及有关数据如图所示
下列有关判断不正确的是( )
A.硝酸在反应中既体现氧化性又体现酸性
B.氮的氧化物和NaOH溶液反应时,NO作还原剂
C.混合气体中N2O4的物质的量是0.1mol,生成NaNO30.6mol
D.若浓硝酸体积为 200mL,则其物质的量浓度为11mol / L
16 .某稀溶液中含有 4molKNO3和 2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3 被还原为NO),
最终溶液体积为1L。下列说法正确的是( )
A.所得溶液中 c NO 3 2.75mol L 1
B.所得溶液中 c Fe2 : c Fe3 1: 2
C.反应后生成NO的体积为33.6L(标准状况)
D.所得溶液中的溶质只有FeSO4
二、非选择题(本部分共含 5 大题,共 52 分)
17.(10分)
硫元素是动植物生长不可缺少的元素,图 1是自然界中硫元素的存在示意图。图 2是硫元素的常见化合价与部分物
质类别的对应关系,回答下列问题。
(1)图 1中与图 2中M、N对应的物质分别是______、______。
(2)Na2SO3 溶液易变质,实验室检验Na2SO3 溶液是否变质的基本操作是______。
( 3 ) 已 知 Na2SO3 能 被 酸 性 K2Cr2O7 氧 化 为 Na2SO4 , 则 24mL0.05mol L
1
的 Na2SO3 溶 液 与
20mL0.02mol L 1的K2Cr2O7溶液恰好反应时,发生的离子方程式为:______。
(4)过二硫酸钠(Na2S2O3)有强氧化性,在碱性条件下Na2S2O I
IO 8溶液能将 氧化成 3 ,且反应后的溶液滴入
BaCl2溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为______________________________。
(5)雌黄(As2S3)和雄黄(As4S4)在自然界中共生且可以相互转化(两者的硫元素价态均为 2价)。
①As2S3和SnCl2在盐酸中恰好完全反应转化为As4S4和SnCl4并放出H2S气体。则参加反应的As2S3和SnCl2的
物质的量之比为______。
②As2S3和As4S4可以相互转化,转化过程中存在如图所示的步骤。若1molAsS4 参加反应时,转移 28mol电子,
则物质 a为______。
18.(10分)
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,写出实验室制备C的化学反应方程式:
________________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气
的主要成分,写出反应③的化学方程式:______________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。写出
反应④的离子方程式:______________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱
性。写出②反应的化学方程式:__________________________________________。D的化学式是______。
19.(12分)
某研究性学习小组学生根据氧化还原反应规律,探究NO2 、NO与Na 2O2 反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析Na 2O2 和NO2 都既有氧化性又有还原性,于是提出如下假设:
假设 1:Na 2O2 氧化NO2 ;假设 2:NO2 氧化Na 2O2 。
(1)甲同学设计如图装置进行实验:
①试管A中反应的离子方程式是______________________________。
②待试管B中充满红棕色气体,关闭旋塞 a和 b;取下试管B,向其中加入适量Na 2O2 粉末,塞上塞子,轻轻振
荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
结论:甲同学认为假设 2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带
火星的木条未复燃,得出结论:假设Ⅰ正确。则NO2 和Na 2O2 反应的化学方程式是__________________。
Ⅱ.该研究性学习小组同学还认为 NO 易与 O2 发生反应,应该更易被 Na 2O2 氧化。查阅资料:
2NO Na2O2 2NaNO2 ; 2NaNO2 2HCl 2NaCl NO2 NO H2O;酸性条件下,NO能与
MnO NO Mn2 4 反应生成 3 和 。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na 2O2 的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是________________________。
②B中观察到的主要现象的是______(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________,则产物是NaNO2。
20.(10分)
为消除燃煤烟气中含有的SO2 、NOx ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2 气体转化为CaSO4的化学方程式是______。
(2)选择性催化还原法(SCR )“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3
还原NO的化学方程式是______________________________。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的 pH 5.5,将烟气中的SO2 、NO转化
为SO2 4 、NO3 。
①NaClO溶液吸收烟气中SO2 的离子方程式是______________________________。
②一定时间内,温度对硫、硝脱除率的影响曲线如图, SO2 的脱除率高于 NO ,可能的原因是
______________________________________________________________________________(1种即可)
③烟气中SO2 和NO的体积比为 4 :1,50℃
时的脱除率见图,则此吸收液中烟气转化生成的NO3 和Cl 的物质的
量之比为____________。
21.(10分)
(1)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6molHNO3
溶液恰好使混合物完全溶解,同时收集到 224mLNO气体(标况)。则产物中硝酸铜的物质的量为______。如原混
合物中有0.01molCu,则其中Cu2O与CuO的质量之比为______。
(2)将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO
气体 560mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 m2g,则
m1 m2 为______。
(3)将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的
体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。
编号 ① ② ③ ④
硝酸体积 /mL 100 200 300 400
剩余金属 /g 18.6 9.6 0 0
NO体积 /L 2.24 4.48 6.72 V
①稀硝酸的物质的量的浓度为______mol / L。
②V ______。
武汉二中 2026 届高一下化学周练(一)A 卷
参考答案
一、选择题(每小题只有 1 个正确答案,共 48 分)
题号 1 2 3 4 5 6 7 8
答案 D B D B C B B A
题号 9 10 11 12 13 14 15 16
答案 D D D D D C C A
二、非选择题(本部分共含 5 大题,共 52 分)
17、(共 11分)
(1)CaSO4 2H2O、Na 2SO4 10H2O(2分) CuFeS2
(2)取少量溶液于试管中,向其中加入过量稀盐酸,再滴加BaCl2溶液,如果产生白色沉淀,证明混有Na2SO4(2
分)
(3)3SO2 3 8H Cr O
2 3SO2 4H O 2Cr3 2 7 4 2 (2分)
(4)3S2O
2 I 6OH 6SO2 IO 8 4 3 3H2O(2分)
(5)1:1 SO2
18、(共 10分)
(1)Na2SO3 H2SO4 浓 Na2SO4 SO2 H2O
催化剂
(2) 4NH3 5O2 4NO 6H2O
(3) Al OH CO
4 2
HCO3 Al OH 3
(4)Si 2NaOH H2O Na2SiO3 2H2 Na 2CO3
19、(共 11分)
(1)Cu 4H 2NO Cu2 3 2NO2 2H2O
(2)除去NO2 中混有的水蒸气(2分) Na2O2 2NO2 2NaNO3(2分)
(3)将装置中的空气排出 ac(2分) a 加入稀盐酸,产生红棕色气体(2分)
20、(共 10分)
高温
(1) 2CaCO3 2SO2 O2 2CaSO4 2CO2
催化剂
(2) 4NH3 6NO 5N2 6H2O
(3)SO2 ClO
H2O SO
2 Cl 4 2H
SO2 在水中的溶解度大于NO,SO2 在溶液中的还原性强于
NO,因此SO2 与NaClO溶液的反应速率大于NO 2 :13(2分)
21、(共 10分)
(1)0.025 9 :5 (2)7.2 (3)①4 ②8.4
同课章节目录
