2024届高三化学二轮复习分子结构与性质课件(共26张PPT)
文档属性
| 名称 | 2024届高三化学二轮复习分子结构与性质课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 931.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 10:40:43 | ||
图片预览







文档简介
(共26张PPT)
分子的结构和性质
一、共价键
复习目标:了解共价键的形成、极性及其主要类型,能用键长、键能、键角等说明简单分子的某些性质。了解配位键的含义。
1、共价键的本质及特征
共价键的本质是在原子之间形成共用电子对(或原子轨道相互重叠),其特征是具有饱和性和方向性。
2、共价键的类型:
(1)按共用电子对数分
单键
双键
三键
(2)按极性分
极性键
非极性键
(3)按成键方式分
σ键
π键
共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键
(共价键极性强弱的比较:
电负性差值越大,极性越强)
讨论1:、在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有2个原子的S轨道重叠形成的σ键的是:
(5)分子中含有由一个原子的S轨道和另一个原子的P轨道重叠形成的σ 键的是:
(6)分子中含有由一个原子的P轨道与另一个原子的P轨道重叠形成的σ键的是:
①②③⑥⑦
④⑤⑧
②④⑤
⑥
①③⑦⑧
②④⑤⑦⑧
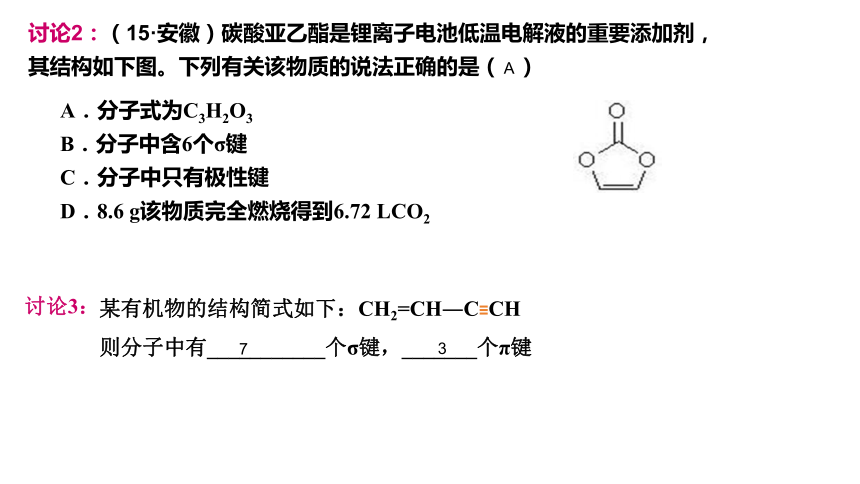
讨论2:(15·安徽)碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,
其结构如下图。下列有关该物质的说法正确的是( )
A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6 g该物质完全燃烧得到6.72 LCO2
讨论3:
某有机物的结构简式如下:CH2=CH―C≡CH
则分子中有___________个σ键,_______个π键
7
3
A
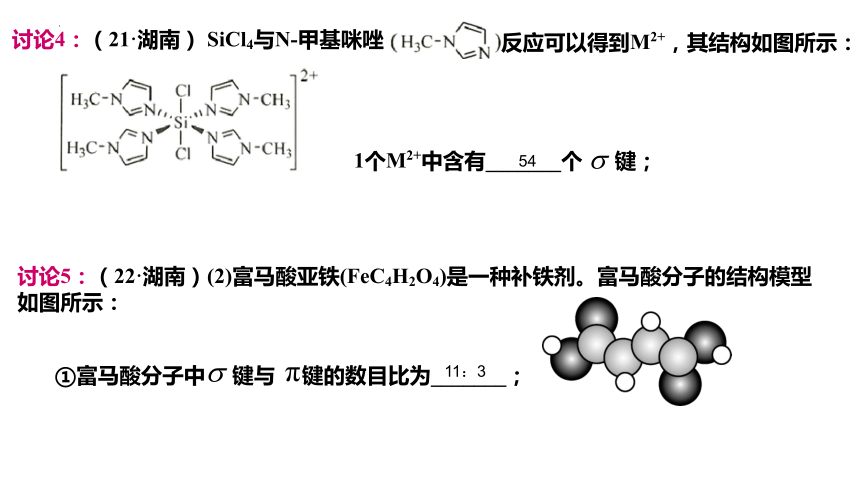
讨论4:(21·湖南) SiCl4与N-甲基咪唑
反应可以得到M2+,其结构如图所示:
1个M2+中含有_______个 键;
讨论5:(22·湖南)(2)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型
如图所示:
①富马酸分子中 键与 键的数目比为_______;
54
11:3
键参数
键能
键长
键角
衡量化学键的稳定性
描述分子的立体构型的重要因素
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
3、共价键的键参数:
已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更 (填“高”或“低”),说明理由 。
讨论1:(2021.成都二诊)
一般共价键的键长越短,共价键越稳定
高
讨论2:(2022·全国甲卷)
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释
原因_______。
C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定
讨论3:(2022·全国乙卷)
一氯乙烷>一氯乙烯>一氯乙炔
Cl参与形成的大π键越多,形成的C-Cl键的键长越短
讨论4:(2023.山东卷)
[ Cu ( NH3 ) 4 ] 2+ SO42-
中心原子
内界(配离子)
配位原子
配位体
配位数
外界离子
配合物
配合物的组成:
4、特殊的共价键—配位键
成键特点:一方提供孤对电子,一方提供空轨道
配离子:中心离子、配体、配位原子、配位数
配合物溶于水电离为内界配离子和外界离子,而内界的配体离子和分子通常不能电离。
讨论2:(22成都二诊)(3)甲酸根中C原子的杂化类型为_______,其与铜离子配位的原子是_______;
讨论1:(2023北京卷)
)
S2O32-中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子
O
讨论3:(2021·全国乙)(2)三价铬离子能形成多种配位化合物。
中提供电子对形成配位键的原子是_______,
中心离子的配位数为_______。
N,O,Cl
6
讨论4:Co2+在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,[Co(NH3)6]2+更稳定,原因是
N的电负性小于O的,更易提供孤对电子形成配位键
讨论5:往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________
电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键。
讨论6:[2020山东](3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有_________mol。
6
结构如图所示。
讨论7:(2022·北京)
(3)H2O与Fe2+、SO42-和H2O的作用分别为___________。
配位键 氢键
大π键
m:指参与形成大π键的原子数
n: 指参与形成大π键的电子数
大π键的形成条件:
①原子共面;
②p轨道相互平行;
③p轨道上的电子总数小于p轨道数的2倍。
定义:3个及以上原子构成的离子团或分子中,原子有彼此
平行的未参与杂化的p轨道电子,连贯重叠在一起
构成π型化学键,又称为离域或共轭大π键。
表示:
讨论1:(2023·山东卷)
讨论2:(2022·全国乙卷)
(2)①一氯乙烯(C2H3Cl)分子中,C的一个_______杂化轨道与Cl的3px轨道
形成C-Cl_______键,并且Cl的3px轨道与C的2px轨道形成大
键
sp2
σ
讨论3:(上期周考)(3)N4H62+只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为____
π
讨论4:(上期天天练)(2)4-甲基咪唑
也可与Cu2+形成配合物,4-甲基咪唑分子中1号N原子的孤电子对因参与形成大π键,电子云密度降低。其中其中的大π键可表示为____ (填“1”或“3”)号N原子更容易与Cu2+形成配位键。
π
3
讨论5:(2023·全国甲卷)(2)酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中P轨道能提供一对电子的N原子是_______(填图2酞菁中N原子的标号)
③
(3)吡啶(
的π66大π键、则吡啶中N原子的价层孤电子对占据_______(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
讨论6:(2022·山东)
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似
D
复习目标:能用价层电子对互斥理论推测常见的简单分子或者离子的空间结构;了解杂化轨道理论及简单的杂化轨道类型。
二、分子的立体结构
1、原子杂化方式和分子立体构型的判断
价层电子对互斥理论和杂化轨道理论
σ键对数
孤电子对数
分子的立体构型
VSEPR模型
价层电子对数
杂化轨道类型
孤电子对数
σ键个数
(a-xb)/2
2 3 4
sp sp2 sp3
2 3 4
直线形 平面三角形 四面体形
杂化轨道只用于形成σ键或者用来容纳孤对电子,
剩余的p轨道可以形成π键
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为_______。
讨论1:(2023·全国甲卷)
sp3
讨论2:(2021·山东卷)OF2分子的空间构型为__;
V形
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。下列对XeF2中心原子杂化方式推断合理的是___(填标号)。A.sp B.sp2 C.sp3 D.sp3d
讨论3:(2021·山东卷)
D
讨论4:(2021·全国甲卷)
SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。
②
2、键角的大小比较
讨论1:(2023.山东卷)
>
③比较键角大小:气态SeO3分子_______SeO32-离子(填“>”“<”或“=”),原因是_______。
讨论2:(2022.湖南卷)
>
前者中心原子Se为sp2杂化,后者为sp3
讨论3:(22·北京)(2)比较SO42-和H2O分子中的键角大小并给出相应解释: ____________________________________________ 。
SO42-键角大于H2O,两者的中心原子都是sp3杂化,但SO42-中S无孤对电子,而H2O中的中心原子O有两对孤对电子。
讨论4:(2020.山东卷)
(2)NH3、PH3、AsH3键角由大到小的顺序为___________
NH3、PH3、AsH3
比较键角大小的思维方法
(1)杂化轨道类型不同:
(2)杂化轨道类型相同:孤电子对数越多,键角越小
(3)杂化轨道类型相同,孤电子对数相同,中心原子电子云密度越
大,键角越大。
小结:
分子的结构和性质
一、共价键
复习目标:了解共价键的形成、极性及其主要类型,能用键长、键能、键角等说明简单分子的某些性质。了解配位键的含义。
1、共价键的本质及特征
共价键的本质是在原子之间形成共用电子对(或原子轨道相互重叠),其特征是具有饱和性和方向性。
2、共价键的类型:
(1)按共用电子对数分
单键
双键
三键
(2)按极性分
极性键
非极性键
(3)按成键方式分
σ键
π键
共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键
(共价键极性强弱的比较:
电负性差值越大,极性越强)
讨论1:、在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有2个原子的S轨道重叠形成的σ键的是:
(5)分子中含有由一个原子的S轨道和另一个原子的P轨道重叠形成的σ 键的是:
(6)分子中含有由一个原子的P轨道与另一个原子的P轨道重叠形成的σ键的是:
①②③⑥⑦
④⑤⑧
②④⑤
⑥
①③⑦⑧
②④⑤⑦⑧
讨论2:(15·安徽)碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,
其结构如下图。下列有关该物质的说法正确的是( )
A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6 g该物质完全燃烧得到6.72 LCO2
讨论3:
某有机物的结构简式如下:CH2=CH―C≡CH
则分子中有___________个σ键,_______个π键
7
3
A
讨论4:(21·湖南) SiCl4与N-甲基咪唑
反应可以得到M2+,其结构如图所示:
1个M2+中含有_______个 键;
讨论5:(22·湖南)(2)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型
如图所示:
①富马酸分子中 键与 键的数目比为_______;
54
11:3
键参数
键能
键长
键角
衡量化学键的稳定性
描述分子的立体构型的重要因素
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
3、共价键的键参数:
已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更 (填“高”或“低”),说明理由 。
讨论1:(2021.成都二诊)
一般共价键的键长越短,共价键越稳定
高
讨论2:(2022·全国甲卷)
(4)聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释
原因_______。
C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定
讨论3:(2022·全国乙卷)
一氯乙烷>一氯乙烯>一氯乙炔
Cl参与形成的大π键越多,形成的C-Cl键的键长越短
讨论4:(2023.山东卷)
[ Cu ( NH3 ) 4 ] 2+ SO42-
中心原子
内界(配离子)
配位原子
配位体
配位数
外界离子
配合物
配合物的组成:
4、特殊的共价键—配位键
成键特点:一方提供孤对电子,一方提供空轨道
配离子:中心离子、配体、配位原子、配位数
配合物溶于水电离为内界配离子和外界离子,而内界的配体离子和分子通常不能电离。
讨论2:(22成都二诊)(3)甲酸根中C原子的杂化类型为_______,其与铜离子配位的原子是_______;
讨论1:(2023北京卷)
)
S2O32-中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子
O
讨论3:(2021·全国乙)(2)三价铬离子能形成多种配位化合物。
中提供电子对形成配位键的原子是_______,
中心离子的配位数为_______。
N,O,Cl
6
讨论4:Co2+在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,[Co(NH3)6]2+更稳定,原因是
N的电负性小于O的,更易提供孤对电子形成配位键
讨论5:往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________
电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键。
讨论6:[2020山东](3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有_________mol。
6
结构如图所示。
讨论7:(2022·北京)
(3)H2O与Fe2+、SO42-和H2O的作用分别为___________。
配位键 氢键
大π键
m:指参与形成大π键的原子数
n: 指参与形成大π键的电子数
大π键的形成条件:
①原子共面;
②p轨道相互平行;
③p轨道上的电子总数小于p轨道数的2倍。
定义:3个及以上原子构成的离子团或分子中,原子有彼此
平行的未参与杂化的p轨道电子,连贯重叠在一起
构成π型化学键,又称为离域或共轭大π键。
表示:
讨论1:(2023·山东卷)
讨论2:(2022·全国乙卷)
(2)①一氯乙烯(C2H3Cl)分子中,C的一个_______杂化轨道与Cl的3px轨道
形成C-Cl_______键,并且Cl的3px轨道与C的2px轨道形成大
键
sp2
σ
讨论3:(上期周考)(3)N4H62+只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为____
π
讨论4:(上期天天练)(2)4-甲基咪唑
也可与Cu2+形成配合物,4-甲基咪唑分子中1号N原子的孤电子对因参与形成大π键,电子云密度降低。其中其中的大π键可表示为____ (填“1”或“3”)号N原子更容易与Cu2+形成配位键。
π
3
讨论5:(2023·全国甲卷)(2)酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中P轨道能提供一对电子的N原子是_______(填图2酞菁中N原子的标号)
③
(3)吡啶(
的π66大π键、则吡啶中N原子的价层孤电子对占据_______(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
讨论6:(2022·山东)
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似
D
复习目标:能用价层电子对互斥理论推测常见的简单分子或者离子的空间结构;了解杂化轨道理论及简单的杂化轨道类型。
二、分子的立体结构
1、原子杂化方式和分子立体构型的判断
价层电子对互斥理论和杂化轨道理论
σ键对数
孤电子对数
分子的立体构型
VSEPR模型
价层电子对数
杂化轨道类型
孤电子对数
σ键个数
(a-xb)/2
2 3 4
sp sp2 sp3
2 3 4
直线形 平面三角形 四面体形
杂化轨道只用于形成σ键或者用来容纳孤对电子,
剩余的p轨道可以形成π键
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为_______。
讨论1:(2023·全国甲卷)
sp3
讨论2:(2021·山东卷)OF2分子的空间构型为__;
V形
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。下列对XeF2中心原子杂化方式推断合理的是___(填标号)。A.sp B.sp2 C.sp3 D.sp3d
讨论3:(2021·山东卷)
D
讨论4:(2021·全国甲卷)
SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。
②
2、键角的大小比较
讨论1:(2023.山东卷)
>
③比较键角大小:气态SeO3分子_______SeO32-离子(填“>”“<”或“=”),原因是_______。
讨论2:(2022.湖南卷)
>
前者中心原子Se为sp2杂化,后者为sp3
讨论3:(22·北京)(2)比较SO42-和H2O分子中的键角大小并给出相应解释: ____________________________________________ 。
SO42-键角大于H2O,两者的中心原子都是sp3杂化,但SO42-中S无孤对电子,而H2O中的中心原子O有两对孤对电子。
讨论4:(2020.山东卷)
(2)NH3、PH3、AsH3键角由大到小的顺序为___________
NH3、PH3、AsH3
比较键角大小的思维方法
(1)杂化轨道类型不同:
(2)杂化轨道类型相同:孤电子对数越多,键角越小
(3)杂化轨道类型相同,孤电子对数相同,中心原子电子云密度越
大,键角越大。
小结:
同课章节目录
