专题 22微粒化学(微观粒子结构模型)(含解析)
文档属性
| 名称 | 专题 22微粒化学(微观粒子结构模型)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 110.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-12 07:42:08 | ||
图片预览




文档简介
专题 22 微粒化学(微观粒子结构模型)
一 、选择题
1.如图是某品牌牛奶的营养成分表,由图可知每 100 毫升牛奶中含 60 亳克钠。这里的“钠 ”指的是
( )
A.离子 B.分子 C.元素 D.原子
2.上课时,老师拿出一张卡片,标有“Cu“,要学生说出其含义。下列不能表示的其含义的是( )
A. B. C. D.
3. “ ”示意图可表示的分子是( )
A.He B.Cl2 C.CO D.CH4
4.化学元素周期表已经诞生 150 多年了。联合国宣布 2019 年为“ 国际化学元素周期表年 ”。根据化学 元素周期表我们无法得知的是某元素( )
A. 一个原子核内的质子数
B. 一个原子的质量
C. 一个原子的核外电子数
D. 是金属还是非金属元素
5.氧化汞分子分解示意图如图所示。下列说法正确的是( )
A.在化学变化中, 分子可以分成原子
B.分子是化学变化中的最小粒子
C.在这个变化中, 原子的种类发生改变
第 1 页(共 11 页)
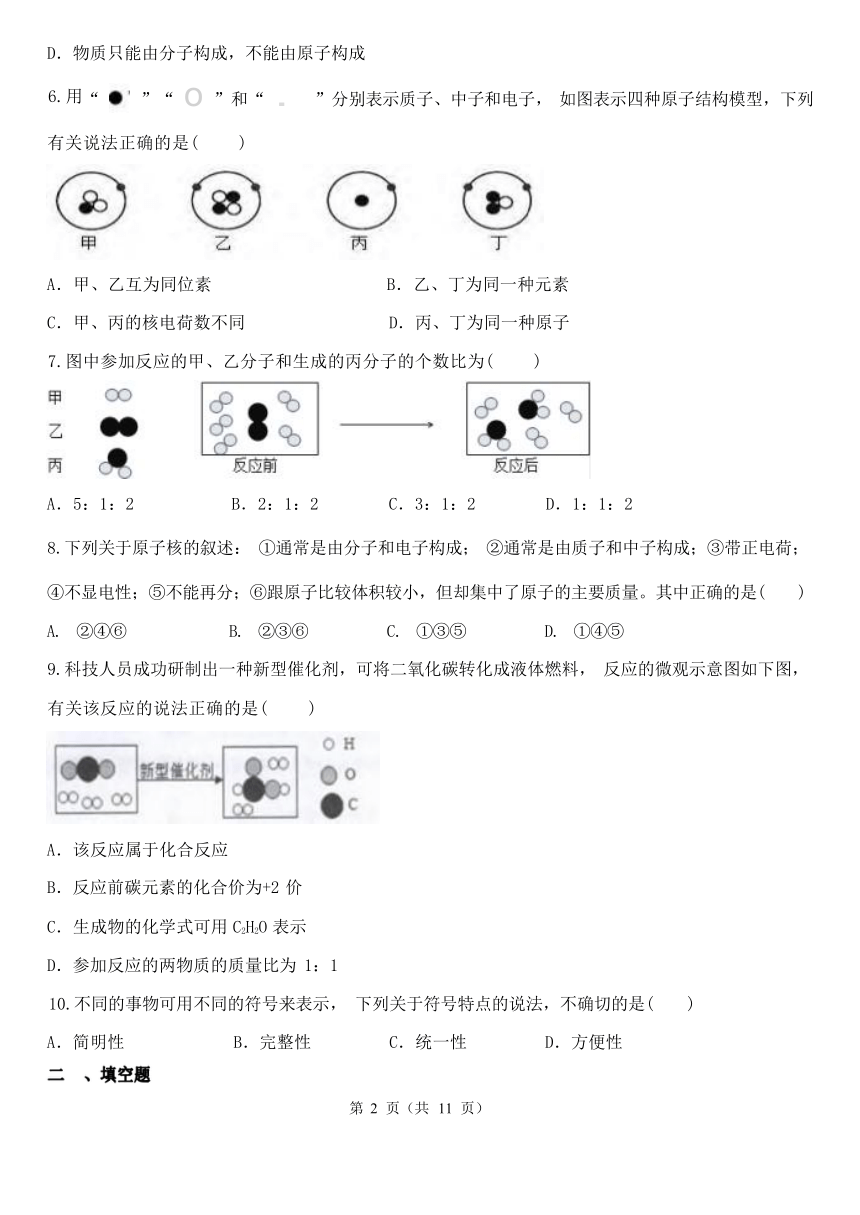
D.物质只能由分子构成,不能由原子构成
6.用“ ”“ o ”和“ . ”分别表示质子、中子和电子, 如图表示四种原子结构模型,下列
有关说法正确的是( )
A.甲、乙互为同位素 B.乙、丁为同一种元素
C.甲、丙的核电荷数不同 D.丙、丁为同一种原子
7.图中参加反应的甲、乙分子和生成的丙分子的个数比为( )
A.5:1:2 B.2:1:2 C.3:1:2 D.1:1:2
8.下列关于原子核的叙述: ①通常是由分子和电子构成; ②通常是由质子和中子构成;③带正电荷;
④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )
A. ②④⑥ B. ②③⑥ C. ①③⑤ D. ①④⑤
9.科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料, 反应的微观示意图如下图,
有关该反应的说法正确的是( )
A.该反应属于化合反应
B.反应前碳元素的化合价为+2 价
C.生成物的化学式可用 C2H2O 表示
D.参加反应的两物质的质量比为 1:1
10.不同的事物可用不同的符号来表示, 下列关于符号特点的说法,不确切的是( )
A.简明性 B.完整性 C.统一性 D.方便性
二 、填空题
第 2 页(共 11 页)
11.请先写出下列符号中数字“2”的意义, 然后试着归纳总结符号周围数字的意义。
意义: O2 ;2H ;
Mg2+ ;
我的归纳: ①符号的前面的数字表示 ;②符号右下角的数字表
示 ;
③符号右上角的数字表示 。
12.我们所知的原子结构,是经过科学家上百年的不懈努力探究得知的。
(1)卢瑟福核式结构模型是在利用 α 粒子轰击金箔实验的基础上提出的。仔细观察图甲、乙、丙三
图,能正确反映他的实验结果的示意图是图 。
(2)图丁为原子模型, 如果内圈表示原子核, 则外圈上的小球表示 。
13.根据下面元素周期表,回答有关问题:
(1)编号①②③④代表元素周期表中的四种元素, 其中属于金属元素的是 (填序号)。
(2)①处元素和②处元素形成的化合物的化学式为 。
14.月球上的“土壤 ”主要由月球岩石碎屑、粉末等物质组成。太空中长期的太阳风,使得月壤中携带
了大量的可作为清洁能源的氦-3,规模总计有 100 万至 500 万吨, 远远超过了地球的储量。
(1)月壤中岩石碎屑、粉末这些成分相当于地球土壤中的 。(“矿物质颗粒 ”或“腐
殖质”)
第 3 页(共 11 页)
(2)氦-3 是一种氦气同位素气体, 其化学符号 He,它的核内中子比“正常 ”氦少一个(如图),氦-3
原子内有 个电子。
15.如图所示为元素周期表的一部分,已知 B 元素的原子核内有 8 个质子, 请回答下列问题:
(1)写出 A 元素原子的核外电子数 。
(2)写出由 B、C 两种元素组成常见的化合物的化学式 。
(3)AC 两种元素在元素周期表中处于同一纵列, 每一个纵列叫做一个
三 、实验探究题
16.探究原子结构的奥秘。
【收集证据】绝大多数 α 粒子穿过金箔后仍沿原来的方向前进,但是有少数 α 粒子却发生了较大 的偏转,并且有极少数 α 粒子的偏转超过 90°, 有的甚至几乎达到 180°,像是被金箔弹了回来; 【猜想与假设】 α 粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而 结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的;
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布, 则极少数 α 粒子就 (填“会 ”或“不会”) 发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上 ”中的“很小的
结构 ”指的是 。
(2)1um 金箔包含了 3000 层金原子,绝大多数 α 粒子穿过后方向不变, 说明 ;
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为以下的
。
A.不可再分的实心球体
第 4 页(共 11 页)
B.正负电荷均匀分布
C.核位于原子中心,质量集中在核上
(4)1919 年,卢瑟福用加速了的高能 α 粒子轰击氮原子,结果有种微粒从氮原子被打出,而 α 粒子
留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
17.利用分子的性质解释下列事实:
(1)把糖块放在水里, 糖块逐渐消失,而水却有甜
味: 。
(2)气体容易压缩, 而液体、固态难以压缩: 。
(3)液氧和氧气状态不同,但具有相同的化学性质: 。
(4)蜡烛燃烧后生成二氧化碳和水: 。
四 、解答题
18.阅读有关材料并回答问题。
(1)原子或离子半径大小比较的一般方法是: 电子层数越多, 半径越大;若电子层数相同, 则核电荷 数越大,半径越小;若电子层数和核电荷数均相同, 则最外层电子数越多, 半径越大,则Al3+ 、F、Cl
三种微粒半径由小到大的顺序是 。
(2)对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,
其对应的阳离子的氧化性越弱.有Na、Mg 、K 其原子核外电子排布是:
NaOH、Mg(OH)2 、KOH 中碱性最强的是 ,Na+、Mg2+ 、K+ 中氧化性最强的是 。
19. “○”代表氢原子,“ 0 ”代表氧原子。由氢氧两种原子构成的分子如下“
(1)比较 A.B、D 可知: ;
(2)比较 C、E 可知: ;
(3)比较 B、D 可知: 。
20.人类对原子结构的认识, 经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体 ”,汤姆生认为原子是“嵌着葡
第 5 页(共 11 页)
萄干的面包 ”,如今发现这些观点均是 (填“正确 ”或“错误”)的。
(2)卢瑟福核式结构模型是利用 a 粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果
的示意图是 (填序号)。
(3)从原子结构模型建立的过程中, 我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
第 6 页(共 11 页)
专题 22 微粒化学(微观粒子结构模型)答案解析
一 、选择题
1.C
【解析】元素是具有相同核电荷数的同一类原子的统称, 据此分析判断。
每 100 毫升牛奶中含 60 亳克钠。这里的“钠 ”就是具有相同核电荷数的同一类原子, 指的的是元素,
故 C 正确, 而 A.B、D 错误。
2.D
3.C
【解析】A.氦气是由氦原子构成的, 不是由分子构成的, 故错误;
B.一个氯气分子是由两个相同的氯原子构成的,故错误;
C.一个一氧化碳分子是由一个碳原子和一个氧原子构成的,故正确;
D.一个甲烷分子是由 1 个碳原子和 4 个氢原子构成的,故错误.
4.B
5.A
【解析】 由图中可以知道,氧化汞分子分解成汞原子和氧原子,汞原子重新构成汞,氧原子重新构成
氧分子。原子在化学变化前后没有改变。
A.由图中可以知道,在化学变化中分子可以分成原子, 故 A 正确;
B.原子是化学变化中的最小粒子,故 B 错误;
C.化学反应前后原子的种类和个数都没有发生改变,故 C 错误;
D.氧化汞分子是由原子构成的, 汞是由汞原子构成,故 D 错误。
6.B
【解析】A.甲的质子数为 1,乙的质子数为 2,二者不是同位素, 故 A 错误;
B.乙和丁的质子数都是 2,为同种元素, 故 B 正确;
C.甲和丙的质子数都是 1,根据核电荷数=质子数可知,它们的核电荷数相等,故 C 错误;
D.甲的质子数为 1,丁的质子数为 2,二者不是一种原子,故 D 错误。
7.B
8.B
第 7 页(共 11 页)
【解析】原子核通常由质子和中子构成, 其中质子带正电荷, 中子不带电, 所以原子核显正电, 原子
核几乎占有了整个原子的质量, 但是其体积和整个原子相比几乎可以忽略。
①原子核由质子和中子构成,错误; ⑤原子核分为质子和中子,说明可以再分, 错误; 其它选项都正
确。
9.A
【解析】 有关微观模拟图的题目在解答时,要根据反应前后各微粒的构成确定反应物和生成物,写出
反应方程式,然后利用方程式判断。
该反应方程式为 CO2+H2=CH2O2,
A.该反应为化合反应,说法正确;
B、 反应前碳元素的化合价为+4 价 ,说法错误;
C、 生成物的化学式可用 CH2O2 表示, 说法错误;
D、 参加反应的两物质的质量比为 44:2,说法错误;
10.B
【解析】用符号能简单明了地表示事物, 还可避免由于事物外形不同和表达的文字语言不同而引起的
混乱。
不同的事物可用不同的符号来表示, 因此符号具有统一性;用符号能简单明了地表示事物, 因此符号
具有简明性而不具有完整性;符号还可避免由于事物外形不同和表达的文字语言不同而引起的混乱,
因此符号具有方便性。
二 、填空题
11.1 个氧分子由 2 个氧原子构成的;两个氢原子;每个镁离子带 2 个单位正电荷; 几个分子、原子
或离子;每个分子中含有几个原子; 每个离子带有几个电荷
【解析】意义: O2 表示 1 个氧分子由 2 个氧原子构成的; 2H 表示两个氢原子;Mg2+表示每个镁离子带 2 个单位正电荷;我的归纳: ①符号的前面的数字表示几个分子、原子或离子; ②符号右下角的数字
表示每个分子中含有几个原子; ③符号右上角的数字表示每个离子带有几个电荷。
故答案为: 表示 1 个氧分子由 2 个氧原子构成的;表示两个氢原子;表示每个镁离子带 2 个单位正
电荷; ①几个分子、原子或离子;②每个分子中含有几个原子;③每个离子带有几个电荷。
12.(1)乙
(2)核外电子
第 8 页(共 11 页)
【解析】 1、卢瑟福核式结构模型 认为原子是空心的, 原子核很小集中了几乎所有的质量, 原子核带
正电。 α 粒子 带正电,根据正电荷间的相互作用和原子核的特点可以确定实验结果的示意图;
2、原子核由带正电的质子和不带电的中子构成,电子在原子核外绕核运动。
(1)根据卢瑟福的原子核式结构可知, α 粒子不可能穿过原子核, 甲不可能。 α 粒子与原子核带同
种电荷,距离较近时会受到相斥的力的作用, 丙不可能。乙图符合实验结果;
(2) 图丁为原子模型, 如果内圈表示原子核,则外圈上的小球表示 核外电子。
13.(1)②
(2)MgO
【解析】(1)根据元素周期表确定元素名称,根据元素名称中是否含有金字旁确定是否属于金属元素;
(2)首先确定①和②的元素名称,再确定生成化合物的名称。
(1)根据图片可知,①为 O 元素,②为 Mg 元素, ③为 S 元素, ④为 Cl 元素,其中②号元素镁中含有
金字旁,属于金属元素。
(2)①为 O 元素, ②为 Mg 元素,二者生成的化合物为氧化镁,化学式为 MgO。
14.(1)矿物质颗粒
(2)2
【解析】(1)腐殖质指的是被生物分解时候的剩余的富含大量对植物有有利作用的土壤所含的物质, 也对整个生态系统有直接的正面作用。矿物质,是地壳中自然存在的化合物或天然元素,又称无机盐;
(2)在原子中,核外电子数等于质子数等于原子序数。
15.7 P2O5 族
【解析】
(1)素周期表是按原子的原子序数递增的顺序排列的, 则 A 元素的原子序数为 7,原子中原子序数=
核电荷数=质子数=核外电子数, 则 A 元素的原子核外有 7 个电子;
(2)B 和 D 在同一族, 最外层电子数相同,则 D 为硫元素,C 为磷元素, 所以由 B、C 两种元素组成常
化合物是五氧化二磷,其化学式为 P2O5;
(3)元素周期表中每一个纵列叫做一个族。
三 、实验探究题
16.(1)不会;原子核
第 9 页(共 11 页)
(2)B
(3)C
(4)质子
【解析】(1)原子核上 原子核外有一个非常大的空间 核外电子围绕原子核作高速运动。若原子质量、 正电荷在原子内均匀分布 则极少数 α 粒子就不会发生大角度散射 说明原子的质量主要集中在原子核
上 且正电荷不是均匀分布的 ;
(2)原子核外有一个非常大的空间 使绝大多数 α 粒子穿过后方向不变;
(3)A 是道尔顿的原子实心模型;B 是汤姆森的葡萄模型; C 为卢瑟福核式结构模型, 最完善的是 C; (4)氮原子有 7 个质子, 氧原子有 8 个质子, 既然 粒子留在了氮原子中,使氮原子变成了氧原子 ,
说明改变了质子数。
故答案为:(1)不会、原子核;(2)B;(3)C;(4)质子
17.(1)糖块溶解在水中后,糖分子不断地运动, 扩散到水分子中去了
(2)气体分子间间隔大,液体、固体分子间间隔较小
(3)同种物质的分子化学性质相同
(4)分子在化学变化中分成原子,原子又重新组合成新的分子
【解析】回答本题首先要熟悉分子的性质:分子质量和体积都很小;分子间有间隔;分子在不断地运 动; 同种物质的分子化学性质相同,不同种物质的分子化学性质不同;分子在化学变化中可分为原子,
原子又重新组合成新的分子。
四 、解答题
18.F、Al3+ 、 Cl KOH Mg2+
【解析】
(1)电子层数越多,半径越大;若电子层数相同,则核电荷数越大,半径越小; 若电子层数和核电荷
数均相同,则最外层电子数越多,半径越大,则Cl 电子层数最多,半径最大,Al3+ 、F电子层数相同,
Al3+ 最外层电子数大,Al3+ 半径大,故三种微粒半径由小到大的顺序是F、Al3+ 、Cl 。
(2)对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,
则 NaOH、Mg(OH)2 、KOH 中碱性最强的是KOH ,对金属元素来说, 原子半径越大, 最外层电子
第 10 页(共 11 页)
数越少,金属性越强,其对应的氢氧化物碱性越强,其对应的阳离子的氧化性越弱,三种原子半径由
大到小的顺序是钾、钠、镁,则Na+、Mg2+ 、K+ 中氧化性最强的是Mg2+ 。
19.(1)分子可以由同种原子构成
(2)分子可以由不同种原子构成
(3)数量不相同的原子可以构成不同的分子
【解析】A 中氢分子只由氢原子构成,B 中氧分子只由氧原子构成,D 中臭氧分子只由氧原子构成, 分
析可知:分子可以由同种原子构成;
(2)C 中水分子由氢原子和氧原子构成, E 中过氧化氢分子也由氢原子和氧原子构成, 分析得到:分
子可以由不同种原子构成;
(3)B 中氧分子和 D 中臭氧分子都由氧原子构成, 只是数量不同, 分析得到:数量不相同的原子可以
构成不同的分子,
20.(1)错误
(2)乙
(3)A;B;D
【解析】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实
心球体 ”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a 粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥 ”可知, a 粒子会受到原子核的排 斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数 a
粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回, 故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程, 故 A 正确;
B.模型在科学研究中起着很重要的作用, 故 B 正确;
C.波尔的原子模型建立, 使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故
C 错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质, 故 D 正确。
第 11 页(共 11 页)
一 、选择题
1.如图是某品牌牛奶的营养成分表,由图可知每 100 毫升牛奶中含 60 亳克钠。这里的“钠 ”指的是
( )
A.离子 B.分子 C.元素 D.原子
2.上课时,老师拿出一张卡片,标有“Cu“,要学生说出其含义。下列不能表示的其含义的是( )
A. B. C. D.
3. “ ”示意图可表示的分子是( )
A.He B.Cl2 C.CO D.CH4
4.化学元素周期表已经诞生 150 多年了。联合国宣布 2019 年为“ 国际化学元素周期表年 ”。根据化学 元素周期表我们无法得知的是某元素( )
A. 一个原子核内的质子数
B. 一个原子的质量
C. 一个原子的核外电子数
D. 是金属还是非金属元素
5.氧化汞分子分解示意图如图所示。下列说法正确的是( )
A.在化学变化中, 分子可以分成原子
B.分子是化学变化中的最小粒子
C.在这个变化中, 原子的种类发生改变
第 1 页(共 11 页)
D.物质只能由分子构成,不能由原子构成
6.用“ ”“ o ”和“ . ”分别表示质子、中子和电子, 如图表示四种原子结构模型,下列
有关说法正确的是( )
A.甲、乙互为同位素 B.乙、丁为同一种元素
C.甲、丙的核电荷数不同 D.丙、丁为同一种原子
7.图中参加反应的甲、乙分子和生成的丙分子的个数比为( )
A.5:1:2 B.2:1:2 C.3:1:2 D.1:1:2
8.下列关于原子核的叙述: ①通常是由分子和电子构成; ②通常是由质子和中子构成;③带正电荷;
④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )
A. ②④⑥ B. ②③⑥ C. ①③⑤ D. ①④⑤
9.科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料, 反应的微观示意图如下图,
有关该反应的说法正确的是( )
A.该反应属于化合反应
B.反应前碳元素的化合价为+2 价
C.生成物的化学式可用 C2H2O 表示
D.参加反应的两物质的质量比为 1:1
10.不同的事物可用不同的符号来表示, 下列关于符号特点的说法,不确切的是( )
A.简明性 B.完整性 C.统一性 D.方便性
二 、填空题
第 2 页(共 11 页)
11.请先写出下列符号中数字“2”的意义, 然后试着归纳总结符号周围数字的意义。
意义: O2 ;2H ;
Mg2+ ;
我的归纳: ①符号的前面的数字表示 ;②符号右下角的数字表
示 ;
③符号右上角的数字表示 。
12.我们所知的原子结构,是经过科学家上百年的不懈努力探究得知的。
(1)卢瑟福核式结构模型是在利用 α 粒子轰击金箔实验的基础上提出的。仔细观察图甲、乙、丙三
图,能正确反映他的实验结果的示意图是图 。
(2)图丁为原子模型, 如果内圈表示原子核, 则外圈上的小球表示 。
13.根据下面元素周期表,回答有关问题:
(1)编号①②③④代表元素周期表中的四种元素, 其中属于金属元素的是 (填序号)。
(2)①处元素和②处元素形成的化合物的化学式为 。
14.月球上的“土壤 ”主要由月球岩石碎屑、粉末等物质组成。太空中长期的太阳风,使得月壤中携带
了大量的可作为清洁能源的氦-3,规模总计有 100 万至 500 万吨, 远远超过了地球的储量。
(1)月壤中岩石碎屑、粉末这些成分相当于地球土壤中的 。(“矿物质颗粒 ”或“腐
殖质”)
第 3 页(共 11 页)
(2)氦-3 是一种氦气同位素气体, 其化学符号 He,它的核内中子比“正常 ”氦少一个(如图),氦-3
原子内有 个电子。
15.如图所示为元素周期表的一部分,已知 B 元素的原子核内有 8 个质子, 请回答下列问题:
(1)写出 A 元素原子的核外电子数 。
(2)写出由 B、C 两种元素组成常见的化合物的化学式 。
(3)AC 两种元素在元素周期表中处于同一纵列, 每一个纵列叫做一个
三 、实验探究题
16.探究原子结构的奥秘。
【收集证据】绝大多数 α 粒子穿过金箔后仍沿原来的方向前进,但是有少数 α 粒子却发生了较大 的偏转,并且有极少数 α 粒子的偏转超过 90°, 有的甚至几乎达到 180°,像是被金箔弹了回来; 【猜想与假设】 α 粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而 结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的;
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布, 则极少数 α 粒子就 (填“会 ”或“不会”) 发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上 ”中的“很小的
结构 ”指的是 。
(2)1um 金箔包含了 3000 层金原子,绝大多数 α 粒子穿过后方向不变, 说明 ;
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为以下的
。
A.不可再分的实心球体
第 4 页(共 11 页)
B.正负电荷均匀分布
C.核位于原子中心,质量集中在核上
(4)1919 年,卢瑟福用加速了的高能 α 粒子轰击氮原子,结果有种微粒从氮原子被打出,而 α 粒子
留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
17.利用分子的性质解释下列事实:
(1)把糖块放在水里, 糖块逐渐消失,而水却有甜
味: 。
(2)气体容易压缩, 而液体、固态难以压缩: 。
(3)液氧和氧气状态不同,但具有相同的化学性质: 。
(4)蜡烛燃烧后生成二氧化碳和水: 。
四 、解答题
18.阅读有关材料并回答问题。
(1)原子或离子半径大小比较的一般方法是: 电子层数越多, 半径越大;若电子层数相同, 则核电荷 数越大,半径越小;若电子层数和核电荷数均相同, 则最外层电子数越多, 半径越大,则Al3+ 、F、Cl
三种微粒半径由小到大的顺序是 。
(2)对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,
其对应的阳离子的氧化性越弱.有Na、Mg 、K 其原子核外电子排布是:
NaOH、Mg(OH)2 、KOH 中碱性最强的是 ,Na+、Mg2+ 、K+ 中氧化性最强的是 。
19. “○”代表氢原子,“ 0 ”代表氧原子。由氢氧两种原子构成的分子如下“
(1)比较 A.B、D 可知: ;
(2)比较 C、E 可知: ;
(3)比较 B、D 可知: 。
20.人类对原子结构的认识, 经历了道尔顿、汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体 ”,汤姆生认为原子是“嵌着葡
第 5 页(共 11 页)
萄干的面包 ”,如今发现这些观点均是 (填“正确 ”或“错误”)的。
(2)卢瑟福核式结构模型是利用 a 粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果
的示意图是 (填序号)。
(3)从原子结构模型建立的过程中, 我们发现 (填序号)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
第 6 页(共 11 页)
专题 22 微粒化学(微观粒子结构模型)答案解析
一 、选择题
1.C
【解析】元素是具有相同核电荷数的同一类原子的统称, 据此分析判断。
每 100 毫升牛奶中含 60 亳克钠。这里的“钠 ”就是具有相同核电荷数的同一类原子, 指的的是元素,
故 C 正确, 而 A.B、D 错误。
2.D
3.C
【解析】A.氦气是由氦原子构成的, 不是由分子构成的, 故错误;
B.一个氯气分子是由两个相同的氯原子构成的,故错误;
C.一个一氧化碳分子是由一个碳原子和一个氧原子构成的,故正确;
D.一个甲烷分子是由 1 个碳原子和 4 个氢原子构成的,故错误.
4.B
5.A
【解析】 由图中可以知道,氧化汞分子分解成汞原子和氧原子,汞原子重新构成汞,氧原子重新构成
氧分子。原子在化学变化前后没有改变。
A.由图中可以知道,在化学变化中分子可以分成原子, 故 A 正确;
B.原子是化学变化中的最小粒子,故 B 错误;
C.化学反应前后原子的种类和个数都没有发生改变,故 C 错误;
D.氧化汞分子是由原子构成的, 汞是由汞原子构成,故 D 错误。
6.B
【解析】A.甲的质子数为 1,乙的质子数为 2,二者不是同位素, 故 A 错误;
B.乙和丁的质子数都是 2,为同种元素, 故 B 正确;
C.甲和丙的质子数都是 1,根据核电荷数=质子数可知,它们的核电荷数相等,故 C 错误;
D.甲的质子数为 1,丁的质子数为 2,二者不是一种原子,故 D 错误。
7.B
8.B
第 7 页(共 11 页)
【解析】原子核通常由质子和中子构成, 其中质子带正电荷, 中子不带电, 所以原子核显正电, 原子
核几乎占有了整个原子的质量, 但是其体积和整个原子相比几乎可以忽略。
①原子核由质子和中子构成,错误; ⑤原子核分为质子和中子,说明可以再分, 错误; 其它选项都正
确。
9.A
【解析】 有关微观模拟图的题目在解答时,要根据反应前后各微粒的构成确定反应物和生成物,写出
反应方程式,然后利用方程式判断。
该反应方程式为 CO2+H2=CH2O2,
A.该反应为化合反应,说法正确;
B、 反应前碳元素的化合价为+4 价 ,说法错误;
C、 生成物的化学式可用 CH2O2 表示, 说法错误;
D、 参加反应的两物质的质量比为 44:2,说法错误;
10.B
【解析】用符号能简单明了地表示事物, 还可避免由于事物外形不同和表达的文字语言不同而引起的
混乱。
不同的事物可用不同的符号来表示, 因此符号具有统一性;用符号能简单明了地表示事物, 因此符号
具有简明性而不具有完整性;符号还可避免由于事物外形不同和表达的文字语言不同而引起的混乱,
因此符号具有方便性。
二 、填空题
11.1 个氧分子由 2 个氧原子构成的;两个氢原子;每个镁离子带 2 个单位正电荷; 几个分子、原子
或离子;每个分子中含有几个原子; 每个离子带有几个电荷
【解析】意义: O2 表示 1 个氧分子由 2 个氧原子构成的; 2H 表示两个氢原子;Mg2+表示每个镁离子带 2 个单位正电荷;我的归纳: ①符号的前面的数字表示几个分子、原子或离子; ②符号右下角的数字
表示每个分子中含有几个原子; ③符号右上角的数字表示每个离子带有几个电荷。
故答案为: 表示 1 个氧分子由 2 个氧原子构成的;表示两个氢原子;表示每个镁离子带 2 个单位正
电荷; ①几个分子、原子或离子;②每个分子中含有几个原子;③每个离子带有几个电荷。
12.(1)乙
(2)核外电子
第 8 页(共 11 页)
【解析】 1、卢瑟福核式结构模型 认为原子是空心的, 原子核很小集中了几乎所有的质量, 原子核带
正电。 α 粒子 带正电,根据正电荷间的相互作用和原子核的特点可以确定实验结果的示意图;
2、原子核由带正电的质子和不带电的中子构成,电子在原子核外绕核运动。
(1)根据卢瑟福的原子核式结构可知, α 粒子不可能穿过原子核, 甲不可能。 α 粒子与原子核带同
种电荷,距离较近时会受到相斥的力的作用, 丙不可能。乙图符合实验结果;
(2) 图丁为原子模型, 如果内圈表示原子核,则外圈上的小球表示 核外电子。
13.(1)②
(2)MgO
【解析】(1)根据元素周期表确定元素名称,根据元素名称中是否含有金字旁确定是否属于金属元素;
(2)首先确定①和②的元素名称,再确定生成化合物的名称。
(1)根据图片可知,①为 O 元素,②为 Mg 元素, ③为 S 元素, ④为 Cl 元素,其中②号元素镁中含有
金字旁,属于金属元素。
(2)①为 O 元素, ②为 Mg 元素,二者生成的化合物为氧化镁,化学式为 MgO。
14.(1)矿物质颗粒
(2)2
【解析】(1)腐殖质指的是被生物分解时候的剩余的富含大量对植物有有利作用的土壤所含的物质, 也对整个生态系统有直接的正面作用。矿物质,是地壳中自然存在的化合物或天然元素,又称无机盐;
(2)在原子中,核外电子数等于质子数等于原子序数。
15.7 P2O5 族
【解析】
(1)素周期表是按原子的原子序数递增的顺序排列的, 则 A 元素的原子序数为 7,原子中原子序数=
核电荷数=质子数=核外电子数, 则 A 元素的原子核外有 7 个电子;
(2)B 和 D 在同一族, 最外层电子数相同,则 D 为硫元素,C 为磷元素, 所以由 B、C 两种元素组成常
化合物是五氧化二磷,其化学式为 P2O5;
(3)元素周期表中每一个纵列叫做一个族。
三 、实验探究题
16.(1)不会;原子核
第 9 页(共 11 页)
(2)B
(3)C
(4)质子
【解析】(1)原子核上 原子核外有一个非常大的空间 核外电子围绕原子核作高速运动。若原子质量、 正电荷在原子内均匀分布 则极少数 α 粒子就不会发生大角度散射 说明原子的质量主要集中在原子核
上 且正电荷不是均匀分布的 ;
(2)原子核外有一个非常大的空间 使绝大多数 α 粒子穿过后方向不变;
(3)A 是道尔顿的原子实心模型;B 是汤姆森的葡萄模型; C 为卢瑟福核式结构模型, 最完善的是 C; (4)氮原子有 7 个质子, 氧原子有 8 个质子, 既然 粒子留在了氮原子中,使氮原子变成了氧原子 ,
说明改变了质子数。
故答案为:(1)不会、原子核;(2)B;(3)C;(4)质子
17.(1)糖块溶解在水中后,糖分子不断地运动, 扩散到水分子中去了
(2)气体分子间间隔大,液体、固体分子间间隔较小
(3)同种物质的分子化学性质相同
(4)分子在化学变化中分成原子,原子又重新组合成新的分子
【解析】回答本题首先要熟悉分子的性质:分子质量和体积都很小;分子间有间隔;分子在不断地运 动; 同种物质的分子化学性质相同,不同种物质的分子化学性质不同;分子在化学变化中可分为原子,
原子又重新组合成新的分子。
四 、解答题
18.F、Al3+ 、 Cl KOH Mg2+
【解析】
(1)电子层数越多,半径越大;若电子层数相同,则核电荷数越大,半径越小; 若电子层数和核电荷
数均相同,则最外层电子数越多,半径越大,则Cl 电子层数最多,半径最大,Al3+ 、F电子层数相同,
Al3+ 最外层电子数大,Al3+ 半径大,故三种微粒半径由小到大的顺序是F、Al3+ 、Cl 。
(2)对金属元素来说,原子半径越大,最外层电子数越少,金属性越强,其对应的氢氧化物碱性越强,
则 NaOH、Mg(OH)2 、KOH 中碱性最强的是KOH ,对金属元素来说, 原子半径越大, 最外层电子
第 10 页(共 11 页)
数越少,金属性越强,其对应的氢氧化物碱性越强,其对应的阳离子的氧化性越弱,三种原子半径由
大到小的顺序是钾、钠、镁,则Na+、Mg2+ 、K+ 中氧化性最强的是Mg2+ 。
19.(1)分子可以由同种原子构成
(2)分子可以由不同种原子构成
(3)数量不相同的原子可以构成不同的分子
【解析】A 中氢分子只由氢原子构成,B 中氧分子只由氧原子构成,D 中臭氧分子只由氧原子构成, 分
析可知:分子可以由同种原子构成;
(2)C 中水分子由氢原子和氧原子构成, E 中过氧化氢分子也由氢原子和氧原子构成, 分析得到:分
子可以由不同种原子构成;
(3)B 中氧分子和 D 中臭氧分子都由氧原子构成, 只是数量不同, 分析得到:数量不相同的原子可以
构成不同的分子,
20.(1)错误
(2)乙
(3)A;B;D
【解析】(1)根据卢瑟福的核实结构可知,道尔顿最早提出原子的概念并认为原子是“不可再分的实
心球体 ”,汤姆生认为原子是“嵌着葡萄干的面包”,如今发现这些观点均是错误的。
(2)a 粒子带正电荷,原子核也带正电荷,根据"同种电荷相互排斥 ”可知, a 粒子会受到原子核的排 斥力而改变运动方向,即从上方经过的运动轨迹向上弯曲,从下方经过的运动轨迹向下弯曲。极少数 a
粒子正面撞向原子核,此时它们受到的排斥力最大,几乎沿原路返回, 故选乙。
(3)A.科学模型的建立是一个不断完善、不断修正的过程, 故 A 正确;
B.模型在科学研究中起着很重要的作用, 故 B 正确;
C.波尔的原子模型建立, 使人们对原子结构的认识达到了新的高度,但是距离完美还有一段距离,故
C 错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质, 故 D 正确。
第 11 页(共 11 页)
同课章节目录
