2024年中考化学二轮专题复习综合计算专项课件(共23张PPT)
文档属性
| 名称 | 2024年中考化学二轮专题复习综合计算专项课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 766.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 16:06:04 | ||
图片预览





文档简介
(共23张PPT)
综合计算专项
自主学习
问题思索1
读完题干,应该找到哪些信息呢?
1.书写化学方程式
2.圈画告诉的已知量和待求量
【典型例题】
在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加足量水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答问题:
(1)当滴加了73g稀盐酸时,放出气体的总质量为多少 g?
典型例题
Na2CO3+2HCl===2NaCl+H2O+CO2↑
自主学习
问题思索2
哪些已知量可以当做计算的“代入量”?
1、生成的气体或沉淀,直接作为代入量
2、溶液的质量×溶质质量分数=溶质质量
3、根据质量守恒定律求生成的气体或沉淀的质量
关注学考
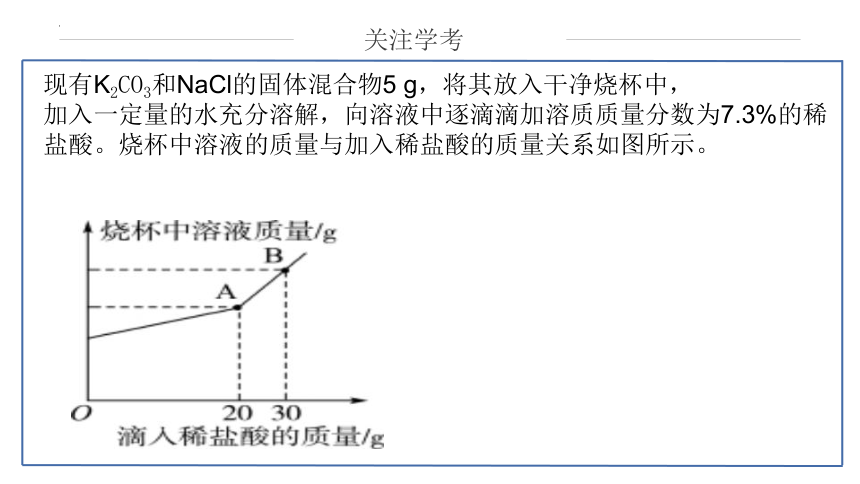
现有K2CO3和NaCl的固体混合物5 g,将其放入干净烧杯中,
加入一定量的水充分溶解,向溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸。烧杯中溶液的质量与加入稀盐酸的质量关系如图所示。
关注学考
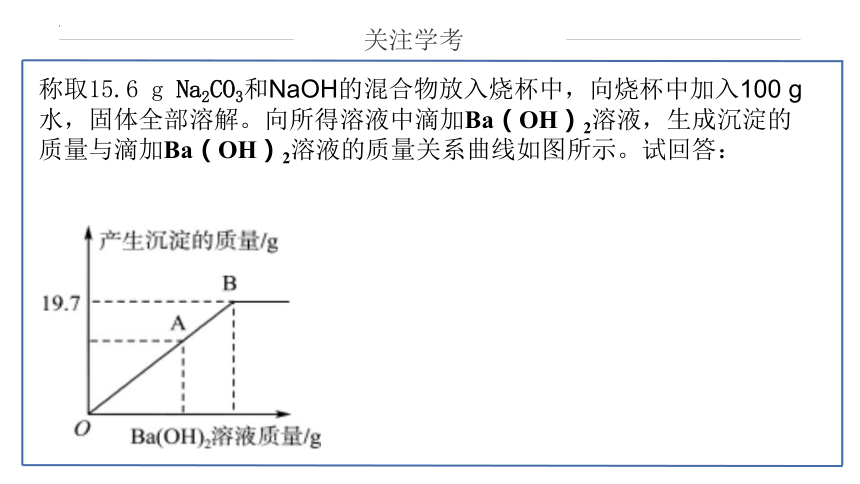
称取15.6 g Na2CO3和NaOH的混合物放入烧杯中,向烧杯中加入100 g水,固体全部溶解。向所得溶液中滴加Ba(OH)2溶液,生成沉淀的质量与滴加Ba(OH)2溶液的质量关系曲线如图所示。试回答:
自主学习
问题思索3
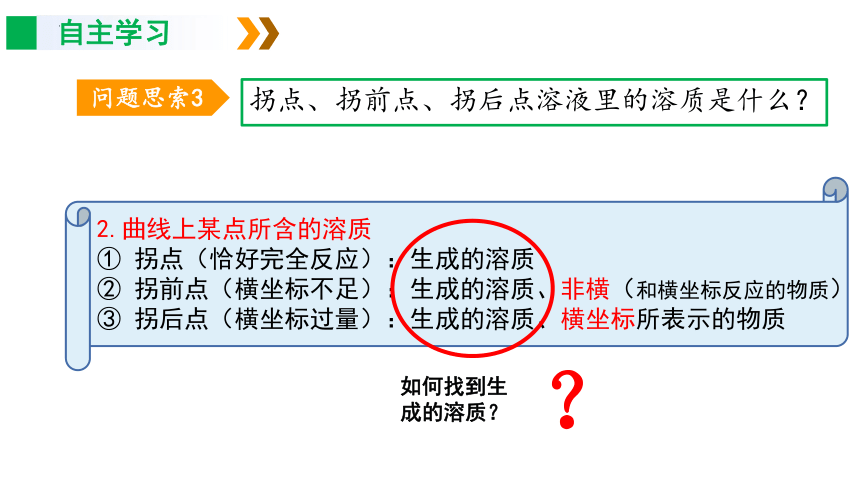
拐点、拐前点、拐后点溶液里的溶质是什么?
2.曲线上某点所含的溶质
① 拐点(恰好完全反应):生成的溶质
② 拐前点(横坐标不足):生成的溶质、非横(和横坐标反应的物质)
③ 拐后点(横坐标过量):生成的溶质、横坐标所表示的物质
?
如何找到生成的溶质?
关注学考
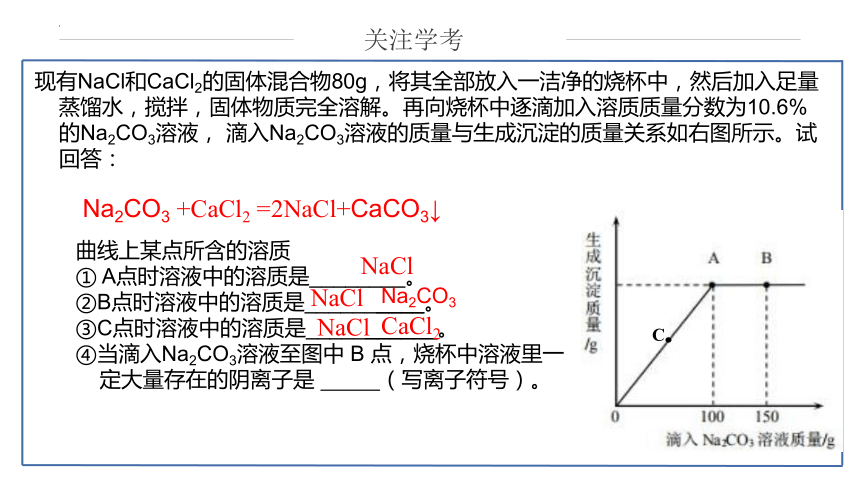
曲线上某点所含的溶质
① A点时溶液中的溶质是________。
②B点时溶液中的溶质是__________。
③C点时溶液中的溶质是___________。
④当滴入Na2CO3溶液至图中 B 点,烧杯中溶液里一定大量存在的阴离子是 (写离子符号)。
Na2CO3 +CaCl2 =2NaCl+CaCO3↓
现有NaCl和CaCl2的固体混合物80g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,固体物质完全溶解。再向烧杯中逐滴加入溶质质量分数为10.6%的Na2CO3溶液, 滴入Na2CO3溶液的质量与生成沉淀的质量关系如右图所示。试回答:
C
NaCl
NaCl
CaCl2
NaCl
Na2CO3
反应前后某纯量质量或纯量的质量分数
定量计算
所得不饱和溶液的质量
反应后所得溶质质量
?
反应后所得溶液质量的计算(质量守恒定律)
反应后所得溶液的质量 = 反应前所有物质的总质量(所有的溶质溶液)
—生成气体的质量
—生成沉淀的质量
—反应前不溶性物质质量
加入的物质
生成沉淀
烧杯内原液体
生成气体
不溶性杂质
反应后所得溶质质量的计算(看来源)
反应后所得溶质的质量 = 反应后生成的溶质质量+反应前的跟屁虫
(如果没有就不加)
设未知量
写方程式
标质量比
列比例式
解出答案
答出结论
提个醒
(1)设出的未知量不加单位,实际物质的质量要加单位
(2)写出的方程式要正确:物质的化学式书写无误
配平使其遵守遵循质量守恒定律
(3)找出各物质质量关系时a查准相对原子质量,算对分子量
b相对分子质量要乘以化学计量数
c相关量要上下对齐
(4)解未知数时,按要求保留有效数字
C
A拐点:刚好反应,溶质只有生成物
C拐前点:没反应完,溶质有生成物和剩余 物(和横坐标反应的物质)
B拐后点:反应完,溶质有生成物和横坐标加入物
CaCO3 + 2HCl ===CaCl2 + H2O + CO2↑
2NaOH + MgSO4 ===Mg(OH)2↓ + Na2SO4
1.定量研究化学反应的依据:质量守恒定律。
一点基本认识:任何化学变化都遵守质量守恒定律
三个核心观念:化学变化前后:物质总质量不变
化学变化前后:原子种类、数目不变
化学变化前后:元素种类、质量不变
学习任务三
化学反应的定量计算
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
室温下,某化学兴趣小组把溶质质量分数为 10%的 NaOH 溶液,逐滴加入盛有10 g CuSO4 不饱和溶液的烧杯中,生成沉淀的质量与滴入 NaOH 溶液的质量关系如下图所示。试回答下列问题:
例题分析
混合物溶于水
生成沉淀
滴加NaOH溶液
C
(1)在滴加NaOH 溶液过程中发生的化学反应是 。
2NaOH + CuSO4=Na2SO4+Cu(OH)2↓
关注学考
H2SO4 +BaCl2 =2HCl+BaSO4↓
现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如右图所示。试回答:
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。(计算结果精确至0.1g)
C
加入BaCl2溶液的质量/g
B
200 416
0
g
产生沉淀的质量
A
解:设硫酸钡沉淀的质量为X
mBaCl2=416g×10%=41.6g
208
41.6g
233
X
=
208
233
41.6g
X
X=46.6g
答:产生的沉淀的质量为46.6 g。
室温下,某化学兴趣小组把溶质质量分数为 10%的 NaOH 溶液,逐滴加入盛有10 g CuSO4 不饱和溶液的烧杯中,生成沉淀的质量与滴入 NaOH 溶液的质量关系如下图所示。试回答下列问题:
例题分析
C
当滴加溶质质量分数为10%的NaOH溶液80g时(即图中A 点),
(4)计算所得不饱和溶液的质量。
2NaOH + CuSO4=Na2SO4+Cu(OH)2↓
X
解:
mNaOH =
设氢氧化铜沉淀的质量为X
10% × 80 g = 8 g
8 g
80
98
80
8g
98
x
=
x=9.8g
m不饱和溶液 =
答:所得不饱和溶液的质量为80.2 g。
80 g + 10 g - 9.8 g = 80.2 g
【典型例题2】以反应物为纵坐标
(在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解。然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的明显实验现象是:① ,② 。
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是___________(写化学式) 。
(3)当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量。(计算结果精确至0.1g)
典型例题
3.图像数据呈现类
有气体生成
固体不断减少
CaCl2
CaCO3+2HCl=CaCl2+H2O+CO2↑
综合计算专项
自主学习
问题思索1
读完题干,应该找到哪些信息呢?
1.书写化学方程式
2.圈画告诉的已知量和待求量
【典型例题】
在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加足量水溶解,制成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答问题:
(1)当滴加了73g稀盐酸时,放出气体的总质量为多少 g?
典型例题
Na2CO3+2HCl===2NaCl+H2O+CO2↑
自主学习
问题思索2
哪些已知量可以当做计算的“代入量”?
1、生成的气体或沉淀,直接作为代入量
2、溶液的质量×溶质质量分数=溶质质量
3、根据质量守恒定律求生成的气体或沉淀的质量
关注学考
现有K2CO3和NaCl的固体混合物5 g,将其放入干净烧杯中,
加入一定量的水充分溶解,向溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸。烧杯中溶液的质量与加入稀盐酸的质量关系如图所示。
关注学考
称取15.6 g Na2CO3和NaOH的混合物放入烧杯中,向烧杯中加入100 g水,固体全部溶解。向所得溶液中滴加Ba(OH)2溶液,生成沉淀的质量与滴加Ba(OH)2溶液的质量关系曲线如图所示。试回答:
自主学习
问题思索3
拐点、拐前点、拐后点溶液里的溶质是什么?
2.曲线上某点所含的溶质
① 拐点(恰好完全反应):生成的溶质
② 拐前点(横坐标不足):生成的溶质、非横(和横坐标反应的物质)
③ 拐后点(横坐标过量):生成的溶质、横坐标所表示的物质
?
如何找到生成的溶质?
关注学考
曲线上某点所含的溶质
① A点时溶液中的溶质是________。
②B点时溶液中的溶质是__________。
③C点时溶液中的溶质是___________。
④当滴入Na2CO3溶液至图中 B 点,烧杯中溶液里一定大量存在的阴离子是 (写离子符号)。
Na2CO3 +CaCl2 =2NaCl+CaCO3↓
现有NaCl和CaCl2的固体混合物80g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,固体物质完全溶解。再向烧杯中逐滴加入溶质质量分数为10.6%的Na2CO3溶液, 滴入Na2CO3溶液的质量与生成沉淀的质量关系如右图所示。试回答:
C
NaCl
NaCl
CaCl2
NaCl
Na2CO3
反应前后某纯量质量或纯量的质量分数
定量计算
所得不饱和溶液的质量
反应后所得溶质质量
?
反应后所得溶液质量的计算(质量守恒定律)
反应后所得溶液的质量 = 反应前所有物质的总质量(所有的溶质溶液)
—生成气体的质量
—生成沉淀的质量
—反应前不溶性物质质量
加入的物质
生成沉淀
烧杯内原液体
生成气体
不溶性杂质
反应后所得溶质质量的计算(看来源)
反应后所得溶质的质量 = 反应后生成的溶质质量+反应前的跟屁虫
(如果没有就不加)
设未知量
写方程式
标质量比
列比例式
解出答案
答出结论
提个醒
(1)设出的未知量不加单位,实际物质的质量要加单位
(2)写出的方程式要正确:物质的化学式书写无误
配平使其遵守遵循质量守恒定律
(3)找出各物质质量关系时a查准相对原子质量,算对分子量
b相对分子质量要乘以化学计量数
c相关量要上下对齐
(4)解未知数时,按要求保留有效数字
C
A拐点:刚好反应,溶质只有生成物
C拐前点:没反应完,溶质有生成物和剩余 物(和横坐标反应的物质)
B拐后点:反应完,溶质有生成物和横坐标加入物
CaCO3 + 2HCl ===CaCl2 + H2O + CO2↑
2NaOH + MgSO4 ===Mg(OH)2↓ + Na2SO4
1.定量研究化学反应的依据:质量守恒定律。
一点基本认识:任何化学变化都遵守质量守恒定律
三个核心观念:化学变化前后:物质总质量不变
化学变化前后:原子种类、数目不变
化学变化前后:元素种类、质量不变
学习任务三
化学反应的定量计算
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
室温下,某化学兴趣小组把溶质质量分数为 10%的 NaOH 溶液,逐滴加入盛有10 g CuSO4 不饱和溶液的烧杯中,生成沉淀的质量与滴入 NaOH 溶液的质量关系如下图所示。试回答下列问题:
例题分析
混合物溶于水
生成沉淀
滴加NaOH溶液
C
(1)在滴加NaOH 溶液过程中发生的化学反应是 。
2NaOH + CuSO4=Na2SO4+Cu(OH)2↓
关注学考
H2SO4 +BaCl2 =2HCl+BaSO4↓
现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如右图所示。试回答:
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量。(计算结果精确至0.1g)
C
加入BaCl2溶液的质量/g
B
200 416
0
g
产生沉淀的质量
A
解:设硫酸钡沉淀的质量为X
mBaCl2=416g×10%=41.6g
208
41.6g
233
X
=
208
233
41.6g
X
X=46.6g
答:产生的沉淀的质量为46.6 g。
室温下,某化学兴趣小组把溶质质量分数为 10%的 NaOH 溶液,逐滴加入盛有10 g CuSO4 不饱和溶液的烧杯中,生成沉淀的质量与滴入 NaOH 溶液的质量关系如下图所示。试回答下列问题:
例题分析
C
当滴加溶质质量分数为10%的NaOH溶液80g时(即图中A 点),
(4)计算所得不饱和溶液的质量。
2NaOH + CuSO4=Na2SO4+Cu(OH)2↓
X
解:
mNaOH =
设氢氧化铜沉淀的质量为X
10% × 80 g = 8 g
8 g
80
98
80
8g
98
x
=
x=9.8g
m不饱和溶液 =
答:所得不饱和溶液的质量为80.2 g。
80 g + 10 g - 9.8 g = 80.2 g
【典型例题2】以反应物为纵坐标
(在一烧杯中盛有42.2g CaCO3和CaCl2的粉末状混合物,向其中加入188.8g水,使混合物中的可溶物完全溶解。然后再向其中逐滴加入溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的明显实验现象是:① ,② 。
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是___________(写化学式) 。
(3)当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量。(计算结果精确至0.1g)
典型例题
3.图像数据呈现类
有气体生成
固体不断减少
CaCl2
CaCO3+2HCl=CaCl2+H2O+CO2↑
同课章节目录
