化学人教版(2019)选择性必修2 2.3.1共价键的极性(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1共价键的极性(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 20:54:34 | ||
图片预览








文档简介
(共22张PPT)
第三节 分子结构与物质的性质
第1课时 共价键的极性
——被静电气球吸引的H2O
第二章 分子结构与性质
键合原子的电负性差值越大,共用电子对偏移程度 ,形成的共价键的极性 。
【思考】极性共价键、非极性共价键的概念是什么?
共价键
极性共价键:
非极性共价键:
由不同原子形成的共价键,共用电子对会发生偏移
由相同原子形成的共价键,共用电子对不发生偏移
【思考】为什么共用电子对会发生偏移?已知H的电负性为2.1,比较HF、HCl、HBr、HI中共价键的极性
实质是原子对键合电子的吸引力不同,即元素的电负性的不同。
越大
越强
【练习】1、下列物质中含有非极性键的是 ,含有极性键的是 。
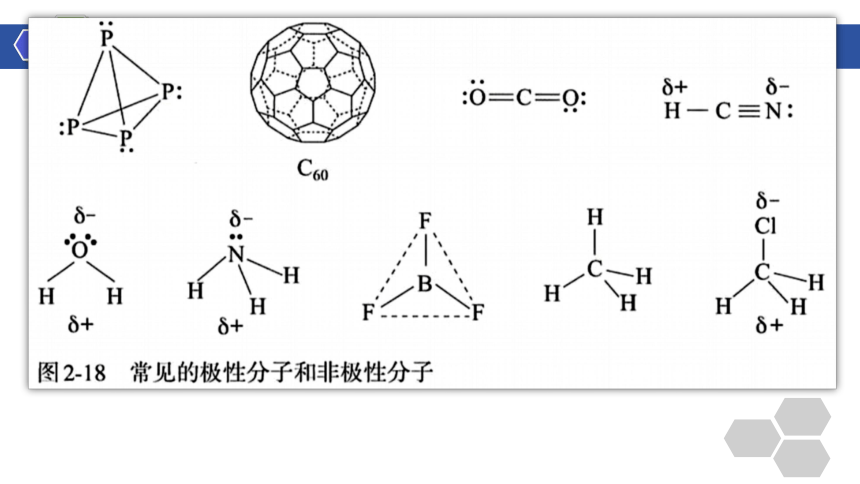
H2、O2、Cl2、HCl、P4、C60、CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
H2、O2、Cl2、P4、C60
HCl、CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
一、共价键的极性
3.0
2.1
H — Cl
1、键的极性和分子的极性:
(1)键的极性:由于共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
(2)极性向量
极性向量可描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键有无极性向量?
δ+
δ-
非极性键无极性向量
【思考】什么是极性分子和非极性分子?
(3)分子的极性
①极性分子:分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子。
δ+
δ-
H—F
②非极性分子:分子中的正电中心和负电中心重合
O=O
①只含非极性键的分子都是非极性分子
②含极性键
含极性键的双原子分子都是极性分子
含极性键的多原子分子空间结构对称的是非极性分子
非极性分子
极性分子
非极性分子
(如CO2、BF3、CH4等的直线形、平面三角形、正四面体形)
【思考】共价键极性与分子极性是否一致?
不一定
③化学键的极性的向量和是否为零、分子的正电中心和负电中心是否重合
极性向量和=0
CO2
±
非极性分子
δ+
δ-
δ-
极性向量和≠0
极性分子
δ-
δ+
δ+
δ+
【思考】水分子是否为极性分子?为什么会被静电气球吸引?
H2O极性分子
δ+
δ-
分子中的正电中心和负电中心不重合,使分子的氢原子一侧呈正电性(δ+),氧原子一侧呈负电性(δ-)。当带负电的气球靠近时,水流会被吸引。
南方55页:问题探究
用酸式滴定管分别盛装A和B两种纯液体,打开活塞,让A和B呈线状慢慢流下。将摩擦带电的玻璃棒分别接近A和B纯液体流,现象如图所示。根据实验现象分析A、B两种分子是极性分子还是非极性分子,并简要说明判断依据。
δ+
δ-
O3中为极性键,臭氧分子为极性分子
疏水基团:没有
或几乎没有极性,如烃基
亲水基团:有极性
2、键的极性对化学性质的影响
+ H+
— H
δ+
δ-
以CH3COOH为例
①羧酸中羟基的极性越大(即共用电子对偏离H),羟基越容易断开,酸性越强。
酸性增强
推电子基团
— H
δ+
δ-
吸电子
— H
δ+
δ-
看电负性(烷基、-X为例)
【思考】比较甲酸、乙酸、丙酸的酸性,你能得出什么规律?
烷基是推电子基团,烷基越长,推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越小
【思考】比较三氟乙酸和三氯乙酸的酸性,你能得出什么规律?
(F和Cl的电负性分别为4.0、3.0)
电负性:F>Cl,使羧酸中羟基的极性更大,更易电离出氢离子,
羧酸的酸性更强
【思考】乙醇和水分别与金属钠反应,哪个反应更剧烈,为什么?
C2H5—O—H
H—O—H
乙醇分子中的C2H5—是推电子基团,使羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
钠和水的反应
钠和乙醇的反应
A
C
B
谢谢观看
第三节 分子结构与物质的性质
第1课时 共价键的极性
——被静电气球吸引的H2O
第二章 分子结构与性质
键合原子的电负性差值越大,共用电子对偏移程度 ,形成的共价键的极性 。
【思考】极性共价键、非极性共价键的概念是什么?
共价键
极性共价键:
非极性共价键:
由不同原子形成的共价键,共用电子对会发生偏移
由相同原子形成的共价键,共用电子对不发生偏移
【思考】为什么共用电子对会发生偏移?已知H的电负性为2.1,比较HF、HCl、HBr、HI中共价键的极性
实质是原子对键合电子的吸引力不同,即元素的电负性的不同。
越大
越强
【练习】1、下列物质中含有非极性键的是 ,含有极性键的是 。
H2、O2、Cl2、HCl、P4、C60、CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
H2、O2、Cl2、P4、C60
HCl、CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
一、共价键的极性
3.0
2.1
H — Cl
1、键的极性和分子的极性:
(1)键的极性:由于共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
(2)极性向量
极性向量可描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键有无极性向量?
δ+
δ-
非极性键无极性向量
【思考】什么是极性分子和非极性分子?
(3)分子的极性
①极性分子:分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子。
δ+
δ-
H—F
②非极性分子:分子中的正电中心和负电中心重合
O=O
①只含非极性键的分子都是非极性分子
②含极性键
含极性键的双原子分子都是极性分子
含极性键的多原子分子空间结构对称的是非极性分子
非极性分子
极性分子
非极性分子
(如CO2、BF3、CH4等的直线形、平面三角形、正四面体形)
【思考】共价键极性与分子极性是否一致?
不一定
③化学键的极性的向量和是否为零、分子的正电中心和负电中心是否重合
极性向量和=0
CO2
±
非极性分子
δ+
δ-
δ-
极性向量和≠0
极性分子
δ-
δ+
δ+
δ+
【思考】水分子是否为极性分子?为什么会被静电气球吸引?
H2O极性分子
δ+
δ-
分子中的正电中心和负电中心不重合,使分子的氢原子一侧呈正电性(δ+),氧原子一侧呈负电性(δ-)。当带负电的气球靠近时,水流会被吸引。
南方55页:问题探究
用酸式滴定管分别盛装A和B两种纯液体,打开活塞,让A和B呈线状慢慢流下。将摩擦带电的玻璃棒分别接近A和B纯液体流,现象如图所示。根据实验现象分析A、B两种分子是极性分子还是非极性分子,并简要说明判断依据。
δ+
δ-
O3中为极性键,臭氧分子为极性分子
疏水基团:没有
或几乎没有极性,如烃基
亲水基团:有极性
2、键的极性对化学性质的影响
+ H+
— H
δ+
δ-
以CH3COOH为例
①羧酸中羟基的极性越大(即共用电子对偏离H),羟基越容易断开,酸性越强。
酸性增强
推电子基团
— H
δ+
δ-
吸电子
— H
δ+
δ-
看电负性(烷基、-X为例)
【思考】比较甲酸、乙酸、丙酸的酸性,你能得出什么规律?
烷基是推电子基团,烷基越长,推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越小
【思考】比较三氟乙酸和三氯乙酸的酸性,你能得出什么规律?
(F和Cl的电负性分别为4.0、3.0)
电负性:F>Cl,使羧酸中羟基的极性更大,更易电离出氢离子,
羧酸的酸性更强
【思考】乙醇和水分别与金属钠反应,哪个反应更剧烈,为什么?
C2H5—O—H
H—O—H
乙醇分子中的C2H5—是推电子基团,使羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
钠和水的反应
钠和乙醇的反应
A
C
B
谢谢观看
