邓州市第六高级中学校2023-2024学年高二下学期开学考试化学试卷(含解析)
文档属性
| 名称 | 邓州市第六高级中学校2023-2024学年高二下学期开学考试化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 954.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 20:49:55 | ||
图片预览



文档简介
邓州市第六高级中学校2023-2024学年高二下学期开学考试化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.有一块铁的“氧化物”样品,用140mL5.0盐酸恰好将之完全溶解,所得溶液还能吸收0.56L(标况下),恰好使其中的全部转变为,则该样品可能的化学式为( )
A. B. C. D.
2.M、R、T、X、Y为短周期主族元素,且原子序数依次增大。M的基态原子所含3个能级中电子数均相等;T的基态原子能级上的未成对电子数与M原子的相同;X与T位于同一周期;Y和T位于同一主族。下列说法正确的是( )
A.原子半径: B.第一电离能:
C.X的最高正化合价为 D.Y的氧化物对应水化物一定为强酸
3.某有机物的结构简式为,该分子中键与键的个数比为( )
A. B. C. D.
4.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 检验纯碱中是否存在NaCl 向待测液中加入AgNO3溶液
B 检验新制氯水的酸碱性 将pH试纸放在玻璃片上,用玻璃棒蘸取新制氯水点在试纸中部,再与标准比色卡对照
C 除去气体中混杂的少量HCl气体 将混合气体依次通过盛有饱和溶液和浓硫酸的洗气瓶
D 测定和固体混合物中的质量分数 准确称取ag样品和试管总质量。充分加热后冷却至室温,再称量总质量为bg
A.A B.B C.C D.D
5.下列有关胶体的说法错误的是( )
A.用激光笔照射可以区别溶液和胶体
B.向沸水中滴加饱和溶液可以制备胶体
C.胶体区别于溶液的本质特征是具有丁达尔效应
D.胶体和溶液都是混合物,它们属于不同的分散系
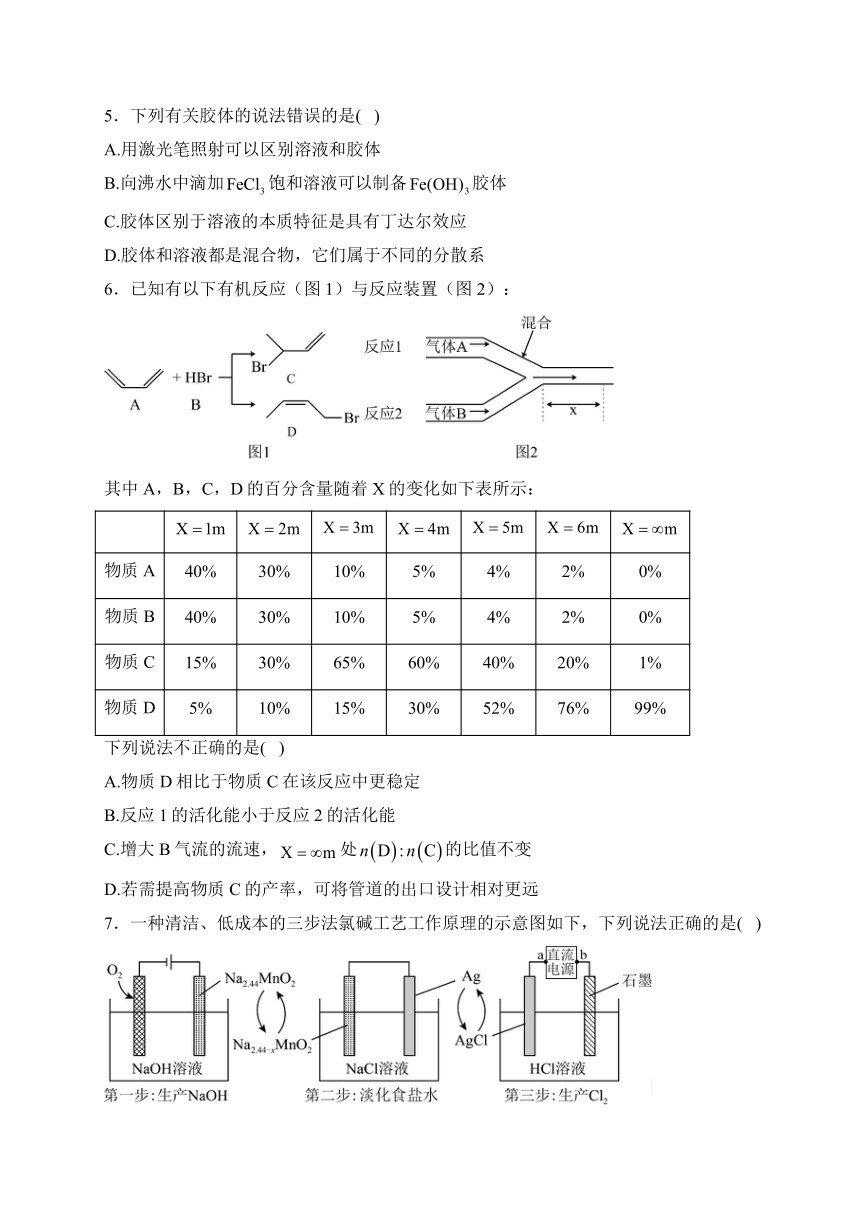
6.已知有以下有机反应(图1)与反应装置(图2):
其中A,B,C,D的百分含量随着X的变化如下表所示:
物质A 40% 30% 10% 5% 4% 2% 0%
物质B 40% 30% 10% 5% 4% 2% 0%
物质C 15% 30% 65% 60% 40% 20% 1%
物质D 5% 10% 15% 30% 52% 76% 99%
下列说法不正确的是( )
A.物质D相比于物质C在该反应中更稳定
B.反应1的活化能小于反应2的活化能
C.增大B气流的流速,处的比值不变
D.若需提高物质C的产率,可将管道的出口设计相对更远
7.一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法正确的是( )
A.第三步中a为直流电源的正极
B.第一步生产的总反应为
C.第二步为原电池,正极质量增加,负极质量减少
D.第三步外电路上每转移电子,电解池中就有被电解
8.向溶液中通入至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是( )
A.溶液 B.溶液 C.溶液 D.溶液
9.下列各组离子在水溶液中能大量共存的是( )
(1)
(2)
(3)
(4)
(5)
(6)
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
10.当不考虑水的电离时,在氢硫酸溶液中,下列的离子浓度关系中正确的是( )
A. B.
C. D.
11.沙丁胺醇是目前治疗哮喘的常用药物,其结构简式如图所示.下列叙述正确的是( )
A.沙丁胺醇分子中含有2个手性碳原子
B.该分子中C、N原子的杂化方式完全相同
C.该物质可以发生氧化反应,但不能发生还原反应
D.该物质分别与足量的反应,消耗两者的量分别为
12.完成下述实验,装置或试剂不正确的是( )
实验室收集 验证碳酸氢钠受热分解 验证易溶于水且溶液呈碱性 除去中混有的少量HCl
A B C D
A.A B.B C.C D.D
13.为除去粗盐水中含有的杂质、和,得到精制食盐,设计了如下实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去
B.步骤ⅰ、ⅱ的顺序可以互换
C.滤液2中有四种离子:、、、
D.步骤iv中发生的离子反应为:、
14.蔗糖与浓硫酸发生作用的过程如下图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中发生的反应
二、多选题
15.Co是维生素的重要组成元素。工业上可用下图装置制取单质Co并获得副产品盐酸。下列说法错误的是( )
A.电势:石墨电极电极
B.A膜为阴离子交换膜
C.阳极反应式:
D.外电路中通过时,阴极室溶液质量减轻59g
三、填空题
16.由和组成的混合气体,其平均相对分子质量为12.4,取此混合气体0.5mol充入密闭容器中,使之反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.6倍,求:
(1)反应前混合气体中和的体积比_______;
(2)平衡混合气体中和的物质的量_______;
(3)达到平衡时的转化率_______。
17.卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙等食品添加剂。和在结构和性质上有很多相似的地方。请完成下列问题:
(1)属于_______(填“离子化合物”或“共价化合物”),其阴、阳离子个数比为_______。
(2)与水反应的化学方程式为_______,生成单质气体,转移的电子数为_______。(用代表阿伏加德罗常数)
(3)与二氧化碳反应的化学方程式为_______,该反应属于_______。
A.置换反应
B.氧化还原反应
C.复分解反应
(4)请综合上述题目,分析为何卫生部禁止在面粉生产中添加过氧化钙等食品添加剂。_______。
四、实验题
18.Ⅰ.金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在中燃烧,可能产物为MgO、和。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:气体能被NaOH溶液吸收,极易与水反应。
(1)实验中,装置依次连接的顺序为A_______(填字母);装置B的作用是_______。
(2)用来检验的实验装置为_______(填字母)。
(3)设计实验证明产物中存在:_______。
Ⅱ.二氧化氯()是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备并验证其某些性质。回答下列问题:
(4)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是_______。
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是_______。
(6)B装置的作用是_______。C装置用来吸收,则C中液体宜选用_______(填序号)。
①热水
②冰水
③饱和食盐水
(7)D装置中与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为,D装置中生成这两种钠盐的化学方程式为_______;饱和溶液在温度低于38℃时析出晶体,在温度高于38℃时析出晶体。请补充从溶液中制得晶体的操作步骤:A._______;B._______;C.洗涤;D.干燥。
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:_______。
19.1,6 己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6 己二酸。反应原理为:
相关物质的物理性质见下表:
试剂 相对分子质量 密度/() 熔点/℃ 沸点/℃ 溶解性
环己醇 100 0.962 25.9 161.8 可溶于水、乙醇、乙醚
1,6-己二酸 146 1.360 152 330.5 微溶于冷水,易溶于乙醇
117 2.326 210(分解) — 微溶于冷水,易溶于热水
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03g固体和18mL浓(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为_______,其作用是_______。
(2)B中发生反应的离子方程式为_______(其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为_______,滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应的_______0(填“>”或“<”)。
(4)将步骤Ⅲ补充完整:_______。步骤Ⅳ提纯方法的名称为_______。如图为1,6 己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为;该溶液的物质的量浓度为_______。
(5)最终得到1,6 己二酸产品4.810g,则1,6 己二酸的产率为___________。
A.46.07% B.57.08% C.63.03% D.74.61%
参考答案
1.答案:C
解析:试题解析:=0.14L×5.0mol/L=0.7mol,由氧化物和盐酸反应生成水可知,氧化物中含有=0.35mol,所得溶液还能吸收=0.025mol,恰好使其中的全部转变为,反应后所得溶液为,因=0.7mol+0.025mol×2=0.75mol,则=0.25mol,所以氧化物中=0.25:0.35=5:7,所以化学式为,故选C。
2.答案:B
解析:A.Y为S、X为F、T为O,同一周期主族元素从左向右原子半径逐渐减小,同一主族元素从上向下原子半径逐渐增大,因此原子半径:,A错误;
B.R为N、T为O、M为C,同一周期主族元素从左向右第一电离能呈增大趋势,同一主族元素从上向下第一电离能逐渐减小,ⅡA全满,ⅤA半满反常,第一电离能:,B正确;
C.X为F,无最高正价,C错误;
D.Y为S,Y的氧化物对应水化物可能为不一定为强酸,D错误;
故选B。
3.答案:A
解析:单键全是键;双键中一个键一个键,由有机物的结构可知,该分子中键数目为19个,键数目为3个,综上所述,故选A。
4.答案:C
解析:A.溶液与碳酸钠溶液反应生成白色沉淀,溶液与NaCl反应生成白色沉淀,无法检验,故A错误;
B.新制氯水中含有,具有漂白性,会使试纸褪色,无法对比测酸碱性,故B错误;
C.饱和溶液可以除去气体中混杂的少量气体,浓硫酸起到干燥作用,故C正确;
D.测定和固体混合物中的质量分数,应该准确称取ag样品和试管总质量,加强热后在干燥器冷却至室温,再称量得到总质量,不能直接在空气中冷却,否则影响测定结果,故D错误;
故选C。
5.答案:C
解析:A.胶体的分散质粒子能够使光线发生散射作用而沿直线传播,即用光照射会产生一条光亮的通路,而溶液的溶质离子不能使光线发生散射作用,因此用光照射不能产生光亮的通路,因此用激光笔照射区分溶液和胶体,A正确;
B.把几滴饱和溶液滴入到沸腾的蒸馏水中,继续加热至液体呈红褐色,停止加热,得到胶体,B正确;
C.胶体区别于其他分散系的本质特征是分散质微粒直径的大小,C错误;
D.分散系根据分散微粒直径大小分为溶液、胶体、浊液,D正确;
故合理选项是C。
6.答案:D
解析:A.随X的增加,C的含量先增加后减少,D的含量增加,这说明生成C的反应速率快,所以物质D相比于物质C在该反应中更稳定,A正确;
B.生成C的反应速率快,所以反应1的活化能小于反应2的活化能,B正确;
C.时,反应物全部转化为生成物,所以增大B气流的流速,处的比值不变,C正确;
D.随X的增加,C的含量先增加后减少,D的含量增加,因此若需提高物质C的产率,可将管道的出口设计相对更近,而不是更远,D错误;
答案选D。
7.答案:B
解析:A.由图可知,第三步中Ag电极的变化是AgCl得到电子转化为Ag,发生还原反应,是阴极,则a为直流电源的负极,故A错误;
B.第一步为电解池,阳极反应为,阴极反应为,根据得失电子守恒,可得第一步电解池的总反应为,故B正确;
C.第二步为原电池,正极反应为,负极反应为,生成的AgCl附着在负极表面,故正、负极质量均增加,故C错误;
D.第三步的总反应为,溶液中HCl的物质的量保持不变,故D错误;
故答案为:B。
8.答案:B
解析:A.具有还原性,能被离子氧化为离子,所以再向溶液中加入溶液,生沉淀,A正确;
B.氯化铝溶液与溶液、都不反应,加入氯化铝溶液后不会生成沉淀,B错误;
C.向溶液中加入硫化钠溶液,会发生反应:,溶液变浑浊,C正确;
D.溶液中含有离子,加入溶液生成AgCl沉淀,D正确;
故选B。
9.答案:B
解析:(1)在酸性条件下,和都可以氧化,故不能大量共存,不符合题意;
(2)、都与要反应,故不能大量共存,不符合题意;
(3)相互间不反应,可以大量共存,符合题意;
(4)相互间不反应,可以大量共存,符合题意;
(5)与、都要反应,故不能大量共存,不符合题意;
(6)与要反应,故不能大量共存,不符合题意;
符合题意的有:(3)和(4)。
答案选B。
10.答案:A
解析:为二元弱酸,在水中存在电离平衡,电离方程式为:、;
A.在氢硫酸溶液中,存在电荷守恒:(不考虑水的电离时),故A正确;
B.溶液中存在电荷守恒:,故B错误;
C.为二元弱酸,主要以第一步电离为主,第二步电离比第一步电离弱得多,所以比小很多,故C错误;
D.为二元弱酸,主要以第一步电离为主,第二步电离比第一步电离弱得多,所以,故D错误;
故本题选A.
11.答案:D
解析:A.该物质苯环上较长取代基中连有醇羟基的碳原子为手性碳原子,分子中只含有1个手性碳原子,A错误;
B.该分子中,C原子有和两种杂化方式,N原子采取杂化,B错误;
C.该物质含有苯环,可以与氢气发生加成反应,该加成反应属于还原反应,C错误;
D.羟基都能与反应,酚羟基又可以与反应,该物质分别与足量的反应时消耗两者的量分别为,D正确;
故选D。
12.答案:A
解析:A.能和水反应,不能用排水法收集,故选A;
B.若澄清石灰水变浑浊,则证明碳酸氢钠分解放出二氧化碳,故不选B;
C.烧瓶内形成红色喷泉,证明易溶于水且溶液呈碱性,故不选C;
D.二氧化碳不溶于不含碳酸氢钠溶液,HCl能与碳酸氢钠反应放出二氧化碳气体,用饱和碳酸氢钠溶液除二氧化碳中的氯化氢,故不选D;
选A。
13.答案:C
解析:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,NaOH溶液的作用是除去,A正确;
B.加入过量氢氧化钡(或氯化钡)溶液是除去硫酸根离子,加入过量氢氧化钠溶液是除去镁离子,加入过量碳酸钠溶液目的是除去钙离子和过量钡离子,则加入氢氧化钠和氢氧化钡(或氯化钡)溶液的顺序可以调换,但是加入碳酸钠必须在加入氢氧化钡(或氯化钡)溶液之后,B正确;
C.滤液2中除了四种离子:、、、,还含有过量的钡离子,C错误;
D.滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,反应为、,D正确;
故选C。
14.答案:C
解析:A.浓硫酸具有脱水性,能将有机物中的H原子和O原子按2∶1的比例脱除,蔗糖中加入浓硫酸,白色固体变黑,体现浓硫酸的脱水性,A项正确;
B.浓硫酸脱水过程中释放大量热,此时发生反应,产生大量气体,使固体体积膨胀,B项正确;
C.结合选项B可知,浓硫酸脱水过程中生成的SO2能使品红溶液褪色,体现浓硫酸的强氧化性,C项错误;
D.白色固体变黑,过程中发生的反应,D项正确;
故选C。
15.答案:BD
解析:该装置为电解池,左侧为阳极,电极反应式为,右侧为阴极,电极反应式为,A为阳离子交换膜,阳极室的移动向产品室,B为阴离子交换膜,阴极室的移动向产品室,在产品室获得盐酸,据此解答。
解析:A.石墨电极与电源正极相连作阳极,Co电极与电源负极相连作阴极,因此电势:石墨电极>Co电极,A正确;
B.根据分析可知,A为阳离子交换膜,B为阴离子交换膜,B错误;
C.阳极反应式:,C正确;
D.外电路中通过时,有1mol转化为Co,有2mol从阴极室移动向产品室,则阴极溶液减少1mol,质量减少,D错误;
故选BD。
16.答案:(1)2:3
(2)
(3)
解析:(1)和按一定比例混合,设氮气为xmol,氢气为ymol,其平均相对分子质量为12.4,则=12.4,解得=2:3,相同条件下物质的量之比等于体积之比,所以体积为2:3。
(2)由(1)可知,0.5mol该混合气体,物质的量分别为0.2mol、0.3mol,根据已知条件列出“三段式”
达到平衡后容器内压强是相同条件下反应前压强的0.6倍,则=0.6,解得x=0.1mol,平衡时。
(3)氮气的转化率为×100%=50%。
17.答案:(1)离子化合物;1:1
(2);2
(3);B
(4)易与空气中的水和二氧化碳反应,反应放热可能导致危险;
解析:(1)由和组成,属于离子化合物,阴阳离子个数比为1:1;
(2)与水反应生成氢氧化钙和氧气,反应方程式为:;由反应可知生成1mol氧气时转移2mol电子即2;
(3)与二氧化碳反应生成碳酸钙和氧气,反应方程式为:;由反应特征可知,该反应属于氧化还原反应;
(4)易与空气中的水和二氧化碳反应,反应放热可能导致危险;另外禁止添加过氧化钙能减少不必要化学品摄入,有利于身体健康。
18.答案:(1)BCBED;在C的两侧防止水蒸气进入C中
(2)D
(3)取C中少量反应产物,加入水中产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝。
(4)水浴加热
(5)降低的浓度(或减小的体积分数),防止爆炸
(6)安全瓶,防止倒吸;②
(7);蒸发结晶;趁热过滤
(8)取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不恢复红色
解析:(1)装置A中Cu与浓硝酸反应生成的气体为,用装置B干燥剂干燥,通入硬质玻璃管C与镁粉发生反应,用E装置除去多余的,装置D用排水法收集,为防止E中的水分进入装置C使氮化镁水解,在E装置前也要连B装置干燥,故连接装置的顺序为ABCBED;根据分析可知装置B的作用是在C的两侧防止水蒸气进入C中;
(2)根据分析可知用来检验,的实验装置为D
(3)氮化镁能与水反应生成氢氧化镁和氨气,则检验氮化镁的实验操作为取少量反应后的固体产物,加入水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色
(4)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是水浴加热,故答案为:水浴加热;
(5)通入氮气的主要作用有2个,一是可以起到搅拌作用,二是稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸,故答案为:降低的浓度(或减小的体积分数),防止爆炸;
(6)B装置为安全瓶,可起到防止倒吸的作用,C用于吸收,为避免温度过高,可用冷水,故答案为:安全瓶,防止倒吸;②;
(7)装置D中与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为,另一种为,装置C中生成这两种钠盐的化学方程式为,饱和溶液在温度低于38℃时析出晶体,在温度高于38℃时析出晶体,则从溶液中制得晶体的操作步骤:A.蒸发结晶;B.趁热过滤;C.洗涤;D.干燥故答案为:;蒸发结晶;趁热过滤;
(8)二氧化氯可使品红褪色,检验是否具有永久漂白性,可取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色,故答案为:取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色。
19.答案:(1)球形冷凝管;冷凝回流,减少反应物损失,导出气体
(2)
(3)浓硝酸在加热时分解生成;<
(4)用冷水洗涤晶体2~3次;重结晶;2.89
(5)B
解析:(1)根据仪器A的形状可知,仪器A的名称为球形冷凝管,其作用是冷凝回流,减少反应物损失,导出气体;
(2)B中发生反应为二氧化氮和氢氧化钠的反应,生成硝酸钠、亚硝酸钠和水,离子方程式为;
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为浓硝酸具有不稳定性,在加热时分解生成、水和氧气;滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应放热,;
(4)由于1,6 己二酸微溶于冷水,用冷水洗涤晶体2~3次,减少洗涤时的损耗;将1,6 己二酸粗产品进行提纯,步骤Ⅳ提纯方法的名称为重结晶;根据图中1,6 己二酸在水中的溶解度曲线,80℃时1,6 己二酸的溶解度为0.73g,根据质量分数为,溶液的密度为;该溶液的物质的量浓度为;
(5)由表中数据可知,6mL环己醇的密度为,摩尔质量为100g/mol,得到质量为,根据+2+2+2+6+6+3,得到~~,设的质量的x,计算得的理论产量为8.427g,最终得到1,6 己二酸产品4.810g,则1,6 己二酸的产率为。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.有一块铁的“氧化物”样品,用140mL5.0盐酸恰好将之完全溶解,所得溶液还能吸收0.56L(标况下),恰好使其中的全部转变为,则该样品可能的化学式为( )
A. B. C. D.
2.M、R、T、X、Y为短周期主族元素,且原子序数依次增大。M的基态原子所含3个能级中电子数均相等;T的基态原子能级上的未成对电子数与M原子的相同;X与T位于同一周期;Y和T位于同一主族。下列说法正确的是( )
A.原子半径: B.第一电离能:
C.X的最高正化合价为 D.Y的氧化物对应水化物一定为强酸
3.某有机物的结构简式为,该分子中键与键的个数比为( )
A. B. C. D.
4.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 检验纯碱中是否存在NaCl 向待测液中加入AgNO3溶液
B 检验新制氯水的酸碱性 将pH试纸放在玻璃片上,用玻璃棒蘸取新制氯水点在试纸中部,再与标准比色卡对照
C 除去气体中混杂的少量HCl气体 将混合气体依次通过盛有饱和溶液和浓硫酸的洗气瓶
D 测定和固体混合物中的质量分数 准确称取ag样品和试管总质量。充分加热后冷却至室温,再称量总质量为bg
A.A B.B C.C D.D
5.下列有关胶体的说法错误的是( )
A.用激光笔照射可以区别溶液和胶体
B.向沸水中滴加饱和溶液可以制备胶体
C.胶体区别于溶液的本质特征是具有丁达尔效应
D.胶体和溶液都是混合物,它们属于不同的分散系
6.已知有以下有机反应(图1)与反应装置(图2):
其中A,B,C,D的百分含量随着X的变化如下表所示:
物质A 40% 30% 10% 5% 4% 2% 0%
物质B 40% 30% 10% 5% 4% 2% 0%
物质C 15% 30% 65% 60% 40% 20% 1%
物质D 5% 10% 15% 30% 52% 76% 99%
下列说法不正确的是( )
A.物质D相比于物质C在该反应中更稳定
B.反应1的活化能小于反应2的活化能
C.增大B气流的流速,处的比值不变
D.若需提高物质C的产率,可将管道的出口设计相对更远
7.一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法正确的是( )
A.第三步中a为直流电源的正极
B.第一步生产的总反应为
C.第二步为原电池,正极质量增加,负极质量减少
D.第三步外电路上每转移电子,电解池中就有被电解
8.向溶液中通入至饱和,此过程看不到现象,再向溶液中加入一种物质,溶液变浑浊,加入的这种物质不可能是( )
A.溶液 B.溶液 C.溶液 D.溶液
9.下列各组离子在水溶液中能大量共存的是( )
(1)
(2)
(3)
(4)
(5)
(6)
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
10.当不考虑水的电离时,在氢硫酸溶液中,下列的离子浓度关系中正确的是( )
A. B.
C. D.
11.沙丁胺醇是目前治疗哮喘的常用药物,其结构简式如图所示.下列叙述正确的是( )
A.沙丁胺醇分子中含有2个手性碳原子
B.该分子中C、N原子的杂化方式完全相同
C.该物质可以发生氧化反应,但不能发生还原反应
D.该物质分别与足量的反应,消耗两者的量分别为
12.完成下述实验,装置或试剂不正确的是( )
实验室收集 验证碳酸氢钠受热分解 验证易溶于水且溶液呈碱性 除去中混有的少量HCl
A B C D
A.A B.B C.C D.D
13.为除去粗盐水中含有的杂质、和,得到精制食盐,设计了如下实验流程
下列说法不正确的是( )
A.NaOH溶液的作用是除去
B.步骤ⅰ、ⅱ的顺序可以互换
C.滤液2中有四种离子:、、、
D.步骤iv中发生的离子反应为:、
14.蔗糖与浓硫酸发生作用的过程如下图所示。
下列关于该过程的分析不正确的是( )
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中发生的反应
二、多选题
15.Co是维生素的重要组成元素。工业上可用下图装置制取单质Co并获得副产品盐酸。下列说法错误的是( )
A.电势:石墨电极电极
B.A膜为阴离子交换膜
C.阳极反应式:
D.外电路中通过时,阴极室溶液质量减轻59g
三、填空题
16.由和组成的混合气体,其平均相对分子质量为12.4,取此混合气体0.5mol充入密闭容器中,使之反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.6倍,求:
(1)反应前混合气体中和的体积比_______;
(2)平衡混合气体中和的物质的量_______;
(3)达到平衡时的转化率_______。
17.卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙等食品添加剂。和在结构和性质上有很多相似的地方。请完成下列问题:
(1)属于_______(填“离子化合物”或“共价化合物”),其阴、阳离子个数比为_______。
(2)与水反应的化学方程式为_______,生成单质气体,转移的电子数为_______。(用代表阿伏加德罗常数)
(3)与二氧化碳反应的化学方程式为_______,该反应属于_______。
A.置换反应
B.氧化还原反应
C.复分解反应
(4)请综合上述题目,分析为何卫生部禁止在面粉生产中添加过氧化钙等食品添加剂。_______。
四、实验题
18.Ⅰ.金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在中燃烧,可能产物为MgO、和。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:气体能被NaOH溶液吸收,极易与水反应。
(1)实验中,装置依次连接的顺序为A_______(填字母);装置B的作用是_______。
(2)用来检验的实验装置为_______(填字母)。
(3)设计实验证明产物中存在:_______。
Ⅱ.二氧化氯()是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备并验证其某些性质。回答下列问题:
(4)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是_______。
(5)通入氮气的主要作用有两个,一是可以起到搅拌作用,二是_______。
(6)B装置的作用是_______。C装置用来吸收,则C中液体宜选用_______(填序号)。
①热水
②冰水
③饱和食盐水
(7)D装置中与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为,D装置中生成这两种钠盐的化学方程式为_______;饱和溶液在温度低于38℃时析出晶体,在温度高于38℃时析出晶体。请补充从溶液中制得晶体的操作步骤:A._______;B._______;C.洗涤;D.干燥。
(8)设计一个简易实验证明二氧化氯具有永久的漂白性:_______。
19.1,6 己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6 己二酸。反应原理为:
相关物质的物理性质见下表:
试剂 相对分子质量 密度/() 熔点/℃ 沸点/℃ 溶解性
环己醇 100 0.962 25.9 161.8 可溶于水、乙醇、乙醚
1,6-己二酸 146 1.360 152 330.5 微溶于冷水,易溶于乙醇
117 2.326 210(分解) — 微溶于冷水,易溶于热水
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03g固体和18mL浓(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为_______,其作用是_______。
(2)B中发生反应的离子方程式为_______(其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为_______,滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应的_______0(填“>”或“<”)。
(4)将步骤Ⅲ补充完整:_______。步骤Ⅳ提纯方法的名称为_______。如图为1,6 己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为;该溶液的物质的量浓度为_______。
(5)最终得到1,6 己二酸产品4.810g,则1,6 己二酸的产率为___________。
A.46.07% B.57.08% C.63.03% D.74.61%
参考答案
1.答案:C
解析:试题解析:=0.14L×5.0mol/L=0.7mol,由氧化物和盐酸反应生成水可知,氧化物中含有=0.35mol,所得溶液还能吸收=0.025mol,恰好使其中的全部转变为,反应后所得溶液为,因=0.7mol+0.025mol×2=0.75mol,则=0.25mol,所以氧化物中=0.25:0.35=5:7,所以化学式为,故选C。
2.答案:B
解析:A.Y为S、X为F、T为O,同一周期主族元素从左向右原子半径逐渐减小,同一主族元素从上向下原子半径逐渐增大,因此原子半径:,A错误;
B.R为N、T为O、M为C,同一周期主族元素从左向右第一电离能呈增大趋势,同一主族元素从上向下第一电离能逐渐减小,ⅡA全满,ⅤA半满反常,第一电离能:,B正确;
C.X为F,无最高正价,C错误;
D.Y为S,Y的氧化物对应水化物可能为不一定为强酸,D错误;
故选B。
3.答案:A
解析:单键全是键;双键中一个键一个键,由有机物的结构可知,该分子中键数目为19个,键数目为3个,综上所述,故选A。
4.答案:C
解析:A.溶液与碳酸钠溶液反应生成白色沉淀,溶液与NaCl反应生成白色沉淀,无法检验,故A错误;
B.新制氯水中含有,具有漂白性,会使试纸褪色,无法对比测酸碱性,故B错误;
C.饱和溶液可以除去气体中混杂的少量气体,浓硫酸起到干燥作用,故C正确;
D.测定和固体混合物中的质量分数,应该准确称取ag样品和试管总质量,加强热后在干燥器冷却至室温,再称量得到总质量,不能直接在空气中冷却,否则影响测定结果,故D错误;
故选C。
5.答案:C
解析:A.胶体的分散质粒子能够使光线发生散射作用而沿直线传播,即用光照射会产生一条光亮的通路,而溶液的溶质离子不能使光线发生散射作用,因此用光照射不能产生光亮的通路,因此用激光笔照射区分溶液和胶体,A正确;
B.把几滴饱和溶液滴入到沸腾的蒸馏水中,继续加热至液体呈红褐色,停止加热,得到胶体,B正确;
C.胶体区别于其他分散系的本质特征是分散质微粒直径的大小,C错误;
D.分散系根据分散微粒直径大小分为溶液、胶体、浊液,D正确;
故合理选项是C。
6.答案:D
解析:A.随X的增加,C的含量先增加后减少,D的含量增加,这说明生成C的反应速率快,所以物质D相比于物质C在该反应中更稳定,A正确;
B.生成C的反应速率快,所以反应1的活化能小于反应2的活化能,B正确;
C.时,反应物全部转化为生成物,所以增大B气流的流速,处的比值不变,C正确;
D.随X的增加,C的含量先增加后减少,D的含量增加,因此若需提高物质C的产率,可将管道的出口设计相对更近,而不是更远,D错误;
答案选D。
7.答案:B
解析:A.由图可知,第三步中Ag电极的变化是AgCl得到电子转化为Ag,发生还原反应,是阴极,则a为直流电源的负极,故A错误;
B.第一步为电解池,阳极反应为,阴极反应为,根据得失电子守恒,可得第一步电解池的总反应为,故B正确;
C.第二步为原电池,正极反应为,负极反应为,生成的AgCl附着在负极表面,故正、负极质量均增加,故C错误;
D.第三步的总反应为,溶液中HCl的物质的量保持不变,故D错误;
故答案为:B。
8.答案:B
解析:A.具有还原性,能被离子氧化为离子,所以再向溶液中加入溶液,生沉淀,A正确;
B.氯化铝溶液与溶液、都不反应,加入氯化铝溶液后不会生成沉淀,B错误;
C.向溶液中加入硫化钠溶液,会发生反应:,溶液变浑浊,C正确;
D.溶液中含有离子,加入溶液生成AgCl沉淀,D正确;
故选B。
9.答案:B
解析:(1)在酸性条件下,和都可以氧化,故不能大量共存,不符合题意;
(2)、都与要反应,故不能大量共存,不符合题意;
(3)相互间不反应,可以大量共存,符合题意;
(4)相互间不反应,可以大量共存,符合题意;
(5)与、都要反应,故不能大量共存,不符合题意;
(6)与要反应,故不能大量共存,不符合题意;
符合题意的有:(3)和(4)。
答案选B。
10.答案:A
解析:为二元弱酸,在水中存在电离平衡,电离方程式为:、;
A.在氢硫酸溶液中,存在电荷守恒:(不考虑水的电离时),故A正确;
B.溶液中存在电荷守恒:,故B错误;
C.为二元弱酸,主要以第一步电离为主,第二步电离比第一步电离弱得多,所以比小很多,故C错误;
D.为二元弱酸,主要以第一步电离为主,第二步电离比第一步电离弱得多,所以,故D错误;
故本题选A.
11.答案:D
解析:A.该物质苯环上较长取代基中连有醇羟基的碳原子为手性碳原子,分子中只含有1个手性碳原子,A错误;
B.该分子中,C原子有和两种杂化方式,N原子采取杂化,B错误;
C.该物质含有苯环,可以与氢气发生加成反应,该加成反应属于还原反应,C错误;
D.羟基都能与反应,酚羟基又可以与反应,该物质分别与足量的反应时消耗两者的量分别为,D正确;
故选D。
12.答案:A
解析:A.能和水反应,不能用排水法收集,故选A;
B.若澄清石灰水变浑浊,则证明碳酸氢钠分解放出二氧化碳,故不选B;
C.烧瓶内形成红色喷泉,证明易溶于水且溶液呈碱性,故不选C;
D.二氧化碳不溶于不含碳酸氢钠溶液,HCl能与碳酸氢钠反应放出二氧化碳气体,用饱和碳酸氢钠溶液除二氧化碳中的氯化氢,故不选D;
选A。
13.答案:C
解析:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,NaOH溶液的作用是除去,A正确;
B.加入过量氢氧化钡(或氯化钡)溶液是除去硫酸根离子,加入过量氢氧化钠溶液是除去镁离子,加入过量碳酸钠溶液目的是除去钙离子和过量钡离子,则加入氢氧化钠和氢氧化钡(或氯化钡)溶液的顺序可以调换,但是加入碳酸钠必须在加入氢氧化钡(或氯化钡)溶液之后,B正确;
C.滤液2中除了四种离子:、、、,还含有过量的钡离子,C错误;
D.滤液中加入HCl,除去多余的碳酸钠和氢氧根离子,反应为、,D正确;
故选C。
14.答案:C
解析:A.浓硫酸具有脱水性,能将有机物中的H原子和O原子按2∶1的比例脱除,蔗糖中加入浓硫酸,白色固体变黑,体现浓硫酸的脱水性,A项正确;
B.浓硫酸脱水过程中释放大量热,此时发生反应,产生大量气体,使固体体积膨胀,B项正确;
C.结合选项B可知,浓硫酸脱水过程中生成的SO2能使品红溶液褪色,体现浓硫酸的强氧化性,C项错误;
D.白色固体变黑,过程中发生的反应,D项正确;
故选C。
15.答案:BD
解析:该装置为电解池,左侧为阳极,电极反应式为,右侧为阴极,电极反应式为,A为阳离子交换膜,阳极室的移动向产品室,B为阴离子交换膜,阴极室的移动向产品室,在产品室获得盐酸,据此解答。
解析:A.石墨电极与电源正极相连作阳极,Co电极与电源负极相连作阴极,因此电势:石墨电极>Co电极,A正确;
B.根据分析可知,A为阳离子交换膜,B为阴离子交换膜,B错误;
C.阳极反应式:,C正确;
D.外电路中通过时,有1mol转化为Co,有2mol从阴极室移动向产品室,则阴极溶液减少1mol,质量减少,D错误;
故选BD。
16.答案:(1)2:3
(2)
(3)
解析:(1)和按一定比例混合,设氮气为xmol,氢气为ymol,其平均相对分子质量为12.4,则=12.4,解得=2:3,相同条件下物质的量之比等于体积之比,所以体积为2:3。
(2)由(1)可知,0.5mol该混合气体,物质的量分别为0.2mol、0.3mol,根据已知条件列出“三段式”
达到平衡后容器内压强是相同条件下反应前压强的0.6倍,则=0.6,解得x=0.1mol,平衡时。
(3)氮气的转化率为×100%=50%。
17.答案:(1)离子化合物;1:1
(2);2
(3);B
(4)易与空气中的水和二氧化碳反应,反应放热可能导致危险;
解析:(1)由和组成,属于离子化合物,阴阳离子个数比为1:1;
(2)与水反应生成氢氧化钙和氧气,反应方程式为:;由反应可知生成1mol氧气时转移2mol电子即2;
(3)与二氧化碳反应生成碳酸钙和氧气,反应方程式为:;由反应特征可知,该反应属于氧化还原反应;
(4)易与空气中的水和二氧化碳反应,反应放热可能导致危险;另外禁止添加过氧化钙能减少不必要化学品摄入,有利于身体健康。
18.答案:(1)BCBED;在C的两侧防止水蒸气进入C中
(2)D
(3)取C中少量反应产物,加入水中产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝。
(4)水浴加热
(5)降低的浓度(或减小的体积分数),防止爆炸
(6)安全瓶,防止倒吸;②
(7);蒸发结晶;趁热过滤
(8)取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不恢复红色
解析:(1)装置A中Cu与浓硝酸反应生成的气体为,用装置B干燥剂干燥,通入硬质玻璃管C与镁粉发生反应,用E装置除去多余的,装置D用排水法收集,为防止E中的水分进入装置C使氮化镁水解,在E装置前也要连B装置干燥,故连接装置的顺序为ABCBED;根据分析可知装置B的作用是在C的两侧防止水蒸气进入C中;
(2)根据分析可知用来检验,的实验装置为D
(3)氮化镁能与水反应生成氢氧化镁和氨气,则检验氮化镁的实验操作为取少量反应后的固体产物,加入水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色
(4)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是水浴加热,故答案为:水浴加热;
(5)通入氮气的主要作用有2个,一是可以起到搅拌作用,二是稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸,故答案为:降低的浓度(或减小的体积分数),防止爆炸;
(6)B装置为安全瓶,可起到防止倒吸的作用,C用于吸收,为避免温度过高,可用冷水,故答案为:安全瓶,防止倒吸;②;
(7)装置D中与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为,另一种为,装置C中生成这两种钠盐的化学方程式为,饱和溶液在温度低于38℃时析出晶体,在温度高于38℃时析出晶体,则从溶液中制得晶体的操作步骤:A.蒸发结晶;B.趁热过滤;C.洗涤;D.干燥故答案为:;蒸发结晶;趁热过滤;
(8)二氧化氯可使品红褪色,检验是否具有永久漂白性,可取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色,故答案为:取少量品红溶液于试管中,通入二氧化氯,观察到品红溶液褪色,再加热已褪色的溶液,溶液不变红色。
19.答案:(1)球形冷凝管;冷凝回流,减少反应物损失,导出气体
(2)
(3)浓硝酸在加热时分解生成;<
(4)用冷水洗涤晶体2~3次;重结晶;2.89
(5)B
解析:(1)根据仪器A的形状可知,仪器A的名称为球形冷凝管,其作用是冷凝回流,减少反应物损失,导出气体;
(2)B中发生反应为二氧化氮和氢氧化钠的反应,生成硝酸钠、亚硝酸钠和水,离子方程式为;
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为浓硝酸具有不稳定性,在加热时分解生成、水和氧气;滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应放热,;
(4)由于1,6 己二酸微溶于冷水,用冷水洗涤晶体2~3次,减少洗涤时的损耗;将1,6 己二酸粗产品进行提纯,步骤Ⅳ提纯方法的名称为重结晶;根据图中1,6 己二酸在水中的溶解度曲线,80℃时1,6 己二酸的溶解度为0.73g,根据质量分数为,溶液的密度为;该溶液的物质的量浓度为;
(5)由表中数据可知,6mL环己醇的密度为,摩尔质量为100g/mol,得到质量为,根据+2+2+2+6+6+3,得到~~,设的质量的x,计算得的理论产量为8.427g,最终得到1,6 己二酸产品4.810g,则1,6 己二酸的产率为。
同课章节目录
