化学人教版(2019)必修第二册5.1硫及其化合物(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1硫及其化合物(共38张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 22.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 21:46:45 | ||
图片预览








文档简介
(共38张PPT)
硫及其化合物
我国古代的四大发明之一,其配方为“一硫二硝三木炭”,其中“硫”俗称硫黄,“硝”是火硝(KNO3)
早在1 000多年前,我国古代劳动人民就已经发现和利用了硫
黑火药
思考:古代的硫磺从哪里生产来的?
在南北朝以前,人们使用的硫磺主要是天然的。在汉代时,中原一带开始从黑色含煤黄铁矿提取硫磺。后来,特别是在宋代之后,硫黄逐以硫铁矿中冶炼出的硫黄为主。
一、硫的存在和性质
(一)存在:
火山口的硫单质
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
游离态:火山喷口附近
化合态:硫化物和硫酸盐
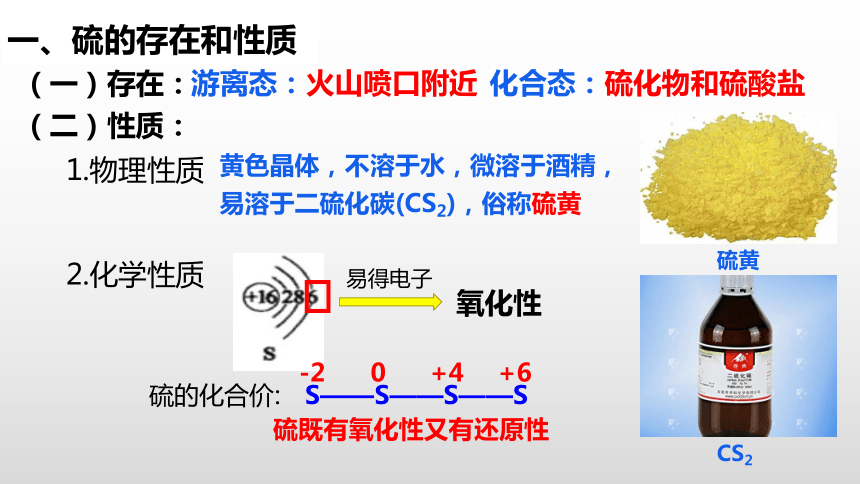
一、硫的存在和性质
(一)存在:
游离态:火山喷口附近
化合态:硫化物和硫酸盐
(二)性质:
硫黄
1.物理性质
黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳(CS2),俗称硫黄
2.化学性质
氧化性
易得电子
CS2
硫的化合价:
S——S——S——S
-2
+6
+4
0
硫既有氧化性又有还原性
一、硫的存在和性质
(一)存在:
游离态:火山喷口附近
化合态:硫化物和硫酸盐
(二)性质:
硫黄
1.物理性质
淡黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳(CS2),俗称硫黄
2.化学性质
氧化性:
Fe+S=FeS
2Na+S==Na2S
研磨
H2+S=H2S
还原性:
S+O2==SO2
点燃
(产生蓝色火焰)
2Cu+S=Cu2S
+2
+1
硫化亚铜
硫化亚铁
弱
硫与变价金属生成低价态金属硫化物
银手镯发黑是由于银与环境中或者汗液中的少量硫产生反应,生成了硫化银,或者银被空气氧化之后生成氧化银,氧化银和硫化银都是黑色的,所以导致手镯变黑。
银手镯戴久了会变黑,这是什么原因呢?
如何清洗试管上的硫?
1.除去试管壁附着的硫,可以采用的方法是( )
A.通入氢气后加热
B.伸入灼热的铁丝
C.用水洗涤
D.用二硫化碳洗涤
难溶于水,微溶于酒精,易溶CS2
【思考】
牛刀小试
D
(1)物理法:加二硫化碳(CS2)溶解;
(2)化学法:加热的氢氧化钠溶液溶解。
0
-2
+4
既是氧化剂又是还原剂
更常用
3S+6NaOH = 2Na2S+Na2SO3+3H2O
如何清洗试管上的硫?
【思考】
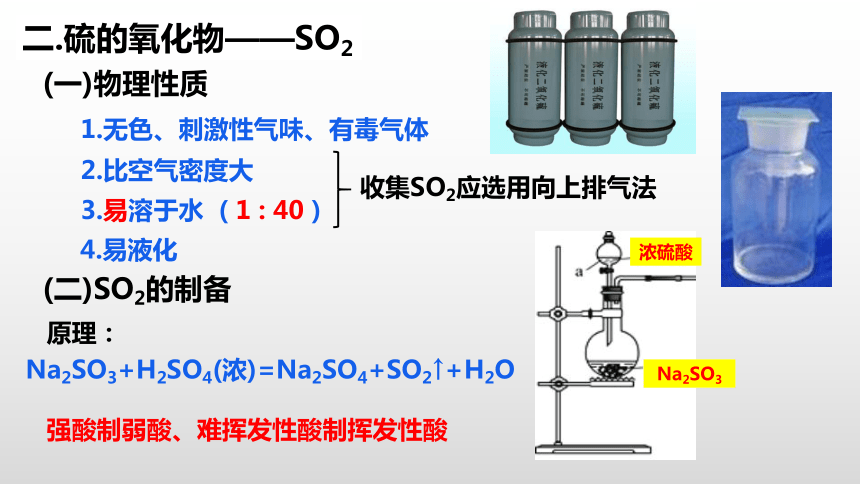
二.硫的氧化物——SO2
1.无色、刺激性气味、有毒气体
2.比空气密度大
3.易溶于水 ( 1 : 40 )
4.易液化
收集SO2应选用向上排气法
(二)SO2的制备
Na2SO3
浓硫酸
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
原理:
强酸制弱酸、难挥发性酸制挥发性酸
(一)物理性质
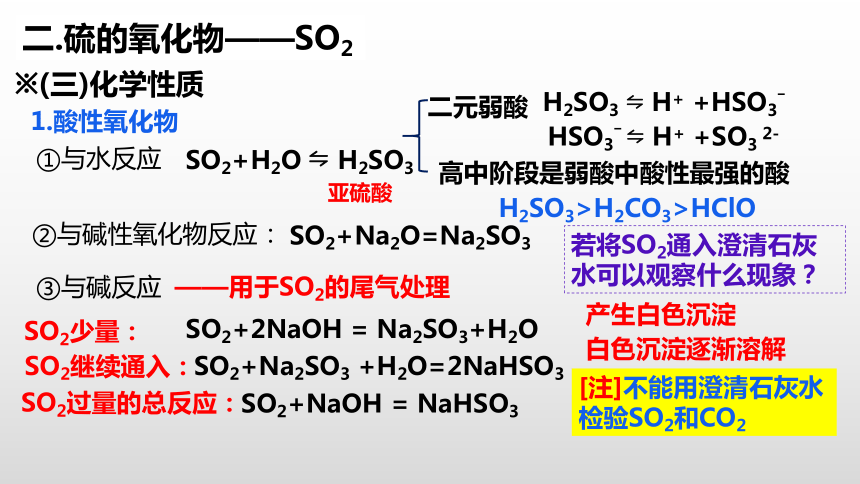
①与水反应
1.酸性氧化物
※(三)化学性质
SO2+H2O H2SO3
二元弱酸
亚硫酸
高中阶段是弱酸中酸性最强的酸
H2SO3 H+ +HSO3ˉ
HSO3ˉ H+ +SO3 2-
H2SO3>H2CO3>HClO
②与碱性氧化物反应:
SO2+Na2O=Na2SO3
③与碱反应
SO2+2NaOH = Na2SO3+H2O
SO2+NaOH = NaHSO3
SO2+Na2SO3 +H2O=2NaHSO3
SO2少量:
SO2继续通入:
SO2过量的总反应:
产生白色沉淀
白色沉淀逐渐溶解
若将SO2通入澄清石灰水可以观察什么现象?
[注]不能用澄清石灰水检验SO2和CO2
——用于SO2的尾气处理
二.硫的氧化物——SO2
二.硫的氧化物——SO2
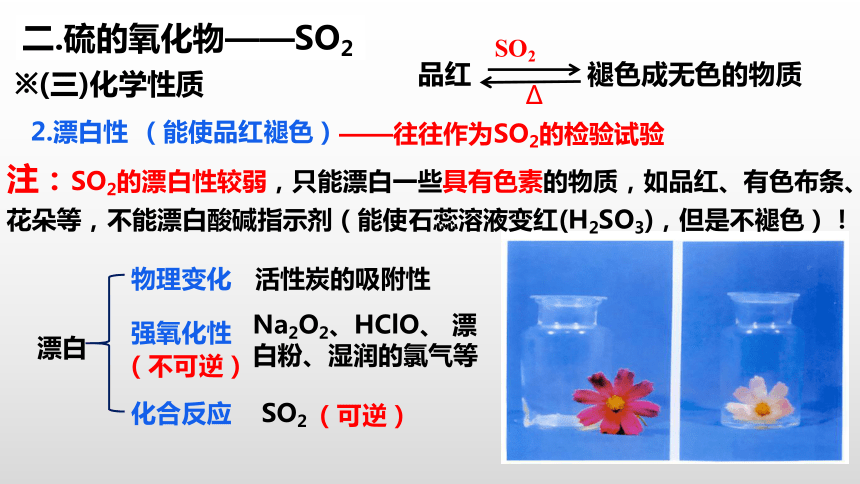
2.漂白性
※(三)化学性质
(能使品红褪色)
品红
褪色成无色的物质
——往往作为SO2的检验试验
注:SO2的漂白性较弱,只能漂白一些具有色素的物质,如品红、有色布条、花朵等,不能漂白酸碱指示剂(能使石蕊溶液变红(H2SO3),但是不褪色)!
漂白
物理变化
活性炭的吸附性
强氧化性
Na2O2、HClO、 漂白粉、湿润的氯气等
化合反应
SO2
(不可逆)
(可逆)
SO2
Na2SO3
浓H2SO4
KMnO4(H+)
紫色石蕊
品红
H2S溶液
NaOH溶液
SO2性质组合实验
褪色
变红
褪色
黄色浑浊
还原性
酸性
漂白性
氧化性
体现了SO2的什么性质?
溴水
褪色
尾气处理
还原性
SO2+Br2+2H2O=
2HBr+H2SO4
S
+4
S
+6
0
S
① 氧化性
SO2+2H2S=
+4
-2
2H2O+3S↓
② 还原性
SO2+Cl2+2H2O=
2HCl+H2SO4
注:两种有漂白性的物质混合后将失去漂白性
2SO2+O2 2SO3
催化剂
SO2+ MnO4- = SO42- + Mn2+
大家尝试配平
5 2 +2H2O 5 2 +4H+
——使高锰酸钾溶液褪色
弱
强
溶液浑浊
二.硫的氧化物——SO2
3.既有氧化性又有还原性
※(三)化学性质
是漂白吗?
高中阶段漂白特指漂白有机色素
用途
硫的氧化物——二氧化硫
漂白剂
食品添加剂
牛刀小试
2. 如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A.紫色石蕊溶液变蓝色B.品红溶液褪色C.溴水橙色褪去D.含酚酞的NaOH溶液红色变浅
制取SO2
褪色
褪色
SO2+Br2+2H2O=2HBr+H2SO4
SO2+H2O H2SO3
变红
NaOH+H2SO3 =Na2SO3+H2O
红变浅
A
牛刀小试
3.下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力
强氧化性
强氧化性
化合反应
√
Na2O2、HClO
SO2+Cl2+2H2O=2HCl+H2SO4
失去漂白性
×
×
B
二.硫的氧化物——SO3
(二)化学性质
(一)物理性质
标况下是一种无色易升华的固体
——酸性氧化物的通性
1.与水反应
SO3+H2O=H2SO4
2.与碱性氧化物反应:
SO3+CaO=CaSO4
3.与碱反应
SO3+Ca(OH)2 = CaSO4+H2O
(工业制备硫酸原理)
牛刀小试
4.下列说法中正确的是( )A.三氧化硫极易溶于水,能与水反应生成硫酸B.标准状况下,1 mol三氧化硫的体积为22.4 LC.二氧化硫在空气中易被氧化为三氧化硫 D.三氧化硫具有漂白性,能使品红溶液褪色
A
√
固体
×
2SO2+O2 2SO3
催化剂
×
陆地
海洋
H2S
SO2
SO3
H2SO3
H2SO4
喷发
+H2O
降雨
O2
植
物
吸
收
硫化物、硫酸盐
吸收
S
解
微
生
物
分
三、SO2与环境保护
硫在自然界的循环
三、SO2与环境保护
1.什么是酸雨?
2.正常雨水pH应在什么范围?
3.酸雨是怎样形成的?
4.空气中SO2的来源
5.如何治理?
阅读课本P16-17
pH<5.6
矿石燃料(煤和石油)的燃烧
燃煤的脱硫、改进燃烧技术、改变以煤为主的能源结构
5.6-7
SO2和NO2溶于雨水
俗话说盛世古董,乱世黄金,古陶瓷的收藏是比较热门的一类,而有些人在利益的驱使下,就会烧制大量的仿古瓷器,然后用做旧来把这些仿古瓷做旧,得以获取暴利,而高锰酸钾加浓硫酸(做色)就是很多瓷器造假者最为常用的手段之一。
最为低等的瓷器做旧手段
2KMnO4 + H2SO4(浓) Mn2O7 + H2O + 2KHSO4
化学方程式:
那么,浓硫酸到底有哪些性质呢?
一、硫酸:
与指示剂作用:
与活泼金属反应:
与碱性氧化物反应:
与碱反应:
与某些盐的反应:
使石蕊变红
生成H2
生成盐和水
生成盐和水
强酸制弱酸
其溶质是强电解质
二元强酸
稀硫酸、
浓硫酸
(一)稀硫酸
稀硫酸
具有酸的通性:
(二)浓硫酸
1.物理性质:
颜 色 :
状 态 :
沸 点 :
挥发性:
溶解度:
密 度 :
无 色
油状液体
高沸点(338 C)
比水大
难挥发
易溶与水,能与水以任意比混合。溶解时放出大量的热。
【回忆】实验室如何稀释浓硫酸?
将浓硫酸缓慢地沿玻璃棒倒入盛有蒸馏水的烧杯内,并用玻棒不断搅拌。
酸入水
浓盐酸具有挥发性需要密封保存,那浓硫酸为什么也要密封保存呢?
浓硫酸的特性
——吸水性
故浓硫酸要密封保存!
2.化学性质
浓硫酸的三大特性
①吸水性
——吸收物质或者体系中原本就有的水(或水蒸气)
应用:
——做干燥剂,常干燥O2、H2、Cl2、 N2 、HCl、SO2、 CO2 等气体
不能干燥
碱性气体NH3
还原性气体HI、H2S、
SO3
SO2
(二)浓硫酸
SO2也是还原性气体,为什么可以用浓硫酸干燥?
+4 +6
SO2,H2SO4,相邻价态不反应
(二)浓硫酸
2.化学性质
【实验1】往蔗糖上滴几滴浓硫酸溶液。
现象:
蔗糖变黑,体积膨胀,有刺激性气味的气体生成,放出大量的热。
有炭生成
“炭化现象”
【原因】蔗糖由碳、氢、氧三种元素组成,浓硫酸能把蔗糖中的氢、氧元素按照水的比例脱去。(属于化学变化)
②脱水性
有气体生成
有SO2生成
C+2H2SO4(浓) = CO2↑+2SO2↑+2H2O
放热反应
0
+6
+4
+4
③强氧化性
浓硫酸的三大特性
②脱水性
③强氧化性
实 验 2
在试管中放入一块铜片, 然后加入约3ml浓硫酸,加热,放出的气体通入品红溶液中。
褪色
SO2
Cu + 2H2SO4(浓)= CuSO4 + SO2 + 2H2O
有Cu2+生成
注:参加反应的浓硫酸只有1/2被还原;硫酸体现酸性和氧化性。
2.化学性质
(二)浓硫酸
浓硫酸的三大特性
②脱水性
③强氧化性
Cu + 2H2SO4(浓)= CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4(浓)=Fe2(SO4)3 +3SO2 + 6H2O
Ⅰ.加热下,浓硫酸与金属反应时不能生成H2,硫酸体现酸性和氧化性。
Ⅱ.常温下,浓硫酸使得铁和铝发生“钝化”
Ⅲ.浓硫酸与非金属反应只体现氧化性。
2.化学性质
(二)浓硫酸
Cu + 2H2SO4 (浓)== CuSO4 + SO2↑+ 2H2O
C + 2H2SO4 (浓) == CO2 ↑+ 2SO2↑+ 2H2O
总结
(1)敞口放置浓硫酸时,质量增加, 。
(2)把CuSO4 5H2O 晶体放入浓硫酸中,变白色, 。
(3)锌粒放入稀硫酸中,有气体放出, 。
(4)把木屑放入浓硫酸中,变黑, 。
(5)铁、铝在浓硫酸中:“钝化 ” 。
吸水性
酸性、氧化性
脱水性
6.储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现浓硫酸的( )
A.脱水性和吸水性 B.吸水性和酸性
C.强氧化性和吸水性 D.不挥发性与酸性
B
强氧化性
5.将下列现象中硫酸表现出来的性质写在空白处:
吸水性
牛刀小试
名称 浓硫酸 稀硫酸
主要成份
氧化性
还原产物
遇Fe、Al (常温)
遇Cu(加热)
遇C (加热)
脱水性
吸水性
★浓硫酸与稀硫酸的比较:
H2SO4分子
H+、SO42-、H2O
+6价S,强氧化性
+1价H+,弱氧化性
SO2
H2
钝化
反应
加热生成 SO2
反应
反应
有
生成 H2
不反应
不反应
无
有
无
二、硫酸根离子的检验:
取待测液
加盐酸酸化
无变化
有无白色沉淀
滴加BaCl2溶液
※SO32- 、 HSO3-的检验:
待测液
白色沉淀
刺激性气味的气体
褪色
品红
无明显变化
刺激性气味的气体
褪色
品红
BaCl2溶液
BaCl2溶液
盐酸
则待测液中有SO32-
则待测液中有HSO3-
待测液
盐酸
注:不能用Ba(OH)2来检验这两种离子!
加盐不加碱(类比鉴别Na2CO3、NaHCO3)
现象一样,不能用于检验!
能否将BaCl2溶液换成Ba(OH)2
三、常见的硫酸盐
芒硝
胆矾
绿矾
明矾
KAl(SO4)2 12H2O
CuSO4 5H2O
FeSO4 7H2O
矾:含有结晶水的金属硫酸盐
Na2SO4 10H2O
四、工业制硫酸
4FeS2+11O2==2Fe2O3+8SO2↑
高温
2SO2+O2 2SO3
催化剂
SO3+H2O=H2SO4
7.如图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色,请回答:
(1)①中发生反应的离子方程式为_______________________________________。(2)②中的实验现象是__________________________________________________。(3)③中的实验现象是__________________________________________________,证明SO2有________性。 (4)④中SO2作________剂。(5)⑤中反应生成两种强酸,该反应的离子方程式是_____________________,当1 mol SO2参与反应时,转移电子的物质的量是________。(6)⑥的作用是_________________________________________________________。
牛刀小试
SO32-+2H+=SO2↑+H2O
石蕊溶液变红色
品红溶液褪色
漂白
氧化
吸收过量的二氧化硫,防止污染环境
2 mol
SO2+Br2+2H2O=4H++2Br-+SO42-
感谢聆听!
硫及其化合物
我国古代的四大发明之一,其配方为“一硫二硝三木炭”,其中“硫”俗称硫黄,“硝”是火硝(KNO3)
早在1 000多年前,我国古代劳动人民就已经发现和利用了硫
黑火药
思考:古代的硫磺从哪里生产来的?
在南北朝以前,人们使用的硫磺主要是天然的。在汉代时,中原一带开始从黑色含煤黄铁矿提取硫磺。后来,特别是在宋代之后,硫黄逐以硫铁矿中冶炼出的硫黄为主。
一、硫的存在和性质
(一)存在:
火山口的硫单质
硫铁矿(FeS2)
黄铜矿(CuFeS2)
石膏(CaSO4 2H2O)
芒硝(Na2SO4 10H2O)
游离态:火山喷口附近
化合态:硫化物和硫酸盐
一、硫的存在和性质
(一)存在:
游离态:火山喷口附近
化合态:硫化物和硫酸盐
(二)性质:
硫黄
1.物理性质
黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳(CS2),俗称硫黄
2.化学性质
氧化性
易得电子
CS2
硫的化合价:
S——S——S——S
-2
+6
+4
0
硫既有氧化性又有还原性
一、硫的存在和性质
(一)存在:
游离态:火山喷口附近
化合态:硫化物和硫酸盐
(二)性质:
硫黄
1.物理性质
淡黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳(CS2),俗称硫黄
2.化学性质
氧化性:
Fe+S=FeS
2Na+S==Na2S
研磨
H2+S=H2S
还原性:
S+O2==SO2
点燃
(产生蓝色火焰)
2Cu+S=Cu2S
+2
+1
硫化亚铜
硫化亚铁
弱
硫与变价金属生成低价态金属硫化物
银手镯发黑是由于银与环境中或者汗液中的少量硫产生反应,生成了硫化银,或者银被空气氧化之后生成氧化银,氧化银和硫化银都是黑色的,所以导致手镯变黑。
银手镯戴久了会变黑,这是什么原因呢?
如何清洗试管上的硫?
1.除去试管壁附着的硫,可以采用的方法是( )
A.通入氢气后加热
B.伸入灼热的铁丝
C.用水洗涤
D.用二硫化碳洗涤
难溶于水,微溶于酒精,易溶CS2
【思考】
牛刀小试
D
(1)物理法:加二硫化碳(CS2)溶解;
(2)化学法:加热的氢氧化钠溶液溶解。
0
-2
+4
既是氧化剂又是还原剂
更常用
3S+6NaOH = 2Na2S+Na2SO3+3H2O
如何清洗试管上的硫?
【思考】
二.硫的氧化物——SO2
1.无色、刺激性气味、有毒气体
2.比空气密度大
3.易溶于水 ( 1 : 40 )
4.易液化
收集SO2应选用向上排气法
(二)SO2的制备
Na2SO3
浓硫酸
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
原理:
强酸制弱酸、难挥发性酸制挥发性酸
(一)物理性质
①与水反应
1.酸性氧化物
※(三)化学性质
SO2+H2O H2SO3
二元弱酸
亚硫酸
高中阶段是弱酸中酸性最强的酸
H2SO3 H+ +HSO3ˉ
HSO3ˉ H+ +SO3 2-
H2SO3>H2CO3>HClO
②与碱性氧化物反应:
SO2+Na2O=Na2SO3
③与碱反应
SO2+2NaOH = Na2SO3+H2O
SO2+NaOH = NaHSO3
SO2+Na2SO3 +H2O=2NaHSO3
SO2少量:
SO2继续通入:
SO2过量的总反应:
产生白色沉淀
白色沉淀逐渐溶解
若将SO2通入澄清石灰水可以观察什么现象?
[注]不能用澄清石灰水检验SO2和CO2
——用于SO2的尾气处理
二.硫的氧化物——SO2
二.硫的氧化物——SO2
2.漂白性
※(三)化学性质
(能使品红褪色)
品红
褪色成无色的物质
——往往作为SO2的检验试验
注:SO2的漂白性较弱,只能漂白一些具有色素的物质,如品红、有色布条、花朵等,不能漂白酸碱指示剂(能使石蕊溶液变红(H2SO3),但是不褪色)!
漂白
物理变化
活性炭的吸附性
强氧化性
Na2O2、HClO、 漂白粉、湿润的氯气等
化合反应
SO2
(不可逆)
(可逆)
SO2
Na2SO3
浓H2SO4
KMnO4(H+)
紫色石蕊
品红
H2S溶液
NaOH溶液
SO2性质组合实验
褪色
变红
褪色
黄色浑浊
还原性
酸性
漂白性
氧化性
体现了SO2的什么性质?
溴水
褪色
尾气处理
还原性
SO2+Br2+2H2O=
2HBr+H2SO4
S
+4
S
+6
0
S
① 氧化性
SO2+2H2S=
+4
-2
2H2O+3S↓
② 还原性
SO2+Cl2+2H2O=
2HCl+H2SO4
注:两种有漂白性的物质混合后将失去漂白性
2SO2+O2 2SO3
催化剂
SO2+ MnO4- = SO42- + Mn2+
大家尝试配平
5 2 +2H2O 5 2 +4H+
——使高锰酸钾溶液褪色
弱
强
溶液浑浊
二.硫的氧化物——SO2
3.既有氧化性又有还原性
※(三)化学性质
是漂白吗?
高中阶段漂白特指漂白有机色素
用途
硫的氧化物——二氧化硫
漂白剂
食品添加剂
牛刀小试
2. 如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A.紫色石蕊溶液变蓝色B.品红溶液褪色C.溴水橙色褪去D.含酚酞的NaOH溶液红色变浅
制取SO2
褪色
褪色
SO2+Br2+2H2O=2HBr+H2SO4
SO2+H2O H2SO3
变红
NaOH+H2SO3 =Na2SO3+H2O
红变浅
A
牛刀小试
3.下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力
强氧化性
强氧化性
化合反应
√
Na2O2、HClO
SO2+Cl2+2H2O=2HCl+H2SO4
失去漂白性
×
×
B
二.硫的氧化物——SO3
(二)化学性质
(一)物理性质
标况下是一种无色易升华的固体
——酸性氧化物的通性
1.与水反应
SO3+H2O=H2SO4
2.与碱性氧化物反应:
SO3+CaO=CaSO4
3.与碱反应
SO3+Ca(OH)2 = CaSO4+H2O
(工业制备硫酸原理)
牛刀小试
4.下列说法中正确的是( )A.三氧化硫极易溶于水,能与水反应生成硫酸B.标准状况下,1 mol三氧化硫的体积为22.4 LC.二氧化硫在空气中易被氧化为三氧化硫 D.三氧化硫具有漂白性,能使品红溶液褪色
A
√
固体
×
2SO2+O2 2SO3
催化剂
×
陆地
海洋
H2S
SO2
SO3
H2SO3
H2SO4
喷发
+H2O
降雨
O2
植
物
吸
收
硫化物、硫酸盐
吸收
S
解
微
生
物
分
三、SO2与环境保护
硫在自然界的循环
三、SO2与环境保护
1.什么是酸雨?
2.正常雨水pH应在什么范围?
3.酸雨是怎样形成的?
4.空气中SO2的来源
5.如何治理?
阅读课本P16-17
pH<5.6
矿石燃料(煤和石油)的燃烧
燃煤的脱硫、改进燃烧技术、改变以煤为主的能源结构
5.6-7
SO2和NO2溶于雨水
俗话说盛世古董,乱世黄金,古陶瓷的收藏是比较热门的一类,而有些人在利益的驱使下,就会烧制大量的仿古瓷器,然后用做旧来把这些仿古瓷做旧,得以获取暴利,而高锰酸钾加浓硫酸(做色)就是很多瓷器造假者最为常用的手段之一。
最为低等的瓷器做旧手段
2KMnO4 + H2SO4(浓) Mn2O7 + H2O + 2KHSO4
化学方程式:
那么,浓硫酸到底有哪些性质呢?
一、硫酸:
与指示剂作用:
与活泼金属反应:
与碱性氧化物反应:
与碱反应:
与某些盐的反应:
使石蕊变红
生成H2
生成盐和水
生成盐和水
强酸制弱酸
其溶质是强电解质
二元强酸
稀硫酸、
浓硫酸
(一)稀硫酸
稀硫酸
具有酸的通性:
(二)浓硫酸
1.物理性质:
颜 色 :
状 态 :
沸 点 :
挥发性:
溶解度:
密 度 :
无 色
油状液体
高沸点(338 C)
比水大
难挥发
易溶与水,能与水以任意比混合。溶解时放出大量的热。
【回忆】实验室如何稀释浓硫酸?
将浓硫酸缓慢地沿玻璃棒倒入盛有蒸馏水的烧杯内,并用玻棒不断搅拌。
酸入水
浓盐酸具有挥发性需要密封保存,那浓硫酸为什么也要密封保存呢?
浓硫酸的特性
——吸水性
故浓硫酸要密封保存!
2.化学性质
浓硫酸的三大特性
①吸水性
——吸收物质或者体系中原本就有的水(或水蒸气)
应用:
——做干燥剂,常干燥O2、H2、Cl2、 N2 、HCl、SO2、 CO2 等气体
不能干燥
碱性气体NH3
还原性气体HI、H2S、
SO3
SO2
(二)浓硫酸
SO2也是还原性气体,为什么可以用浓硫酸干燥?
+4 +6
SO2,H2SO4,相邻价态不反应
(二)浓硫酸
2.化学性质
【实验1】往蔗糖上滴几滴浓硫酸溶液。
现象:
蔗糖变黑,体积膨胀,有刺激性气味的气体生成,放出大量的热。
有炭生成
“炭化现象”
【原因】蔗糖由碳、氢、氧三种元素组成,浓硫酸能把蔗糖中的氢、氧元素按照水的比例脱去。(属于化学变化)
②脱水性
有气体生成
有SO2生成
C+2H2SO4(浓) = CO2↑+2SO2↑+2H2O
放热反应
0
+6
+4
+4
③强氧化性
浓硫酸的三大特性
②脱水性
③强氧化性
实 验 2
在试管中放入一块铜片, 然后加入约3ml浓硫酸,加热,放出的气体通入品红溶液中。
褪色
SO2
Cu + 2H2SO4(浓)= CuSO4 + SO2 + 2H2O
有Cu2+生成
注:参加反应的浓硫酸只有1/2被还原;硫酸体现酸性和氧化性。
2.化学性质
(二)浓硫酸
浓硫酸的三大特性
②脱水性
③强氧化性
Cu + 2H2SO4(浓)= CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4(浓)=Fe2(SO4)3 +3SO2 + 6H2O
Ⅰ.加热下,浓硫酸与金属反应时不能生成H2,硫酸体现酸性和氧化性。
Ⅱ.常温下,浓硫酸使得铁和铝发生“钝化”
Ⅲ.浓硫酸与非金属反应只体现氧化性。
2.化学性质
(二)浓硫酸
Cu + 2H2SO4 (浓)== CuSO4 + SO2↑+ 2H2O
C + 2H2SO4 (浓) == CO2 ↑+ 2SO2↑+ 2H2O
总结
(1)敞口放置浓硫酸时,质量增加, 。
(2)把CuSO4 5H2O 晶体放入浓硫酸中,变白色, 。
(3)锌粒放入稀硫酸中,有气体放出, 。
(4)把木屑放入浓硫酸中,变黑, 。
(5)铁、铝在浓硫酸中:“钝化 ” 。
吸水性
酸性、氧化性
脱水性
6.储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现浓硫酸的( )
A.脱水性和吸水性 B.吸水性和酸性
C.强氧化性和吸水性 D.不挥发性与酸性
B
强氧化性
5.将下列现象中硫酸表现出来的性质写在空白处:
吸水性
牛刀小试
名称 浓硫酸 稀硫酸
主要成份
氧化性
还原产物
遇Fe、Al (常温)
遇Cu(加热)
遇C (加热)
脱水性
吸水性
★浓硫酸与稀硫酸的比较:
H2SO4分子
H+、SO42-、H2O
+6价S,强氧化性
+1价H+,弱氧化性
SO2
H2
钝化
反应
加热生成 SO2
反应
反应
有
生成 H2
不反应
不反应
无
有
无
二、硫酸根离子的检验:
取待测液
加盐酸酸化
无变化
有无白色沉淀
滴加BaCl2溶液
※SO32- 、 HSO3-的检验:
待测液
白色沉淀
刺激性气味的气体
褪色
品红
无明显变化
刺激性气味的气体
褪色
品红
BaCl2溶液
BaCl2溶液
盐酸
则待测液中有SO32-
则待测液中有HSO3-
待测液
盐酸
注:不能用Ba(OH)2来检验这两种离子!
加盐不加碱(类比鉴别Na2CO3、NaHCO3)
现象一样,不能用于检验!
能否将BaCl2溶液换成Ba(OH)2
三、常见的硫酸盐
芒硝
胆矾
绿矾
明矾
KAl(SO4)2 12H2O
CuSO4 5H2O
FeSO4 7H2O
矾:含有结晶水的金属硫酸盐
Na2SO4 10H2O
四、工业制硫酸
4FeS2+11O2==2Fe2O3+8SO2↑
高温
2SO2+O2 2SO3
催化剂
SO3+H2O=H2SO4
7.如图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中有淡黄色沉淀生成,⑤中的溴水褪色,请回答:
(1)①中发生反应的离子方程式为_______________________________________。(2)②中的实验现象是__________________________________________________。(3)③中的实验现象是__________________________________________________,证明SO2有________性。 (4)④中SO2作________剂。(5)⑤中反应生成两种强酸,该反应的离子方程式是_____________________,当1 mol SO2参与反应时,转移电子的物质的量是________。(6)⑥的作用是_________________________________________________________。
牛刀小试
SO32-+2H+=SO2↑+H2O
石蕊溶液变红色
品红溶液褪色
漂白
氧化
吸收过量的二氧化硫,防止污染环境
2 mol
SO2+Br2+2H2O=4H++2Br-+SO42-
感谢聆听!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
