第五章 化工生产中的重要非金属元素 测试题 (含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 测试题 (含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1020.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 23:17:47 | ||
图片预览



文档简介
第五章 化工生产中的重要非金属元素 测试题
一、单选题
1.世界文明史上,中华文化是世界上唯一从未间断的文明,始终显示出顽强的生命力和无穷的魅力。
下列文物主要由硅酸盐材料制成的是( )
A.东汉青铜奔马“马踏飞燕” B.唐代“鎏金舞马衔杯纹银壶” C.秦“兵马俑” D.仅49 g的西汉“直裾素纱禅衣”
A.A B.B C.C D.D
2.我国历史文化悠久,科技发展迅猛,给人类留下了无数瑰宝。下列物品的主要成分是硅酸盐的是( )
A B C D
东汉马踏飞燕 白釉绿彩长颈鹿 我国宇航员穿的航天服 我国研制的歼20用的隐形涂料
A.A B.B C.C D.D
3.下列说法错误的是( )
A.二氧化氮会导致酸雨和光化学烟雾,危害较大
B.铝的氧化物熔点高,常用于制造耐火材料
C.人体中极少量的NO会促进血管扩张,可防止血管栓塞
D.Al(OH)3胶体能凝聚水中的悬浮物并使之沉降,因此明矾常用于自来水消毒剂
4.下列物品所用材料含有硅单质的是( )
A.计算机芯片 B.光导纤维 C.水晶镜片 D.门窗玻璃
5.水泥和普通玻璃都是常见的硅酸盐产品。下列说法中错误的是( )
A.生产水泥和普通玻璃的每一种原料都含有硅
B.水泥、普通玻璃都是混合物
C.生产水泥和玻璃都必须用石灰石
D.用纯净的石英制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器
6.下列关于元素及其化合物的性质说法不正确的是( )
A.铁和浓硫酸在常温时不能反应
B.实验室用过氧化氢分解制氧气
C.Al2O3可溶于NaOH溶液生成偏铝酸钠
D.水玻璃中通入CO2会产生沉淀
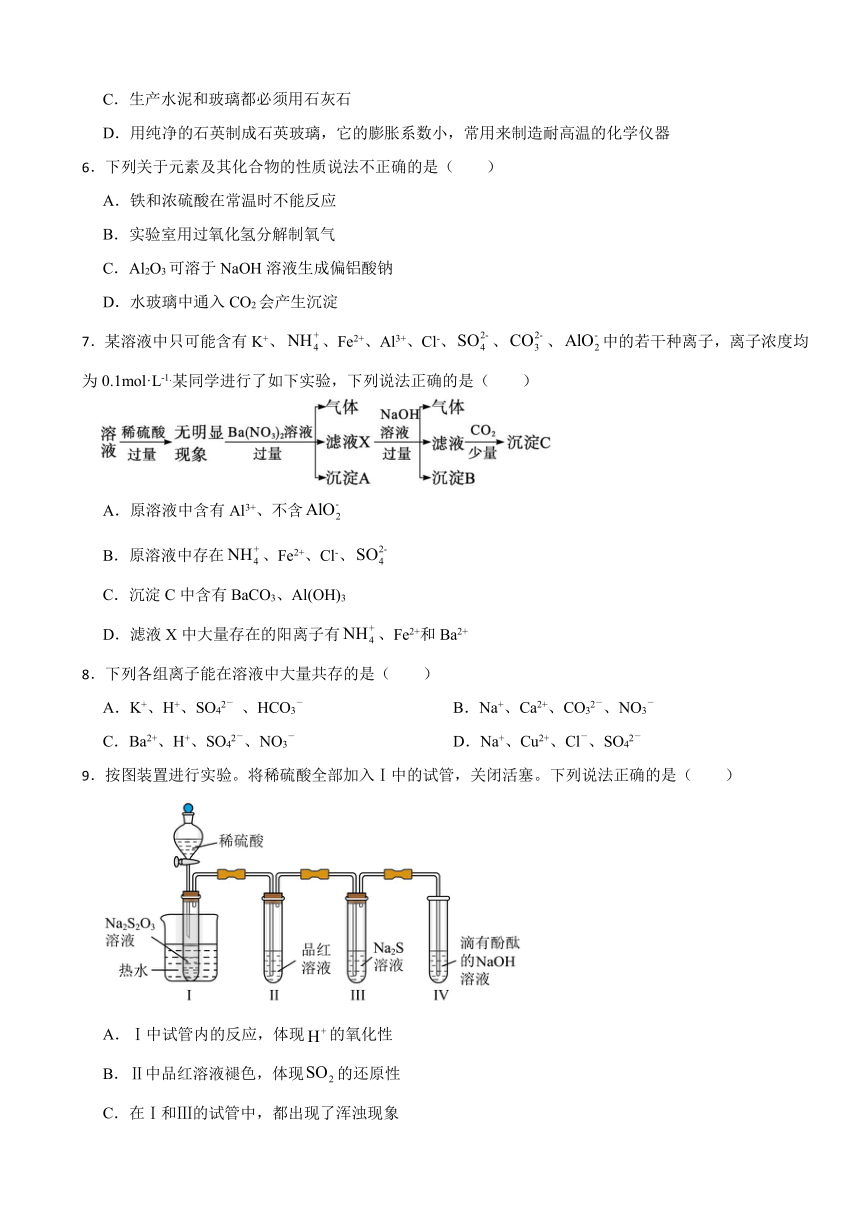
7.某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )
A.原溶液中含有Al3+、不含
B.原溶液中存在、Fe2+、Cl-、
C.沉淀C中含有BaCO3、Al(OH)3
D.滤液X中大量存在的阳离子有、Fe2+和Ba2+
8.下列各组离子能在溶液中大量共存的是( )
A.K+、H+、SO42- 、HCO3- B.Na+、Ca2+、CO32-、NO3-
C.Ba2+、H+、SO42-、NO3- D.Na+、Cu2+、Cl-、SO42-
9.按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内的反应,体现的氧化性
B.Ⅱ中品红溶液褪色,体现的还原性
C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
10.下列说法错误的是( )
A.利用丁达尔现象可以鉴别胶体和溶液
B.用浓硫酸干燥二氧化硫
C.用酒精灯直接加热蒸发皿
D.KCl溶液、水和淀粉溶液都属于分散系
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Fe3+、Ba2+、NO、Cl-
B.使酚酞变红色的溶液中:Na+、NH4+、Cl-、SO
C.可以与铁反应产生氢气的溶液中:K+、Cl-、SO、NO3-
D.可以使紫色石蕊试液变红的溶液中:K+、Na+、HCO、NO
12.向含的溶液中通入一定体积的使其充分反应,再向所得溶液中逐滴滴加稀盐酸。测得产生的物质的量随加入的物质的量变化如图所示。则下列说法错误的是( )
A.A点之前发生的离子反应为
B.图中的
C.在D点对应的溶液中,不能大量共存
D.向氢氧化钠溶液中通入的体积为
13.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.②③ B.①③④ C.①④ D.①②③
14.下列各组离子在水溶液中能够大量共存的是( )
A.OH -、 K+、NH4+ B.Ba2+、SO42-、H+
C.Ag+、 K+、Cl - D.Na+、 Cl -、 CO32-
15.下列各组离子在给定溶液中能大量共存的是( )
A.pH=1的盐酸中:
B.澄清透明的溶液中:
C.弱碱性溶液中:
D.的Na2CO3溶液中:
16.下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.①②③ B.①③ C.②③ D.①④
17.能在酸性溶液中大量共存且溶液为无色的离子组是( )
A.Na+、Al3+、NO、Cl- B.Na+、Fe3+、SO、Cl-
C.Ba2+、Al3+、NO、SO D.Na+、K+、ClO-、NO
18.物质的性质决定用途,下列两者对应关系错误的是
A.具有还原性,可用作消毒剂
B.硬铝密度小、强度高,可用作航空材料
C.溶液呈碱性,可用于去除油污
D.具有漂白性,可用于漂白纸浆
19.化学与生产和生活密切相关,下列有关说法正确的是( )
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
C.泡沫灭火器中用的是小苏打和硫酸铝
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
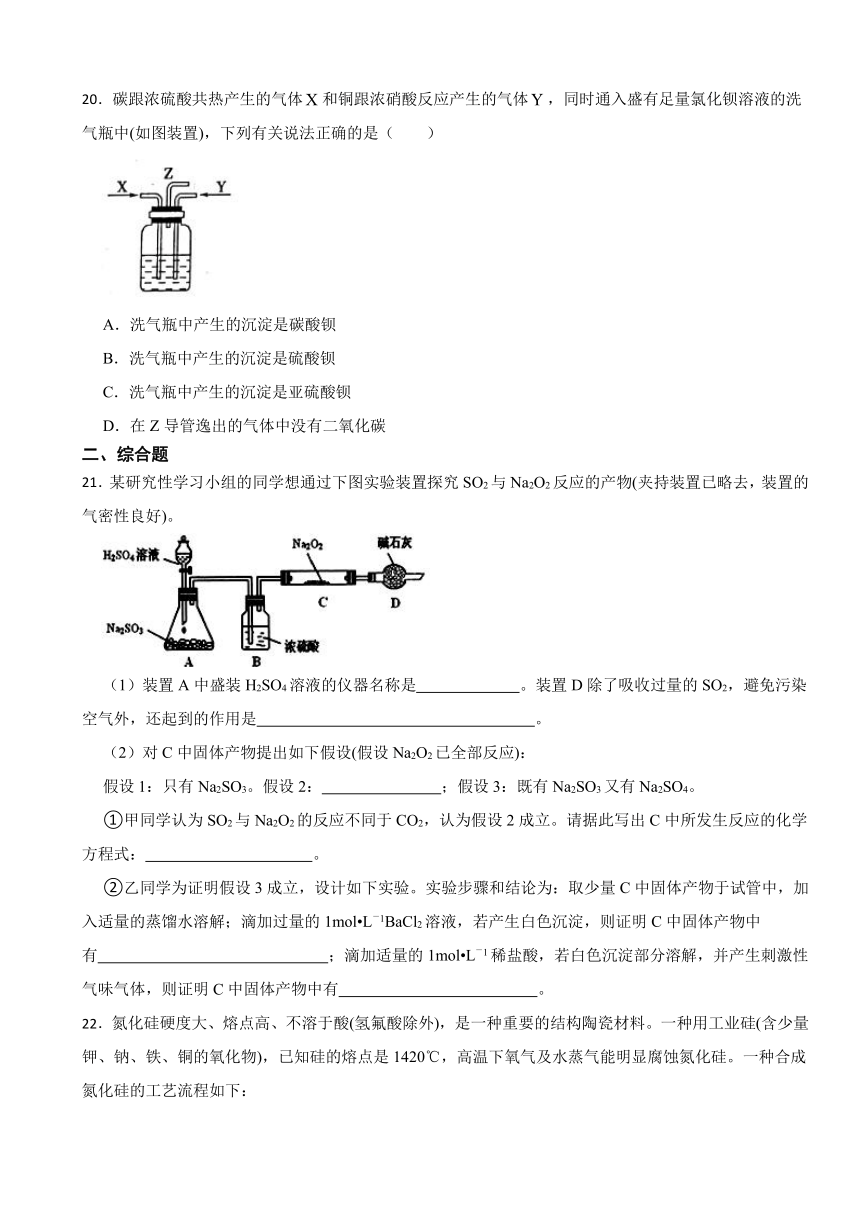
20.碳跟浓硫酸共热产生的气体和铜跟浓硝酸反应产生的气体,同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管逸出的气体中没有二氧化碳
二、综合题
21.某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物(夹持装置已略去,装置的气密性良好)。
(1)装置A中盛装H2SO4溶液的仪器名称是 。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是 。
(2)对C中固体产物提出如下假设(假设Na2O2已全部反应):
假设1:只有Na2SO3。假设2: ;假设3:既有Na2SO3又有Na2SO4。
①甲同学认为SO2与Na2O2的反应不同于CO2,认为假设2成立。请据此写出C中所发生反应的化学方程式: 。
②乙同学为证明假设3成立,设计如下实验。实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;滴加过量的1mol L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有 ;滴加适量的1mol L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有 。
22.氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺流程如下:
注:原料中的N2是采用空气分离法制备。
(1)净化N2和H2时,铜屑的作用是 ;硅胶的作用是 。
(2)氮化炉中发生反应:3SiO2(s)+2N2(g)=Si3N4(s),同时会剧烈放热,反应时要严格控制氮气的流速以控制 ,原因是 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
23.某些化学反应可用下式表示:A+B→C+D+H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C为氯化钠,D为能使澄清石灰水变浑浊的无色无味气体,则A与B的组合是 或 。
(3)若A为紫红色金属,D为红棕色气体,请写出符合上式的化学方程式 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
24.自然界的氮循环如图所示,回答下列问题。
(1)①、②、③中,属于氮的固定的是 。
(2)如图为N2转化为HNO3的流程。
N2NONO2HNO3
①N2转化为NO的化学方程式是 。
②NO2转化为HNO3的反应中,NO2体现 性。
(3)N2也可以转化为NH3,写出工业合成氨的化学方程式 。
(4)任意写出一个以稀硝酸为原料,制备KNO3的反应的化学方程式 。
25.某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
(1)“酸浸”过程中发生的主要反应的离子方程式为 。
(2)“氧化”的目的是 。检验Fe3+的方法是 。
(3)滤渣I的主要成分 。溶于酸的反应方程式 。
(4)②“转化”时主要反应的离子方程式为 。
答案解析部分
1.【答案】C
【解析】【解答】A、东汉青铜奔马“马踏飞燕”由金属材料制成,故A不符合题意;
B、唐代“鎏金舞马衔杯纹银壶”由金属材料制成,故B不符合题意;
C、秦“兵马俑”成分为陶瓷,主要由硅酸盐材料制成,故C符合题意;
D、“直裾素纱禅衣”主要成分为蚕丝,蚕丝为蛋白质,故D不符合题意;
故答案为:C。
【分析】A、青铜属于金属材料;
B、银属于金属材料;
C、秦“兵马俑”成分为陶瓷;
D、禅衣的主要成分为蛋白质。
2.【答案】B
【解析】【解答】A.主要成分是铜合金,A选项是错误的;
B. 白釉绿彩长颈鹿属于陶瓷,属于硅酸盐材料,B选项是正确的;
C.我国宇航员穿的航天服 属于特殊材质,具有特殊性能,属于有机材料,C选项是错误的;
D. 我国研制的歼20用的隐形涂料 ,属于超材料隐身薄膜,超材料是一种特种复合材料,D选项是错误的。
故答案为:B。
【分析】硅酸盐是一种无机材料,具有良好的绝热性能和耐高温性能。 它通常由硅酸盐水泥、轻质骨料(如珍珠岩、蛭石等)、外加剂以及其他辅助材料组成。 复合硅酸盐制品的制作工艺简单,成本相对较低,且具有较高的强度和抗压性能,因此被广泛应用于各种建筑工程和工业设备中。
3.【答案】D
【解析】【解答】A.NO2大量排放不仅会形成硝酸型酸雨,还会导致光化学烟雾,危害较大,故A不符合题意;
B.氧化铝的熔点很高,常用于制造耐火材料,如耐火砖、坩埚等,故B不符合题意;
C.NO是明星分子,在人体的血管系统内具有传送信号的功能,NO极少量时在人体的血管系统内会促进血管扩张,防止血管栓塞,故C不符合题意;
D.明矾无强氧化性,不能杀菌消毒,故D符合题意;
故答案为:D。
【分析】A、根据二氧化氮的性质分析;
B、根据氧化铝的特点分析;
C、NO极少量有助于人体健康;
D、明矾不能用于杀菌。
4.【答案】A
【解析】【解答】A.硅正好处于金属与非金属的过渡位置,其单质的导电性介于导体与绝缘体之间,是应用最为广泛的半导体材料;利用其半导体性能可以制成计算机、通信设备和家用电器等的芯片,以光伏电站、人造卫星和电动汽车等的硅太阳能电池,A符合题意;
B.二氧化硅可用来生产光导纤维,其通信容量大,抗干扰性能好,传输的信号不易衰减,能有效提高通信效率,B不符合题意;
C.石英晶体中无色透明的晶体就是通常所说的水晶,所以水晶镜片的材料为二氧化硅,C不符合题意;
D.传统的无机非金属材料多为硅酸盐材料,在日常生活中随处可见,如制作餐具的陶瓷、窗户上的玻璃、建筑用的水泥等,所以门窗玻璃的材料为硅酸盐,D不符合题意;
故答案为:A。
【分析】单质硅具有良好的导电性,是计算机芯片的主要材料。
5.【答案】A
【解析】【解答】A.硅酸盐工业所用原料有硅酸盐、二氧化硅、石灰石、纯碱等,不一定每一种原料中都必须含有硅,A符合题意;
B.玻璃是传统硅酸盐产品,主要成分有硅酸钠、硅酸钙等,水泥是传统硅酸盐产品,其中含有硅酸三钙、硅酸二钙、铝酸三钙、铝酸三钙,都是混合物,B不符合题意;
C.生产玻璃的原料主要有纯碱、石灰石、石英,生产水泥的原料主要有石灰石、粘土,都需用石灰石,C不符合题意;
D.二氧化硅为原子晶体,熔点高,硬度大,结构稳定,用纯净的石英可制成石英玻璃,它的膨胀系数小,故常用来制造耐高温的化学仪器,D不符合题意。
故答案为:A
【分析】A.硅酸盐工业还用到了石灰石(主要成分碳酸钙)、纯碱(碳酸钠)等;
B.玻璃和水泥均为各种硅酸盐的混合物;
C.熟记生产水泥和玻璃的原料;
D.石英的主要成分为二氧化硅,为原子晶体,可用于制作半导体、电光源器、半导通信装置、激光器,光学仪器,实验室仪器、电学设备、医疗设备和耐高温耐腐蚀的化学仪器、化工、电子、冶金、建材以及国防等工业,应用十分广泛。
6.【答案】A
【解析】【解答】A:铁在冷浓硫酸中钝化,即在铁表面生成致密的氧化膜从而阻止内层金属进一步反应,并非不反应,故A符合题意;
B:实验室用过氧化氢分解制氧气,故B不符合题意;
C:Al2O3可溶于NaOH溶液生成偏铝酸钠,故C不符合题意;
D:水玻璃主要成分为硅酸钠,硅酸钠与CO2会生产硅酸沉淀,故D不符合题意;
故答案为:A
【分析】铁在冷的浓硫酸或浓硝酸中钝化。
7.【答案】B
【解析】【解答】A.根据上述分析可知,溶液中不含Al3+、,故A不符合题意;
B.根据上述分析可知,溶液中存在、Fe2+、Cl-、,故B符合题意;
C.根据上述分析可知,溶液中不含Al3+,则沉淀C为碳酸钡,不含Al(OH)3,故C不符合题意;
D.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Ba2+,故D不符合题意;
故答案为:B。
【分析】加入过量稀硫酸无明显变化,说明无 、Ba2+和;加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀A为硫酸钡;加入NaOH有气体,说明存在铵根离子,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;通入少量CO2产生沉淀,沉淀C为碳酸钡,不能说明存在Al3+; 离子浓度均为0.1mol·L-1,根据电荷守恒,只能含有、Fe2+、Cl-、,才能保证电荷守恒,K+一定不存在。
8.【答案】D
【解析】【解答】A.氢离子和碳酸氢根离子形成气体不共存,故A不符合题意;
B.钙离子和碳酸根离子形成沉淀不共存,故B不符合题意;
C.钡离子和硫酸根离子形成沉淀不共存,故C不符合题意;
D.该四种离子可共存,故D符合题易;
故答案为:D
【分析】A.氢离子和碳酸根离子不共存;
B.钙离子和碳酸根离子不共存;
C.钡离子和硫酸根离子不共存;
D.找出不共存离子对即可。
9.【答案】C
【解析】【解答】A、装置Ⅰ中稀硫酸提供H+反应后生成H2O,因此反应过程中体现了H+的酸性,A不符合题意。
B、装置Ⅱ中品红溶液褪色,体现了SO2的漂白性,B不符合题意。
C、装置Ⅰ和装置Ⅲ都反应生成了S,因此都产生了淡黄色浑浊,C符合题意。
D、撤去水浴加热后,重新实验,则SO2逸出的量减少,装置Ⅳ中溶液红色褪去变慢,D不符合题意。
故答案为:C
【分析】装置Ⅰ中发生反应S2O32-+2H+=S↓+SO2↑+H2O,烧杯中的热水,可促使SO2逸出。SO2加入装置Ⅱ中,使得品红溶液褪色,体现了SO2的漂白性。SO2进入装置Ⅲ中,SO2将Na2S溶液中S2-氧化成S,体现了SO2的氧化性。最后SO2进入滴有酚酞的NaOH溶液中,溶液红色褪去,体现了SO2酸性氧化物的性质;同时也进行了尾气处理,防止SO2逸出,造成空气污染。
10.【答案】D
【解析】【解答】A.胶体能产生丁达尔效应,溶液不能,则利用丁达尔现象可以鉴别胶体和溶液,故A不符合题意;
B.二氧化硫属于酸性氧化物,浓硫酸属于酸性干燥剂,S元素相邻价态之间不发生反应,可用浓硫酸干燥二氧化硫,故B不符合题意;
C.蒸发皿为可以直接加热的实验仪器,故C不符合题意;
D.分散系属于混合物,纯水属于纯净物,KCl溶液和淀粉溶液都属于分散系,故D符合题意;
故答案为:D。
【分析】分散系中包含分散质和分散剂,是混合物,氯化钾溶液中分散质是氯化钾,分散剂是水,淀粉溶液分散质是淀粉,分散剂是水,而水是纯净物。
11.【答案】A
【解析】【解答】A、溶液中各个离子相互间不发生反应,可大量共存,A符合题意。
B、能使酚酞变红色的溶液中含有大量的OH-,OH-能与NH4+反应生成NH3·H2O,不可大量共存,B不符合题意。
C、能与Fe反应的溶液中含有大量的H+,NO3-在H+条件下具有氧化性,能将SO32-氧化成SO42-,不可大量共存,C不符合题意。
D、能使紫色石蕊溶液变红色的溶液中含有大量的H+,H+能与HCO3-反应生成H2O和CO2,不可大量共促,D不符合题意。
故答案为:A
【分析】此题是对离子共存的考查,溶液中的离子可大量共存,则相互间不发生反应。即不形成难溶(或微溶)物质、不形成弱电解质、不形成易挥发性物质;不发生氧化还原反应;不发生络合反应。据此结合选项所给离子组进行分析。
12.【答案】D
【解析】【解答】A、由分析可知,OA段发生反应,故A正确;
B、由分析可知,图中的,故B正确;
C、D点溶液中的溶质为NaCl、HCl,酸性条件下,高锰酸根离子会将氯离子氧化为氯气,不能大量共存,故C正确;
D、气体所处的状态未知,不能计算其体积,故D错误;
故答案为:D。
【分析】向NaOH溶液中通入一定量气体,发生反应:2NaOH+CO2=Na2CO3+H2O,当该反应完成后,向所得溶液中滴入稀盐酸,BC段发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,C点时完全反应,此时溶液中的溶质为NaCl,根据元素守恒可知n(HCl)=n(NaCl)= n(NaOH)=1mol,则b=1.0;消耗HCl的物质的量为1mol -0.6 mol =0.4 mol<0.6 mol,说明NaOH溶液与CO2气体反应时NaOH未完全反应,所得溶液为NaOH与Na2CO3混合溶液。则在OA段发生反应:NaOH+HCl=NaCl+H2O,AB段发生反应:Na2CO3+HCl=NaCl+NaHCO3。
13.【答案】D
【解析】【解答】①Si Na2SiO3 H2SiO3 SiO2 Si,满足表中图示物质在一定条件下一步转化关系;
②Na NaOH Na2CO3 NaCl Na,满足表中图示物质在一定条件下一步转化关系;
③Cl2 Ca(ClO)2 HClO HCl Cl2,满足表中图示物质在一定条件下一步转化关系;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故不满足题意;
故答案为:D。
【分析】①硅与氢氧化钠生成硅酸钠,与盐酸反应生成硅酸,受热分解成二氧化硅,与碳共热反应生成硅单质;
②钠与水生成氢氧化钠,通二氧化碳生成碳酸钠,与盐酸反应生成氯化钠,电解成钠;
③氯气与熟石灰生成次氯酸钙,与二氧化碳生成次氯酸,见光分解成氯化氢气体,二氧化锰反应生成氯气;
④铁与氯气生成氯化铁,溶液种与铁单质生成氯化亚铁,与氢氧化钠反应生成氢氧化亚铁;
14.【答案】D
【解析】【解答】A.OH –和NH4+离子之间发生反应生成氨水,在溶液中不能大量共存,故A不符合题意;
B.Ba2+和SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B不符合题意;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C不符合题意;
D.Na+、Cl-、CO32-之间不发生反应,在溶液中可以大量共存,故D符合题意;
故答案为:D。
【分析】能够反应生成沉淀,气体和水,以及弱酸和弱碱的离子在溶液中不能大量共存,据此解答即可。
15.【答案】C
【解析】【解答】A.pH=1的盐酸中含有大量H+,H+与ClO-结合生成弱酸HClO,不能大量共存,A不符合题意;
B. 结合生成络合物,不能大量共存,B不符合题意;
C. 弱碱性溶液中含有OH-较少,各离子之间能大量共存,C符合题意;
D. CO32- 与Al3+能发生双水解反应,不能大量共存,D不符合题意;
故答案为:C。
【分析】判断离子之间是否能大量共存,主要看离子之间是否发生反应。若离子之间反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应等时,离子之间不可大量共存。在遇到此类试题时,注意题干中是否涉及颜色,要熟悉溶液中常见离子的颜色,以及溶液的酸碱性。另注意“H+与NO3-”组合具有强氧化性,能与S2-、Fe2+、I-等发生氧化还原反应。
16.【答案】A
【解析】【解答】①硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸受热分解生成二氧化硅,二氧化硅在高温条件下与碳反应生成硅单质,选项①符合;
②钠与水反应生成氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与盐酸反应生成氯化钠,电解熔融氯化钠得到钠,选项②符合;
③氯气与石灰乳反应生成次氯酸钙,次氯酸钙与二氧化碳和水反应生成次氯酸,次氯酸见光分解生成盐酸,浓盐酸与二氧化锰加热条件下反应制备氯气,选项③符合;
④铁与氯气反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不能一步转化为铁,选项④不符合,
综上所述,①②③符合题意,A项符合题意
故答案为:A。
【分析】①Si+2NaOH+H2O=Na2SiO3+2H2↑,Na2SiO3+2HCl= H2SiO3+2NaCl,H2SiO3SiO2+H2O;
②2Na+2H2O=2NaOH+H2↑,2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=CO2↑+H2O+2NaCl;
③2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,Ca(ClO)2+CO2+H2O=2HClO+CaCO3,2HClO2HCl+O2↑;
④氢氧化亚铁不能一步转化为铁。
17.【答案】A
【解析】【解答】A. Na+、Al3+、NO、Cl-,各离子均为无色,且均能与H+大量共存,A符合题意;
B. 含有Fe3+的溶液呈黄色,B不合题意;
C. Ba2+与SO将生成硫酸钡沉淀而不能大量共存,C不合题意;
D. ClO-与H+将转化为HClO,二者不能大量共存,D不合题意;
故答案为:A。
【分析】思路分析:判断离子共存方法,1.看溶液中离子之间因发生复分解反应生成沉淀、气体和弱电解质而不能共存;2看离子之间因发生氧化还原反应而不能共存,3.注意题目隐含条件,颜色、pH.
18.【答案】A
【解析】【解答】A.具有强氧化性,可用作消毒剂,故A符合题意;
B.硬铝合金具有密度小、强度高的优良特性,因此可用作航空材料,故B不符合题意;
C.溶液呈碱性,可促进油脂水解生成溶水物质,常用于去除油污,故C不符合题意;
D.具有漂白性,可用于漂白纸浆、草帽等,故D不符合题意;
故答案为:A。
【分析】依据物质的性质判断应用,A.具有强氧化性。
19.【答案】C
【解析】【解答】A. 生石灰具有吸水性,可作干燥剂,不能作还原性,A不符合题意;
B. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是硅酸盐,B不符合题意;
C.小苏打是强碱弱酸盐,水解使溶液显碱性;硫酸铝是强酸弱碱盐,水解使溶液显酸性,当二者在溶液中混合时,发生双水解反应,相互促进,产生大量CO2气体和Al(OH)3固体,从而可以起到灭火作用,故用在泡沫灭火器中灭火,C符合题意;
D. 二氧化硫具有强的还原性,可用作葡萄酒的抗氧化剂,D不符合题意;
故答案为:C
【分析】A.生石灰具有吸水性,不与空气中的氧气反应;
B.瓷器的主要成分是硅酸盐;
C.泡沫灭火器的主要原料为NaHCO3和Al2(SO4)3;
D.少量SO2可做抗氧化剂;
20.【答案】B
【解析】【解答】A.H2SO4能与氯化钡反应生成BaSO4,由于盐酸的酸性比碳酸强,所以二氧化碳不与氯化钡反应,所以没有BaCO3生成,A不符合题意;
B.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,B符合题意;
C.根据选项B分析可知洗气瓶中产生的沉淀是硫酸钡,C不符合题意;
D.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,CO2、NO气体不能发生反应,以气体形式逸出,故在Z导管逸出的气体中含有CO2,D不符合题意;
故答案为:B。
【分析】根据题干信息可知,X是CO2与SO2的混合气体,Y是NO2。将X、Y同时通入洗气瓶中,发生反应SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,CO2不参与反应,所以Z导管逸出的气体中含有CO2和NO。
21.【答案】(1)分液漏斗;防止空气中的水和CO2进入玻璃管C
(2)只有Na2SO4;SO2+Na2O2=Na2SO4;Na2SO3和Na2SO4至少有一种;既有Na2SO3又有Na2SO4
【解析】【解答】(1)根据仪器的结构可知,装置A中盛装H2SO4溶液的仪器名称是分液漏斗;空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰,碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;(2)根据题给假设1、假设3可知假设2应该为:只有Na2SO4;①若假设2成立,二氧化硫和过氧化钠反应生成硫酸钠,反应的化学方程式为:Na2O2+SO2=Na2SO4;②乙同学为证明假设3成立,设计如下实验:实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
滴加过量的1mol L-1BaCl2溶液,若产生白色沉淀,由于硫酸钡和亚硫酸钡均为不溶于水的白色固体,则证明C中固体产物中Na2SO3和Na2SO4至少有一种;
滴加适量的1mol L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,溶解的为亚硫酸钡,不溶的为硫酸钡,则证明C中固体产物中既有Na2SO3又有Na2SO4。
【分析】本试验的目的为探究过氧化钠与二氧化硫反应,但过氧化钠与水和二氧化碳都反应,所以这两种物质对本实验产生干扰,所以要防止这两种物质进入C中。所以B的作用为干燥二氧化硫,D的作用防止空气中的水和二氧化碳进入C中。
22.【答案】(1)除去原料气中残存的氧气;除去生成的水蒸气
(2)温度;防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触
(3)硝酸
(4)用pH试纸测得最后一次洗涤的滤出液呈中性
(5)9Si+4NaN33Si3N4 +4Na↑
【解析】【解答】(1) Cu能与O2反应,除去原料气中的氧气,高温下H2与O2反应生成水,硅胶有吸水性,可除去生成的水蒸气;
(2)氮化炉中3SiO2(s)+2N2(g)=Si3N4(s),是放热反应, 控制温度,温度过高,会导致硅熔化熔合成团,阻碍与N2接触;
(3)为除去混有的Cu,可选择硝酸,Cu与硝酸能够反应,氮化硅与硝酸不反应;
(4)可以用pH试纸测得最后一次洗涤的滤出液的酸碱性;
(5)硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧反应生成氮化硅,和Na,化学方程式为 9Si+4NaN33Si3N4 +4Na↑ ;
【分析】(1) Cu能与O2反应,高温下H2与O2反应生成水,硅胶有吸水性;
(2)放热反应,反应需控制温度;
(3)Cu与硝酸能够反应,氮化硅与硝酸不反应;
(4)可以使用pH试纸测酸碱性;
(5)硅和NaN3直接燃烧反应生成氮化硅,和Na。
23.【答案】(1)Cl2+2OH-=Cl-+ClO-+H2O
(2)Na2CO3、HCl;NaHCO3、HCl
(3)Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O
(4)碳与浓硫酸
【解析】【解答】(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,则该反应可能是氯气与NaOH反应,产生NaCl、NaClO和水,该反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
(2)若C为氯化钠,D为能使澄清石灰水变浑浊的无色无味气体,该气体是CO2,A与B的组合是盐酸与NaHCO3或盐酸与Na2CO3,(3)若A为紫红色金属,D为红棕色气体,则A是Cu单质,B是浓硝酸,C是Cu(NO3)2,D是NO2,符合上式的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4) 若C、D均为气体且都能使澄清石灰水变浑浊,则A是C单质,B是浓硫酸,C与D分别是CO2、SO2中的一种。
【分析】(1)氯气的歧化反应;
(2)NaHCO3和Na2CO3均可以和盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑; NaHCO3+HCl=NaCl+CO2↑+H2O;
(3)Cu和浓硝酸发生氧化还原反应;
(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O 。
24.【答案】(1)①、②
(2);氧化和还原
(3)
(4)
【解析】【解答】(1)①、②、③中,属于氮的固定的是①和②属于非生物固氮,故答案为①、②。
(2)①N2和O2生成NO,化学方程式为;故答案为。
②NO2转化为HNO3,反应方程式为,N元素化合价从+4价变为+2价和+5价;即表现出氧化性也表现出还原性;故答案为氧化和还原。
(3)N2也可以转化为NH3,工业合成氨的化学方程式为;
(4)稀硝酸为原料,制备KNO3;可用稀硝酸与强氧化钾反应;化学方程式为;故答案为。
【分析】(1)氮的固定指的是将氮元素由单质转化为化合物;
(2) ① 氮气和氧气在放点后置高温下生成一氧化氮;
② 二氧化氮中氮元素化合价有升有将,既体现为氧化性,又体现为还原性;
(3)氮气和氢气在高温高压催化剂的条件下生成氨气;
(4)硝酸和氢氧化钾反应生成硝酸钾和水。
25.【答案】(1)Al2O3+6H+=2Al3++3H2O
(2)将Fe2+氧化成Fe3+,有利于其水解除去铁元素;取少量待测液于试管中,滴加KSCN溶液,若溶液出现血红色,则证明有Fe3+
(3)SiO2;SiO2+4HF=SiF4↑+2H2O
(4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-)
【解析】【解答】(1)酸浸过程中金属氧化物都和稀盐酸反应生成氯化物,主要离子反应方程式为 ,
故答案为: ;(2)铁离子易水解生成沉淀且需要的pH较小,将Fe2+氧化成Fe3+,有利于其水解除去铁元素;铁离子用KSCN溶液检验,其检验方法是:取少量母液Ⅰ,滴加KSCN溶液,无血红色,则Fe3+已水解完全,
故答案为:将Fe2+氧化成Fe3+,有利于其水解除去铁元素;取少量待测液于试管中,滴加KSCN溶液,若溶液出现血红色,则证明有Fe3+;(3)通过以上分析知,滤渣I的成分为SiO2,SiO2只能和HF发生反应 故答案为:SiO2; ;(4)通过以上分析知,转化时发生的离子反应方程式为 (或 ),故答案为: (或 )。
【分析】煤矸石溶于稀盐酸发生的反应有 、 、 ,然后过滤,得到的滤渣I为SiO2,向滤液中通入氯气,发生的反应为 ,向溶液中加入碳酸钠,发生的反应为 、 、 、 ,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为 (或 ),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,据此分析解答。
一、单选题
1.世界文明史上,中华文化是世界上唯一从未间断的文明,始终显示出顽强的生命力和无穷的魅力。
下列文物主要由硅酸盐材料制成的是( )
A.东汉青铜奔马“马踏飞燕” B.唐代“鎏金舞马衔杯纹银壶” C.秦“兵马俑” D.仅49 g的西汉“直裾素纱禅衣”
A.A B.B C.C D.D
2.我国历史文化悠久,科技发展迅猛,给人类留下了无数瑰宝。下列物品的主要成分是硅酸盐的是( )
A B C D
东汉马踏飞燕 白釉绿彩长颈鹿 我国宇航员穿的航天服 我国研制的歼20用的隐形涂料
A.A B.B C.C D.D
3.下列说法错误的是( )
A.二氧化氮会导致酸雨和光化学烟雾,危害较大
B.铝的氧化物熔点高,常用于制造耐火材料
C.人体中极少量的NO会促进血管扩张,可防止血管栓塞
D.Al(OH)3胶体能凝聚水中的悬浮物并使之沉降,因此明矾常用于自来水消毒剂
4.下列物品所用材料含有硅单质的是( )
A.计算机芯片 B.光导纤维 C.水晶镜片 D.门窗玻璃
5.水泥和普通玻璃都是常见的硅酸盐产品。下列说法中错误的是( )
A.生产水泥和普通玻璃的每一种原料都含有硅
B.水泥、普通玻璃都是混合物
C.生产水泥和玻璃都必须用石灰石
D.用纯净的石英制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器
6.下列关于元素及其化合物的性质说法不正确的是( )
A.铁和浓硫酸在常温时不能反应
B.实验室用过氧化氢分解制氧气
C.Al2O3可溶于NaOH溶液生成偏铝酸钠
D.水玻璃中通入CO2会产生沉淀
7.某溶液中只可能含有K+、、Fe2+、Al3+、Cl-、、、中的若干种离子,离子浓度均为0.1mol·L-1.某同学进行了如下实验,下列说法正确的是( )
A.原溶液中含有Al3+、不含
B.原溶液中存在、Fe2+、Cl-、
C.沉淀C中含有BaCO3、Al(OH)3
D.滤液X中大量存在的阳离子有、Fe2+和Ba2+
8.下列各组离子能在溶液中大量共存的是( )
A.K+、H+、SO42- 、HCO3- B.Na+、Ca2+、CO32-、NO3-
C.Ba2+、H+、SO42-、NO3- D.Na+、Cu2+、Cl-、SO42-
9.按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内的反应,体现的氧化性
B.Ⅱ中品红溶液褪色,体现的还原性
C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
10.下列说法错误的是( )
A.利用丁达尔现象可以鉴别胶体和溶液
B.用浓硫酸干燥二氧化硫
C.用酒精灯直接加热蒸发皿
D.KCl溶液、水和淀粉溶液都属于分散系
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Fe3+、Ba2+、NO、Cl-
B.使酚酞变红色的溶液中:Na+、NH4+、Cl-、SO
C.可以与铁反应产生氢气的溶液中:K+、Cl-、SO、NO3-
D.可以使紫色石蕊试液变红的溶液中:K+、Na+、HCO、NO
12.向含的溶液中通入一定体积的使其充分反应,再向所得溶液中逐滴滴加稀盐酸。测得产生的物质的量随加入的物质的量变化如图所示。则下列说法错误的是( )
A.A点之前发生的离子反应为
B.图中的
C.在D点对应的溶液中,不能大量共存
D.向氢氧化钠溶液中通入的体积为
13.下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.②③ B.①③④ C.①④ D.①②③
14.下列各组离子在水溶液中能够大量共存的是( )
A.OH -、 K+、NH4+ B.Ba2+、SO42-、H+
C.Ag+、 K+、Cl - D.Na+、 Cl -、 CO32-
15.下列各组离子在给定溶液中能大量共存的是( )
A.pH=1的盐酸中:
B.澄清透明的溶液中:
C.弱碱性溶液中:
D.的Na2CO3溶液中:
16.下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 X Y Z W
① Si Na2SiO3 H2SiO3 SiO2
② Na NaOH Na2CO3 NaCl
③ Cl2 Ca(ClO)2 HClO HCl
④ Fe FeCl3 FeCl2 Fe(OH)2
A.①②③ B.①③ C.②③ D.①④
17.能在酸性溶液中大量共存且溶液为无色的离子组是( )
A.Na+、Al3+、NO、Cl- B.Na+、Fe3+、SO、Cl-
C.Ba2+、Al3+、NO、SO D.Na+、K+、ClO-、NO
18.物质的性质决定用途,下列两者对应关系错误的是
A.具有还原性,可用作消毒剂
B.硬铝密度小、强度高,可用作航空材料
C.溶液呈碱性,可用于去除油污
D.具有漂白性,可用于漂白纸浆
19.化学与生产和生活密切相关,下列有关说法正确的是( )
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
C.泡沫灭火器中用的是小苏打和硫酸铝
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
20.碳跟浓硫酸共热产生的气体和铜跟浓硝酸反应产生的气体,同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管逸出的气体中没有二氧化碳
二、综合题
21.某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物(夹持装置已略去,装置的气密性良好)。
(1)装置A中盛装H2SO4溶液的仪器名称是 。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是 。
(2)对C中固体产物提出如下假设(假设Na2O2已全部反应):
假设1:只有Na2SO3。假设2: ;假设3:既有Na2SO3又有Na2SO4。
①甲同学认为SO2与Na2O2的反应不同于CO2,认为假设2成立。请据此写出C中所发生反应的化学方程式: 。
②乙同学为证明假设3成立,设计如下实验。实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;滴加过量的1mol L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有 ;滴加适量的1mol L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有 。
22.氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺流程如下:
注:原料中的N2是采用空气分离法制备。
(1)净化N2和H2时,铜屑的作用是 ;硅胶的作用是 。
(2)氮化炉中发生反应:3SiO2(s)+2N2(g)=Si3N4(s),同时会剧烈放热,反应时要严格控制氮气的流速以控制 ,原因是 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
23.某些化学反应可用下式表示:A+B→C+D+H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C为氯化钠,D为能使澄清石灰水变浑浊的无色无味气体,则A与B的组合是 或 。
(3)若A为紫红色金属,D为红棕色气体,请写出符合上式的化学方程式 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
24.自然界的氮循环如图所示,回答下列问题。
(1)①、②、③中,属于氮的固定的是 。
(2)如图为N2转化为HNO3的流程。
N2NONO2HNO3
①N2转化为NO的化学方程式是 。
②NO2转化为HNO3的反应中,NO2体现 性。
(3)N2也可以转化为NH3,写出工业合成氨的化学方程式 。
(4)任意写出一个以稀硝酸为原料,制备KNO3的反应的化学方程式 。
25.某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
(1)“酸浸”过程中发生的主要反应的离子方程式为 。
(2)“氧化”的目的是 。检验Fe3+的方法是 。
(3)滤渣I的主要成分 。溶于酸的反应方程式 。
(4)②“转化”时主要反应的离子方程式为 。
答案解析部分
1.【答案】C
【解析】【解答】A、东汉青铜奔马“马踏飞燕”由金属材料制成,故A不符合题意;
B、唐代“鎏金舞马衔杯纹银壶”由金属材料制成,故B不符合题意;
C、秦“兵马俑”成分为陶瓷,主要由硅酸盐材料制成,故C符合题意;
D、“直裾素纱禅衣”主要成分为蚕丝,蚕丝为蛋白质,故D不符合题意;
故答案为:C。
【分析】A、青铜属于金属材料;
B、银属于金属材料;
C、秦“兵马俑”成分为陶瓷;
D、禅衣的主要成分为蛋白质。
2.【答案】B
【解析】【解答】A.主要成分是铜合金,A选项是错误的;
B. 白釉绿彩长颈鹿属于陶瓷,属于硅酸盐材料,B选项是正确的;
C.我国宇航员穿的航天服 属于特殊材质,具有特殊性能,属于有机材料,C选项是错误的;
D. 我国研制的歼20用的隐形涂料 ,属于超材料隐身薄膜,超材料是一种特种复合材料,D选项是错误的。
故答案为:B。
【分析】硅酸盐是一种无机材料,具有良好的绝热性能和耐高温性能。 它通常由硅酸盐水泥、轻质骨料(如珍珠岩、蛭石等)、外加剂以及其他辅助材料组成。 复合硅酸盐制品的制作工艺简单,成本相对较低,且具有较高的强度和抗压性能,因此被广泛应用于各种建筑工程和工业设备中。
3.【答案】D
【解析】【解答】A.NO2大量排放不仅会形成硝酸型酸雨,还会导致光化学烟雾,危害较大,故A不符合题意;
B.氧化铝的熔点很高,常用于制造耐火材料,如耐火砖、坩埚等,故B不符合题意;
C.NO是明星分子,在人体的血管系统内具有传送信号的功能,NO极少量时在人体的血管系统内会促进血管扩张,防止血管栓塞,故C不符合题意;
D.明矾无强氧化性,不能杀菌消毒,故D符合题意;
故答案为:D。
【分析】A、根据二氧化氮的性质分析;
B、根据氧化铝的特点分析;
C、NO极少量有助于人体健康;
D、明矾不能用于杀菌。
4.【答案】A
【解析】【解答】A.硅正好处于金属与非金属的过渡位置,其单质的导电性介于导体与绝缘体之间,是应用最为广泛的半导体材料;利用其半导体性能可以制成计算机、通信设备和家用电器等的芯片,以光伏电站、人造卫星和电动汽车等的硅太阳能电池,A符合题意;
B.二氧化硅可用来生产光导纤维,其通信容量大,抗干扰性能好,传输的信号不易衰减,能有效提高通信效率,B不符合题意;
C.石英晶体中无色透明的晶体就是通常所说的水晶,所以水晶镜片的材料为二氧化硅,C不符合题意;
D.传统的无机非金属材料多为硅酸盐材料,在日常生活中随处可见,如制作餐具的陶瓷、窗户上的玻璃、建筑用的水泥等,所以门窗玻璃的材料为硅酸盐,D不符合题意;
故答案为:A。
【分析】单质硅具有良好的导电性,是计算机芯片的主要材料。
5.【答案】A
【解析】【解答】A.硅酸盐工业所用原料有硅酸盐、二氧化硅、石灰石、纯碱等,不一定每一种原料中都必须含有硅,A符合题意;
B.玻璃是传统硅酸盐产品,主要成分有硅酸钠、硅酸钙等,水泥是传统硅酸盐产品,其中含有硅酸三钙、硅酸二钙、铝酸三钙、铝酸三钙,都是混合物,B不符合题意;
C.生产玻璃的原料主要有纯碱、石灰石、石英,生产水泥的原料主要有石灰石、粘土,都需用石灰石,C不符合题意;
D.二氧化硅为原子晶体,熔点高,硬度大,结构稳定,用纯净的石英可制成石英玻璃,它的膨胀系数小,故常用来制造耐高温的化学仪器,D不符合题意。
故答案为:A
【分析】A.硅酸盐工业还用到了石灰石(主要成分碳酸钙)、纯碱(碳酸钠)等;
B.玻璃和水泥均为各种硅酸盐的混合物;
C.熟记生产水泥和玻璃的原料;
D.石英的主要成分为二氧化硅,为原子晶体,可用于制作半导体、电光源器、半导通信装置、激光器,光学仪器,实验室仪器、电学设备、医疗设备和耐高温耐腐蚀的化学仪器、化工、电子、冶金、建材以及国防等工业,应用十分广泛。
6.【答案】A
【解析】【解答】A:铁在冷浓硫酸中钝化,即在铁表面生成致密的氧化膜从而阻止内层金属进一步反应,并非不反应,故A符合题意;
B:实验室用过氧化氢分解制氧气,故B不符合题意;
C:Al2O3可溶于NaOH溶液生成偏铝酸钠,故C不符合题意;
D:水玻璃主要成分为硅酸钠,硅酸钠与CO2会生产硅酸沉淀,故D不符合题意;
故答案为:A
【分析】铁在冷的浓硫酸或浓硝酸中钝化。
7.【答案】B
【解析】【解答】A.根据上述分析可知,溶液中不含Al3+、,故A不符合题意;
B.根据上述分析可知,溶液中存在、Fe2+、Cl-、,故B符合题意;
C.根据上述分析可知,溶液中不含Al3+,则沉淀C为碳酸钡,不含Al(OH)3,故C不符合题意;
D.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Ba2+,故D不符合题意;
故答案为:B。
【分析】加入过量稀硫酸无明显变化,说明无 、Ba2+和;加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀A为硫酸钡;加入NaOH有气体,说明存在铵根离子,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;通入少量CO2产生沉淀,沉淀C为碳酸钡,不能说明存在Al3+; 离子浓度均为0.1mol·L-1,根据电荷守恒,只能含有、Fe2+、Cl-、,才能保证电荷守恒,K+一定不存在。
8.【答案】D
【解析】【解答】A.氢离子和碳酸氢根离子形成气体不共存,故A不符合题意;
B.钙离子和碳酸根离子形成沉淀不共存,故B不符合题意;
C.钡离子和硫酸根离子形成沉淀不共存,故C不符合题意;
D.该四种离子可共存,故D符合题易;
故答案为:D
【分析】A.氢离子和碳酸根离子不共存;
B.钙离子和碳酸根离子不共存;
C.钡离子和硫酸根离子不共存;
D.找出不共存离子对即可。
9.【答案】C
【解析】【解答】A、装置Ⅰ中稀硫酸提供H+反应后生成H2O,因此反应过程中体现了H+的酸性,A不符合题意。
B、装置Ⅱ中品红溶液褪色,体现了SO2的漂白性,B不符合题意。
C、装置Ⅰ和装置Ⅲ都反应生成了S,因此都产生了淡黄色浑浊,C符合题意。
D、撤去水浴加热后,重新实验,则SO2逸出的量减少,装置Ⅳ中溶液红色褪去变慢,D不符合题意。
故答案为:C
【分析】装置Ⅰ中发生反应S2O32-+2H+=S↓+SO2↑+H2O,烧杯中的热水,可促使SO2逸出。SO2加入装置Ⅱ中,使得品红溶液褪色,体现了SO2的漂白性。SO2进入装置Ⅲ中,SO2将Na2S溶液中S2-氧化成S,体现了SO2的氧化性。最后SO2进入滴有酚酞的NaOH溶液中,溶液红色褪去,体现了SO2酸性氧化物的性质;同时也进行了尾气处理,防止SO2逸出,造成空气污染。
10.【答案】D
【解析】【解答】A.胶体能产生丁达尔效应,溶液不能,则利用丁达尔现象可以鉴别胶体和溶液,故A不符合题意;
B.二氧化硫属于酸性氧化物,浓硫酸属于酸性干燥剂,S元素相邻价态之间不发生反应,可用浓硫酸干燥二氧化硫,故B不符合题意;
C.蒸发皿为可以直接加热的实验仪器,故C不符合题意;
D.分散系属于混合物,纯水属于纯净物,KCl溶液和淀粉溶液都属于分散系,故D符合题意;
故答案为:D。
【分析】分散系中包含分散质和分散剂,是混合物,氯化钾溶液中分散质是氯化钾,分散剂是水,淀粉溶液分散质是淀粉,分散剂是水,而水是纯净物。
11.【答案】A
【解析】【解答】A、溶液中各个离子相互间不发生反应,可大量共存,A符合题意。
B、能使酚酞变红色的溶液中含有大量的OH-,OH-能与NH4+反应生成NH3·H2O,不可大量共存,B不符合题意。
C、能与Fe反应的溶液中含有大量的H+,NO3-在H+条件下具有氧化性,能将SO32-氧化成SO42-,不可大量共存,C不符合题意。
D、能使紫色石蕊溶液变红色的溶液中含有大量的H+,H+能与HCO3-反应生成H2O和CO2,不可大量共促,D不符合题意。
故答案为:A
【分析】此题是对离子共存的考查,溶液中的离子可大量共存,则相互间不发生反应。即不形成难溶(或微溶)物质、不形成弱电解质、不形成易挥发性物质;不发生氧化还原反应;不发生络合反应。据此结合选项所给离子组进行分析。
12.【答案】D
【解析】【解答】A、由分析可知,OA段发生反应,故A正确;
B、由分析可知,图中的,故B正确;
C、D点溶液中的溶质为NaCl、HCl,酸性条件下,高锰酸根离子会将氯离子氧化为氯气,不能大量共存,故C正确;
D、气体所处的状态未知,不能计算其体积,故D错误;
故答案为:D。
【分析】向NaOH溶液中通入一定量气体,发生反应:2NaOH+CO2=Na2CO3+H2O,当该反应完成后,向所得溶液中滴入稀盐酸,BC段发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,C点时完全反应,此时溶液中的溶质为NaCl,根据元素守恒可知n(HCl)=n(NaCl)= n(NaOH)=1mol,则b=1.0;消耗HCl的物质的量为1mol -0.6 mol =0.4 mol<0.6 mol,说明NaOH溶液与CO2气体反应时NaOH未完全反应,所得溶液为NaOH与Na2CO3混合溶液。则在OA段发生反应:NaOH+HCl=NaCl+H2O,AB段发生反应:Na2CO3+HCl=NaCl+NaHCO3。
13.【答案】D
【解析】【解答】①Si Na2SiO3 H2SiO3 SiO2 Si,满足表中图示物质在一定条件下一步转化关系;
②Na NaOH Na2CO3 NaCl Na,满足表中图示物质在一定条件下一步转化关系;
③Cl2 Ca(ClO)2 HClO HCl Cl2,满足表中图示物质在一定条件下一步转化关系;
④Fe与Cl2反应可生成FeCl3,FeCl3与Fe反应可得到FeCl2,FeCl2与氢氧化钠生成氢氧化亚铁,氢氧化亚铁得不到Fe,故不满足题意;
故答案为:D。
【分析】①硅与氢氧化钠生成硅酸钠,与盐酸反应生成硅酸,受热分解成二氧化硅,与碳共热反应生成硅单质;
②钠与水生成氢氧化钠,通二氧化碳生成碳酸钠,与盐酸反应生成氯化钠,电解成钠;
③氯气与熟石灰生成次氯酸钙,与二氧化碳生成次氯酸,见光分解成氯化氢气体,二氧化锰反应生成氯气;
④铁与氯气生成氯化铁,溶液种与铁单质生成氯化亚铁,与氢氧化钠反应生成氢氧化亚铁;
14.【答案】D
【解析】【解答】A.OH –和NH4+离子之间发生反应生成氨水,在溶液中不能大量共存,故A不符合题意;
B.Ba2+和SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B不符合题意;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C不符合题意;
D.Na+、Cl-、CO32-之间不发生反应,在溶液中可以大量共存,故D符合题意;
故答案为:D。
【分析】能够反应生成沉淀,气体和水,以及弱酸和弱碱的离子在溶液中不能大量共存,据此解答即可。
15.【答案】C
【解析】【解答】A.pH=1的盐酸中含有大量H+,H+与ClO-结合生成弱酸HClO,不能大量共存,A不符合题意;
B. 结合生成络合物,不能大量共存,B不符合题意;
C. 弱碱性溶液中含有OH-较少,各离子之间能大量共存,C符合题意;
D. CO32- 与Al3+能发生双水解反应,不能大量共存,D不符合题意;
故答案为:C。
【分析】判断离子之间是否能大量共存,主要看离子之间是否发生反应。若离子之间反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应等时,离子之间不可大量共存。在遇到此类试题时,注意题干中是否涉及颜色,要熟悉溶液中常见离子的颜色,以及溶液的酸碱性。另注意“H+与NO3-”组合具有强氧化性,能与S2-、Fe2+、I-等发生氧化还原反应。
16.【答案】A
【解析】【解答】①硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,硅酸受热分解生成二氧化硅,二氧化硅在高温条件下与碳反应生成硅单质,选项①符合;
②钠与水反应生成氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与盐酸反应生成氯化钠,电解熔融氯化钠得到钠,选项②符合;
③氯气与石灰乳反应生成次氯酸钙,次氯酸钙与二氧化碳和水反应生成次氯酸,次氯酸见光分解生成盐酸,浓盐酸与二氧化锰加热条件下反应制备氯气,选项③符合;
④铁与氯气反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不能一步转化为铁,选项④不符合,
综上所述,①②③符合题意,A项符合题意
故答案为:A。
【分析】①Si+2NaOH+H2O=Na2SiO3+2H2↑,Na2SiO3+2HCl= H2SiO3+2NaCl,H2SiO3SiO2+H2O;
②2Na+2H2O=2NaOH+H2↑,2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=CO2↑+H2O+2NaCl;
③2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,Ca(ClO)2+CO2+H2O=2HClO+CaCO3,2HClO2HCl+O2↑;
④氢氧化亚铁不能一步转化为铁。
17.【答案】A
【解析】【解答】A. Na+、Al3+、NO、Cl-,各离子均为无色,且均能与H+大量共存,A符合题意;
B. 含有Fe3+的溶液呈黄色,B不合题意;
C. Ba2+与SO将生成硫酸钡沉淀而不能大量共存,C不合题意;
D. ClO-与H+将转化为HClO,二者不能大量共存,D不合题意;
故答案为:A。
【分析】思路分析:判断离子共存方法,1.看溶液中离子之间因发生复分解反应生成沉淀、气体和弱电解质而不能共存;2看离子之间因发生氧化还原反应而不能共存,3.注意题目隐含条件,颜色、pH.
18.【答案】A
【解析】【解答】A.具有强氧化性,可用作消毒剂,故A符合题意;
B.硬铝合金具有密度小、强度高的优良特性,因此可用作航空材料,故B不符合题意;
C.溶液呈碱性,可促进油脂水解生成溶水物质,常用于去除油污,故C不符合题意;
D.具有漂白性,可用于漂白纸浆、草帽等,故D不符合题意;
故答案为:A。
【分析】依据物质的性质判断应用,A.具有强氧化性。
19.【答案】C
【解析】【解答】A. 生石灰具有吸水性,可作干燥剂,不能作还原性,A不符合题意;
B. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是硅酸盐,B不符合题意;
C.小苏打是强碱弱酸盐,水解使溶液显碱性;硫酸铝是强酸弱碱盐,水解使溶液显酸性,当二者在溶液中混合时,发生双水解反应,相互促进,产生大量CO2气体和Al(OH)3固体,从而可以起到灭火作用,故用在泡沫灭火器中灭火,C符合题意;
D. 二氧化硫具有强的还原性,可用作葡萄酒的抗氧化剂,D不符合题意;
故答案为:C
【分析】A.生石灰具有吸水性,不与空气中的氧气反应;
B.瓷器的主要成分是硅酸盐;
C.泡沫灭火器的主要原料为NaHCO3和Al2(SO4)3;
D.少量SO2可做抗氧化剂;
20.【答案】B
【解析】【解答】A.H2SO4能与氯化钡反应生成BaSO4,由于盐酸的酸性比碳酸强,所以二氧化碳不与氯化钡反应,所以没有BaCO3生成,A不符合题意;
B.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,B符合题意;
C.根据选项B分析可知洗气瓶中产生的沉淀是硫酸钡,C不符合题意;
D.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,CO2、NO气体不能发生反应,以气体形式逸出,故在Z导管逸出的气体中含有CO2,D不符合题意;
故答案为:B。
【分析】根据题干信息可知,X是CO2与SO2的混合气体,Y是NO2。将X、Y同时通入洗气瓶中,发生反应SO2+H2O+NO2=H2SO4+NO,H2SO4与BaCl2溶液反应产生BaSO4沉淀,CO2不参与反应,所以Z导管逸出的气体中含有CO2和NO。
21.【答案】(1)分液漏斗;防止空气中的水和CO2进入玻璃管C
(2)只有Na2SO4;SO2+Na2O2=Na2SO4;Na2SO3和Na2SO4至少有一种;既有Na2SO3又有Na2SO4
【解析】【解答】(1)根据仪器的结构可知,装置A中盛装H2SO4溶液的仪器名称是分液漏斗;空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰,碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;(2)根据题给假设1、假设3可知假设2应该为:只有Na2SO4;①若假设2成立,二氧化硫和过氧化钠反应生成硫酸钠,反应的化学方程式为:Na2O2+SO2=Na2SO4;②乙同学为证明假设3成立,设计如下实验:实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
滴加过量的1mol L-1BaCl2溶液,若产生白色沉淀,由于硫酸钡和亚硫酸钡均为不溶于水的白色固体,则证明C中固体产物中Na2SO3和Na2SO4至少有一种;
滴加适量的1mol L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,溶解的为亚硫酸钡,不溶的为硫酸钡,则证明C中固体产物中既有Na2SO3又有Na2SO4。
【分析】本试验的目的为探究过氧化钠与二氧化硫反应,但过氧化钠与水和二氧化碳都反应,所以这两种物质对本实验产生干扰,所以要防止这两种物质进入C中。所以B的作用为干燥二氧化硫,D的作用防止空气中的水和二氧化碳进入C中。
22.【答案】(1)除去原料气中残存的氧气;除去生成的水蒸气
(2)温度;防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触
(3)硝酸
(4)用pH试纸测得最后一次洗涤的滤出液呈中性
(5)9Si+4NaN33Si3N4 +4Na↑
【解析】【解答】(1) Cu能与O2反应,除去原料气中的氧气,高温下H2与O2反应生成水,硅胶有吸水性,可除去生成的水蒸气;
(2)氮化炉中3SiO2(s)+2N2(g)=Si3N4(s),是放热反应, 控制温度,温度过高,会导致硅熔化熔合成团,阻碍与N2接触;
(3)为除去混有的Cu,可选择硝酸,Cu与硝酸能够反应,氮化硅与硝酸不反应;
(4)可以用pH试纸测得最后一次洗涤的滤出液的酸碱性;
(5)硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧反应生成氮化硅,和Na,化学方程式为 9Si+4NaN33Si3N4 +4Na↑ ;
【分析】(1) Cu能与O2反应,高温下H2与O2反应生成水,硅胶有吸水性;
(2)放热反应,反应需控制温度;
(3)Cu与硝酸能够反应,氮化硅与硝酸不反应;
(4)可以使用pH试纸测酸碱性;
(5)硅和NaN3直接燃烧反应生成氮化硅,和Na。
23.【答案】(1)Cl2+2OH-=Cl-+ClO-+H2O
(2)Na2CO3、HCl;NaHCO3、HCl
(3)Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O
(4)碳与浓硫酸
【解析】【解答】(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,则该反应可能是氯气与NaOH反应,产生NaCl、NaClO和水,该反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
(2)若C为氯化钠,D为能使澄清石灰水变浑浊的无色无味气体,该气体是CO2,A与B的组合是盐酸与NaHCO3或盐酸与Na2CO3,(3)若A为紫红色金属,D为红棕色气体,则A是Cu单质,B是浓硝酸,C是Cu(NO3)2,D是NO2,符合上式的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4) 若C、D均为气体且都能使澄清石灰水变浑浊,则A是C单质,B是浓硫酸,C与D分别是CO2、SO2中的一种。
【分析】(1)氯气的歧化反应;
(2)NaHCO3和Na2CO3均可以和盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑; NaHCO3+HCl=NaCl+CO2↑+H2O;
(3)Cu和浓硝酸发生氧化还原反应;
(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O 。
24.【答案】(1)①、②
(2);氧化和还原
(3)
(4)
【解析】【解答】(1)①、②、③中,属于氮的固定的是①和②属于非生物固氮,故答案为①、②。
(2)①N2和O2生成NO,化学方程式为;故答案为。
②NO2转化为HNO3,反应方程式为,N元素化合价从+4价变为+2价和+5价;即表现出氧化性也表现出还原性;故答案为氧化和还原。
(3)N2也可以转化为NH3,工业合成氨的化学方程式为;
(4)稀硝酸为原料,制备KNO3;可用稀硝酸与强氧化钾反应;化学方程式为;故答案为。
【分析】(1)氮的固定指的是将氮元素由单质转化为化合物;
(2) ① 氮气和氧气在放点后置高温下生成一氧化氮;
② 二氧化氮中氮元素化合价有升有将,既体现为氧化性,又体现为还原性;
(3)氮气和氢气在高温高压催化剂的条件下生成氨气;
(4)硝酸和氢氧化钾反应生成硝酸钾和水。
25.【答案】(1)Al2O3+6H+=2Al3++3H2O
(2)将Fe2+氧化成Fe3+,有利于其水解除去铁元素;取少量待测液于试管中,滴加KSCN溶液,若溶液出现血红色,则证明有Fe3+
(3)SiO2;SiO2+4HF=SiF4↑+2H2O
(4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-)
【解析】【解答】(1)酸浸过程中金属氧化物都和稀盐酸反应生成氯化物,主要离子反应方程式为 ,
故答案为: ;(2)铁离子易水解生成沉淀且需要的pH较小,将Fe2+氧化成Fe3+,有利于其水解除去铁元素;铁离子用KSCN溶液检验,其检验方法是:取少量母液Ⅰ,滴加KSCN溶液,无血红色,则Fe3+已水解完全,
故答案为:将Fe2+氧化成Fe3+,有利于其水解除去铁元素;取少量待测液于试管中,滴加KSCN溶液,若溶液出现血红色,则证明有Fe3+;(3)通过以上分析知,滤渣I的成分为SiO2,SiO2只能和HF发生反应 故答案为:SiO2; ;(4)通过以上分析知,转化时发生的离子反应方程式为 (或 ),故答案为: (或 )。
【分析】煤矸石溶于稀盐酸发生的反应有 、 、 ,然后过滤,得到的滤渣I为SiO2,向滤液中通入氯气,发生的反应为 ,向溶液中加入碳酸钠,发生的反应为 、 、 、 ,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为CaCO3、Mg(OH)2和Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为 (或 ),然后过滤得到Al(OH)3,滤液II中含有NaHCO3或碳酸钠,据此分析解答。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
