第四章 化学反应与电能 测试题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 测试题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-11 23:29:22 | ||
图片预览


文档简介
第四章 化学反应与电能 测试题
一、单选题
1.使用石墨电极电解溶液,阴极产物为
A. B.Cu C. D.
2.化学课外活动小组设计的用化学电源使LED灯发光的装置示意图如图。下列有关该装置的说法正确的是( )
A.如果将锌片换成铁片,那么电路中的电流方向将改变锌片铜片
B.该装置工作时,电解质溶液中阴离子移向锌片
C.铜片为负极,其附近的溶液变蓝
D.如果将稀硫酸换成柠檬汁,那么LED灯一定不会发光
3.下列说法错误的是( )
A.铜丝缠在石墨棒上插入稀硝酸,可加快NO生成速率
B.双液电池中,可用浸有CCl4的滤纸作盐桥
C.K2FeO4可用作碱性Zn-K2FeO4电池的正极材料
D.生铁发生吸氧腐蚀时的腐蚀速率与O2的浓度有关
4.氯碱工业是以电解食盐水为基础的工业,电解食盐水同时得到两种气体(一种是密度最小的气体,一种是黄绿色气体)和一种强碱。下列有关说法错误的是( )
A.电解食盐水得到的两种气体分别是H2和Cl2
B.实际生产中采用电解饱和食盐水,可以减少产品的损失
C.氯碱工业的产品之一为烧碱
D.工业常用光照H2和Cl2混合气体的方法制备HCl
5.下列设备工作时,将化学能转化为电能的是( )
A.风力发电机 B.锂离子电池
C.燃气灶 D.硅太阳能电池
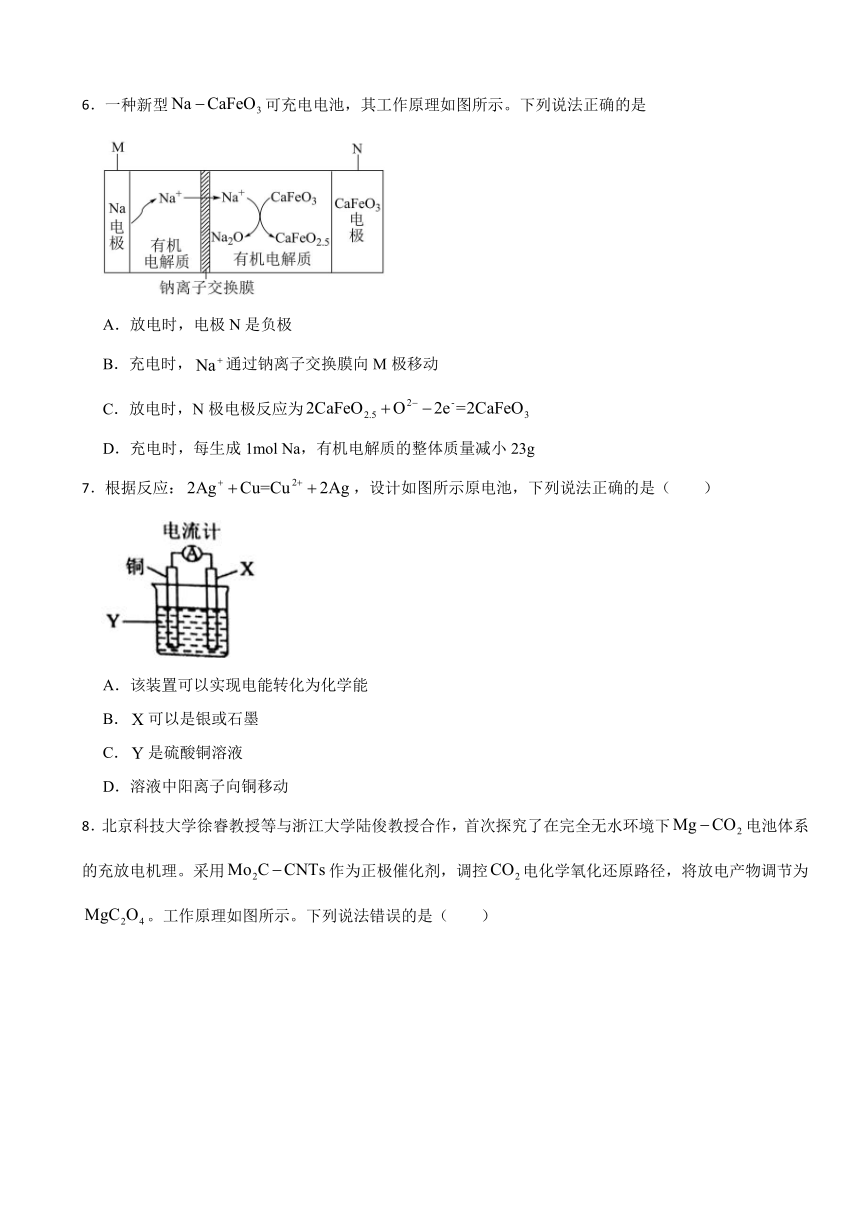
6.一种新型可充电电池,其工作原理如图所示。下列说法正确的是
A.放电时,电极N是负极
B.充电时,通过钠离子交换膜向M极移动
C.放电时,N极电极反应为
D.充电时,每生成1mol Na,有机电解质的整体质量减小23g
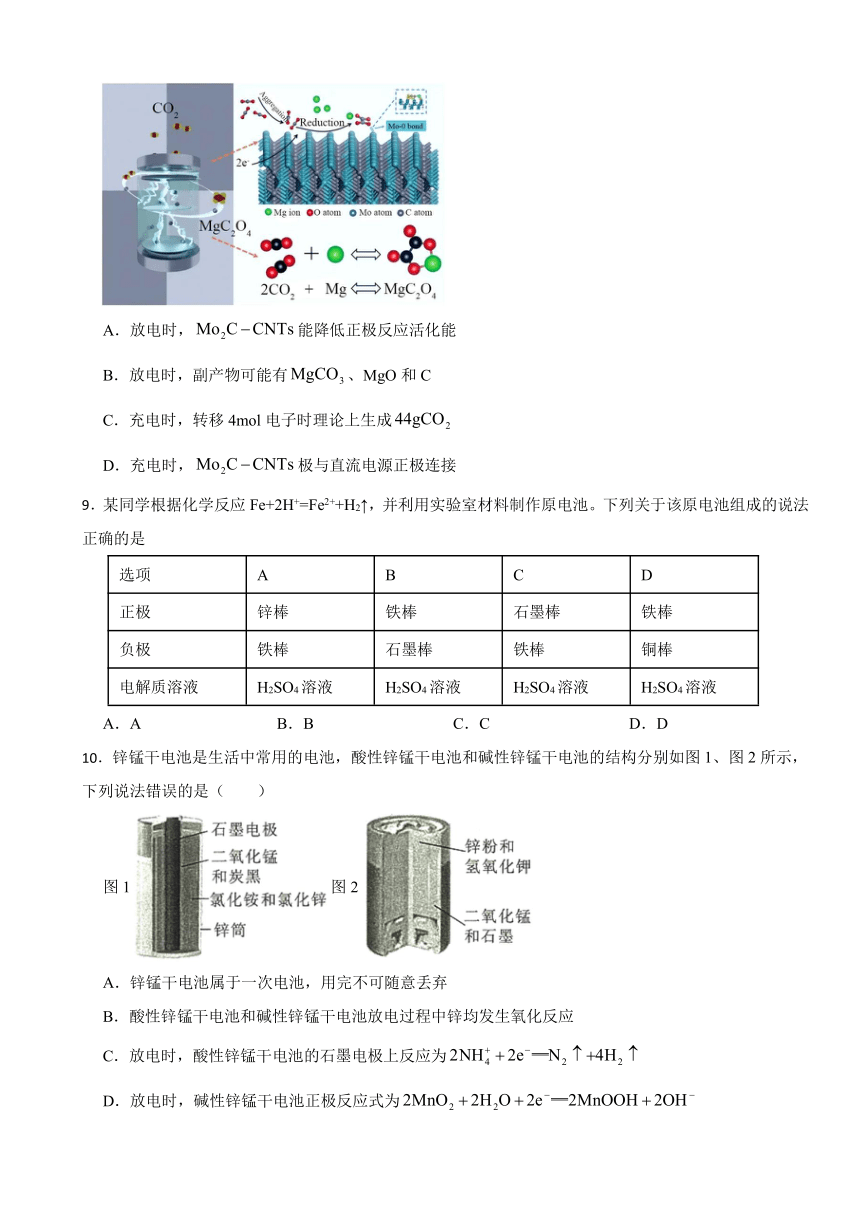
7.根据反应:,设计如图所示原电池,下列说法正确的是( )
A.该装置可以实现电能转化为化学能
B.可以是银或石墨
C.是硫酸铜溶液
D.溶液中阳离子向铜移动
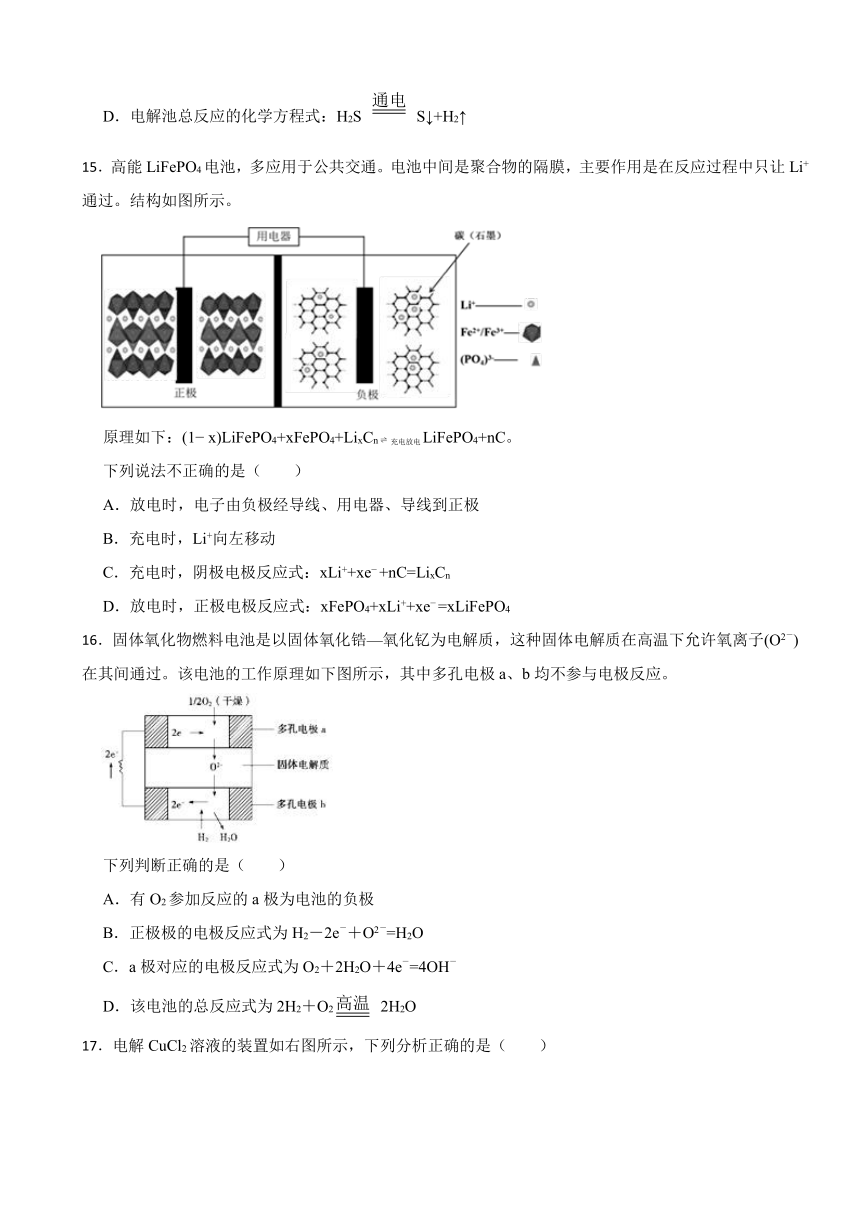
8.北京科技大学徐睿教授等与浙江大学陆俊教授合作,首次探究了在完全无水环境下电池体系的充放电机理。采用作为正极催化剂,调控电化学氧化还原路径,将放电产物调节为。工作原理如图所示。下列说法错误的是( )
A.放电时,能降低正极反应活化能
B.放电时,副产物可能有、MgO和C
C.充电时,转移4mol电子时理论上生成
D.充电时,极与直流电源正极连接
9.某同学根据化学反应Fe+2H+=Fe2++H2↑,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 锌棒 铁棒 石墨棒 铁棒
负极 铁棒 石墨棒 铁棒 铜棒
电解质溶液 H2SO4溶液 H2SO4溶液 H2SO4溶液 H2SO4溶液
A.A B.B C.C D.D
10.锌锰干电池是生活中常用的电池,酸性锌锰干电池和碱性锌锰干电池的结构分别如图1、图2所示,下列说法错误的是( )
图1图2
A.锌锰干电池属于一次电池,用完不可随意丢弃
B.酸性锌锰干电池和碱性锌锰干电池放电过程中锌均发生氧化反应
C.放电时,酸性锌锰干电池的石墨电极上反应为
D.放电时,碱性锌锰干电池正极反应式为
11.下列方程式不能合理解释实验现象或事实的是
A.湿润的淀粉KI试纸遇变蓝:
B.电解溶液制取镁单质:
C.钢铁发生吸氧腐蚀,正极反应:
D.用除去输水管道中的:
12.酒驾是交通事故的第一大“杀手”。 一种酒精检测仪工作原理如图,a、b两个多孔铂电极外均覆盖了一层聚四氟乙烯纳米纤维膜,方便气体透过。下列说法错误的是( )
A.采用多孔铂电极可增大电极与气体接触面积
B.该酒精检测仪运用了原电池原理
C.a极的电极反应:CH3CH2OH+12OH--12e-=2CO2+9H2O
D.乙醇浓度越大,电路中的电流强度就越大
13.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO)
14.利用如图所示装置可处理含H2S的废气。下列说法正确的是( )
A.电解池中惰性电极C1为阴极
B.FeCl3溶液在反应过程中可循环利用
C.反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓
D.电解池总反应的化学方程式:H2S S↓+H2↑
15.高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
原理如下:(1 x)LiFePO4+xFePO4+LixCn 充电放电LiFePO4+nC。
下列说法不正确的是( )
A.放电时,电子由负极经导线、用电器、导线到正极
B.充电时,Li+向左移动
C.充电时,阴极电极反应式:xLi++xe +nC=LixCn
D.放电时,正极电极反应式:xFePO4+xLi++xe =xLiFePO4
16.固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是( )
A.有O2参加反应的a极为电池的负极
B.正极极的电极反应式为H2-2e-+O2-=H2O
C.a极对应的电极反应式为O2+2H2O+4e-=4OH-
D.该电池的总反应式为2H2+O2 2H2O
17.电解CuCl2溶液的装置如右图所示,下列分析正确的是( )
A.b电极的质量不变 B.a电极是该装置的负极
C.a电极上发生氧化反应 D.电子由b电极经溶液流向a电极
18.用石墨作电极电解下列溶液一段时间后,溶液的pH均增大,再加入一定量括号内的物质,都能使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3) B.NaOH (H2O)
C.KCl (KCl) D.CuSO4(CuSO4)
19.燃料电池近几年发展迅速,如图是科学家利用页岩气设计的一种固态(熔盐)燃料电池工作示意图。下列说法错误的是( )
A.电极材料采用石墨烯,吸附甲烷的电极为负极,发生氧化反应
B.通入氧气的电极上电极反应式为
C.电池工作时,向通甲烷的电极一侧移动
D.该电池的优点是二氧化碳可循环利用,不会释放温室气体
20.pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)来确定待测溶液的pH。pH与电池的电动势E存在关系:pH= (E的单位为V,K为常数)。
下列说法错误的是
A.pH计工作时,化学能转化为电能
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化
C.若测得pH=3的标准溶液电池电动势E为0.377V ,可标定常数K=0.2
D.若玻璃电极电势比参比电极电势低,则玻璃电极反应为AgCl(s)+e-=Ag(s)+Cl-
二、综合题
21.LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为 mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H= 。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是 (填字母)。
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 。
22.如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答下列问题:
(1)A极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的质量之比为 。
(3)现用丙装置给铜件镀银,则G应是 (填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(此时乙溶液体积为100mL),丙中镀件上析出银的质量为 .
23.水环境中存在过量的氨氮会造成溶解氧浓度降低、水体富营养化等多方面的危害,人们正不断寻求处理氨氮废水的高效措施。回答下列问题:
(1)某研究团队设计了一种处理方法,先利用水中的微生物将 氧化成 ,再利用电化学降解法除去水中的 。
①微生物经两步反应将 氧化成 ,两步反应的能量变化如图所示:
第一步反应是 (填“放热”或“吸热”)反应,1mol (aq)全部氧化成 (aq)的热化学方程式为 。
②如图为利用电化学降解法除去水中 的装置。
直流电源的正极为 (填“A”或“B”),质子的移动方向是 (填“从M到N”或“从N到M”),阴极的电极反应式为 。
(2)有研究团队设计了一种利用电解原理制备H2O2,并用产生的H2O2处理氨氮废水的装置,如图所示:
①生成H2O2的电极反应式为 。
②已知氨氮废水中氨(以NH3计)的浓度为1750mg L 1,当降为50mg L-1)时即可达到排放标准。电路中转移3mole-,最多可处理废水的体积为 L。
24. 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
已知:① 是一种不溶于水易溶于强酸的沉淀;②已知 , 的 。
(1)Ni的原子序数为28,则它在周期表中的位置为 ,写出H2O2的结构式 。
(2)步骤②,向滤液I中加入适量 溶液的目的是除去Cu2+和 ,其中除去Cu2+的离子方程式为 ;加 之前需控制pH不能太低的目的是 。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是 。若在 时,调pH=4除去铁,此时溶液中 。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是___(已知:氧化性Fe2+A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
25.电解精炼铜的阳极泥中含有、、、、、、等,从其中提取、、、的单质的流程如图所示,回答下列问题:
(1)粗铜中含有、两种元素的单质,但在阳极泥中几乎检测不到,原因是 。
(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有,等。
①写出“焙烧”过程中与浓硫酸反应的化学方程式: 。
②将、通入水中即可生成单质硒,该反应的离子方程式为 。
③实验室中将粗硒从溶液中分离出来的操作为 。
(3)用惰性电极电解“浸液”时,溶液中发生的总反应离子方程式为 。
(4)“银电解”时,阳极材料是 。
(5)上述流程中,可以循环利用的物质是 (填写化学式)。
答案解析部分
1.【答案】B
【解析】【解答】使用石墨电极电解溶液,阳极上Cl-发生氧化还原反应生成氯气,电极反应式为,阴极上Cu2+发生还原反应生成Cu,电极反应式为Cu2++2e-=Cu;
故答案为:B。
【分析】阳离子在阴极反应,铜离子比氢离子优先放电,生成铜。
2.【答案】B
【解析】【解答】A、若将锌片换为铁片,由于金属活动性Fe>Cu,因此铁片做负极,铜片做正极,电流方向为:铜片→铁片,A不符合题意。
B、在原电池中,阴离子移向负极,因此该装置工作时,电解质溶液中的阴离子移向锌片,B符合题意。
C、H+在铜片上发生得电子的还原反应,C不符合题意。
D、柠檬汁为电解质溶液,存在可自由移动的离子,同时柠檬汁显酸性,因此可构成原电池装置,LED灯会发光,D不符合题意。
故答案为:B
【分析】在该原电池装置中,电池总反应式为Zn+2H+=Zn2++H2↑。因此锌片为负极,发生失电子的氧化反应,其电极反应式为:Zn-2e-=Zn2+。铜片为正极,稀硫酸中的H+在正极发生得电子的还原反应,其电极反应式为2H++2e-=H2↑。
3.【答案】B
【解析】【解答】A.铜丝和石墨棒在硝酸溶液中可构成原电池,从而加快反应速率,提高NO的生成速率,A项不符合题意;
B.CCl4属于非电解质,不能导电,因此不能用其制作盐桥,B项符合题意;
C.K2FeO4中的Fe为+6价,具有很强的氧化性,因此可以用作正极材料,与Zn制作的负极构成电池,C项不符合题意;
D.O2浓度越大,那么发生吸氧腐蚀时腐蚀速率也就越大,这体现了浓度对于反应速率的影响,D项不符合题意;
故答案为:B。
【分析】B、盐桥的的前提是电解质溶液。
4.【答案】D
【解析】【解答】A.电解食盐水同时得到两种气体,一种是密度最小的气体是氢气,一种是黄绿色气体为氯气,和一种强碱应该是氢氧化钠,即电解食盐水得到的两种气体分别是H2和Cl2,A不符合题意;
B.饱和食盐水可以降低氯气的溶解度,因此实际生产中采用电解饱和食盐水,可以减少产品的损失,B不符合题意;
C.根据原子守恒可知氯碱工业的产品之一为烧碱,C不符合题意;
D.光照H2和Cl2混合气体容易发生爆炸,工业常用点燃H2和Cl2混合气体的方法制备HCl,D符合题意;
故答案为:D。
【分析】A、电解食盐水生成氯气、氢气、氢氧化钠;
B、饱和食盐水可以减少氯气的溶解;
C、氢氧化钠俗称烧碱、火碱、苛性钠;
D、氯气和氢气混合光照容易发生爆炸。
5.【答案】B
【解析】【解答】A、风力发电机是将风能转化成电能,故A不符合题意;
B、锂离子电池放电时,化学能转化为电能,故B符合题意;
C、燃气灶是将化学能转化为热能,故C不符合题意;
D、硅太阳能电池将太阳能转化为电能,故D不符合题意;
故答案为:B。
【分析】原电池是一种将化学能转化为电能的装置,据此解答。
6.【答案】B
【解析】【解答】A.根据上述分析可知,放电时,电极M为负极,A不符合题意;
B.充电为放电的逆过程,所以充电时,通过钠离子交换膜向阴极(M极)移动,B符合题意;
C.放电时,N极转化为,发生还原反应,其电极反应为,C不符合题意;
D.充电时,每生成1mol Na,同时也会有0.5molO2-消耗,所以有机电解质的整体质量减小23g+=31g,D不符合题意;
故答案为:B。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
7.【答案】B
【解析】【解答】A.由题意可知该装置为原电池装置,故该装置可以实现化学能转化为电能,A不符合题意;
B.总反应为,Cu化合价升高,为原电池负极,则X为正极,X电极不参与电池反应,可以是没有Cu活泼的Ag或者石墨,B符合题意;
C.由总反应可知正极为银离子得电子,溶液应该含银离子,不能是硫酸铜溶液,C不符合题意;
D.Cu为负极,X电极为正极,原电池中阳离子向正极移动,因此阳离子向X电极移动,D不符合题意;
故答案为:B。
【分析】根据总反应可知,Cu失去电子发生氧化反应生成Cu2+,则铜为负极,正极为活泼性比铜差的金属银或者石墨,电解质溶液为含有银离子的溶液,原电池是将化学能转化为电能的装置,原电池中阳离子向正极移动。
8.【答案】C
【解析】【解答】A.作正极催化剂,降低了正极反应的活化能,提高反应速率,A项不符合题意;
B.放电时,正极发生还原反应,得到电子,化合价降价可能生成C、CO、等,也可能发生反应,B项不符合题意;
C.充电时,阳极反应为,或,转移4mol电子时理论上生成,质量是176g,C项符合题意;
D.充电时,正极变为阳极,与电源正极连接,即充电时,极与直流电源正极连接,D项不符合题意。
故答案为:C。
【分析】A.催化剂降低了反应的活化能,反应速率加快;
B.放电时,正极得到电子,发生还原反应;
C.依据得失电子守恒;
D.充电时,与电源正极相连的电极是阳极,与电源负极相连的电极是阴极。
9.【答案】C
【解析】【解答】 A.由于金属活动性:Zn>Fe,Zn为负极,Fe为正极,A不符合题意;
B.由于电极活动性:Fe>石墨,则Fe为负极,石墨为正极,B不符合题意;
C.由于电极活动性:Fe>石墨,则Fe为负极,石墨为正极,H2SO4为电解质溶液,能够发生原电池反应Fe+2H+=Fe2++H2↑,C符合题意;
D.由于电极活动性:Fe>Cu,则Fe为负极,Cu为正极,D不符合题意;
故答案为:C。
【分析】 若将反应Fe+2H+=Fe2++H2↑设计为原电池,则Fe为负极,活动性比Fe弱的电极为正极,电解质溶液为硫酸,结合原电池反应中,活动性强的为负极,活动性弱的为正极,据此分析解答。
10.【答案】C
【解析】【解答】A. 锌锰干电池属于一次电池,用完不可随意丢弃 ,易污染水资源,故A不符合题意;
B. 酸性锌锰干电池和碱性锌锰干电池放电过程中锌做负极,均发生氧化反应,故B不符合题意;
C. 放电时,酸性锌锰干电池的石墨电极上反应为,故C符合题意;
D. 放电时,碱性锌锰干电池正极反应式为 ,故D不符合题意;
故答案为:C
【分析】 锌锰干电池属于一次电池,不能重复使用,不能随意丢弃,防止污染水资源,酸性和碱性条件下锌锰干电池,锌做负极,均发生氧化反应,放电时,酸性锌锰干电池石墨电极上是二氧化锰得到电子变为三氧化二锰,碱性锌锰电池是二氧化锰变为MnOOH,结合选项判断即可。
11.【答案】B
【解析】【解答】A.湿润的淀粉KI试纸遇变蓝,氯气将碘离子氧化为单质碘即,能合理解释实验现象,故A不符合题意;
B.是电解熔融制取镁单质,而不是电解氯化镁溶液,不能合理解释实验现象,故B符合题意;
C.钢铁发生吸氧腐蚀,正极氧气得到电子变为氢氧根,电极反应式为:,能合理解释实验现象,故C不符合题意;
D.用除去输水管道中的,利用亚硫酸钠的还原性:,能合理解释实验现象,故D不符合题意。
故答案为:B。
【分析】依据元素及其化合物的性质分析,B项中Mg是活泼金属,电解熔融制取镁单质。
12.【答案】C
【解析】【解答】A. 采用多孔铂电极可增大电极与气体接触面积,使反应更充分,故A不符合题意;
B.
该酒精检测仪运用了原电池原理,乙醇在负极失电子被氧化,氧气在正极得电子被还原,故B不符合题意;
C. O2通入右侧Pt电极,则右侧Pt电极为正极,左侧Pt电极为负极,该电池的负极反应式为CH3CH2OH+3H2O-12e-═CO2↑+12H+,故C符合题意;
D.
乙醇浓度越大,电路中的电流强度就越大,读出的数值越大,故D不符合题意;
故答案为:C。
【分析】该装置中生成物为二氧化碳,则电解质溶液为酸性,酸性条件下,乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应;根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式来判断。
13.【答案】C
【解析】【解答】正极反应:2H++2e-=H2,负极反应Zn-2e-=Zn2+。
A.铜棒的质量不随着电子的转移发生变化,故A不符合题意;
B.随着电子的转移, c(Zn2+) 增大,故B不符合题意;
C.随着电子的转移, c(H+) 减小,故C符合题意;
D. c(SO) 随着电子的转移发生变化,故D不符合题意;
故答案为:C
【分析】铜锌原电池正极反应:2H++2e-=H2,负极反应Zn-2e-=Zn2+。工作时,Zn2+不断进入溶液,H+不断转化为H2,铜棒质量和 c(SO) 不发生变化,
14.【答案】B
【解析】【解答】A.根据图示可知C1电极产生Fe3+,应该是发生氧化反应,所以C1电极为阳极,A不符合题意;
B.电解池中生成FeCl3可作为反应池中的反应物,则FeCl3溶液在反应过程中可循环利用,B符合题意;
C.反应池中反应物H2S是气体,反应的离子方程式:2Fe3++H2S=2Fe2++S↓+2H+,C不符合题意;
D.电解池中Fe2+失去电子,被氧化,H+获得电子被还原,所以电解池中总反应的化学方程式:2FeCl2+2HCl 2FeCl3+H2↑,D不符合题意;
故答案为:B。
【分析】 H2S 通入FeCl3溶液中,二者之间发生氧化还原反应得到单质硫以及氯化亚铁、盐酸的混合溶液,对混合液进行电解,由装置图可知,C1电极发生二价铁失电子生成三价铁离子,则C1电极为阳极,C2电极为阴极,氢离子得电子发生还原反应,根据电解池的工作原理进行回答即可。
15.【答案】B
【解析】【解答】A.放电过程中,电子由负极经导线、用电器、导线,流向正极,选项正确,A不符合题意;
B.充电时为电解池,在电解池中,阳离子移向阴极,因此Li+向右侧移动,选项错误,B符合题意;
C.由分析可知,充电时阴极的电极反应式为:xLi++nC+xe-=LixCn,选项正确,C不符合题意;
D.由分析可知,放电时正极的电极反应式为:xFePO4+xLi++xe-=xLiFePO4,选项正确,D不符合题意;
故答案为:B
【分析】可充电电池,其放电过程为原电池,充电过程为电解池;由电池总反应可知,放电过程的负极反应式为:LixCn-xe-=xLi++nC,正极的电极反应式为:xFePO4+xLi++xe-=xLiFePO4;
充电过程,阳极的电极反应式为:xLiFePO4-xe-=xFePO4+xLi+,阴极的电极反应式为:xLi++nC+xe-=LixCn;据此结合选项进行分析。
16.【答案】D
【解析】【解答】因为电子从b电极流向a电极,所以b电极为负极,H2在该极发生氧化反应;a电极为正极,O2在该极发生还原反应。由此推断该原电池的负极反应式为H2-2e-+O2-=H2O,正极电极反应式为 O2+2e-=O2-,则电池总反应式为2H2+O2 2H2O。
故答案为:D
【分析】氢氧燃料电池中,氢气作为负极反应物,其电极反应式为:2H2-4e-+2O2-=2H2O;氧气作为正极反应物,其电极反应式为:O2+4e-=2O2-,据此结合选项进行分析。
17.【答案】C
【解析】【解答】A.b为阴极,电极反应为 ,所以b电极质量增加,A不符合题意;
B.a连接电源的正极,为电解池的阳极,B不符合题意;
C.a为阳极,发生氧化反应,C符合题意;
D.电子不能经过溶液进行转移,D不符合题意;
故答案为:C。
【分析】根据电解CuCl2溶液的装置可知,a连接电源的正极,为电解池的阳极发生氧化反应,b为阴极,发生还原反应;
18.【答案】B
【解析】【解答】A.电解AgNO3溶液,银离子和OH-放电,应加入氧化银恢复原样,故A不符合题意;
B.电解NaOH溶液,氢离子和OH-放电,则加入水能恢复原样,故B符合题意;
C.电解KCl溶液,氢离子和氯离子放电,则应加入HCl恢复原样,故C不符合题意;
D.电解CuSO4溶液,铜离子和OH-放电,则一段时间内应加入氧化铜能恢复原样,故D不符合题意;
故答案为:B。
【分析】A.电解AgNO3是放氧生酸型;
B.电解NaOH是电解水型;
C.电解KCl是放氢生碱型;
D.电解CuSO4是放氧生酸型;
19.【答案】D
【解析】【解答】A.甲烷发生氧化反应生成二氧化碳,作负极,A不符合题意;
B.电极反应式为 ,B不符合题意;
C.原电池中阴离子向负极移动,C不符合题意;
D.会释放出二氧化碳,是温室气体,D符合题意;
故答案为:D
【分析】A.发生氧化反应作负极;
B.电极反应式的书写;
C.原电池中阴离子向负极移动;
D.二氧化碳是温室气体。
20.【答案】D
【解析】【解答】A.pH计的工作原理是通过测定电池电动势E(即玻璃电极和参比电极的电势差)来确定待测溶液的pH,则pH计工作时,化学能转化为电能,A不符合题意;
B.根据pH计的工作原理可知,玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化从而使得其能确定溶液的pH,B不符合题意;
C.pH=,若测得pH=3的标准溶液电池电动势E为0.377V ,则3=,解得K=0.2,C不符合题意;
D.若玻璃电极电势比参比电极电势低,则玻璃电极为负极,失去电子发生氧化反应,反应为Ag(s)- e-+Cl-=AgCl(s),D符合题意;
故答案为:D。
【分析】A.原电池将化学能转化为电能;
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化从而测定溶液的pH;
C.根据pH=计算。
21.【答案】(1)2
(2)-93 kJ·mol-1
(3)ab;LiBH4;2Al+6H2O=2Al(OH)3+3H2↑
(4)增大;BH4--8e-+8OH-=BO2-+6H2O
【解析】【解答】(1)LiBH4中氢元素化合价为-1价,生成1mol氢气转移电子2mol;
(2)能量由上到下分别为1、2、3、4,则该反应的焓变为-(1+3-2-4)= -93 kJ·mol-1;
(3)①a、图中当全为铝时气体为0,故纯铝与水不反应,故正确;
b、f线代表纯LiBH4与水反应产生氢气,故正确;
c、当材料含LiBH4为25%时(d线),产生氢气的量最多,故不正确;
故答案为:ab;
②由图得出反应后已没有LiBH4,但存在大量铝,故其完全反应,与水完全反应的物质是LiBH4;铝部分反应(有氢氧化铝等铝的产物),反应化学方程式为2Al+6H2O=2Al(OH)3+3H2↑;
(4)右室双氧水得到电子为正极,电极反应式为H2O2+2e-=2OH-,故该极碱性增强,负极为BH4--8e-+8OH-=BO2-+6H2O。
【分析】(1) 根据氧化还原反应得失电子的情况,即可计算出电子的物质的量
(2)根据盖斯定律找出关系即可
(3)考查的是看图获取信息的能力
(4)考查的是电解池原理以及电极方程式
22.【答案】(1)正极;变浅;氢氧化铁胶粒带正电
(2)16:64:71:2
(3)镀层金属;1.08
【解析】【解答】(1)结合以上分析可知,A极是电源的正极;电解硫酸铜溶液,阳极生成氧气,极反应式:4OH--4e﹣= O2↑+2H2O,阴极铜离子生成铜,极反应式:Cu2++2e﹣═Cu;铜离子浓度减小,所以甲中溶液颜色变浅;阳离子向阴极移动,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,因此氢氧化铁胶粒带正电,在电场作用下向Y极移动;
(2)甲池中:电解硫酸铜溶液:2CuSO4+2H2O 2Cu+2H2SO4+O2↑;乙池中:电解氯化钠溶液:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;串联电路电子转移电子数相等,因此当转移的电子数相等时,满足4e-~2Cu~O2~2Cl2~2H2关系;甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为n(O2):n(Cu):n(Cl2):n(H2)=1:2:2:2,对应单质的质量之比为1mol×32g/mol:2mol×64g/mol:2×71g/mol:2×2g/mol=16:64:71:2;
(3)电镀时,待镀金属做阴极,镀层金属做阳极,因此现用丙装置给铜件镀银,银做阳极,铜做阴极,丙装置中G为阳极,因此G是镀层金属;乙池中:电解氯化钠溶液:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;当乙中溶液的pH是13时,溶液体积为100 mL,则n(NaOH)=0.1mol/L×0.1L=0.01mol,根据2e-~2NaOH关系可知,转移电子为0.01mol,串联电路转移电子数相等,根据Ag++e-=Ag可知,生成银的量为0.01mol,质量为0.01mol×108g/mol=1.08g。
【分析】将直流电源接通后,电解滴有酚酞的饱和食盐水,F极附近呈红色,产生了氢氧根离子,氢离子转化为氢气,所以F为阴极,电极反应式:2H2O+2e-=H2↑+2OH-;据此分析可知,E、C、G、X为阳极,D、F、H、Y为阴极,因此电源B为负极,A为正极,结合以上分析解答。
23.【答案】(1)放热; (aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;A;从M到N;2 +12H++10e-=N2↑+6H2O
(2)O2+2H++2e-=H2O2;10
【解析】【解答】(1)①根据图像,反应物的总能量大于生成物的总能量,则第一步反应为放热反应;根据图像, H1=-273kJ/mol, H2=-73kJ/mol,则总反应为放热反应, H=-346kJ/mol,热化学方程式为 (aq)+2O2(g)= (aq)+2H+(aq)+H2O(1) ΔH=-346kJ·mol-1;
②根据电解装置,Ag-Pt电极上N原子得电子,生成氮气,则B电极为负极,A为正极;电解质溶液中的质子由阳极向阴极区移动,即从M到N;阴极上硝酸根离子得电子与质子反应生成氮气和水,电极反应式为2 +12H++10e-=N2↑+6H2O;
(2)①根据电解装置,阴极中氧气得电子与溶液中的氢离子反应生成过氧化氢,电极反应式为O2+2H++2e-=H2O2;
②氨氮废水中氨(以NH3计)的浓度为1750mg L 1,当降为50mg L-1)时即可达到排放标准,需要反应1700mg/L,即1.7g/L,也为0.1mol/L。1mol氨转变为氮气时,转移3mol电子,电路中转移3mole-,需反应1mol氨气,需要氨氮废水10L。
【分析】(1)①根据图像,反应物的总能量大于生成物的总能量;②根据电解装置,Ag-Pt电极上N原子得电子,生成氮气,为负极;(2)①阴极中氧气得电子与溶液中的氢离子反应生成过氧化氢;②废液达到排放标准时的浓度变化,计算转移电子数目及体积。
24.【答案】(1)第四周期,第Ⅷ族;H-O-O-H
(2)Cu2++ S2-=CuS↓;避免生成H2S,影响除杂
(3)防止H2O2受热分解;2.64 10-9mol/L
(4)A;E
【解析】【解答】(1)根据元素的排列规律及Ni的原子序数为28,可知Ni的位置为:第四周期第Ⅷ族;H2O2为分子晶体,原子之间均以共价单键相连,故的结构式为:H-O-O-H;
故答案为:第四周期第Ⅷ族;H-O-O-H;(2)S2-与Cu2+和 结合可生成沉淀,所以用 溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
故答案为:Cu2++ S2-=CuS↓ ;避免生成H2S,影响除杂;(3)步骤③除去Fe采用生成 的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡: ,平衡常数 ,已知pH=4,则 ,公式换算可得: ;
故答案为:防止H2O2受热分解; ;(4)用电解法制备高纯度镍,原理同于制备高纯度铜,粗镍做阳极,活泼金属在阳极放电,该处在阳极反应的金属有Fe、Zn, 失去电子生成Fe2+、Zn2+,Cu和Pt作为阳极泥,在电解槽的底部,阴极发生的电极反应式为: ,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
故答案为:AE。
【分析】本题将工艺流程与氧化还原、电解池、沉淀溶解平衡相互结合,第一步操作为溶解金属,第二步为除去Cu2+和 ,第三步除去Fe和Cr,最后得到 ,在各个步骤中结合氧化还原等一些应用。
25.【答案】(1)、的单质均比铜活泼,先于铜失去电子进入电解质溶液中
(2);;过滤
(3)
(4)含金、银、铅的合金(或粗银)
(5)
【解析】【解答】(1)已知Fe、Zn比Cu更活泼的金属,故粗铜中含有、两种元素的单质,但由于二者先于铜失去电子进入电解质溶液中,故在阳极泥中几乎检测不到,故答案为:、的单质均比铜活泼,先于铜失去电子进入电解质溶液中;
(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有,等。
①“焙烧”过程中与浓硫酸反应即Cu与浓硫酸在加热条件下反应生成CuSO4、SO2和H2O,故该反应的化学方程式为:,故答案为:;
②将、通入水中即可生成单质硒,Se的化合价降低被还原为Se单质,故S的化合价升高被氧化为,故该反应的离子方程式为,故答案为:;
③实验室中分离不溶性固体和液体的方法是过滤,故将粗硒从溶液中分离出来的操作为过滤,故答案为:过滤;
(3)用惰性电极电解“浸液”即主要电解硫酸铜溶液时,溶液中发生的总反应离子方程式为 ,故答案为:;
(4)由题干信息可知,“银电解”即进行银的精炼,根据铜的精炼过程可知,用含金、银、铅的合金(或粗银)作阳极材料,用纯银作阴极,故答案为:含金、银、铅的合金(或粗银);
(5) 焙烧需消耗硫酸,而得到粗硒生成硫酸,则硫酸可循环利用,故答案为:H2SO4。
【分析】(1)活泼金属做阳极,活泼金属先放电。
(2)②二氧化硫具有还原性,氧化硒具有氧化性,发生氧化还原反应得到单 硒
(3)电解硫酸铜,铜离子得电子得到单质铜。
(4)对金属精炼时,阳极为含有杂质的精炼金属。
一、单选题
1.使用石墨电极电解溶液,阴极产物为
A. B.Cu C. D.
2.化学课外活动小组设计的用化学电源使LED灯发光的装置示意图如图。下列有关该装置的说法正确的是( )
A.如果将锌片换成铁片,那么电路中的电流方向将改变锌片铜片
B.该装置工作时,电解质溶液中阴离子移向锌片
C.铜片为负极,其附近的溶液变蓝
D.如果将稀硫酸换成柠檬汁,那么LED灯一定不会发光
3.下列说法错误的是( )
A.铜丝缠在石墨棒上插入稀硝酸,可加快NO生成速率
B.双液电池中,可用浸有CCl4的滤纸作盐桥
C.K2FeO4可用作碱性Zn-K2FeO4电池的正极材料
D.生铁发生吸氧腐蚀时的腐蚀速率与O2的浓度有关
4.氯碱工业是以电解食盐水为基础的工业,电解食盐水同时得到两种气体(一种是密度最小的气体,一种是黄绿色气体)和一种强碱。下列有关说法错误的是( )
A.电解食盐水得到的两种气体分别是H2和Cl2
B.实际生产中采用电解饱和食盐水,可以减少产品的损失
C.氯碱工业的产品之一为烧碱
D.工业常用光照H2和Cl2混合气体的方法制备HCl
5.下列设备工作时,将化学能转化为电能的是( )
A.风力发电机 B.锂离子电池
C.燃气灶 D.硅太阳能电池
6.一种新型可充电电池,其工作原理如图所示。下列说法正确的是
A.放电时,电极N是负极
B.充电时,通过钠离子交换膜向M极移动
C.放电时,N极电极反应为
D.充电时,每生成1mol Na,有机电解质的整体质量减小23g
7.根据反应:,设计如图所示原电池,下列说法正确的是( )
A.该装置可以实现电能转化为化学能
B.可以是银或石墨
C.是硫酸铜溶液
D.溶液中阳离子向铜移动
8.北京科技大学徐睿教授等与浙江大学陆俊教授合作,首次探究了在完全无水环境下电池体系的充放电机理。采用作为正极催化剂,调控电化学氧化还原路径,将放电产物调节为。工作原理如图所示。下列说法错误的是( )
A.放电时,能降低正极反应活化能
B.放电时,副产物可能有、MgO和C
C.充电时,转移4mol电子时理论上生成
D.充电时,极与直流电源正极连接
9.某同学根据化学反应Fe+2H+=Fe2++H2↑,并利用实验室材料制作原电池。下列关于该原电池组成的说法正确的是
选项 A B C D
正极 锌棒 铁棒 石墨棒 铁棒
负极 铁棒 石墨棒 铁棒 铜棒
电解质溶液 H2SO4溶液 H2SO4溶液 H2SO4溶液 H2SO4溶液
A.A B.B C.C D.D
10.锌锰干电池是生活中常用的电池,酸性锌锰干电池和碱性锌锰干电池的结构分别如图1、图2所示,下列说法错误的是( )
图1图2
A.锌锰干电池属于一次电池,用完不可随意丢弃
B.酸性锌锰干电池和碱性锌锰干电池放电过程中锌均发生氧化反应
C.放电时,酸性锌锰干电池的石墨电极上反应为
D.放电时,碱性锌锰干电池正极反应式为
11.下列方程式不能合理解释实验现象或事实的是
A.湿润的淀粉KI试纸遇变蓝:
B.电解溶液制取镁单质:
C.钢铁发生吸氧腐蚀,正极反应:
D.用除去输水管道中的:
12.酒驾是交通事故的第一大“杀手”。 一种酒精检测仪工作原理如图,a、b两个多孔铂电极外均覆盖了一层聚四氟乙烯纳米纤维膜,方便气体透过。下列说法错误的是( )
A.采用多孔铂电极可增大电极与气体接触面积
B.该酒精检测仪运用了原电池原理
C.a极的电极反应:CH3CH2OH+12OH--12e-=2CO2+9H2O
D.乙醇浓度越大,电路中的电流强度就越大
13.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO)
14.利用如图所示装置可处理含H2S的废气。下列说法正确的是( )
A.电解池中惰性电极C1为阴极
B.FeCl3溶液在反应过程中可循环利用
C.反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓
D.电解池总反应的化学方程式:H2S S↓+H2↑
15.高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
原理如下:(1 x)LiFePO4+xFePO4+LixCn 充电放电LiFePO4+nC。
下列说法不正确的是( )
A.放电时,电子由负极经导线、用电器、导线到正极
B.充电时,Li+向左移动
C.充电时,阴极电极反应式:xLi++xe +nC=LixCn
D.放电时,正极电极反应式:xFePO4+xLi++xe =xLiFePO4
16.固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是( )
A.有O2参加反应的a极为电池的负极
B.正极极的电极反应式为H2-2e-+O2-=H2O
C.a极对应的电极反应式为O2+2H2O+4e-=4OH-
D.该电池的总反应式为2H2+O2 2H2O
17.电解CuCl2溶液的装置如右图所示,下列分析正确的是( )
A.b电极的质量不变 B.a电极是该装置的负极
C.a电极上发生氧化反应 D.电子由b电极经溶液流向a电极
18.用石墨作电极电解下列溶液一段时间后,溶液的pH均增大,再加入一定量括号内的物质,都能使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3) B.NaOH (H2O)
C.KCl (KCl) D.CuSO4(CuSO4)
19.燃料电池近几年发展迅速,如图是科学家利用页岩气设计的一种固态(熔盐)燃料电池工作示意图。下列说法错误的是( )
A.电极材料采用石墨烯,吸附甲烷的电极为负极,发生氧化反应
B.通入氧气的电极上电极反应式为
C.电池工作时,向通甲烷的电极一侧移动
D.该电池的优点是二氧化碳可循环利用,不会释放温室气体
20.pH计的工作原理(如图所示)是通过测定电池电动势E(即玻璃电极和参比电极的电势差)来确定待测溶液的pH。pH与电池的电动势E存在关系:pH= (E的单位为V,K为常数)。
下列说法错误的是
A.pH计工作时,化学能转化为电能
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化
C.若测得pH=3的标准溶液电池电动势E为0.377V ,可标定常数K=0.2
D.若玻璃电极电势比参比电极电势低,则玻璃电极反应为AgCl(s)+e-=Ag(s)+Cl-
二、综合题
21.LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为 mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H= 。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是 (填字母)。
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 。
22.如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答下列问题:
(1)A极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的质量之比为 。
(3)现用丙装置给铜件镀银,则G应是 (填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(此时乙溶液体积为100mL),丙中镀件上析出银的质量为 .
23.水环境中存在过量的氨氮会造成溶解氧浓度降低、水体富营养化等多方面的危害,人们正不断寻求处理氨氮废水的高效措施。回答下列问题:
(1)某研究团队设计了一种处理方法,先利用水中的微生物将 氧化成 ,再利用电化学降解法除去水中的 。
①微生物经两步反应将 氧化成 ,两步反应的能量变化如图所示:
第一步反应是 (填“放热”或“吸热”)反应,1mol (aq)全部氧化成 (aq)的热化学方程式为 。
②如图为利用电化学降解法除去水中 的装置。
直流电源的正极为 (填“A”或“B”),质子的移动方向是 (填“从M到N”或“从N到M”),阴极的电极反应式为 。
(2)有研究团队设计了一种利用电解原理制备H2O2,并用产生的H2O2处理氨氮废水的装置,如图所示:
①生成H2O2的电极反应式为 。
②已知氨氮废水中氨(以NH3计)的浓度为1750mg L 1,当降为50mg L-1)时即可达到排放标准。电路中转移3mole-,最多可处理废水的体积为 L。
24. 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
已知:① 是一种不溶于水易溶于强酸的沉淀;②已知 , 的 。
(1)Ni的原子序数为28,则它在周期表中的位置为 ,写出H2O2的结构式 。
(2)步骤②,向滤液I中加入适量 溶液的目的是除去Cu2+和 ,其中除去Cu2+的离子方程式为 ;加 之前需控制pH不能太低的目的是 。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是 。若在 时,调pH=4除去铁,此时溶液中 。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是___(已知:氧化性Fe2+
B.阳极发生还原反应,其电极反应式:
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
25.电解精炼铜的阳极泥中含有、、、、、、等,从其中提取、、、的单质的流程如图所示,回答下列问题:
(1)粗铜中含有、两种元素的单质,但在阳极泥中几乎检测不到,原因是 。
(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有,等。
①写出“焙烧”过程中与浓硫酸反应的化学方程式: 。
②将、通入水中即可生成单质硒,该反应的离子方程式为 。
③实验室中将粗硒从溶液中分离出来的操作为 。
(3)用惰性电极电解“浸液”时,溶液中发生的总反应离子方程式为 。
(4)“银电解”时,阳极材料是 。
(5)上述流程中,可以循环利用的物质是 (填写化学式)。
答案解析部分
1.【答案】B
【解析】【解答】使用石墨电极电解溶液,阳极上Cl-发生氧化还原反应生成氯气,电极反应式为,阴极上Cu2+发生还原反应生成Cu,电极反应式为Cu2++2e-=Cu;
故答案为:B。
【分析】阳离子在阴极反应,铜离子比氢离子优先放电,生成铜。
2.【答案】B
【解析】【解答】A、若将锌片换为铁片,由于金属活动性Fe>Cu,因此铁片做负极,铜片做正极,电流方向为:铜片→铁片,A不符合题意。
B、在原电池中,阴离子移向负极,因此该装置工作时,电解质溶液中的阴离子移向锌片,B符合题意。
C、H+在铜片上发生得电子的还原反应,C不符合题意。
D、柠檬汁为电解质溶液,存在可自由移动的离子,同时柠檬汁显酸性,因此可构成原电池装置,LED灯会发光,D不符合题意。
故答案为:B
【分析】在该原电池装置中,电池总反应式为Zn+2H+=Zn2++H2↑。因此锌片为负极,发生失电子的氧化反应,其电极反应式为:Zn-2e-=Zn2+。铜片为正极,稀硫酸中的H+在正极发生得电子的还原反应,其电极反应式为2H++2e-=H2↑。
3.【答案】B
【解析】【解答】A.铜丝和石墨棒在硝酸溶液中可构成原电池,从而加快反应速率,提高NO的生成速率,A项不符合题意;
B.CCl4属于非电解质,不能导电,因此不能用其制作盐桥,B项符合题意;
C.K2FeO4中的Fe为+6价,具有很强的氧化性,因此可以用作正极材料,与Zn制作的负极构成电池,C项不符合题意;
D.O2浓度越大,那么发生吸氧腐蚀时腐蚀速率也就越大,这体现了浓度对于反应速率的影响,D项不符合题意;
故答案为:B。
【分析】B、盐桥的的前提是电解质溶液。
4.【答案】D
【解析】【解答】A.电解食盐水同时得到两种气体,一种是密度最小的气体是氢气,一种是黄绿色气体为氯气,和一种强碱应该是氢氧化钠,即电解食盐水得到的两种气体分别是H2和Cl2,A不符合题意;
B.饱和食盐水可以降低氯气的溶解度,因此实际生产中采用电解饱和食盐水,可以减少产品的损失,B不符合题意;
C.根据原子守恒可知氯碱工业的产品之一为烧碱,C不符合题意;
D.光照H2和Cl2混合气体容易发生爆炸,工业常用点燃H2和Cl2混合气体的方法制备HCl,D符合题意;
故答案为:D。
【分析】A、电解食盐水生成氯气、氢气、氢氧化钠;
B、饱和食盐水可以减少氯气的溶解;
C、氢氧化钠俗称烧碱、火碱、苛性钠;
D、氯气和氢气混合光照容易发生爆炸。
5.【答案】B
【解析】【解答】A、风力发电机是将风能转化成电能,故A不符合题意;
B、锂离子电池放电时,化学能转化为电能,故B符合题意;
C、燃气灶是将化学能转化为热能,故C不符合题意;
D、硅太阳能电池将太阳能转化为电能,故D不符合题意;
故答案为:B。
【分析】原电池是一种将化学能转化为电能的装置,据此解答。
6.【答案】B
【解析】【解答】A.根据上述分析可知,放电时,电极M为负极,A不符合题意;
B.充电为放电的逆过程,所以充电时,通过钠离子交换膜向阴极(M极)移动,B符合题意;
C.放电时,N极转化为,发生还原反应,其电极反应为,C不符合题意;
D.充电时,每生成1mol Na,同时也会有0.5molO2-消耗,所以有机电解质的整体质量减小23g+=31g,D不符合题意;
故答案为:B。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
7.【答案】B
【解析】【解答】A.由题意可知该装置为原电池装置,故该装置可以实现化学能转化为电能,A不符合题意;
B.总反应为,Cu化合价升高,为原电池负极,则X为正极,X电极不参与电池反应,可以是没有Cu活泼的Ag或者石墨,B符合题意;
C.由总反应可知正极为银离子得电子,溶液应该含银离子,不能是硫酸铜溶液,C不符合题意;
D.Cu为负极,X电极为正极,原电池中阳离子向正极移动,因此阳离子向X电极移动,D不符合题意;
故答案为:B。
【分析】根据总反应可知,Cu失去电子发生氧化反应生成Cu2+,则铜为负极,正极为活泼性比铜差的金属银或者石墨,电解质溶液为含有银离子的溶液,原电池是将化学能转化为电能的装置,原电池中阳离子向正极移动。
8.【答案】C
【解析】【解答】A.作正极催化剂,降低了正极反应的活化能,提高反应速率,A项不符合题意;
B.放电时,正极发生还原反应,得到电子,化合价降价可能生成C、CO、等,也可能发生反应,B项不符合题意;
C.充电时,阳极反应为,或,转移4mol电子时理论上生成,质量是176g,C项符合题意;
D.充电时,正极变为阳极,与电源正极连接,即充电时,极与直流电源正极连接,D项不符合题意。
故答案为:C。
【分析】A.催化剂降低了反应的活化能,反应速率加快;
B.放电时,正极得到电子,发生还原反应;
C.依据得失电子守恒;
D.充电时,与电源正极相连的电极是阳极,与电源负极相连的电极是阴极。
9.【答案】C
【解析】【解答】 A.由于金属活动性:Zn>Fe,Zn为负极,Fe为正极,A不符合题意;
B.由于电极活动性:Fe>石墨,则Fe为负极,石墨为正极,B不符合题意;
C.由于电极活动性:Fe>石墨,则Fe为负极,石墨为正极,H2SO4为电解质溶液,能够发生原电池反应Fe+2H+=Fe2++H2↑,C符合题意;
D.由于电极活动性:Fe>Cu,则Fe为负极,Cu为正极,D不符合题意;
故答案为:C。
【分析】 若将反应Fe+2H+=Fe2++H2↑设计为原电池,则Fe为负极,活动性比Fe弱的电极为正极,电解质溶液为硫酸,结合原电池反应中,活动性强的为负极,活动性弱的为正极,据此分析解答。
10.【答案】C
【解析】【解答】A. 锌锰干电池属于一次电池,用完不可随意丢弃 ,易污染水资源,故A不符合题意;
B. 酸性锌锰干电池和碱性锌锰干电池放电过程中锌做负极,均发生氧化反应,故B不符合题意;
C. 放电时,酸性锌锰干电池的石墨电极上反应为,故C符合题意;
D. 放电时,碱性锌锰干电池正极反应式为 ,故D不符合题意;
故答案为:C
【分析】 锌锰干电池属于一次电池,不能重复使用,不能随意丢弃,防止污染水资源,酸性和碱性条件下锌锰干电池,锌做负极,均发生氧化反应,放电时,酸性锌锰干电池石墨电极上是二氧化锰得到电子变为三氧化二锰,碱性锌锰电池是二氧化锰变为MnOOH,结合选项判断即可。
11.【答案】B
【解析】【解答】A.湿润的淀粉KI试纸遇变蓝,氯气将碘离子氧化为单质碘即,能合理解释实验现象,故A不符合题意;
B.是电解熔融制取镁单质,而不是电解氯化镁溶液,不能合理解释实验现象,故B符合题意;
C.钢铁发生吸氧腐蚀,正极氧气得到电子变为氢氧根,电极反应式为:,能合理解释实验现象,故C不符合题意;
D.用除去输水管道中的,利用亚硫酸钠的还原性:,能合理解释实验现象,故D不符合题意。
故答案为:B。
【分析】依据元素及其化合物的性质分析,B项中Mg是活泼金属,电解熔融制取镁单质。
12.【答案】C
【解析】【解答】A. 采用多孔铂电极可增大电极与气体接触面积,使反应更充分,故A不符合题意;
B.
该酒精检测仪运用了原电池原理,乙醇在负极失电子被氧化,氧气在正极得电子被还原,故B不符合题意;
C. O2通入右侧Pt电极,则右侧Pt电极为正极,左侧Pt电极为负极,该电池的负极反应式为CH3CH2OH+3H2O-12e-═CO2↑+12H+,故C符合题意;
D.
乙醇浓度越大,电路中的电流强度就越大,读出的数值越大,故D不符合题意;
故答案为:C。
【分析】该装置中生成物为二氧化碳,则电解质溶液为酸性,酸性条件下,乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应;根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式来判断。
13.【答案】C
【解析】【解答】正极反应:2H++2e-=H2,负极反应Zn-2e-=Zn2+。
A.铜棒的质量不随着电子的转移发生变化,故A不符合题意;
B.随着电子的转移, c(Zn2+) 增大,故B不符合题意;
C.随着电子的转移, c(H+) 减小,故C符合题意;
D. c(SO) 随着电子的转移发生变化,故D不符合题意;
故答案为:C
【分析】铜锌原电池正极反应:2H++2e-=H2,负极反应Zn-2e-=Zn2+。工作时,Zn2+不断进入溶液,H+不断转化为H2,铜棒质量和 c(SO) 不发生变化,
14.【答案】B
【解析】【解答】A.根据图示可知C1电极产生Fe3+,应该是发生氧化反应,所以C1电极为阳极,A不符合题意;
B.电解池中生成FeCl3可作为反应池中的反应物,则FeCl3溶液在反应过程中可循环利用,B符合题意;
C.反应池中反应物H2S是气体,反应的离子方程式:2Fe3++H2S=2Fe2++S↓+2H+,C不符合题意;
D.电解池中Fe2+失去电子,被氧化,H+获得电子被还原,所以电解池中总反应的化学方程式:2FeCl2+2HCl 2FeCl3+H2↑,D不符合题意;
故答案为:B。
【分析】 H2S 通入FeCl3溶液中,二者之间发生氧化还原反应得到单质硫以及氯化亚铁、盐酸的混合溶液,对混合液进行电解,由装置图可知,C1电极发生二价铁失电子生成三价铁离子,则C1电极为阳极,C2电极为阴极,氢离子得电子发生还原反应,根据电解池的工作原理进行回答即可。
15.【答案】B
【解析】【解答】A.放电过程中,电子由负极经导线、用电器、导线,流向正极,选项正确,A不符合题意;
B.充电时为电解池,在电解池中,阳离子移向阴极,因此Li+向右侧移动,选项错误,B符合题意;
C.由分析可知,充电时阴极的电极反应式为:xLi++nC+xe-=LixCn,选项正确,C不符合题意;
D.由分析可知,放电时正极的电极反应式为:xFePO4+xLi++xe-=xLiFePO4,选项正确,D不符合题意;
故答案为:B
【分析】可充电电池,其放电过程为原电池,充电过程为电解池;由电池总反应可知,放电过程的负极反应式为:LixCn-xe-=xLi++nC,正极的电极反应式为:xFePO4+xLi++xe-=xLiFePO4;
充电过程,阳极的电极反应式为:xLiFePO4-xe-=xFePO4+xLi+,阴极的电极反应式为:xLi++nC+xe-=LixCn;据此结合选项进行分析。
16.【答案】D
【解析】【解答】因为电子从b电极流向a电极,所以b电极为负极,H2在该极发生氧化反应;a电极为正极,O2在该极发生还原反应。由此推断该原电池的负极反应式为H2-2e-+O2-=H2O,正极电极反应式为 O2+2e-=O2-,则电池总反应式为2H2+O2 2H2O。
故答案为:D
【分析】氢氧燃料电池中,氢气作为负极反应物,其电极反应式为:2H2-4e-+2O2-=2H2O;氧气作为正极反应物,其电极反应式为:O2+4e-=2O2-,据此结合选项进行分析。
17.【答案】C
【解析】【解答】A.b为阴极,电极反应为 ,所以b电极质量增加,A不符合题意;
B.a连接电源的正极,为电解池的阳极,B不符合题意;
C.a为阳极,发生氧化反应,C符合题意;
D.电子不能经过溶液进行转移,D不符合题意;
故答案为:C。
【分析】根据电解CuCl2溶液的装置可知,a连接电源的正极,为电解池的阳极发生氧化反应,b为阴极,发生还原反应;
18.【答案】B
【解析】【解答】A.电解AgNO3溶液,银离子和OH-放电,应加入氧化银恢复原样,故A不符合题意;
B.电解NaOH溶液,氢离子和OH-放电,则加入水能恢复原样,故B符合题意;
C.电解KCl溶液,氢离子和氯离子放电,则应加入HCl恢复原样,故C不符合题意;
D.电解CuSO4溶液,铜离子和OH-放电,则一段时间内应加入氧化铜能恢复原样,故D不符合题意;
故答案为:B。
【分析】A.电解AgNO3是放氧生酸型;
B.电解NaOH是电解水型;
C.电解KCl是放氢生碱型;
D.电解CuSO4是放氧生酸型;
19.【答案】D
【解析】【解答】A.甲烷发生氧化反应生成二氧化碳,作负极,A不符合题意;
B.电极反应式为 ,B不符合题意;
C.原电池中阴离子向负极移动,C不符合题意;
D.会释放出二氧化碳,是温室气体,D符合题意;
故答案为:D
【分析】A.发生氧化反应作负极;
B.电极反应式的书写;
C.原电池中阴离子向负极移动;
D.二氧化碳是温室气体。
20.【答案】D
【解析】【解答】A.pH计的工作原理是通过测定电池电动势E(即玻璃电极和参比电极的电势差)来确定待测溶液的pH,则pH计工作时,化学能转化为电能,A不符合题意;
B.根据pH计的工作原理可知,玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化从而使得其能确定溶液的pH,B不符合题意;
C.pH=,若测得pH=3的标准溶液电池电动势E为0.377V ,则3=,解得K=0.2,C不符合题意;
D.若玻璃电极电势比参比电极电势低,则玻璃电极为负极,失去电子发生氧化反应,反应为Ag(s)- e-+Cl-=AgCl(s),D符合题意;
故答案为:D。
【分析】A.原电池将化学能转化为电能;
B.玻璃电极玻璃膜内外c(H+)的差异会引起电池电动势的变化从而测定溶液的pH;
C.根据pH=计算。
21.【答案】(1)2
(2)-93 kJ·mol-1
(3)ab;LiBH4;2Al+6H2O=2Al(OH)3+3H2↑
(4)增大;BH4--8e-+8OH-=BO2-+6H2O
【解析】【解答】(1)LiBH4中氢元素化合价为-1价,生成1mol氢气转移电子2mol;
(2)能量由上到下分别为1、2、3、4,则该反应的焓变为-(1+3-2-4)= -93 kJ·mol-1;
(3)①a、图中当全为铝时气体为0,故纯铝与水不反应,故正确;
b、f线代表纯LiBH4与水反应产生氢气,故正确;
c、当材料含LiBH4为25%时(d线),产生氢气的量最多,故不正确;
故答案为:ab;
②由图得出反应后已没有LiBH4,但存在大量铝,故其完全反应,与水完全反应的物质是LiBH4;铝部分反应(有氢氧化铝等铝的产物),反应化学方程式为2Al+6H2O=2Al(OH)3+3H2↑;
(4)右室双氧水得到电子为正极,电极反应式为H2O2+2e-=2OH-,故该极碱性增强,负极为BH4--8e-+8OH-=BO2-+6H2O。
【分析】(1) 根据氧化还原反应得失电子的情况,即可计算出电子的物质的量
(2)根据盖斯定律找出关系即可
(3)考查的是看图获取信息的能力
(4)考查的是电解池原理以及电极方程式
22.【答案】(1)正极;变浅;氢氧化铁胶粒带正电
(2)16:64:71:2
(3)镀层金属;1.08
【解析】【解答】(1)结合以上分析可知,A极是电源的正极;电解硫酸铜溶液,阳极生成氧气,极反应式:4OH--4e﹣= O2↑+2H2O,阴极铜离子生成铜,极反应式:Cu2++2e﹣═Cu;铜离子浓度减小,所以甲中溶液颜色变浅;阳离子向阴极移动,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,因此氢氧化铁胶粒带正电,在电场作用下向Y极移动;
(2)甲池中:电解硫酸铜溶液:2CuSO4+2H2O 2Cu+2H2SO4+O2↑;乙池中:电解氯化钠溶液:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;串联电路电子转移电子数相等,因此当转移的电子数相等时,满足4e-~2Cu~O2~2Cl2~2H2关系;甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为n(O2):n(Cu):n(Cl2):n(H2)=1:2:2:2,对应单质的质量之比为1mol×32g/mol:2mol×64g/mol:2×71g/mol:2×2g/mol=16:64:71:2;
(3)电镀时,待镀金属做阴极,镀层金属做阳极,因此现用丙装置给铜件镀银,银做阳极,铜做阴极,丙装置中G为阳极,因此G是镀层金属;乙池中:电解氯化钠溶液:2NaCl+2H2O 2NaOH+Cl2↑+H2↑;当乙中溶液的pH是13时,溶液体积为100 mL,则n(NaOH)=0.1mol/L×0.1L=0.01mol,根据2e-~2NaOH关系可知,转移电子为0.01mol,串联电路转移电子数相等,根据Ag++e-=Ag可知,生成银的量为0.01mol,质量为0.01mol×108g/mol=1.08g。
【分析】将直流电源接通后,电解滴有酚酞的饱和食盐水,F极附近呈红色,产生了氢氧根离子,氢离子转化为氢气,所以F为阴极,电极反应式:2H2O+2e-=H2↑+2OH-;据此分析可知,E、C、G、X为阳极,D、F、H、Y为阴极,因此电源B为负极,A为正极,结合以上分析解答。
23.【答案】(1)放热; (aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;A;从M到N;2 +12H++10e-=N2↑+6H2O
(2)O2+2H++2e-=H2O2;10
【解析】【解答】(1)①根据图像,反应物的总能量大于生成物的总能量,则第一步反应为放热反应;根据图像, H1=-273kJ/mol, H2=-73kJ/mol,则总反应为放热反应, H=-346kJ/mol,热化学方程式为 (aq)+2O2(g)= (aq)+2H+(aq)+H2O(1) ΔH=-346kJ·mol-1;
②根据电解装置,Ag-Pt电极上N原子得电子,生成氮气,则B电极为负极,A为正极;电解质溶液中的质子由阳极向阴极区移动,即从M到N;阴极上硝酸根离子得电子与质子反应生成氮气和水,电极反应式为2 +12H++10e-=N2↑+6H2O;
(2)①根据电解装置,阴极中氧气得电子与溶液中的氢离子反应生成过氧化氢,电极反应式为O2+2H++2e-=H2O2;
②氨氮废水中氨(以NH3计)的浓度为1750mg L 1,当降为50mg L-1)时即可达到排放标准,需要反应1700mg/L,即1.7g/L,也为0.1mol/L。1mol氨转变为氮气时,转移3mol电子,电路中转移3mole-,需反应1mol氨气,需要氨氮废水10L。
【分析】(1)①根据图像,反应物的总能量大于生成物的总能量;②根据电解装置,Ag-Pt电极上N原子得电子,生成氮气,为负极;(2)①阴极中氧气得电子与溶液中的氢离子反应生成过氧化氢;②废液达到排放标准时的浓度变化,计算转移电子数目及体积。
24.【答案】(1)第四周期,第Ⅷ族;H-O-O-H
(2)Cu2++ S2-=CuS↓;避免生成H2S,影响除杂
(3)防止H2O2受热分解;2.64 10-9mol/L
(4)A;E
【解析】【解答】(1)根据元素的排列规律及Ni的原子序数为28,可知Ni的位置为:第四周期第Ⅷ族;H2O2为分子晶体,原子之间均以共价单键相连,故的结构式为:H-O-O-H;
故答案为:第四周期第Ⅷ族;H-O-O-H;(2)S2-与Cu2+和 结合可生成沉淀,所以用 溶液的目的是除去Cu2+和Zn2+,则除去Cu2+的离子方程式为:Cu2++ S2-=CuS↓;S2-可与结合生成弱电解质H2S,所以前一步在调节溶液的pH不能太低,否则会生成杂质H2S,影响除杂;
故答案为:Cu2++ S2-=CuS↓ ;避免生成H2S,影响除杂;(3)步骤③除去Fe采用生成 的方式,在第一步酸溶时,铁变成Fe2+,因此该处需要氧化剂,发生氧化还原反应,温度太高,氧化剂H2O2分解;由于存在沉淀溶解平衡: ,平衡常数 ,已知pH=4,则 ,公式换算可得: ;
故答案为:防止H2O2受热分解; ;(4)用电解法制备高纯度镍,原理同于制备高纯度铜,粗镍做阳极,活泼金属在阳极放电,该处在阳极反应的金属有Fe、Zn, 失去电子生成Fe2+、Zn2+,Cu和Pt作为阳极泥,在电解槽的底部,阴极发生的电极反应式为: ,虽然阴极阳极都是2e-,但Fe、Zn和Cu本身的质量不一样,所以阳极减少的质量不等于阴极生成的质量,所以选AE,
故答案为:AE。
【分析】本题将工艺流程与氧化还原、电解池、沉淀溶解平衡相互结合,第一步操作为溶解金属,第二步为除去Cu2+和 ,第三步除去Fe和Cr,最后得到 ,在各个步骤中结合氧化还原等一些应用。
25.【答案】(1)、的单质均比铜活泼,先于铜失去电子进入电解质溶液中
(2);;过滤
(3)
(4)含金、银、铅的合金(或粗银)
(5)
【解析】【解答】(1)已知Fe、Zn比Cu更活泼的金属,故粗铜中含有、两种元素的单质,但由于二者先于铜失去电子进入电解质溶液中,故在阳极泥中几乎检测不到,故答案为:、的单质均比铜活泼,先于铜失去电子进入电解质溶液中;
(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有,等。
①“焙烧”过程中与浓硫酸反应即Cu与浓硫酸在加热条件下反应生成CuSO4、SO2和H2O,故该反应的化学方程式为:,故答案为:;
②将、通入水中即可生成单质硒,Se的化合价降低被还原为Se单质,故S的化合价升高被氧化为,故该反应的离子方程式为,故答案为:;
③实验室中分离不溶性固体和液体的方法是过滤,故将粗硒从溶液中分离出来的操作为过滤,故答案为:过滤;
(3)用惰性电极电解“浸液”即主要电解硫酸铜溶液时,溶液中发生的总反应离子方程式为 ,故答案为:;
(4)由题干信息可知,“银电解”即进行银的精炼,根据铜的精炼过程可知,用含金、银、铅的合金(或粗银)作阳极材料,用纯银作阴极,故答案为:含金、银、铅的合金(或粗银);
(5) 焙烧需消耗硫酸,而得到粗硒生成硫酸,则硫酸可循环利用,故答案为:H2SO4。
【分析】(1)活泼金属做阳极,活泼金属先放电。
(2)②二氧化硫具有还原性,氧化硒具有氧化性,发生氧化还原反应得到单 硒
(3)电解硫酸铜,铜离子得电子得到单质铜。
(4)对金属精炼时,阳极为含有杂质的精炼金属。
