人教版九年级化学上册第五单元化学方程式单元复习题(含解析)
文档属性
| 名称 | 人教版九年级化学上册第五单元化学方程式单元复习题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 177.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-12 08:43:32 | ||
图片预览




文档简介
人教版九年级化学上册第五单元化学方程式单元复习题
一、单选题
1.利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为,X的化学式为( )
A.C B.CH4 C.CH3OH D.CH2O
2.Sb2O5是一种阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O,则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H2SbO4
3.下列比例模型中,代表水分子的()
A. B. C. D.
4.2023年3月30日,长征二号丁运载火箭成功将宏图一号01组共四颗卫星送入预定轨道。一种火箭推进剂在火箭发射过程中发生反应的微观示意图如图。下列说法正确的是( )
A.化学反应前后分子个数不变
B.该反应前后各元素的化合价没有改变
C.参加反应的甲、乙的质量比为23:16
D.参加反应的甲、丙分子个数比为1:1
5.2017 年 2 月 20 日小鸣单车率先进入无锡,方便了无锡市民的绿色出行;随着夏季气温的升高,“共享单车”的充气轮胎容易发生爆炸的主要原因是( )
A.分子停止运动
B.分子间隔变大,分子运动速率加快
C.分子本身的体积变大,分子运动速率减慢
D.分子质量变大
6.下列反应或过程所对应的图像正确的是( )
A.Cu在空气中灼烧后固体的质量 B.加热一定质量的高锰酸钾
C.红磷在密闭容器中燃烧 D.电解一定质量的水
7我国在西昌卫星发射中心用长征三号甲运载火箭,成功将第十颗北斗导航卫星送入太空预定轨道,卫星所用的燃料是液态偏二甲肼(C2H8N2),氧化剂是N2O4,发生的反应可写作:C2H8N2+2 N2O4=3N2↑+2CO2↑+nH2O↑。下列说法正确的是
A.该化学方程式中n=3 B.该反应是分解反应
C.反应前后原子总数发生变化 D.N2O4是氧化物
8.“尾气催化转化器”可以将汽车尾气中有毒气体转变为无毒气体,下面是其中一个化学反应的微观示意图,其中不同的圆球代表不同的原子。从图中获得信息不正确的是( )
A.化学反应的实质是生成了新分子
B.分子间存在着一定的空隙
C.参加反应的两种分子的个数比为1∶1
D.图中生成物均为化合物
9.下图是某个化学反应的微观模拟示意图,从图中不能获得的信息是( )
A.该反应前后一共涉及3种分子
B.该反应前后各种原子的种类没有变化
C.该反应在常温下就很容易发生
D.该反应属于化合反应
10.反应甲→乙+丙的微观模拟示意图如图所示,图中“●”,“o”表示不同的原子,丙为呼吸作用产物之一,下列有关说法正确的是( )
A.甲混合物物
B.乙的微观示意图为
C.该反应的化学方程式可表示为2H2O2=2H2O+O2↑
D.“●”原子所对应的元素的化合价在该反应前后保持不变
11.下列四种叙述均用如图表示,其中对应说法正确的是()
A.图表示向过氧化氢溶液加入少量的MnO2反应过程中生成O2的质量与时间关系
B.图表示向过氧化氢溶液(含水)加入少量的MnO2反应过程中溶液中水的质量与时间关系
C.图表示一定量KMnO4加热制O2过程中,残留固体中MnO2的质量与时间的关系
D.图表示加热双氧水和二氧化锰制备氧气的反应过程中MnO2的质量变化关系
12.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳催化转化成液体燃料甲醇,如图为该反应的微观模拟示意图(图中微粒恰好完全反应)。说法正确的是( )
A.反应前后分子的种类不变
B.参加反应的甲、乙质量之比为3:1
C.该反应只涉及到一种氧化物
D.该反应前后C、H、O元素的质量都不变
二、非选择题
13.阅读下面科普短文。
随着环境意识的提高,人们对室内空气质量越来越关心。下表列举了室内空气的主要污染物及来源。
污染源 污染物
建筑材料 NH3、甲醛(CH2O)、苯(C6H6)、甲苯(C7H8)、石棉纤维等
家具 甲醛(CH2O)、甲苯(C7H8)等
办公用品 O3、电磁辐射等
烹饪 CO、NO2、SO3、PM10等
室内微生物 结核杆菌、霉菌等
从上表看出室内污染物种类繁多,其中室内甲醛污染已被列入对公众健康影响最大的环境因素之一、室内空气中的甲醛主要来自于人造板材料制作的家具、地板以及胶黏剂等。这些材料用的越多,甲醛在室内空气中的浓度越高。甲醛的释放期非常长,人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味。
改善室内空气质量的方法有很多。通常情况下,开窗通风是改善室内空气质量最有效的方法。
运用功能性装饰材料也可以改善室内空气质量。研究表明硅藻泥也可以净化空气。硅藻泥的主要成分是硅藻土,是由水生浮游类生物沉积而成。电子显微镜显示,硅藻土粒子表面具有无数微小的孔穴,功能与活性炭相似。正是这种多孔的结构,使硅藻泥成为具有净化空气功能的内墙装饰材料。
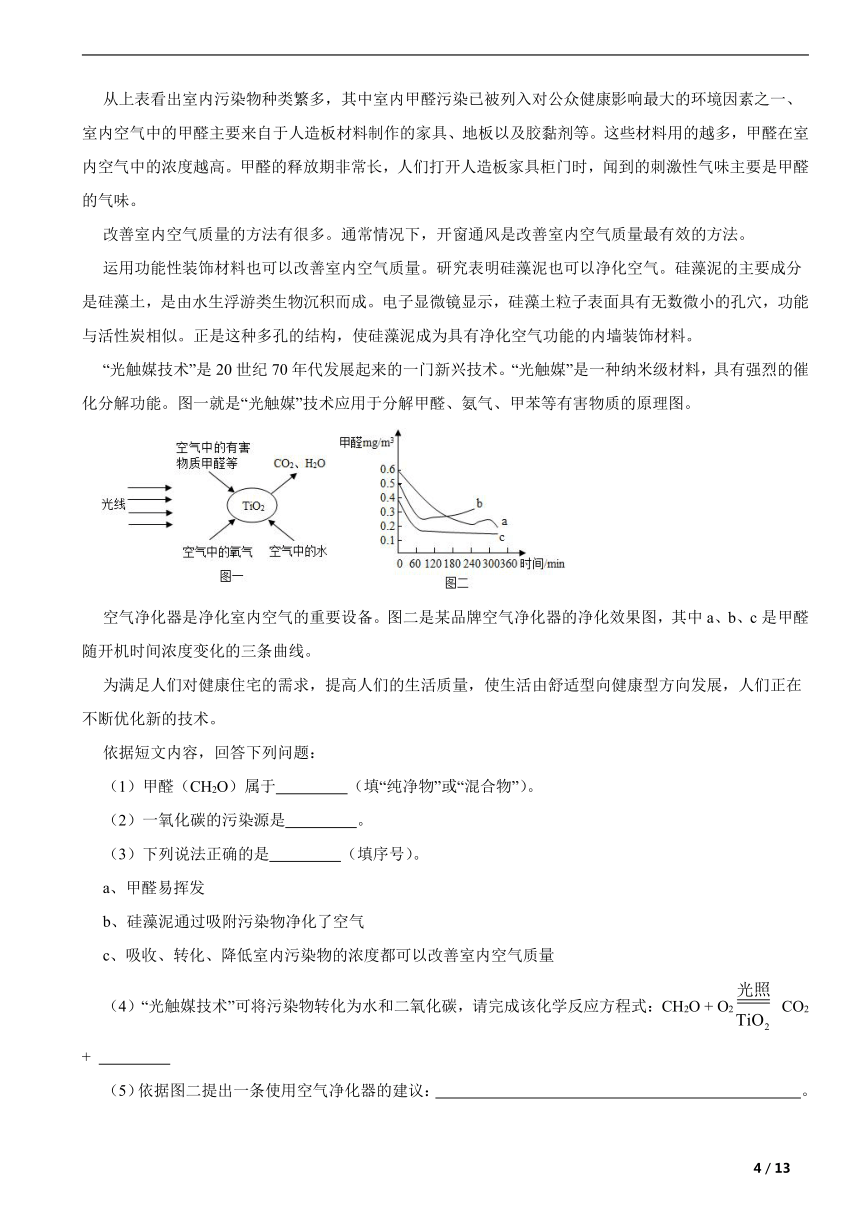
“光触媒技术”是20世纪70年代发展起来的一门新兴技术。“光触媒”是一种纳米级材料,具有强烈的催化分解功能。图一就是“光触媒”技术应用于分解甲醛、氨气、甲苯等有害物质的原理图。
空气净化器是净化室内空气的重要设备。图二是某品牌空气净化器的净化效果图,其中a、b、c是甲醛随开机时间浓度变化的三条曲线。
为满足人们对健康住宅的需求,提高人们的生活质量,使生活由舒适型向健康型方向发展,人们正在不断优化新的技术。
依据短文内容,回答下列问题:
(1)甲醛(CH2O)属于 (填“纯净物”或“混合物”)。
(2)一氧化碳的污染源是 。
(3)下列说法正确的是 (填序号)。
a、甲醛易挥发
b、硅藻泥通过吸附污染物净化了空气
c、吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
(4)“光触媒技术”可将污染物转化为水和二氧化碳,请完成该化学反应方程式:CH2O + O2 CO2 +
(5)依据图二提出一条使用空气净化器的建议: 。
14.人类对空气成分的探究经历了艰辛的过程。
(1)18世纪拉瓦锡为研究空气成分,用上图所示装置持续加热12天,直到曲颈甑中红色粉末不再增加。
①红色粉末(HgO)的物质名称是 。
②为保证实验的科学性,下列数据必须测量的有 。(填标号)
A.实验前后曲颈甑和玻璃钟罩内的气体体积
B.实验前后气体的温度和压强
C.汞槽的容积
(2)下图是仿照拉瓦锡钟罩实验原理设计的装置。
①实验时,红磷燃烧的化学方程式是 。
②如果没有弹簧夹,实验结果会 (填“偏大”“偏小”或“不变”),原因是 。
(3)现在用氧气传感器可直接测量氧气含量。有一种电池型氧气传感器,是利用反应。产生电流,通过测试电流的大小来判定氧气含量。
①此化学方程式中的X是 。(填化学式)
②若在上题(2)实验前,将此氧气传感器固定在集气瓶内。请在坐标图上,画出实验时瓶内气体中,氧气的体积分数随时间变化的趋势。
15.化学是在分子、原子层次上研究物质的科学。下图为三种元素的原子结构示意图。
(1)氧原子在化学反应中容易 (填“得到”或“失去”)电子。
(2)硒(Se)元素能增强人体免疫力,延缓衰老,山药等食物中富含硒元素。回答下列问题:
A.硒原子的核电荷数为 。
B.硒元素与氧、硫元素的化学性质相似,原因是它们的原子 相同。
C.根据上述结构示意图可知,硒离子的符号为 。
(3)如图表示的是工业上将某种有毒物质转化成无毒物质直接排放的过程,反应的微观示意图如下。该反应的化学方程式为 。
16.化学氧自救器是广泛应用于安全生产和应急救生的一种呼吸器,利用超氧化钾(KO2)与人体呼出的二氧化碳反应制得氧气()。
(1)现有710g超氧化钾,可产生氧气的质量为多少?(写出计算过程)
(2)工作人员使用该化学氧自救器时,每分钟消耗8g氧气,以上产生的氧气可提供的防护时间为 分钟。
答案解析部分
1.【答案】C
【解析】【解答】根据质量守恒定律的围观本质,在化学反应 前后原子的种类和数量不变,反应前有1个碳原子、6个氢原子、2个氧原子,反应后有2个氢原子、1个氧原子,X必须提供1个碳原子、4个氢原子、1个氧原子,
故答案为:C。
【分析】根据质量守恒定律确定X的化学式。
2.【答案】C
【解析】【解答】反应前各原子种类和个数为: Sb 2个、O 3个,反应后: Sb 2个、O 7个、H 4个,所以2X中含4个氧原子4个氢原子,X化学式为 H2O2 ;
故答案为:C
【分析】根据化学反应前后原子的种类和个数不变分析。
3.【答案】B
【解析】【解答】有水分子的化学式H2O可知,一个水分子中含有3个原子,所以水分子模型为 ;
故答案为:B。
【分析】根据一个水分子由两个氢原子和一个氧原子构成分析。
4.【答案】C
【解析】【解答】A、N2O4+4N2H2=5N2+4H2O,反应前后分子数改变,A错误;
B、氮元素化合价发生变红,B错误;
C、 参加反应的甲、乙的质量比为 (28+64):4(28+2)= 23:16 ,C正确;
D、 参加反应的甲、丙分子个数比为1:4,D错误。
故答案为:C
【分析】
根据反应方程式进行分析,反应如下:
N2O4+4N2H2=5N2+4H2O。
A、反应前后分子数增多;
B、氮元素价态变红;
C、质量比为(28+64):4(28+2)= 23:16;
D、参加反应的甲、丙分子个数比为1:4
5.【答案】B
【解析】【解答】夏天温度高,分子间的间隔要增大,分子运动速率加快,故会使轮胎发生爆胎,B符合题意。
故答案为:B。【分析】本题主要考查微粒的性质,微粒的运动快慢和空隙与温度有关,温度越高,微粒运动越快,空隙越大。
6.【答案】A
【解析】【解答】A、Cu在空气中灼烧生成氧化铜,固体质量不断增加,且反应前不为0,反应完全后,固体质量保持不变,A图像正确;
B、高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应条件为加热,当加热到一定温度时该反应才能发生,故开始加热时无氧气产生,B图像不正确;
C、一定质量的红磷在密闭容器中燃烧,根据质量守恒定律,反应前后物质的总质量不变,C图像不正确;
D、水通电时分解为氢气和氧气,但没有通电时就没有气体生成,气体的质量为零,D图像不正确;
故选:A。
【分析】A、根据Cu在空气中灼烧生成氧化铜分析;
B、根据高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气分析;
C、根据质量守恒定律分析;
D、根据电解水生成氢气和氧气分析。
7.【答案】D
【解析】A、根据题意可知,偏二甲肼有可燃性,氧气不具有可燃性,故A错误;
B、由反应的方程式可知:反应物和生成物的化学计量数总和为:1+2+2+4+3=12.故B错误;
C、偏二甲肼中碳、氢、氮各元素的质量比为:(12×2):(1×8):(14×2)=6:2:7,故C错误;
D、由反应的方程式,根据质量守恒定律反应前后原子的种类、数目不变,可推出X的化学式为H 2O,故D正确.
故选D.
8.【答案】D
【解析】【解答】A、化学反应的实质是生成了新分子,正确;
B、分子间存在着一定的空隙,正确;
C、反应前的两种分子各有2个分子参加反应,因此参加反应的两种分子的个数比为1:1;正确;
D、由图示可知生成物中有同种原子的构成的单质分子;错误,
故选D.
【分析】观察反应的微观示意图,反应前后有一个构成相同的分子,可判断该分子未参加反应,因此该反应为两种不同的分子各2个参加反应,生成一种同种原子构成的单质分子1个和一种不同种原子构成的化合物分子2个,进而进行分析判断.构成相同的分子为同种物质的分子,由同种原子构成的分子为单质的分子,由不同种原子构成的分子为化合物的分子,只有掌握这些才能顺利解题.
9.【答案】C
【解析】【解答】A、由微粒的构成可知,该反应前后一共涉及3种分子,故A不符合题意;
B、由微粒的变化可知,该反应前后各种原子的种类没有变化,故B不符合题意;
C、通过化学反应的微观模拟示意图,不能反映反应发生的情况,故C符合题意;
D、由微粒的构成可知,该反应是由两种物质生成一种物质,属于化合反应,故D不符合题意。
故答案为:C。
【分析】根据微观示意图写出表达式进行分析
10.【答案】C
【解析】【解答】根据如图所示:反应甲→乙+丙的微观模拟示意图,图中“●”,“o”表示不同的原子,丙为呼吸作用产物之一,则丙为水,图中“●”,“o”分别表示氧原子和氢原子;该反应的化学方程式可表示为2H2O2=2H2O+O2↑;
A、甲表示的物质为H2O2,化合物,A不符合题意;
B、乙物质为氧气,其微观构成为两个原子构成一个分子,B不符合题意;
C、该反应的化学方程式可表示为2H2O2=2H2O+O2↑,C符合题意;
D、“●”原子所对应的元素为氧元素,反应前后由﹣1价变为0价和﹣2价,D不符合题意;
故答案为:C。
【分析】有关微观模拟图的题目在解答时,要根据反应前后各微粒的构成确定反应物和生成物,或写出反应方程式,或直接判断参加反应和生成的微粒的个数,要注意反应后有反应物剩余的微观图,不能误以为反应后物质都是生成物。
11.【答案】B
【解析】【解答】A、起点:从图上看,当反应时间为0的时候,纵坐标(生成氧气的质量)已有一定的量,而事实上当反应时间为0的时候,产生氧气的质量也是0,故单从起点看,不符合题意;
B、起点:当反就时间为0的时候,纵坐标(溶液中水的质量)已有一定的量,而事实上也确实如此,反应还没开始的时候,过氧化氢溶液中就已有一定量的水存在,从起点看,满足要求;拐点:所谓拐点是指线条突然发生变化的点。结合变化趋势分析如下:随着反应的进行,生成水的量越来越多,图上表现为直线向上变化,但当反应进行到完成时,水的量就突然不再增多,而是保持原有的水的质量不变,图上表现为直线平行与横座标,从直线向上变化到直线平等与横座标,必然存在一个拐点,符合题意;
C、从起点看,该图不符合,因为反应时间为0的时候,残留固体中二氧化锰的质量也应该是0,不符合题意;
D、双氧水制取氧气时,二氧化锰作为催化剂来使用的,其质量并不发生改变,图上应体现为是从左到右的一条平行于横座标的直线,且起点不在直角坐标系的原点上,因为反应时间为0的时候,二氧化锰就已有一定的质量了,不符合题意。
故答案为:B。
【分析】识图要从横坐标和纵坐标的理解开始。理解坐标图中纵、横坐标的关系,再结合所学知识,联系相应的知识点,理解图像意义。在此基础上“明点”,曲线中的特殊点(起点、终点、顶点、转折点、交点等)表示什么化学意义。然后再具体分析曲线的走向、变化趋势。最后揭示出各段曲线所包含的含义。
12.【答案】D
【解析】【解答】由微观示意图可知:氢气与二氧化碳在纳米纤维、催化剂的条件下反应生成甲醇和水,该反应的化学方程式: ;
A. 由化学方程式 可知:反应前后分子的数目减少,故不符合题意;
B. 参加反应的甲、乙质量之比= ,故不符合题意;
C. 由两种元素组成且一种元素是氧元素的化合物叫做氧化物,二氧化碳和水都属于氧化物,故不符合题意;
D. 依据质量守恒定律:化学反应前后元素的质量不变,该反应前后C、H、O元素的质量都不变,故符合题意;
故答案为:D。
【分析】首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答。
13.【答案】(1)纯净物
(2)烹饪
(3)abc
(4)H2O
(5)工作时间在1~2小时,降低甲醛的浓度效果显著
【解析】【解答】(1) 甲醛(CH2O)属于纯净物;
(2)由表格可知,一氧化碳的污染源是烹饪;
(3)a.人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味,说明甲醛易挥发,故正确;
b.硅藻泥功能与活性炭相似,过吸附污染物净化了空气,故正确;
c. 吸收、转化、降低室内污染物的浓度都可以改善室内空气质量,正确;
故答案为:abc
(4)水的化学式为H2O。
(5) 由图二曲线可以看出:工作时间在1~2小时,降低甲醛的浓度效果显著。
【分析】(1) 甲醛是由一种物质组成的,属于纯净物。
(2)根据题目中表格可知,一氧化碳的污染源是烹饪;。
(3)根据题目中的文字叙述,进行分析。
(4)根据质量守恒定律,反应前后原子的种类和个数不变,推导出水的化学式。
(5)根据图二曲线中给出的消息,进行分析。
14.【答案】(1)氧化汞;AB
(2);偏大;红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大
(3)Pb;
【解析】【解答】(1)根据化学式的读法,可知HgO的物质名称为氧化汞;
A、通过实验前后曲颈甑和玻璃钟罩内的气体体积对比,才能计算出消耗氧气的体积,故正确;
B、实验前后气体的温度和压强不同,会导致进入玻璃钟罩内汞的体积不同,故正确;
C、汞槽的容积对测量氧气的含量没有影响,故不正确。
故答案为:AB。
(2)红磷和氧气在点燃的条件下反应,生成五氧化二磷,其反应的化学方程式为:;
如果没有弹簧夹,实验结果会偏大;因为如果没有弹簧夹,红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大;
故答案为:;偏大;红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大;
(3)根据反应前后原子的种类和数目不变,反应前的原子的种类为:O、H,原子个数依次为:4、4;反应后的原子种类有:Pb、O、H,原子个数依次为:2、4、4;所以反应前有2个Pb原子,由于X的化学计量系数是2 ,所以X中只含有1个Pb,其化学式为:Pb;
由于集气瓶内氧气约占空气的体积分数为21%,随着反应的进行氧气被消耗,当氧气的体积分数降到一定程度时,不再反应,当温度降至室温后,导管中氧气会进入集气瓶,使氧气的体积分数增大,所以实验时瓶内气体中,氧气的体积分数随时间变化的趋势图为:
【分析】(1)化合物化学式的读法:从右往左读做“某化某”或“某酸某”。
根据通过实验前后曲颈甑和玻璃钟罩内的气体体积对比,才能计算出消耗氧气的体积分析。
(2)红磷和氧气在点燃的条件下反应,生成五氧化二磷。
如果没有弹簧夹,实验结果会偏大;因为如果没有弹簧夹,红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大。
(3)根据质量守恒定律,反应前后原子的种类和数目不变分析。
15.【答案】(1)得到
(2)34;最外层电子数;Se2-
(3)4NH3+6NO
5N2+6H2O
【解析】【解答】(1)氧原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的氧离子;(2)据图可知:A、硒原子的核电荷数为34;
B、元素的化学性质跟它的原子的最外层电子数目关系非常密切,决定元素化学性质的是最外层电子数,硒元素与氧、硫元素的化学性质相似的原因是它们原子的最外层的电子数相同;
C、硒原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成硒离子,其离子符号为:Se2-;(3)由反应的微观示意图可知,反应物是氨气与一氧化氮,生成物是氮气和水,所以反应的化学方程式为:4NH3+6NO
5N2+6H2O。
故答案为:(1)得到(2)34;最外层电子数;Se2-(3)4NH3+6NO 5N2+6H2O。
【分析】(1)一般情况下,原子最外层电子数大于4得电子,小于4失电子
(2)根据原子结构示意图圈内的数为核电荷数,元素的化学性质决定于最外层电子数,
硒原子的最外层为6,得到两个电子带两个单位负电荷
(3)根据围观结构可知,题中为氨气和氧气在催化剂的作用下生成氮气和水
16.【答案】(1)解:设现有710g超氧化钾,可产生氧气的质量为x。
x=240g
答:现有710g超氧化钾,可产生氧气的质量为240g。
(2)30
【解析】【解答】(2) 每分钟消耗8g氧气,以上产生的氧气质量为240g,可提供的防护时间为。
【分析】(1)根据反应的超氧化钾质量及方程式中物质间质量关系计算生成氧气质量分析;
(2)由生成氧气质量及每分钟消耗氧气质量计算防护时间分析。
1 / 1
一、单选题
1.利用催化剂将工厂废气中的二氧化碳转化为燃料x,是实现“碳中和”的路径之一,该反应的化学方程式为,X的化学式为( )
A.C B.CH4 C.CH3OH D.CH2O
2.Sb2O5是一种阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O,则X的化学式为( )
A.H2 B.O2 C.H2O2 D.H2SbO4
3.下列比例模型中,代表水分子的()
A. B. C. D.
4.2023年3月30日,长征二号丁运载火箭成功将宏图一号01组共四颗卫星送入预定轨道。一种火箭推进剂在火箭发射过程中发生反应的微观示意图如图。下列说法正确的是( )
A.化学反应前后分子个数不变
B.该反应前后各元素的化合价没有改变
C.参加反应的甲、乙的质量比为23:16
D.参加反应的甲、丙分子个数比为1:1
5.2017 年 2 月 20 日小鸣单车率先进入无锡,方便了无锡市民的绿色出行;随着夏季气温的升高,“共享单车”的充气轮胎容易发生爆炸的主要原因是( )
A.分子停止运动
B.分子间隔变大,分子运动速率加快
C.分子本身的体积变大,分子运动速率减慢
D.分子质量变大
6.下列反应或过程所对应的图像正确的是( )
A.Cu在空气中灼烧后固体的质量 B.加热一定质量的高锰酸钾
C.红磷在密闭容器中燃烧 D.电解一定质量的水
7我国在西昌卫星发射中心用长征三号甲运载火箭,成功将第十颗北斗导航卫星送入太空预定轨道,卫星所用的燃料是液态偏二甲肼(C2H8N2),氧化剂是N2O4,发生的反应可写作:C2H8N2+2 N2O4=3N2↑+2CO2↑+nH2O↑。下列说法正确的是
A.该化学方程式中n=3 B.该反应是分解反应
C.反应前后原子总数发生变化 D.N2O4是氧化物
8.“尾气催化转化器”可以将汽车尾气中有毒气体转变为无毒气体,下面是其中一个化学反应的微观示意图,其中不同的圆球代表不同的原子。从图中获得信息不正确的是( )
A.化学反应的实质是生成了新分子
B.分子间存在着一定的空隙
C.参加反应的两种分子的个数比为1∶1
D.图中生成物均为化合物
9.下图是某个化学反应的微观模拟示意图,从图中不能获得的信息是( )
A.该反应前后一共涉及3种分子
B.该反应前后各种原子的种类没有变化
C.该反应在常温下就很容易发生
D.该反应属于化合反应
10.反应甲→乙+丙的微观模拟示意图如图所示,图中“●”,“o”表示不同的原子,丙为呼吸作用产物之一,下列有关说法正确的是( )
A.甲混合物物
B.乙的微观示意图为
C.该反应的化学方程式可表示为2H2O2=2H2O+O2↑
D.“●”原子所对应的元素的化合价在该反应前后保持不变
11.下列四种叙述均用如图表示,其中对应说法正确的是()
A.图表示向过氧化氢溶液加入少量的MnO2反应过程中生成O2的质量与时间关系
B.图表示向过氧化氢溶液(含水)加入少量的MnO2反应过程中溶液中水的质量与时间关系
C.图表示一定量KMnO4加热制O2过程中,残留固体中MnO2的质量与时间的关系
D.图表示加热双氧水和二氧化锰制备氧气的反应过程中MnO2的质量变化关系
12.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳催化转化成液体燃料甲醇,如图为该反应的微观模拟示意图(图中微粒恰好完全反应)。说法正确的是( )
A.反应前后分子的种类不变
B.参加反应的甲、乙质量之比为3:1
C.该反应只涉及到一种氧化物
D.该反应前后C、H、O元素的质量都不变
二、非选择题
13.阅读下面科普短文。
随着环境意识的提高,人们对室内空气质量越来越关心。下表列举了室内空气的主要污染物及来源。
污染源 污染物
建筑材料 NH3、甲醛(CH2O)、苯(C6H6)、甲苯(C7H8)、石棉纤维等
家具 甲醛(CH2O)、甲苯(C7H8)等
办公用品 O3、电磁辐射等
烹饪 CO、NO2、SO3、PM10等
室内微生物 结核杆菌、霉菌等
从上表看出室内污染物种类繁多,其中室内甲醛污染已被列入对公众健康影响最大的环境因素之一、室内空气中的甲醛主要来自于人造板材料制作的家具、地板以及胶黏剂等。这些材料用的越多,甲醛在室内空气中的浓度越高。甲醛的释放期非常长,人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味。
改善室内空气质量的方法有很多。通常情况下,开窗通风是改善室内空气质量最有效的方法。
运用功能性装饰材料也可以改善室内空气质量。研究表明硅藻泥也可以净化空气。硅藻泥的主要成分是硅藻土,是由水生浮游类生物沉积而成。电子显微镜显示,硅藻土粒子表面具有无数微小的孔穴,功能与活性炭相似。正是这种多孔的结构,使硅藻泥成为具有净化空气功能的内墙装饰材料。
“光触媒技术”是20世纪70年代发展起来的一门新兴技术。“光触媒”是一种纳米级材料,具有强烈的催化分解功能。图一就是“光触媒”技术应用于分解甲醛、氨气、甲苯等有害物质的原理图。
空气净化器是净化室内空气的重要设备。图二是某品牌空气净化器的净化效果图,其中a、b、c是甲醛随开机时间浓度变化的三条曲线。
为满足人们对健康住宅的需求,提高人们的生活质量,使生活由舒适型向健康型方向发展,人们正在不断优化新的技术。
依据短文内容,回答下列问题:
(1)甲醛(CH2O)属于 (填“纯净物”或“混合物”)。
(2)一氧化碳的污染源是 。
(3)下列说法正确的是 (填序号)。
a、甲醛易挥发
b、硅藻泥通过吸附污染物净化了空气
c、吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
(4)“光触媒技术”可将污染物转化为水和二氧化碳,请完成该化学反应方程式:CH2O + O2 CO2 +
(5)依据图二提出一条使用空气净化器的建议: 。
14.人类对空气成分的探究经历了艰辛的过程。
(1)18世纪拉瓦锡为研究空气成分,用上图所示装置持续加热12天,直到曲颈甑中红色粉末不再增加。
①红色粉末(HgO)的物质名称是 。
②为保证实验的科学性,下列数据必须测量的有 。(填标号)
A.实验前后曲颈甑和玻璃钟罩内的气体体积
B.实验前后气体的温度和压强
C.汞槽的容积
(2)下图是仿照拉瓦锡钟罩实验原理设计的装置。
①实验时,红磷燃烧的化学方程式是 。
②如果没有弹簧夹,实验结果会 (填“偏大”“偏小”或“不变”),原因是 。
(3)现在用氧气传感器可直接测量氧气含量。有一种电池型氧气传感器,是利用反应。产生电流,通过测试电流的大小来判定氧气含量。
①此化学方程式中的X是 。(填化学式)
②若在上题(2)实验前,将此氧气传感器固定在集气瓶内。请在坐标图上,画出实验时瓶内气体中,氧气的体积分数随时间变化的趋势。
15.化学是在分子、原子层次上研究物质的科学。下图为三种元素的原子结构示意图。
(1)氧原子在化学反应中容易 (填“得到”或“失去”)电子。
(2)硒(Se)元素能增强人体免疫力,延缓衰老,山药等食物中富含硒元素。回答下列问题:
A.硒原子的核电荷数为 。
B.硒元素与氧、硫元素的化学性质相似,原因是它们的原子 相同。
C.根据上述结构示意图可知,硒离子的符号为 。
(3)如图表示的是工业上将某种有毒物质转化成无毒物质直接排放的过程,反应的微观示意图如下。该反应的化学方程式为 。
16.化学氧自救器是广泛应用于安全生产和应急救生的一种呼吸器,利用超氧化钾(KO2)与人体呼出的二氧化碳反应制得氧气()。
(1)现有710g超氧化钾,可产生氧气的质量为多少?(写出计算过程)
(2)工作人员使用该化学氧自救器时,每分钟消耗8g氧气,以上产生的氧气可提供的防护时间为 分钟。
答案解析部分
1.【答案】C
【解析】【解答】根据质量守恒定律的围观本质,在化学反应 前后原子的种类和数量不变,反应前有1个碳原子、6个氢原子、2个氧原子,反应后有2个氢原子、1个氧原子,X必须提供1个碳原子、4个氢原子、1个氧原子,
故答案为:C。
【分析】根据质量守恒定律确定X的化学式。
2.【答案】C
【解析】【解答】反应前各原子种类和个数为: Sb 2个、O 3个,反应后: Sb 2个、O 7个、H 4个,所以2X中含4个氧原子4个氢原子,X化学式为 H2O2 ;
故答案为:C
【分析】根据化学反应前后原子的种类和个数不变分析。
3.【答案】B
【解析】【解答】有水分子的化学式H2O可知,一个水分子中含有3个原子,所以水分子模型为 ;
故答案为:B。
【分析】根据一个水分子由两个氢原子和一个氧原子构成分析。
4.【答案】C
【解析】【解答】A、N2O4+4N2H2=5N2+4H2O,反应前后分子数改变,A错误;
B、氮元素化合价发生变红,B错误;
C、 参加反应的甲、乙的质量比为 (28+64):4(28+2)= 23:16 ,C正确;
D、 参加反应的甲、丙分子个数比为1:4,D错误。
故答案为:C
【分析】
根据反应方程式进行分析,反应如下:
N2O4+4N2H2=5N2+4H2O。
A、反应前后分子数增多;
B、氮元素价态变红;
C、质量比为(28+64):4(28+2)= 23:16;
D、参加反应的甲、丙分子个数比为1:4
5.【答案】B
【解析】【解答】夏天温度高,分子间的间隔要增大,分子运动速率加快,故会使轮胎发生爆胎,B符合题意。
故答案为:B。【分析】本题主要考查微粒的性质,微粒的运动快慢和空隙与温度有关,温度越高,微粒运动越快,空隙越大。
6.【答案】A
【解析】【解答】A、Cu在空气中灼烧生成氧化铜,固体质量不断增加,且反应前不为0,反应完全后,固体质量保持不变,A图像正确;
B、高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应条件为加热,当加热到一定温度时该反应才能发生,故开始加热时无氧气产生,B图像不正确;
C、一定质量的红磷在密闭容器中燃烧,根据质量守恒定律,反应前后物质的总质量不变,C图像不正确;
D、水通电时分解为氢气和氧气,但没有通电时就没有气体生成,气体的质量为零,D图像不正确;
故选:A。
【分析】A、根据Cu在空气中灼烧生成氧化铜分析;
B、根据高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气分析;
C、根据质量守恒定律分析;
D、根据电解水生成氢气和氧气分析。
7.【答案】D
【解析】A、根据题意可知,偏二甲肼有可燃性,氧气不具有可燃性,故A错误;
B、由反应的方程式可知:反应物和生成物的化学计量数总和为:1+2+2+4+3=12.故B错误;
C、偏二甲肼中碳、氢、氮各元素的质量比为:(12×2):(1×8):(14×2)=6:2:7,故C错误;
D、由反应的方程式,根据质量守恒定律反应前后原子的种类、数目不变,可推出X的化学式为H 2O,故D正确.
故选D.
8.【答案】D
【解析】【解答】A、化学反应的实质是生成了新分子,正确;
B、分子间存在着一定的空隙,正确;
C、反应前的两种分子各有2个分子参加反应,因此参加反应的两种分子的个数比为1:1;正确;
D、由图示可知生成物中有同种原子的构成的单质分子;错误,
故选D.
【分析】观察反应的微观示意图,反应前后有一个构成相同的分子,可判断该分子未参加反应,因此该反应为两种不同的分子各2个参加反应,生成一种同种原子构成的单质分子1个和一种不同种原子构成的化合物分子2个,进而进行分析判断.构成相同的分子为同种物质的分子,由同种原子构成的分子为单质的分子,由不同种原子构成的分子为化合物的分子,只有掌握这些才能顺利解题.
9.【答案】C
【解析】【解答】A、由微粒的构成可知,该反应前后一共涉及3种分子,故A不符合题意;
B、由微粒的变化可知,该反应前后各种原子的种类没有变化,故B不符合题意;
C、通过化学反应的微观模拟示意图,不能反映反应发生的情况,故C符合题意;
D、由微粒的构成可知,该反应是由两种物质生成一种物质,属于化合反应,故D不符合题意。
故答案为:C。
【分析】根据微观示意图写出表达式进行分析
10.【答案】C
【解析】【解答】根据如图所示:反应甲→乙+丙的微观模拟示意图,图中“●”,“o”表示不同的原子,丙为呼吸作用产物之一,则丙为水,图中“●”,“o”分别表示氧原子和氢原子;该反应的化学方程式可表示为2H2O2=2H2O+O2↑;
A、甲表示的物质为H2O2,化合物,A不符合题意;
B、乙物质为氧气,其微观构成为两个原子构成一个分子,B不符合题意;
C、该反应的化学方程式可表示为2H2O2=2H2O+O2↑,C符合题意;
D、“●”原子所对应的元素为氧元素,反应前后由﹣1价变为0价和﹣2价,D不符合题意;
故答案为:C。
【分析】有关微观模拟图的题目在解答时,要根据反应前后各微粒的构成确定反应物和生成物,或写出反应方程式,或直接判断参加反应和生成的微粒的个数,要注意反应后有反应物剩余的微观图,不能误以为反应后物质都是生成物。
11.【答案】B
【解析】【解答】A、起点:从图上看,当反应时间为0的时候,纵坐标(生成氧气的质量)已有一定的量,而事实上当反应时间为0的时候,产生氧气的质量也是0,故单从起点看,不符合题意;
B、起点:当反就时间为0的时候,纵坐标(溶液中水的质量)已有一定的量,而事实上也确实如此,反应还没开始的时候,过氧化氢溶液中就已有一定量的水存在,从起点看,满足要求;拐点:所谓拐点是指线条突然发生变化的点。结合变化趋势分析如下:随着反应的进行,生成水的量越来越多,图上表现为直线向上变化,但当反应进行到完成时,水的量就突然不再增多,而是保持原有的水的质量不变,图上表现为直线平行与横座标,从直线向上变化到直线平等与横座标,必然存在一个拐点,符合题意;
C、从起点看,该图不符合,因为反应时间为0的时候,残留固体中二氧化锰的质量也应该是0,不符合题意;
D、双氧水制取氧气时,二氧化锰作为催化剂来使用的,其质量并不发生改变,图上应体现为是从左到右的一条平行于横座标的直线,且起点不在直角坐标系的原点上,因为反应时间为0的时候,二氧化锰就已有一定的质量了,不符合题意。
故答案为:B。
【分析】识图要从横坐标和纵坐标的理解开始。理解坐标图中纵、横坐标的关系,再结合所学知识,联系相应的知识点,理解图像意义。在此基础上“明点”,曲线中的特殊点(起点、终点、顶点、转折点、交点等)表示什么化学意义。然后再具体分析曲线的走向、变化趋势。最后揭示出各段曲线所包含的含义。
12.【答案】D
【解析】【解答】由微观示意图可知:氢气与二氧化碳在纳米纤维、催化剂的条件下反应生成甲醇和水,该反应的化学方程式: ;
A. 由化学方程式 可知:反应前后分子的数目减少,故不符合题意;
B. 参加反应的甲、乙质量之比= ,故不符合题意;
C. 由两种元素组成且一种元素是氧元素的化合物叫做氧化物,二氧化碳和水都属于氧化物,故不符合题意;
D. 依据质量守恒定律:化学反应前后元素的质量不变,该反应前后C、H、O元素的质量都不变,故符合题意;
故答案为:D。
【分析】首先要对模型图进行观察,分析物质的微观构成、物质的类别,再找出物质之间的微粒数目关系,写出反应的方程式,然后再对题中各问加以分析解答。
13.【答案】(1)纯净物
(2)烹饪
(3)abc
(4)H2O
(5)工作时间在1~2小时,降低甲醛的浓度效果显著
【解析】【解答】(1) 甲醛(CH2O)属于纯净物;
(2)由表格可知,一氧化碳的污染源是烹饪;
(3)a.人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味,说明甲醛易挥发,故正确;
b.硅藻泥功能与活性炭相似,过吸附污染物净化了空气,故正确;
c. 吸收、转化、降低室内污染物的浓度都可以改善室内空气质量,正确;
故答案为:abc
(4)水的化学式为H2O。
(5) 由图二曲线可以看出:工作时间在1~2小时,降低甲醛的浓度效果显著。
【分析】(1) 甲醛是由一种物质组成的,属于纯净物。
(2)根据题目中表格可知,一氧化碳的污染源是烹饪;。
(3)根据题目中的文字叙述,进行分析。
(4)根据质量守恒定律,反应前后原子的种类和个数不变,推导出水的化学式。
(5)根据图二曲线中给出的消息,进行分析。
14.【答案】(1)氧化汞;AB
(2);偏大;红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大
(3)Pb;
【解析】【解答】(1)根据化学式的读法,可知HgO的物质名称为氧化汞;
A、通过实验前后曲颈甑和玻璃钟罩内的气体体积对比,才能计算出消耗氧气的体积,故正确;
B、实验前后气体的温度和压强不同,会导致进入玻璃钟罩内汞的体积不同,故正确;
C、汞槽的容积对测量氧气的含量没有影响,故不正确。
故答案为:AB。
(2)红磷和氧气在点燃的条件下反应,生成五氧化二磷,其反应的化学方程式为:;
如果没有弹簧夹,实验结果会偏大;因为如果没有弹簧夹,红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大;
故答案为:;偏大;红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大;
(3)根据反应前后原子的种类和数目不变,反应前的原子的种类为:O、H,原子个数依次为:4、4;反应后的原子种类有:Pb、O、H,原子个数依次为:2、4、4;所以反应前有2个Pb原子,由于X的化学计量系数是2 ,所以X中只含有1个Pb,其化学式为:Pb;
由于集气瓶内氧气约占空气的体积分数为21%,随着反应的进行氧气被消耗,当氧气的体积分数降到一定程度时,不再反应,当温度降至室温后,导管中氧气会进入集气瓶,使氧气的体积分数增大,所以实验时瓶内气体中,氧气的体积分数随时间变化的趋势图为:
【分析】(1)化合物化学式的读法:从右往左读做“某化某”或“某酸某”。
根据通过实验前后曲颈甑和玻璃钟罩内的气体体积对比,才能计算出消耗氧气的体积分析。
(2)红磷和氧气在点燃的条件下反应,生成五氧化二磷。
如果没有弹簧夹,实验结果会偏大;因为如果没有弹簧夹,红磷燃烧放热,使部分气体受热膨胀逸出,导致进入瓶内水量增多,导致测量结果偏大。
(3)根据质量守恒定律,反应前后原子的种类和数目不变分析。
15.【答案】(1)得到
(2)34;最外层电子数;Se2-
(3)4NH3+6NO
5N2+6H2O
【解析】【解答】(1)氧原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的氧离子;(2)据图可知:A、硒原子的核电荷数为34;
B、元素的化学性质跟它的原子的最外层电子数目关系非常密切,决定元素化学性质的是最外层电子数,硒元素与氧、硫元素的化学性质相似的原因是它们原子的最外层的电子数相同;
C、硒原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成硒离子,其离子符号为:Se2-;(3)由反应的微观示意图可知,反应物是氨气与一氧化氮,生成物是氮气和水,所以反应的化学方程式为:4NH3+6NO
5N2+6H2O。
故答案为:(1)得到(2)34;最外层电子数;Se2-(3)4NH3+6NO 5N2+6H2O。
【分析】(1)一般情况下,原子最外层电子数大于4得电子,小于4失电子
(2)根据原子结构示意图圈内的数为核电荷数,元素的化学性质决定于最外层电子数,
硒原子的最外层为6,得到两个电子带两个单位负电荷
(3)根据围观结构可知,题中为氨气和氧气在催化剂的作用下生成氮气和水
16.【答案】(1)解:设现有710g超氧化钾,可产生氧气的质量为x。
x=240g
答:现有710g超氧化钾,可产生氧气的质量为240g。
(2)30
【解析】【解答】(2) 每分钟消耗8g氧气,以上产生的氧气质量为240g,可提供的防护时间为。
【分析】(1)根据反应的超氧化钾质量及方程式中物质间质量关系计算生成氧气质量分析;
(2)由生成氧气质量及每分钟消耗氧气质量计算防护时间分析。
1 / 1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
