2.2.2 炔烃 导学案 (无答案)高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 2.2.2 炔烃 导学案 (无答案)高二化学人教版(2019)选择性必修3 | 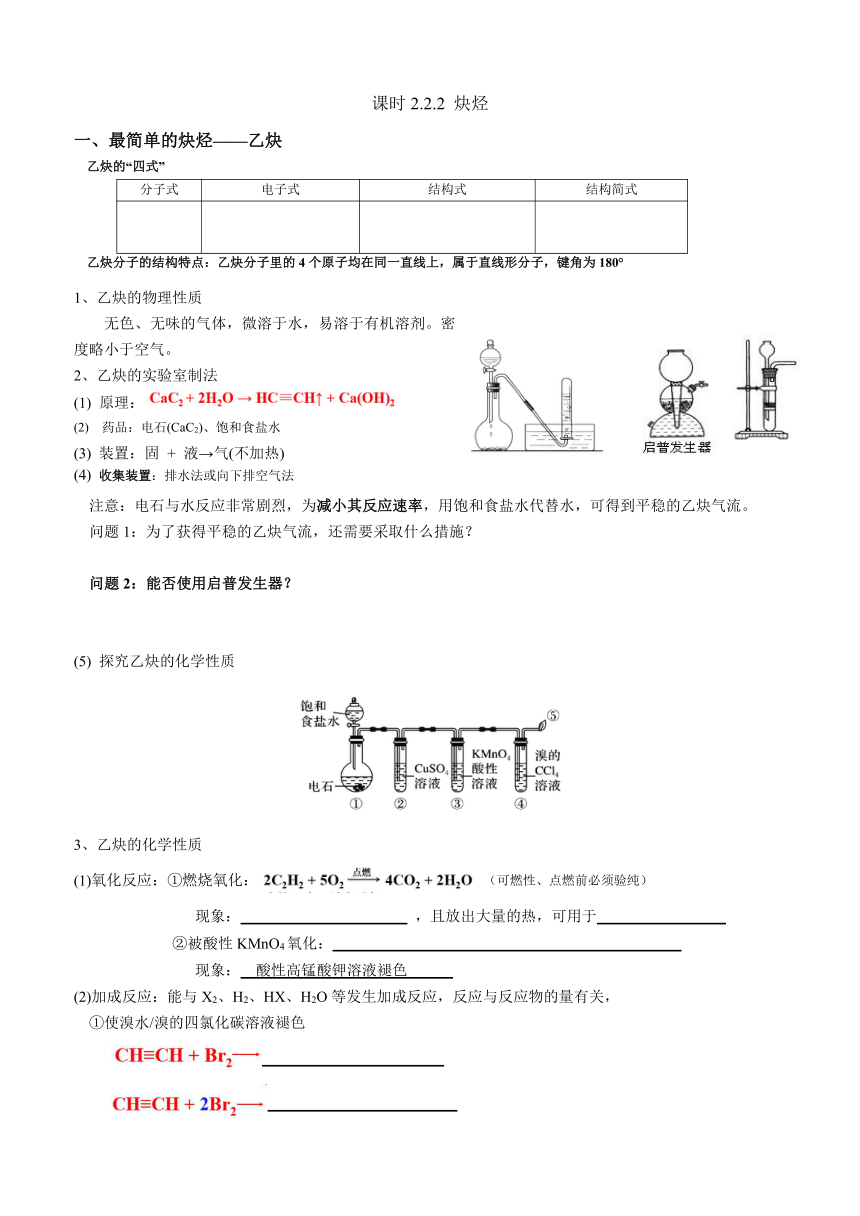 | |
| 格式 | docx | ||
| 文件大小 | 312.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 00:08:15 | ||
图片预览


文档简介
课时2.2.2 炔烃
一、最简单的炔烃——乙炔
乙炔的“四式”
分子式 电子式 结构式 结构简式
乙炔分子的结构特点:乙炔分子里的4个原子均在同一直线上,属于直线形分子,键角为180°
1、乙炔的物理性质
无色、无味的气体,微溶于水,易溶于有机溶剂。密度略小于空气。
2、乙炔的实验室制法
(1) 原理:
(2) 药品:电石(CaC2)、饱和食盐水
(3) 装置:固 + 液→气(不加热)
(4) 收集装置:排水法或向下排空气法
注意:电石与水反应非常剧烈,为减小其反应速率,用饱和食盐水代替水,可得到平稳的乙炔气流。
问题1:为了获得平稳的乙炔气流,还需要采取什么措施?
问题2:能否使用启普发生器?
(5) 探究乙炔的化学性质
3、乙炔的化学性质
(1)氧化反应:①燃烧氧化:(可燃性、点燃前必须验纯)
现象: ,且放出大量的热,可用于
②被酸性KMnO4氧化:
现象: 酸性高锰酸钾溶液褪色
(2)加成反应:能与X2、H2、HX、H2O等发生加成反应,反应与反应物的量有关,
①使溴水/溴的四氯化碳溶液褪色
②催化加氢
(少量氢气)
(足量氢气)
③与HX、H2O、HCN等反应
(3)加聚反应
聚乙炔:制 导电高分子材料
判断下列聚合物的单体
练习1、鉴别甲烷、乙烯、乙炔的简单方法( )
A.通入溴水中,观察溴水是否褪色 B.通入酸性高锰酸钾溶液中,观察颜色变化
C.点燃,检验燃烧产物 D.点燃,观察火焰明亮程度及产生黑烟量的多少
练习2、能证明乙炔分子含有碳碳三键的是( )
A.乙炔能使溴水褪色 B.乙炔能使酸性KMnO4溶液褪色
C.乙炔可以和HCl气体加成 D.1mol乙炔可以和2mol氢气发生加成反应
练习3.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
练习4、如图中的实验装置可制取乙炔,回答下列问题。
(1)图中A管的作用是:
。
(2)制取乙炔的化学反应方程式是:
。
(3)乙炔通入溴的四氯化碳溶液中观察到的现象是:
。
(4)乙炔为原料制取聚氯乙烯的化学方程式: 、
。
二、炔烃
1、概念:分子中含有碳碳三键的烃,属于不饱和烃。
2、官能团:
3、链状单炔烃的通式:
4、结构特点:
①分子里含有碳碳三键,除乙炔外,碳原子杂化方式为sp、sp3;
②以碳碳三键为中心的4个原子(2+2)位于同一直线上。
5、炔烃的物理性质——递变规律与烷烃和烯烃相似
(1)状态:一般情况下,1~4个碳原子炔烃(烃)为气态,5~16个碳原子为液态,16个碳原子以上为固态
(2)溶解性:炔烃不溶于水,易溶于有机溶剂
(3)熔沸点:随着碳原子数增多,熔沸点增高;分子式相同的炔烃,支链越多,熔沸点越低
(4)密度:随着碳原子数的递增,密度逐渐增加;炔烃的相对密度都小于水的密度
6、炔烃的化学性质---与乙炔相似
炔烃和烯烃分子中都含有不饱和烃(三键、双键),因而炔烃与烯烃的化学性质相似,也能发生加成反应、氧化反应和聚合反应,但比乙烯的要困难些。
(1)炔烃的氧化反应
①燃烧:
②炔烃能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液紫色褪去
(2)加成反应:(与H2、X2、HX、H2O)
(3)加聚反应
练习:以丙炔为例,写出其下列反应方程式。
(1) 燃烧:
⑵ 与溴加成:
⑶ 加聚反应:
练习1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
练习2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
练习3.某炔烃与氢气发生加成反应后得到下图结构,则该炔烃的结构有( )
A.1种 B.2种
C. 3种 D.4种
练习4、0.5mol某气态烃能与1mol HCl完全加成,加成产物又最多可与4mol Cl2发生取代反应,则气态烃可能是( )
A. CH2=CH CH3 B. CH≡CH
C. CH2=CH CH=CH2 D. CH≡C CH2CH3
三、乙烷、乙烯、乙炔分子结构和化学性质比较
乙烷 乙烯 乙炔
化学 式 C2H6 C2H4 C2H2
电 子 式
结 构 式
结 构 特 点 C—C(单键) 碳原子的化合达“饱和” C = C(双键) 碳原子的化合价未达“饱和” (叁键) 碳原子的化合价未达“饱和”
化 学 活 动 性 稳 定 活 泼 较 活 泼
化 学 性 质 取 代 反 应 卤代 —— ——
燃 烧 火焰不明亮 火焰明亮,带黑烟 火焰明亮,带浓黑烟
氧 化 反 应 KMnO4溶液不褪色 KMnO4溶液褪色 KMnO4溶液褪色
加 成 反 应 —— 溴水褪色 溴水褪色
聚 合 反 应 —— 能 聚 合 能 聚 合
鉴 别 KMnO4溶液不褪色或溴水不褪色 KMnO4溶液褪色或溴水褪色 KMnO4溶液褪色或溴水褪色
一、最简单的炔烃——乙炔
乙炔的“四式”
分子式 电子式 结构式 结构简式
乙炔分子的结构特点:乙炔分子里的4个原子均在同一直线上,属于直线形分子,键角为180°
1、乙炔的物理性质
无色、无味的气体,微溶于水,易溶于有机溶剂。密度略小于空气。
2、乙炔的实验室制法
(1) 原理:
(2) 药品:电石(CaC2)、饱和食盐水
(3) 装置:固 + 液→气(不加热)
(4) 收集装置:排水法或向下排空气法
注意:电石与水反应非常剧烈,为减小其反应速率,用饱和食盐水代替水,可得到平稳的乙炔气流。
问题1:为了获得平稳的乙炔气流,还需要采取什么措施?
问题2:能否使用启普发生器?
(5) 探究乙炔的化学性质
3、乙炔的化学性质
(1)氧化反应:①燃烧氧化:(可燃性、点燃前必须验纯)
现象: ,且放出大量的热,可用于
②被酸性KMnO4氧化:
现象: 酸性高锰酸钾溶液褪色
(2)加成反应:能与X2、H2、HX、H2O等发生加成反应,反应与反应物的量有关,
①使溴水/溴的四氯化碳溶液褪色
②催化加氢
(少量氢气)
(足量氢气)
③与HX、H2O、HCN等反应
(3)加聚反应
聚乙炔:制 导电高分子材料
判断下列聚合物的单体
练习1、鉴别甲烷、乙烯、乙炔的简单方法( )
A.通入溴水中,观察溴水是否褪色 B.通入酸性高锰酸钾溶液中,观察颜色变化
C.点燃,检验燃烧产物 D.点燃,观察火焰明亮程度及产生黑烟量的多少
练习2、能证明乙炔分子含有碳碳三键的是( )
A.乙炔能使溴水褪色 B.乙炔能使酸性KMnO4溶液褪色
C.乙炔可以和HCl气体加成 D.1mol乙炔可以和2mol氢气发生加成反应
练习3.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
练习4、如图中的实验装置可制取乙炔,回答下列问题。
(1)图中A管的作用是:
。
(2)制取乙炔的化学反应方程式是:
。
(3)乙炔通入溴的四氯化碳溶液中观察到的现象是:
。
(4)乙炔为原料制取聚氯乙烯的化学方程式: 、
。
二、炔烃
1、概念:分子中含有碳碳三键的烃,属于不饱和烃。
2、官能团:
3、链状单炔烃的通式:
4、结构特点:
①分子里含有碳碳三键,除乙炔外,碳原子杂化方式为sp、sp3;
②以碳碳三键为中心的4个原子(2+2)位于同一直线上。
5、炔烃的物理性质——递变规律与烷烃和烯烃相似
(1)状态:一般情况下,1~4个碳原子炔烃(烃)为气态,5~16个碳原子为液态,16个碳原子以上为固态
(2)溶解性:炔烃不溶于水,易溶于有机溶剂
(3)熔沸点:随着碳原子数增多,熔沸点增高;分子式相同的炔烃,支链越多,熔沸点越低
(4)密度:随着碳原子数的递增,密度逐渐增加;炔烃的相对密度都小于水的密度
6、炔烃的化学性质---与乙炔相似
炔烃和烯烃分子中都含有不饱和烃(三键、双键),因而炔烃与烯烃的化学性质相似,也能发生加成反应、氧化反应和聚合反应,但比乙烯的要困难些。
(1)炔烃的氧化反应
①燃烧:
②炔烃能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液紫色褪去
(2)加成反应:(与H2、X2、HX、H2O)
(3)加聚反应
练习:以丙炔为例,写出其下列反应方程式。
(1) 燃烧:
⑵ 与溴加成:
⑶ 加聚反应:
练习1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
练习2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
练习3.某炔烃与氢气发生加成反应后得到下图结构,则该炔烃的结构有( )
A.1种 B.2种
C. 3种 D.4种
练习4、0.5mol某气态烃能与1mol HCl完全加成,加成产物又最多可与4mol Cl2发生取代反应,则气态烃可能是( )
A. CH2=CH CH3 B. CH≡CH
C. CH2=CH CH=CH2 D. CH≡C CH2CH3
三、乙烷、乙烯、乙炔分子结构和化学性质比较
乙烷 乙烯 乙炔
化学 式 C2H6 C2H4 C2H2
电 子 式
结 构 式
结 构 特 点 C—C(单键) 碳原子的化合达“饱和” C = C(双键) 碳原子的化合价未达“饱和” (叁键) 碳原子的化合价未达“饱和”
化 学 活 动 性 稳 定 活 泼 较 活 泼
化 学 性 质 取 代 反 应 卤代 —— ——
燃 烧 火焰不明亮 火焰明亮,带黑烟 火焰明亮,带浓黑烟
氧 化 反 应 KMnO4溶液不褪色 KMnO4溶液褪色 KMnO4溶液褪色
加 成 反 应 —— 溴水褪色 溴水褪色
聚 合 反 应 —— 能 聚 合 能 聚 合
鉴 别 KMnO4溶液不褪色或溴水不褪色 KMnO4溶液褪色或溴水褪色 KMnO4溶液褪色或溴水褪色
