化学人教版(2019)必修第二册5.2.3硝酸(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.3硝酸(共19张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-12 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第二节 氮及其化合物
硝酸
第五章 化工生产中的
重要非金属元素
导入
运输浓硝酸的铝槽车泄露:2023年2月14日,美国亚利桑那州图森市高速公路一卡车侧翻,引发危险物质硝酸泄漏,产生大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以防止其扩散造成更大危害。
思考1.为什么可以用纯碱处理泄漏出来的硝酸?思考2:为什么现场有大量红棕色的烟雾?思考3:为什么可以用铝槽车运输浓硝酸?
一、硝酸
1、物理性质
状态:
气味:
无色
刺激性气味,易挥发
颜色:
液态
溶解性:
与水任意比互溶
常用的浓硝酸质量分数为69%
质量分数98%以上的为发烟硝酸
为什么久置浓硝酸呈黄色?
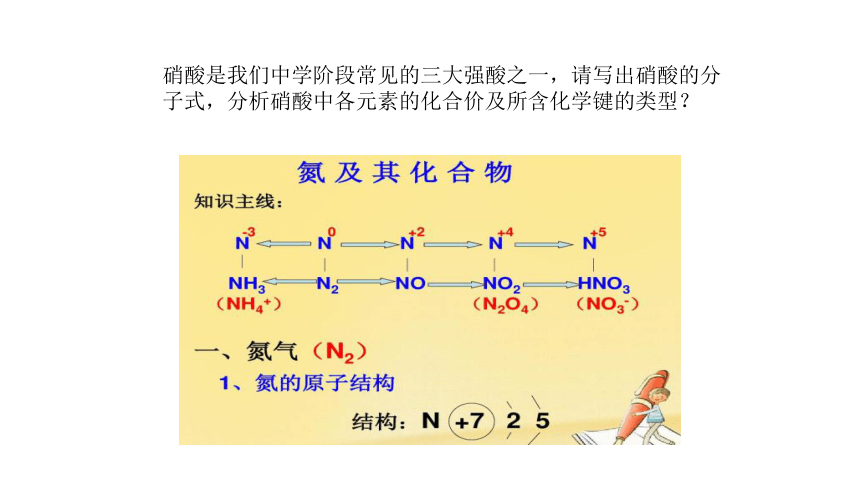
硝酸是我们中学阶段常见的三大强酸之一,请写出硝酸的分子式,分析硝酸中各元素的化合价及所含化学键的类型?
1) 不稳定性
2、化学性质
硝酸越浓,越易分解产生NO2,
NO2溶于硝酸而使硝酸呈现黄色。
一、硝酸
见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
贮存:一般将浓硝酸保存在棕色试剂瓶中,并放置于阴凉处。
2、化学性质
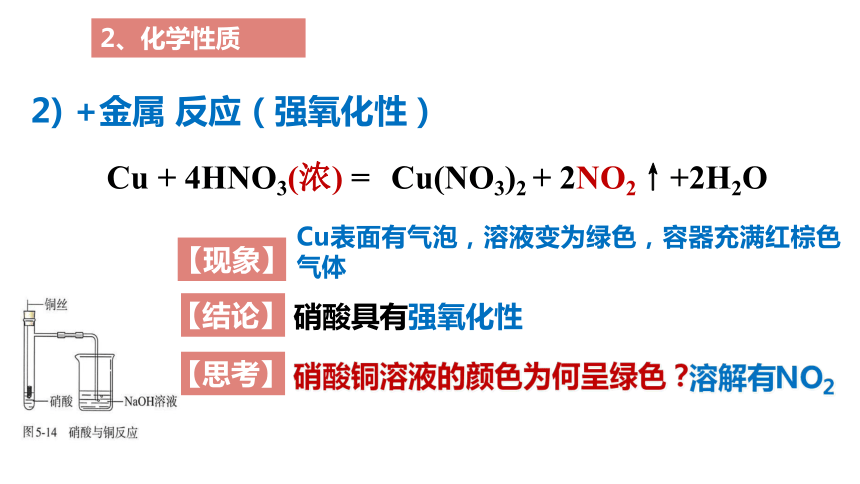
2) +金属 反应(强氧化性)
Cu + 4HNO3(浓) =
Cu(NO3)2 + 2NO2↑+2H2O
硝酸铜溶液的颜色为何呈绿色?
【思考】
Cu表面有气泡,溶液变为绿色,容器充满红棕色气体
硝酸具有强氧化性
【现象】
【结论】
溶解有NO2
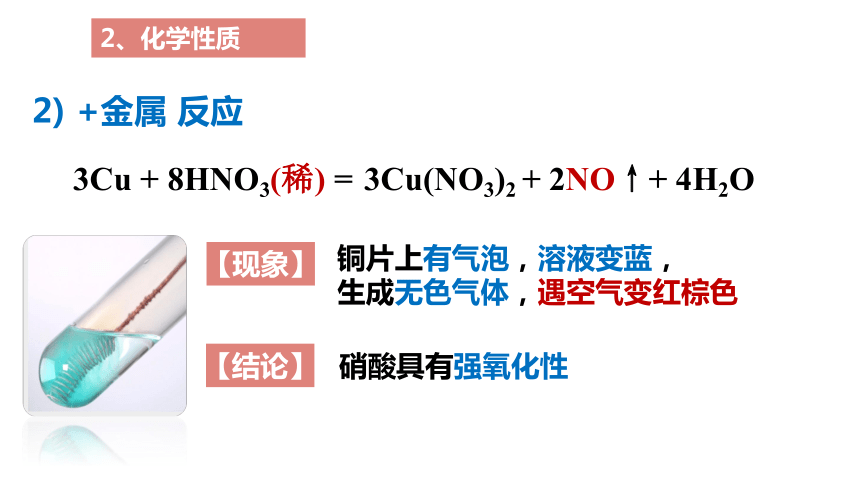
2、化学性质
2) +金属 反应
3Cu + 8HNO3(稀) =
3Cu(NO3)2 + 2NO↑+ 4H2O
【现象】
【结论】
铜片上有气泡,溶液变蓝,
生成无色气体,遇空气变红棕色
硝酸具有强氧化性
2、化学性质
2) +金属 反应
硝酸能与大部分金属反应(除了铂、金)
【规律】
Pt、Au不与硝酸反应,但能与王水反应
V 浓硝酸:V 浓盐酸 =
【王水】
1:3
硝酸与较活泼金属( Fe、Al )
怎样反应呢
(1). 常温下,稀硝酸与较活泼金属 ( Fe、Al ) 反应
Al + 4HNO3(稀) Al(NO3)3 + NO↑ + 2H2O
Fe + 4HNO3(稀) Fe(NO3)3 + NO↑ + 2H2O
(2). 常温下,浓硝酸能使较活泼金属 ( Fe、Al ) 钝化
冷的浓硝酸或浓硫酸使金属表面生成一层致密的氧化物薄膜,阻止内层金属被进一步腐蚀。当加热时,铁、铝会与浓硝酸或浓硫酸发生反应。
(3). 加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
(4). 加热下,浓硝酸与非金属 ( C、S ) 反应
S + 6HNO3(浓) H2SO4 + 6NO2↑ + 2H2O
C + 4HNO3(浓) CO2 + 2NO2↑ + 2H2O
注意:“Fe2+ + H+ + NO3-”不能大量共存
如将SO2通入Ba(NO3)2溶液中产生BaSO4沉淀
2、化学性质
3) + 非金属 反应
C + 4HNO3 (浓)=
C + 2H2SO4(浓)= CO2 ↑ +2SO2 ↑ +2H2O
类比
硝酸浓度越大,氧化性越强。
氧化性:浓HNO3 > 稀HNO3
CO2↑+ 4NO2 ↑+ 2H2O
同浓度条件下,浓硝酸氧化性比浓硫酸强
思考讨论
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以
及每一步反应中含氮物质发生的是氧化反应还是还原反应。
① N2 → NH3 :______________________________
② NH3 → NO :______________________________
③ NO → NO2 :______________________________
④ NO2 → HNO3 :______________________________
(1) 写出每一步反应的化学方程式。
N2 + 3H2 2NH3
催化剂
2NO + O2 2NO2
3NO2 + H2O = 2HNO3 + NO
催化剂
4NH3 + 5O2 4NO + 6H2O
3、用途
制造化肥、炸药、染料、塑料、硝酸盐、医药
治疗心绞痛
二、酸雨及其防治
①煤、石油、金属矿物质的燃烧和冶炼产生SO2
②汽车尾气、硝酸工业产生的NO2
1、污染源
氮氧化物NO2、SO2与水反应
pH<5.6
1)酸雨的pH:
2)酸雨的形成:
2、酸雨
正常雨水pH≈5.6
二、酸雨及其防治
3、危害
破坏农作物、森林,土壤酸化,腐蚀建筑等
二、酸雨及其防治
4、防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
氮的价-类二维图
第二节 氮及其化合物
硝酸
第五章 化工生产中的
重要非金属元素
导入
运输浓硝酸的铝槽车泄露:2023年2月14日,美国亚利桑那州图森市高速公路一卡车侧翻,引发危险物质硝酸泄漏,产生大量红棕色烟雾,现场可闻到刺鼻的气味。消防人员运来纯碱进行处理,以防止其扩散造成更大危害。
思考1.为什么可以用纯碱处理泄漏出来的硝酸?思考2:为什么现场有大量红棕色的烟雾?思考3:为什么可以用铝槽车运输浓硝酸?
一、硝酸
1、物理性质
状态:
气味:
无色
刺激性气味,易挥发
颜色:
液态
溶解性:
与水任意比互溶
常用的浓硝酸质量分数为69%
质量分数98%以上的为发烟硝酸
为什么久置浓硝酸呈黄色?
硝酸是我们中学阶段常见的三大强酸之一,请写出硝酸的分子式,分析硝酸中各元素的化合价及所含化学键的类型?
1) 不稳定性
2、化学性质
硝酸越浓,越易分解产生NO2,
NO2溶于硝酸而使硝酸呈现黄色。
一、硝酸
见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
贮存:一般将浓硝酸保存在棕色试剂瓶中,并放置于阴凉处。
2、化学性质
2) +金属 反应(强氧化性)
Cu + 4HNO3(浓) =
Cu(NO3)2 + 2NO2↑+2H2O
硝酸铜溶液的颜色为何呈绿色?
【思考】
Cu表面有气泡,溶液变为绿色,容器充满红棕色气体
硝酸具有强氧化性
【现象】
【结论】
溶解有NO2
2、化学性质
2) +金属 反应
3Cu + 8HNO3(稀) =
3Cu(NO3)2 + 2NO↑+ 4H2O
【现象】
【结论】
铜片上有气泡,溶液变蓝,
生成无色气体,遇空气变红棕色
硝酸具有强氧化性
2、化学性质
2) +金属 反应
硝酸能与大部分金属反应(除了铂、金)
【规律】
Pt、Au不与硝酸反应,但能与王水反应
V 浓硝酸:V 浓盐酸 =
【王水】
1:3
硝酸与较活泼金属( Fe、Al )
怎样反应呢
(1). 常温下,稀硝酸与较活泼金属 ( Fe、Al ) 反应
Al + 4HNO3(稀) Al(NO3)3 + NO↑ + 2H2O
Fe + 4HNO3(稀) Fe(NO3)3 + NO↑ + 2H2O
(2). 常温下,浓硝酸能使较活泼金属 ( Fe、Al ) 钝化
冷的浓硝酸或浓硫酸使金属表面生成一层致密的氧化物薄膜,阻止内层金属被进一步腐蚀。当加热时,铁、铝会与浓硝酸或浓硫酸发生反应。
(3). 加热下,浓硝酸与较活泼金属 ( Fe、Al ) 直接反应
Al + 6HNO3(浓) Al(NO3)3 + 3NO2↑ + 3H2O
Fe + 6HNO3(浓) Fe(NO3)3 + 3NO2↑ + 3H2O
(4). 加热下,浓硝酸与非金属 ( C、S ) 反应
S + 6HNO3(浓) H2SO4 + 6NO2↑ + 2H2O
C + 4HNO3(浓) CO2 + 2NO2↑ + 2H2O
注意:“Fe2+ + H+ + NO3-”不能大量共存
如将SO2通入Ba(NO3)2溶液中产生BaSO4沉淀
2、化学性质
3) + 非金属 反应
C + 4HNO3 (浓)=
C + 2H2SO4(浓)= CO2 ↑ +2SO2 ↑ +2H2O
类比
硝酸浓度越大,氧化性越强。
氧化性:浓HNO3 > 稀HNO3
CO2↑+ 4NO2 ↑+ 2H2O
同浓度条件下,浓硝酸氧化性比浓硫酸强
思考讨论
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以
及每一步反应中含氮物质发生的是氧化反应还是还原反应。
① N2 → NH3 :______________________________
② NH3 → NO :______________________________
③ NO → NO2 :______________________________
④ NO2 → HNO3 :______________________________
(1) 写出每一步反应的化学方程式。
N2 + 3H2 2NH3
催化剂
2NO + O2 2NO2
3NO2 + H2O = 2HNO3 + NO
催化剂
4NH3 + 5O2 4NO + 6H2O
3、用途
制造化肥、炸药、染料、塑料、硝酸盐、医药
治疗心绞痛
二、酸雨及其防治
①煤、石油、金属矿物质的燃烧和冶炼产生SO2
②汽车尾气、硝酸工业产生的NO2
1、污染源
氮氧化物NO2、SO2与水反应
pH<5.6
1)酸雨的pH:
2)酸雨的形成:
2、酸雨
正常雨水pH≈5.6
二、酸雨及其防治
3、危害
破坏农作物、森林,土壤酸化,腐蚀建筑等
二、酸雨及其防治
4、防治
(1) 调整能源结构,积极开发新能源
(2) 对煤进行处理,如选洗加工、综合开发、在
煤中加入适量的生石灰、对排放的烟进行处理等
(3) 改进汽车尾气的处理技术,控制尾气排放
(4) 加强工厂废气的回收处理,充分利用原料
(5) 种植能够吸收 SO2 的有关树木
氮的价-类二维图
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
