6.1奇光异彩的金属同步练习(含答案)沪教版(上海)化学九年级第二学期
文档属性
| 名称 | 6.1奇光异彩的金属同步练习(含答案)沪教版(上海)化学九年级第二学期 |
|
|
| 格式 | docx | ||
| 文件大小 | 401.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 00:00:00 | ||
图片预览




文档简介
6.1奇光异彩的金属 同步练习
一、多选题
1.下列实验方案不合理的是
选项 实验目的 实验方案
A 除去CO中的CO2 将气体通过灼热的CuO
B 检验木炭粉中是否含有铁粉 取样,用磁铁吸引样品
C 除去FeCl2溶液中的CuCl2 加入足量锌粉,过滤
D 鉴别氮气和氧气 伸入带火星的木条,观察
A.A B.B C.C D.D
2.下图表示某个化学反应,据图分析判断,下列各项中,正确的是
A.该反应属于置换反应 B.图示中x的数值为2
C.反应前后氧元素的化合价不变 D.生成物丙和丁的质量比为11:9
3.下列实验操作不能达到实验目的的是
选项 实验目的 实验操作
A 除去FeSO4溶液中的CuSO4 加入过量的锌粉,过滤
B 除去CO2中少量的CO 将混合气体在氧气中点燃
C 鉴别NH4NO3固体和NaOH固体 分别取少量固体,加入少量的水,测溶液温度
D 鉴别H2O和H2O2二种无色液体 分别取少量液体于试管中,加入MnO2
A.A B.B C.C D.D
4.下列对一些事实解释正确的是( )
A.墙内开花墙外香,是因为分子在不断运动
B.用洗涤剂除去油污,是因为洗涤剂能将油污溶解形成溶液
C.把铅加入锡中制成合金焊锡,结果是升高了熔点
D.老年人适量补钙,可以预防骨质疏松
5.汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用图表示。下列有关说法正确的是( )
A.反应Ⅰ中的反应物分子有三种
B.反应Ⅱ属于置换反应
C.反应Ⅱ中参加反应的二氧化氮与一氧化碳的分子个数比为1:2
D.此净化装置可以消除一氧化碳、一氧化氮、二氧化氮对空气的污染
二、选择题
6.下列鉴别物质的两种方法都不正确的是
待鉴别物质 鉴别方法1 鉴别方法2
A 氧气,二氧化碳 用燃着的木条 通入NaOH溶液
B 黄铜,黄金 加入硝酸银溶液 比较硬度
C 铝粉,银粉 观察颜色 加入稀盐酸
D 氢气,一氧化碳 点燃,观察火焰颜色 在加热状态下,观察是否能还原氧化铜
A.A B.B C.C D.D
7.“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金 B.钢的含碳量比生铁高
C.钢铁是应用最广泛的合金 D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
8.凡是有元素化合价发生变化的化学反应都属于氧化还原反应,在氧化还原反应中,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂,下列不属于氧化还原反应的是:①4P+5O22P2O5 ②CO2+H2O=H2CO3 ③2CO+O22CO2 ④Cu(OH)2CuO+H2O ⑤2CuO+C2Cu+CO2↑ ⑥HCl+NaOH=H2O+NaCl
A.①②⑥ B.①③⑤ C.②④⑥ D.③④⑤
9.某工厂的废液中含有FeCl2、MgCl2、CuCl2,向其中加入一定量的锌粉,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列分析正确的是( )
A.滤渣中一定有Cu、Zn,可能有Fe,滤液中一定有MgCl2、ZnCl2
B.滤渣中一定有Cu、Fe,滤液中一定有MgCl2、ZnCl2
C.滤渣中一定有Cu、Fe、Zn,滤液中可能有FeCl2
D.滤渣中一定有Cu、Fe,可能有Zn,滤液中可能有CuCl2
10.以下归纳和总结完全正确的一组是
A.对鉴别方法的认识 B.对安全的认识
①区分NaCl、NaOH、NH4NO3三种固体,用水即可 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 ①点燃可燃性气体前一定要验纯 ②煤矿矿井要保持通风、严禁烟火 ③海鲜食品喷洒甲醛溶液防腐
C.对现象的认识 D.对防锈的认识
①气体压缩,气体分子之间的间隔变小 ②活性炭除去异味,活性炭具有吸附性 ③喝汽水打嗝,气体溶解度随温度升高而增大 ①自行车的支架喷油漆防锈 ②菜刀用后及时洗净擦干 ③保留铁锈可防止铁进一步锈蚀
A.A B.B C.C D.D
11.下列实验方法不能达到实验目的的是
选项 实验目的 实验方法
A 除去CuO中少量的Cu 在氧气流中加热
B 除去CO(O2) 通过灼热的铜
C 鉴别浓盐酸和蒸馏水 打开瓶塞,观察是否产生白雾
D 鉴别KCl和KClO3 分别与MnO2混合加热,检验是否产生O2
A.A B.B C.C D.D
12.某化学反应的微观示意图如下,下列叙述不正确的是
A.生成物是C2H4和H2O B.化学反应的实质是原子的重新组合
C.该反应属于置换反应 D.参加反应的CO2和H2分子个数比为1∶3
13.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,正确的是
物 质 X Y Z W
反应前的质量(g) 20 m 16 14
反应后的质量(g) 4 6 60 50
A.m的数值为64
B.W为反应的催化剂
C.若X为化合物,Y为单质,则该反应一定为置换反应
D.参加反应的X与Y的质量比为1︰4
14.下列说法正确的是
A.铁质菜刀用过后需及时洗净擦干以减缓或防止锈蚀
B.铁在空气中剧烈燃烧,火星四射,生成黑色固体
C.化合物至少由两种元素组成,所以由至少两种元素组成的物质一定是化合物
D.化学反应前后分子总数一定不变
15.“天为棋盘星作子,中国北斗耀太空”,铷原子钟被称为北斗卫星的“心脏”。铷元素在元素周期表中的部分信息如图所示,下列叙述不正确的是
A.铷单质不具有导电性 B.铷元素属于金属元素
C.铷原子核外有37个电子 D.铷的相对原子质量为85.47
三、综合应用题
16.防止金属腐蚀,特别是钢铁的锈蚀是世界科学家研究和技术领域中的重大问题。
(1)铁生锈的条件为与 同时接触,铁锈成分复杂,主要成分为氧化铁(Fe2O3) 物质可加速铁的锈蚀。用盐酸除去铁锈的化学方程式为 ,为了防止铁制品生锈,应采取的措施是 (写出一种)。
(2)【查阅资料】小明同学发现铁生锈是铁与空气中的物质发生的一系列复杂的化学反应,生成氢氧化亚铁【Fe(OH)2】,后再在空气中被氧化为氢氧化铁【Fe(OH)3】,Fe(OH)3不稳定,在阳光照射下发生缓慢的分解反应生成氧化铁(Fe2O3),铁锈的化学式可简单表示为Fe2O3 nH2O。
【提出问题】铁锈(Fe2O3 nH2O)中的n的值等于多少呢?
【问题探究】小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3 nH2O)的组成,称取27.0g这种铁粉样品,按如图所示装置进行实验。
①为了保证实验安全,实验开始时应先 ,防止 。
②A中的现象是 ,B中浓硫酸的作用是 。D中碱石灰的作用是
③请指出该装置中有一处明显不足 。
17.南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚。
(1)体育馆内照明的导线大多数是铜导线,用铜做导线是利用金属铜的 性和导电性。
(2)体育馆雄伟壮观的主体建筑使用了大量的金属铝板,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是 。
(3)砳砳(lèlè)是2014年南京青奥会吉祥物,其外材料为纯羊毛,内充PET纤维。PET纤维属于 (选填“天然纤维”、“合成纤维”)。
(4)小彭同学想对家中一只10g手镯(银锌合金)中银的含量进行探究。在老师的指导下:他将该手镯放在烧杯中,用足量的稀硫酸分多次加入并与手镯充分反应,实验结果如图所示。
①如果小彭同学用所得的纯银制作一枚戒指,其质量不会超过 克。
②试计算所用稀硫酸的溶质质量分数。(请在答卷纸上写出计算过程)
18.合金在工农业生产和生活中应用广泛。某化学兴趣小组以“合金的探究之旅”为主题开展项目式学习。
活动一:了解合金的有关知识
(1)国产大型客机C919机身部分采用了新型的铝锂合金,铝元素与锂元素的本质区别是_______。
A.相对原子质量不同 B.质子数不同 C.电子数不同 D.中子数不同
(2)《吕氏春秋》记载“金柔锡柔,合两柔则刚(即坚硬)”(注:金指铜单质,锡指锡单质)。这句话说明铜锡合金具有的特性是_________(填字母)。
A.合金的熔点一般比其组分低
B.合金的硬度一般比其组分大
C.合金的抗腐蚀性一般比其组分强
(3)2019年12月,我国首艘国产航母山东舰正式入列。
①建航母用到了钛合金,钛合金属于 (填“金属”或“非金属”)材料。
②航母外壳用涂料覆盖,是为了防止钢铁与 (填化学式)接触锈蚀,而金属铝在空气中更耐腐蚀的原因是 (用化学方程式表示)。
③航母上官兵烧水用的电热水壶电源插头是铜质的,这主要是利用铜的 性。
活动二:探究合金中金属活动性
(4)为探究校运动会奖牌中所含锌、铁、铜金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是_______(填字母)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.溶液中加入足量铁粉后,再加入溶液
C.溶液中加入足量铜粉后,再加入铁粉
活动三:测定合金中组分的含量
(5)取某生铁合金样品放入烧杯中,分两次加入相同质量的稀盐酸(该实验条件下其它成分不参与反应),充分反应。测定实验数据如下表:
加稀盐酸的次数 第一次 第二次
加稀盐酸的质量/g 40.0 40.0
生成气体的质量/g 0.2 0.14
①样品中铁的质量为 g。
②稀盐酸中溶质的质量分数为 (写出计算过程)。
参考答案:
1.AC
2.BD
3.AB
4.AD
5.CD
6.D
7.B
8.C
9.B
10.A
11.B
12.C
13.D
14.A
15.A
16. 水和氧气 酸、盐等 Fe2O3+6HCl═2FeCl3+3H2O 涂一层油漆 通入一会儿一氧化碳把玻璃管中的空气排尽 发生爆炸 红褐色固体变成黑色固体 吸收反应生成的水 防止空气中的水蒸气和二氧化碳进入C装置 没有处理尾气
17.(1)延展
(2)
(3)合成纤维
(4) 4.8 解:设所用稀硫酸的溶质质量分数为x
x=19.6%
答:所用稀硫酸的溶质质量分数为19.6%
18.(1)B
(2)B
(3) 金属 O2和H2O 4Al+3O2=2Al2O3 导电
(4)AB
(5) 9.52 设40g稀盐酸中溶质的质量为y,则
解得y=7.3g
则稀盐酸的溶质质量分数为
答:稀盐酸的溶质质量分数为18.25%。
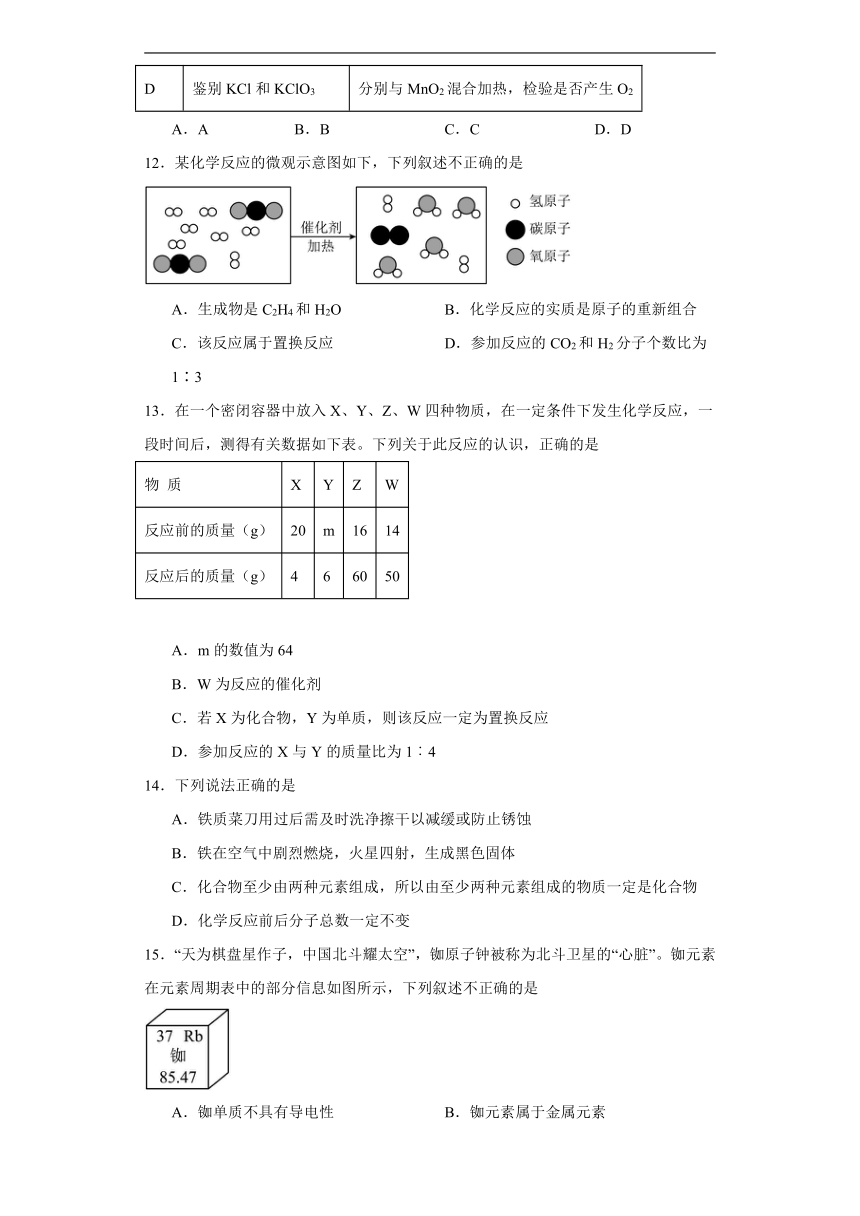
一、多选题
1.下列实验方案不合理的是
选项 实验目的 实验方案
A 除去CO中的CO2 将气体通过灼热的CuO
B 检验木炭粉中是否含有铁粉 取样,用磁铁吸引样品
C 除去FeCl2溶液中的CuCl2 加入足量锌粉,过滤
D 鉴别氮气和氧气 伸入带火星的木条,观察
A.A B.B C.C D.D
2.下图表示某个化学反应,据图分析判断,下列各项中,正确的是
A.该反应属于置换反应 B.图示中x的数值为2
C.反应前后氧元素的化合价不变 D.生成物丙和丁的质量比为11:9
3.下列实验操作不能达到实验目的的是
选项 实验目的 实验操作
A 除去FeSO4溶液中的CuSO4 加入过量的锌粉,过滤
B 除去CO2中少量的CO 将混合气体在氧气中点燃
C 鉴别NH4NO3固体和NaOH固体 分别取少量固体,加入少量的水,测溶液温度
D 鉴别H2O和H2O2二种无色液体 分别取少量液体于试管中,加入MnO2
A.A B.B C.C D.D
4.下列对一些事实解释正确的是( )
A.墙内开花墙外香,是因为分子在不断运动
B.用洗涤剂除去油污,是因为洗涤剂能将油污溶解形成溶液
C.把铅加入锡中制成合金焊锡,结果是升高了熔点
D.老年人适量补钙,可以预防骨质疏松
5.汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用图表示。下列有关说法正确的是( )
A.反应Ⅰ中的反应物分子有三种
B.反应Ⅱ属于置换反应
C.反应Ⅱ中参加反应的二氧化氮与一氧化碳的分子个数比为1:2
D.此净化装置可以消除一氧化碳、一氧化氮、二氧化氮对空气的污染
二、选择题
6.下列鉴别物质的两种方法都不正确的是
待鉴别物质 鉴别方法1 鉴别方法2
A 氧气,二氧化碳 用燃着的木条 通入NaOH溶液
B 黄铜,黄金 加入硝酸银溶液 比较硬度
C 铝粉,银粉 观察颜色 加入稀盐酸
D 氢气,一氧化碳 点燃,观察火焰颜色 在加热状态下,观察是否能还原氧化铜
A.A B.B C.C D.D
7.“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金 B.钢的含碳量比生铁高
C.钢铁是应用最广泛的合金 D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
8.凡是有元素化合价发生变化的化学反应都属于氧化还原反应,在氧化还原反应中,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂,下列不属于氧化还原反应的是:①4P+5O22P2O5 ②CO2+H2O=H2CO3 ③2CO+O22CO2 ④Cu(OH)2CuO+H2O ⑤2CuO+C2Cu+CO2↑ ⑥HCl+NaOH=H2O+NaCl
A.①②⑥ B.①③⑤ C.②④⑥ D.③④⑤
9.某工厂的废液中含有FeCl2、MgCl2、CuCl2,向其中加入一定量的锌粉,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,下列分析正确的是( )
A.滤渣中一定有Cu、Zn,可能有Fe,滤液中一定有MgCl2、ZnCl2
B.滤渣中一定有Cu、Fe,滤液中一定有MgCl2、ZnCl2
C.滤渣中一定有Cu、Fe、Zn,滤液中可能有FeCl2
D.滤渣中一定有Cu、Fe,可能有Zn,滤液中可能有CuCl2
10.以下归纳和总结完全正确的一组是
A.对鉴别方法的认识 B.对安全的认识
①区分NaCl、NaOH、NH4NO3三种固体,用水即可 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 ①点燃可燃性气体前一定要验纯 ②煤矿矿井要保持通风、严禁烟火 ③海鲜食品喷洒甲醛溶液防腐
C.对现象的认识 D.对防锈的认识
①气体压缩,气体分子之间的间隔变小 ②活性炭除去异味,活性炭具有吸附性 ③喝汽水打嗝,气体溶解度随温度升高而增大 ①自行车的支架喷油漆防锈 ②菜刀用后及时洗净擦干 ③保留铁锈可防止铁进一步锈蚀
A.A B.B C.C D.D
11.下列实验方法不能达到实验目的的是
选项 实验目的 实验方法
A 除去CuO中少量的Cu 在氧气流中加热
B 除去CO(O2) 通过灼热的铜
C 鉴别浓盐酸和蒸馏水 打开瓶塞,观察是否产生白雾
D 鉴别KCl和KClO3 分别与MnO2混合加热,检验是否产生O2
A.A B.B C.C D.D
12.某化学反应的微观示意图如下,下列叙述不正确的是
A.生成物是C2H4和H2O B.化学反应的实质是原子的重新组合
C.该反应属于置换反应 D.参加反应的CO2和H2分子个数比为1∶3
13.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,正确的是
物 质 X Y Z W
反应前的质量(g) 20 m 16 14
反应后的质量(g) 4 6 60 50
A.m的数值为64
B.W为反应的催化剂
C.若X为化合物,Y为单质,则该反应一定为置换反应
D.参加反应的X与Y的质量比为1︰4
14.下列说法正确的是
A.铁质菜刀用过后需及时洗净擦干以减缓或防止锈蚀
B.铁在空气中剧烈燃烧,火星四射,生成黑色固体
C.化合物至少由两种元素组成,所以由至少两种元素组成的物质一定是化合物
D.化学反应前后分子总数一定不变
15.“天为棋盘星作子,中国北斗耀太空”,铷原子钟被称为北斗卫星的“心脏”。铷元素在元素周期表中的部分信息如图所示,下列叙述不正确的是
A.铷单质不具有导电性 B.铷元素属于金属元素
C.铷原子核外有37个电子 D.铷的相对原子质量为85.47
三、综合应用题
16.防止金属腐蚀,特别是钢铁的锈蚀是世界科学家研究和技术领域中的重大问题。
(1)铁生锈的条件为与 同时接触,铁锈成分复杂,主要成分为氧化铁(Fe2O3) 物质可加速铁的锈蚀。用盐酸除去铁锈的化学方程式为 ,为了防止铁制品生锈,应采取的措施是 (写出一种)。
(2)【查阅资料】小明同学发现铁生锈是铁与空气中的物质发生的一系列复杂的化学反应,生成氢氧化亚铁【Fe(OH)2】,后再在空气中被氧化为氢氧化铁【Fe(OH)3】,Fe(OH)3不稳定,在阳光照射下发生缓慢的分解反应生成氧化铁(Fe2O3),铁锈的化学式可简单表示为Fe2O3 nH2O。
【提出问题】铁锈(Fe2O3 nH2O)中的n的值等于多少呢?
【问题探究】小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3 nH2O)的组成,称取27.0g这种铁粉样品,按如图所示装置进行实验。
①为了保证实验安全,实验开始时应先 ,防止 。
②A中的现象是 ,B中浓硫酸的作用是 。D中碱石灰的作用是
③请指出该装置中有一处明显不足 。
17.南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚。
(1)体育馆内照明的导线大多数是铜导线,用铜做导线是利用金属铜的 性和导电性。
(2)体育馆雄伟壮观的主体建筑使用了大量的金属铝板,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是 。
(3)砳砳(lèlè)是2014年南京青奥会吉祥物,其外材料为纯羊毛,内充PET纤维。PET纤维属于 (选填“天然纤维”、“合成纤维”)。
(4)小彭同学想对家中一只10g手镯(银锌合金)中银的含量进行探究。在老师的指导下:他将该手镯放在烧杯中,用足量的稀硫酸分多次加入并与手镯充分反应,实验结果如图所示。
①如果小彭同学用所得的纯银制作一枚戒指,其质量不会超过 克。
②试计算所用稀硫酸的溶质质量分数。(请在答卷纸上写出计算过程)
18.合金在工农业生产和生活中应用广泛。某化学兴趣小组以“合金的探究之旅”为主题开展项目式学习。
活动一:了解合金的有关知识
(1)国产大型客机C919机身部分采用了新型的铝锂合金,铝元素与锂元素的本质区别是_______。
A.相对原子质量不同 B.质子数不同 C.电子数不同 D.中子数不同
(2)《吕氏春秋》记载“金柔锡柔,合两柔则刚(即坚硬)”(注:金指铜单质,锡指锡单质)。这句话说明铜锡合金具有的特性是_________(填字母)。
A.合金的熔点一般比其组分低
B.合金的硬度一般比其组分大
C.合金的抗腐蚀性一般比其组分强
(3)2019年12月,我国首艘国产航母山东舰正式入列。
①建航母用到了钛合金,钛合金属于 (填“金属”或“非金属”)材料。
②航母外壳用涂料覆盖,是为了防止钢铁与 (填化学式)接触锈蚀,而金属铝在空气中更耐腐蚀的原因是 (用化学方程式表示)。
③航母上官兵烧水用的电热水壶电源插头是铜质的,这主要是利用铜的 性。
活动二:探究合金中金属活动性
(4)为探究校运动会奖牌中所含锌、铁、铜金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是_______(填字母)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.溶液中加入足量铁粉后,再加入溶液
C.溶液中加入足量铜粉后,再加入铁粉
活动三:测定合金中组分的含量
(5)取某生铁合金样品放入烧杯中,分两次加入相同质量的稀盐酸(该实验条件下其它成分不参与反应),充分反应。测定实验数据如下表:
加稀盐酸的次数 第一次 第二次
加稀盐酸的质量/g 40.0 40.0
生成气体的质量/g 0.2 0.14
①样品中铁的质量为 g。
②稀盐酸中溶质的质量分数为 (写出计算过程)。
参考答案:
1.AC
2.BD
3.AB
4.AD
5.CD
6.D
7.B
8.C
9.B
10.A
11.B
12.C
13.D
14.A
15.A
16. 水和氧气 酸、盐等 Fe2O3+6HCl═2FeCl3+3H2O 涂一层油漆 通入一会儿一氧化碳把玻璃管中的空气排尽 发生爆炸 红褐色固体变成黑色固体 吸收反应生成的水 防止空气中的水蒸气和二氧化碳进入C装置 没有处理尾气
17.(1)延展
(2)
(3)合成纤维
(4) 4.8 解:设所用稀硫酸的溶质质量分数为x
x=19.6%
答:所用稀硫酸的溶质质量分数为19.6%
18.(1)B
(2)B
(3) 金属 O2和H2O 4Al+3O2=2Al2O3 导电
(4)AB
(5) 9.52 设40g稀盐酸中溶质的质量为y,则
解得y=7.3g
则稀盐酸的溶质质量分数为
答:稀盐酸的溶质质量分数为18.25%。
