2.2分子的空间结构同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2分子的空间结构同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 940.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
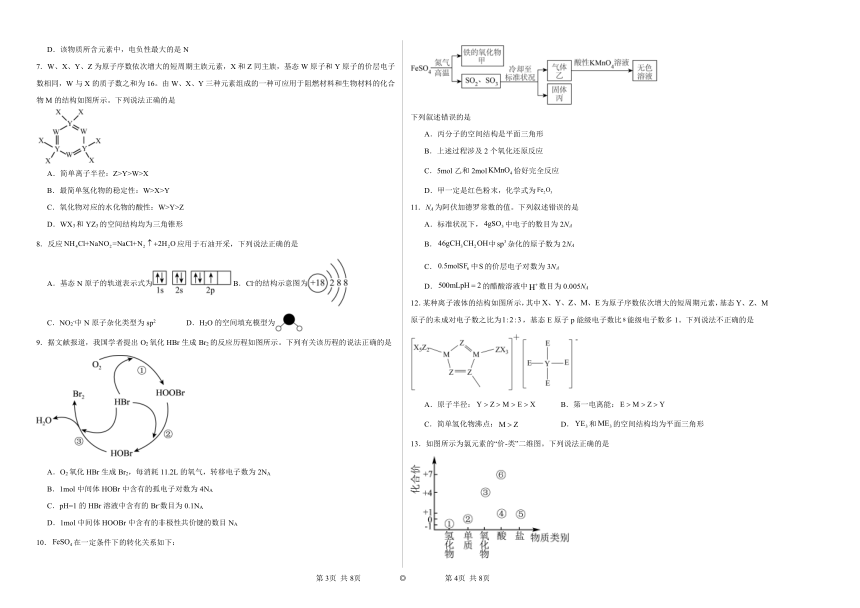
| 更新时间 | 2024-03-13 13:26:12 | ||
图片预览


文档简介
2.2分子的空间结构同步练习
姓名()班级()学号()
一、选择题
1.一种矿石的化学组成为。、、、为原于序数依次增加的短周期元素,且价层电子数之和为15,、、处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
A.与同周期的元素中,第一电离能比大的元素有5种
B.原子半径大小:
C.、的简单氢化物中,中心原子都采取杂化
D.的单质可以和盐酸反应,不能与氢氧化钠溶液反应
2.短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一、丙溶液为二元强酸,上述物质的转化关系如图所示。下列说法正确的是
A.W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物,包含了三种漂白原理
B.K、L、M中键角大小为:K>L>M
C.元素的非金属性:Z>Y>X
D.丙不能由无单质参加的化合反应制得
3.根据价层电子对互斥模型,判断下列分子或离子的空间结构正确的是
编号 分子式 价层电子对互斥模型 分子或离子的空间结构
① AsCl3 四面体形 三角锥形
② HCHO 平面三角形 三角锥形
③ NF3 四面体形 平面三角形
④ 正四面体形 正四面体形
A.①② B.①④ C.②④ D.②③
4.是原子半径依次增大的短周期主族元素,基态原子核外电子有9种空间运动状态,并有2个单电子。由上述六种元素组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如下图所示。下列说法正确的是
A.原子序数:
B.上述六种元素中第一电离能最大的为元素
C.基态原子的价电子排布式为
D.和中原子的杂化方式相同,均为杂化
5.下列化学用语或图示表达错误的是
A.的空间结构模型:
B.键电子云轮廓图:
C.氮原子电子云图:
D.中,碳原子与氧原子之间形成的共价键类型为键
6.氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。下列说法正确的是
A.第一电离能:O>N>C>H
B.该分子中碳原子的杂化类型有sp、sp2和sp3
C.基态氧原子的电子有8种运动状态
D.该物质所含元素中,电负性最大的是N
7.W、X、Y、Z为原子序数依次增大的短周期主族元素,X和Z同主族,基态W原子和Y原子的价层电子数相同,W与X的质子数之和为16。由W、X、Y三种元素组成的一种可应用于阻燃材料和生物材料的化合物M的结构如图所示。下列说法正确的是
A.简单离子半径:Z>Y>W>X
B.最简单氢化物的稳定性:W>X>Y
C.氧化物对应的水化物的酸性:W>Y>Z
D.WX3和YZ3的空间结构均为三角锥形
8.反应应用于石油开采,下列说法正确的是
A.基态N原子的轨道表示式为 B.Cl-的结构示意图为
C.NO2-中N原子杂化类型为sp2 D.H2O的空间填充模型为
9.据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法正确的是
A.O2氧化HBr生成Br2,每消耗11.2L的氧气,转移电子数为2NA
B.1mol中间体HOBr中含有的孤电子对数为4NA
C.pH=1的HBr溶液中含有的Br-数目为0.1NA
D.1mol中间体HOOBr中含有的非极性共价键的数目NA
10.在一定条件下的转化关系如下:
下列叙述错误的是
A.丙分子的空间结构是平面三角形
B.上述过程涉及2个氧化还原反应
C.5mol乙和2mol恰好完全反应
D.甲一定是红色粉末,化学式为
11.NA为阿伏加德罗常数的值。下列叙述错误的是
A.标准状况下,中电子的数目为2NA
B.中杂化的原子数为2NA
C.中的价层电子对数为3NA
D.的醋酸溶液中数目为0.005NA
12.某种离子液体的结构如图所示,其中为原子序数依次增大的短周期元素,基态原子的未成对电子数之比为,基态E原子p能级电子数比能级电子数多1。下列说法不正确的是
A.原子半径: B.第一电离能:
C.简单氢化物沸点: D.和的空间结构均为平面三角形
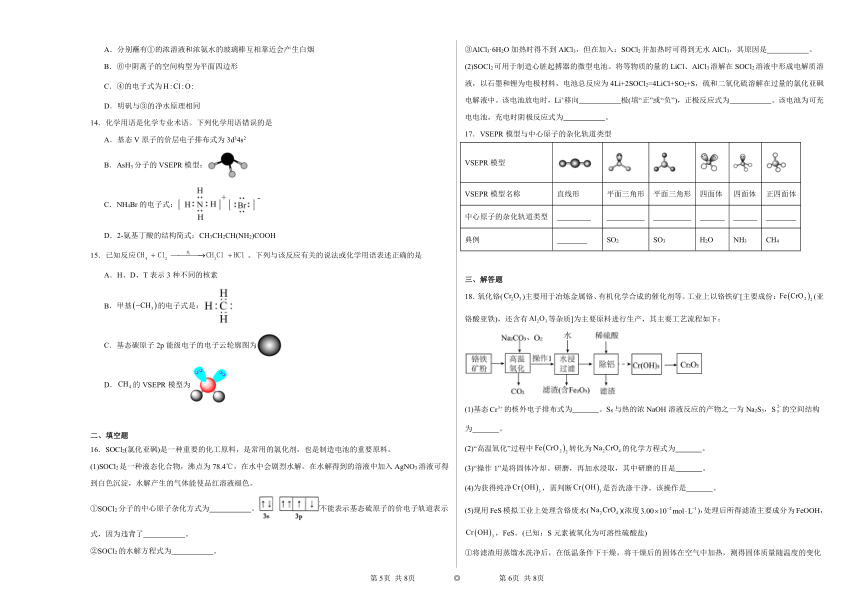
13.如图所示为氯元素的“价-类”二维图。下列说法正确的是
A.分别蘸有①的浓溶液和浓氨水的玻璃棒互相靠近会产生白烟
B.⑥中阴离子的空间构型为平面四边形
C.④的电子式为
D.明矾与③的净水原理相同
14.化学用语是化学专业术语。下列化学用语错误的是
A.基态V原子的价层电子排布式为3d34s2
B.AsH3分子的VSEPR模型:
C.NH4Br的电子式:
D.2-氨基丁酸的结构简式:CH3CH2CH(NH2)COOH
15.已知反应。下列与该反应有关的说法或化学用语表述正确的是
A.H、D、T表示3种不同的核素
B.甲基的电子式是:
C.基态碳原子2p能级电子的电子云轮廓图为
D.的VSEPR模型为
二、填空题
16.SOCl2(氯化亚砜)是一种重要的化工原料,是常用的氯化剂,也是制造电池的重要原料。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为 。不能表示基态硫原子的价电子轨道表示式,因为违背了 。
②SOCl2的水解方程式为 。
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是 。
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向 极(填“正”或“负”),正极反应式为 。该电池为可充电电池,充电时阴极反应式为 。
17.VSEPR模型与中心原子的杂化轨道类型
VSEPR模型
VSEPR模型名称 直线形 平面三角形 平面三角形 四面体 四面体 正四面体
中心原子的杂化轨道类型
典例 SO2 SO3 H2O NH3 CH4
三、解答题
18.氧化铬()主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份:(亚铬酸亚铁),还含有等杂质]为主要原料进行生产,其主要工艺流程如下:
(1)基态的核外电子排布式为 。S8与热的浓NaOH溶液反应的产物之一为Na2S3,S的空间结构为 。
(2)“高温氧化”过程中转化为的化学方程式为 。
(3)“操作1”是将固体冷却、研磨,再加水浸取,其中研磨的目是 。
(4)为获得纯净,需判断是否洗涤干净。该操作是 。
(5)现用FeS模拟工业上处理含铬废水()(浓度),处理后所得滤渣主要成分为FeOOH,,FeS。(已知:S元素被氧化为可溶性硫酸盐)
①将滤渣用蒸馏水洗净后,在低温条件下干燥,将干燥后的固体在空气中加热,测得固体质量随温度的变化如图所示。
说明:780℃以上的残留固体为、的混合物。
A→B固体质量增加的原因是 。
②IL的“废水”可氧化的FeS的质量为 g。
19.某课外兴趣小组为拓展对SO2还原性和氧化性的认识,进行了下列两组探究实验。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示:
已知:室温下1.0的Fe(NO3)3溶液的pH=1;该实验条件下不考虑被酸性KMnO4溶液氧化。
回答下列问题:
①盛装浓硫酸的仪器名称为 。
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成 键。
③如图进行实验,装置B中产生了白色沉淀,其成分是 (填化学式)。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与反应;
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗? (填“是”或“否”)。若不正确,理由是 (正确无需回答)。
⑤请你设计实验验证猜想2,并完成表中内容(提示:在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
实验步骤 预期现象和结论
a.配溶液,用NaNO3和盐酸配成pH= ,浓度为 的溶液,替换装置B中的Fe(NO3)3溶液。 b.打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸并加热。 若装置B中有白色沉淀生成,猜想2成立。 若装置B中无白色沉淀生成,猜想2不成立。
⑥尾气处理装置应选择 (填序号)。
(2)探究SO2与铜反应,实验的相关操作和现象及信息如图所示:
实验I
实验Ⅱ
查阅资料:水溶液显棕色,
①通过上述两组对比实验,SO2与铜反应的条件是 。
②写出SO2在盐酸中和铜反应的离子方程式: 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【分析】X、Z、W处于相邻的主族,X2+和Z3+的电荷与半径之比相近,导致两元素性质相似,则二种元素遵循对角线规则,X为Be,Z为Al;W为ⅣA族元素的Si,同时四种元素价层电子数之和为15,Y为ⅥA族的O;
【详解】A.与Al同周期的元素中,第一电离能比Al大的元素有6种,A错误;
B.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径:,B错误;
C.和中心原子的价层电子对数都为4,都采取杂化,C正确;
D.Be和Al类似,即能与盐酸反应放出氢气,又可以和氢氧化钠溶液反应放出氢气,D项错误;
答案选C。
2.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,则K为SO2,丙溶液为二元强酸,则丙为硫酸,根据流程图,二氧化硫能够与水和氧气反应生成硫酸,因此L为水,乙为氧气,甲为C单质,X为C元素;M为二氧化碳,因此W为H元素、X为C元素、Y为O元素、Z为S元素。
【详解】A.W、X、Y、Z可形成四种常见的具有漂白性的化合物或单质为H2O2、SO2、活性炭、O3,其中H2O2和O3具有强氧化性能使有色物质褪色,活性炭利用吸附性使有色物质褪色,SO2与某些特定化学物质(如品红)化合后可生成不稳定化合物,达到褪色目的,A正确;
B.K为SO2、L为H2O、M为CO2,CO2是中心原子是sp杂化,键角为180°,SO2中心原子价层电子对数为2+=3,中心原子是sp2杂化,H2O中心原子价层电子对数为2+=4,中心原子是sp3杂化,则三者键角关系为:CO2>SO2>H2O,B错误;
C.由分析可知,X为C元素、Y为O元素、Z为S元素,非金属性:O>S>C,C错误;
D.丙为硫酸,SO3和水化合反应生成硫酸,D错误;
故选A。
3.B
【详解】①分子中中心原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,①正确;
②甲醛分子中中心C原子的价层电子对数为3(有1个双键),价层电子对互斥模型为平面三角形,没有孤电子对,分子的空间结构为平面三角形,②错误;
③分子中中心N原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,③错误;
④中中心N原子的价层电子对数为4,价层电子对互斥模型为正四面体形,没有孤电子对,离子的空间结构为正四面体形,④正确;
故选B。
4.A
【分析】X、Y、Z、W、M、R是原子半径依次增大的前四周期元素,基态R原子核外电子有9种空间运动状态,有9个原子轨道,并有2个单电子,则核外有16个电子,R是S元素;X、Y、Z、W、M原子半径依次增大,X能形成1个共价键,X是H元素;Y形成2个共价键,Y是O元素; W形成4个共价键,W是C元素;Z形成4个共价键带1个正电荷、M形成4个共价键带1个负电荷,Z是N元素、M是B元素。
【详解】A.由分析可知,X是H元素、Y是O元素、Z是N元素、W是C元素、M是B元素、R是S元素,原子序数:,故A正确;
B.同周期从左到右,第一电离能逐渐增大;同族从上到下,第一电离能逐渐减小,第IIIA比相邻的左边的IIA小,VIA比相邻的左边的VA小,则上述六种元素中第一电离能最大的为N元素,故B错误;
C.基态S原子的价电子排布式为,故C错误;
D.BH3中心原子价层电子对数为3+=3,B原子为sp2杂化,故D错误;
故选A。
5.A
【详解】A.的中心原子Cl原子的价层电子对数为,为sp3杂化,空间构型为正四面体形,A错误;
B.键电子云轮廓图为镜面对称,B正确;
C.氮原子电子云为哑铃形,C正确;
D.乙醇中碳、氧均为sp3杂化,碳原子与氧原子之间形成的共价键类型为键,D正确;
故选A。
6.C
【详解】A.同周期元素,从左到右第一电离能呈增大的趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,N元素的第一电离能大于O元素,选项A错误;
B.由结构简式可知,该有机物不含有三键碳原子,碳原子的杂化方式不可能有sp杂化,选项B错误;
C.同一核外没有两个电子的各个参数完全相同,原子核外每个电子的运动状态都是不同的,基态氧原子核外电子数为8,所以电子的运动状态有8种,选项C正确;
D.同周期元素,从左到右第电负性增大,故O元素电负性最大,选项D错误;
答案选C。
7.D
【分析】W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,由图中结构式可知,X形成1个共价键,位于ⅦA族,则X为F元素、Z为Cl元素;Y形成5个共价键,W形成3个共价键,基态W原子和Y原子的价层电子数相同,W与X的质子数之和为16,W、Y原子的最外层电子数都是为5,则W为N元素、Y为P元素,据此分析解题。
【详解】A.由分析可知,W、X、Y、Z分别为N、F、P、Cl,故简单离子半径大小顺序为:P3->Cl->N3->F-即Y > Z>W>X,A错误;
B.由分析可知,W、X、Y分别为N、F、P,非金属性F>N>P,则最简单氢化物的稳定性为HF>NH3>PH3,即X > W>Y,B错误;
C.由分析可知,W、X、Y分别为N、F、P,其中F没有含氧酸,且只有最高价氧化物对应水化物的酸性才与元素的非金属性一致,故无法比较三者氧化物对应的水化物的酸性,C错误;
D.由分析可知,W、X、Y、Z分别为N、F、P、Cl,则WX3即NF3中心原子N周围的价层电子对数为:3+=4,和YZ3即PCl3中心原子P周围的价层电子对数为:3+=4,根据价层电子互斥理论可知,二者的空间结构均为三角锥形,D正确;
故答案为:D。
8.C
【详解】A.基态N原子的轨道表示式为 ,A错误;
B.Cl-的结构示意图:,B错误;
C.NO2-中N原子杂化类型为sp2,C正确;
D.H2O的空间填充模型为,D错误;
本题选C。
9.D
【分析】由图可知,反应①为HBr+O2=HOOBr,反应②为HOOBr+HBr=2HOBr,反应③为HBr+HOBr=H2O+Br2,总反应为O2+4HBr=2Br2+2H2O。
【详解】A.没有说明氧气所处的温度和压强,11.2L氧气的体积不一定为0.5mol,故A错误;
B.HOBr中心原子为O,中心原子孤电子对数为=2,另外Br有3对孤电子,则1mol中间体HOBr中含有的孤电子对数为5NA,故B错误;
C.未说明pH=1的HBr溶液的体积,无法计算含有Br-的数目,故C错误;
D.HOOBr的结构式为H-O-O-Br,1mol中间体HOOBr中含有的非极性共价键的数目NA,故D正确;
故选D。
10.D
【详解】A.在标准状况下呈固态,则固体丙为,原子采用杂化,分子呈平面三角形,A项正确;
B.的分解反应中部分S元素化合价降低,则有元素化合价升高,属于氧化还原反应,与酸性溶液反应属于氧化还原反应,故上述过程涉及2个氧化还原反应,B项正确;
C.,C项正确;
D.根据氧化还原反应规律,甲中铁元素化合价高于+2价,故甲可能是,也可能是或和的混合物,D项错误;
答案选D。
11.B
【详解】A.1个SO3分子中含有40个电子,的物质的量为=0.05mol,则含电子的数目为0.05mol×40×NA mol-1=2NA,A正确;
B.的物质的量为1mol,2个C原子、1个O原子都发生杂化,则发生sp3杂化的原子数为3NA,B错误;
C.SF6分子中,1个S与6个F原子各形成1个共用电子对,则1个SF6分子中,S原子的价层电子对数为6,所以中的价层电子对数为3NA,C正确;
D.的醋酸溶液中,H+浓度为0.01mol/L,则数目为0.01mol/L×0.5L×NA mol-1=0.005NA,D正确;
故选B。
12.D
【分析】为原子序数依次增大的短周期元素,根据某种离子液体的结构得到X有一个价键,X为H,基态原子的未成对电子数之比为,依次为B、C、N,基态E原子p能级电子数比能级电子数多1,E有一个价键,E为F,据此分析;
【详解】A.原子半径:,即,A正确;
B.根据同一周期从左往右第一电离能呈增大趋势,第一电离能:,即,B正确;
C.氨分子间存在氢键,简单氢化物沸点:,C正确;
D.的空间结构为平面三角形,的空间结构为三角锥形,D错误;
故选D。
13.A
【详解】A.如图所示,①是,②是,③是,④是,⑤是次氯酸盐,⑥是。蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟,A项正确;
B.中氯原子价层电子对数为4+=4、没有孤电子对,故其空间构型是:正四面体,B项错误;
C.的电子式为,C项错误;
D.明矾和均可用作净水剂,明矾水解生成的氢氧化铝胶体可以吸附水中的悬浮物,达到净水的目的,二氧化氯净水是利用其强氧化性杀死水中的细菌和病毒,原理不同,D项错误;
答案选A。
14.B
【详解】A.V是23号元素,根据构造原理,可知基态V原子的价层电子排布式为3d34s2,A正确;
B.AsH3分子中的中心As原子价层电子对数是3+=4,故该分子的VSEPR模型是四面体形,而不是三角锥形,B错误;
C.NH4Br是离子化合物,阳离子与阴离子Br-通过离子键结合,在阳离子中,N、H元素的原子之间以共价键结合,故该物质的电子式为,C正确;
D.2-氨基丁酸是与羧基直接相连的烃基C原子上的一个H原子被氨基-NH2取代产生的物质,其结构简式为CH3CH2CH(NH2)COOH,D正确;
故合理选项是B。
15.A
【详解】A.核素是具有一定的质子和一定中子的一类原子,H、D、T表示3种不同的核素,A正确;
B.甲基的电子式是:,B错误;
C.基态碳原子2p能级电子的电子云轮廓为哑铃形,不是球形,C错误;
D.的VSEPR模型为正四面体形,没有孤电子对,D错误;
答案选A。
16.(1) 泡利不相容原理和洪特规则 SOCl2遇水既产生HCl气体抑制铝离子的水解,又能除去水,使氯化铝在缺水环境下无法水解;
(2) 正 Li++e-= Li
【详解】(1)①SOCl2分子的中心S原子的价层电子对数为,采用杂化;由轨道表示式可知违背了泡利不相容原理和洪特规则;
②SOCl2的水解得到的溶液中加入AgNO3溶液可得到白色沉淀,可知生成HCl,水解产生的气体能使品红溶液褪色,可知生成二氧化硫气体,则水解方程式为:;
③SOCl2遇水既产生HCl气体抑制铝离子的水解,又能除去水,使氯化铝在缺水环境下无法水解;
(2)原电池中阳离子向正极移动,则Li+移向正极;由总反应可得正极反应式:;充电时阴极反应为负极反应的逆反应,则该电池充电时阴极锂离子得电子生成Li,电极方程式:Li++e-= Li 。
17. sp sp2 sp3 sp2 sp3 sp3 CO2
【详解】CO2:中心原子C原子孤电子对数为×(4-2×2)=0,价层电子对数为2,杂化轨道为sp,VSEPR模型为直线型,无孤电子对,分子空间构型为直线型;
二氧化硫分子(SO2)分子中S和O形成σ键,共有2个σ键,其中心原子(硫原子)的孤电子对数为=1;价层电子对数等于σ键+孤电子对,价层电子对数为2+1=3,该分子的VSEPR模型为平面三角形;孤电子对不占分子形状,则该分子呈V形,根据杂化轨道理论分析,杂化轨道用于成σ键和填充孤电子对,二氧化硫分子的中心原子的杂化类型为sp2;
SO3中,价层电子对个数=σ键个数+孤电子对个数=3+(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;
H2O中价层电子对个数=2+=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子O杂化方式为sp3;
NH3中,价层电子对数=σ 键个数+(a-xb)=3+(5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子形状为三角锥形;
根据价层电子对互斥理论可知,甲烷知碳原子含有的孤对电子对数是(4-1×4)=0,所以甲烷分子的VSEPR模型是正四面体形,其中碳原子是sp3杂化。
18.(1) [Ar]3d3 V
(2)4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2
(3)增大接触面积,提高浸取效率
(4)取最后一次洗涤液少量于试管中,加入BaCl2溶液,若不产生沉淀,则沉淀洗涤干净
(5) FeS被氧化为硫酸盐 0.88
【分析】铬铁矿粉中加入碳酸钠、氧气高温氧化,Fe(CrO2)2转化为Na2CrO4、Fe2O3,Al2O3转化为Na[Al(OH)4],固体物质中含有Na2CrO4、Fe2O3、Na[Al(OH)4],加水Na[Al(OH)4]和Na2CrO4溶解,Fe2O3不溶于水,过滤除去,滤液中加入适量硫酸生成氢氧化铝沉淀过滤除去,得到含有Na2CrO4的滤液,经过处理得到Cr(OH)3沉淀,灼烧得到Cr2O3。
【详解】(1)基态Cr3+的核外电子排布式为[Ar]3d3,Na2S3中与SCl2为等电子体,其价层电子对数为2+=4,有两对孤电子对,空间构型为V形。
(2)高温氧化,Fe(CrO2)2与碳酸钠、氧气反应转化为Na2CrO4、Fe2O3,同时还有二氧化碳生成,化学方程式为4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2。
(3)研磨的目的是将固体磨成更小的颗粒,增大接触面积,提高浸取效率。
(4)除铝时加入了稀硫酸,要检验Cr(OH)3是否洗涤干净,只要检验洗涤液中是否还含有硫酸根离子即可,具体操作为取最后一次洗涤液少量于试管中,加入BaCl2溶液,若不产生沉淀,则沉淀洗涤干净。
(5)①固体加热过程中,先是Cr(OH)3受热分解,固体质量减少,然后是FeS被氧化为硫酸盐,固体质量增大,最后是FeOOH转化为氧化铁,固体质量再减少。故A→B固体质量增加的原因为FeS被氧化为硫酸盐。
②FeS被氧化,S从-2价变为+6价,Fe从+2价变为+3价,Na2CrO4得电子被还原,Cr从+6价转化为+3价,1L废水含有Na2CrO4物质的量为0.03mol,转移电子数为0.09mol,则被氧化的FeS物质的量为0.09mol÷9=0.01mol,质量为0.88g。
19.(1) 分液漏斗 σ BaSO4 否 可能SO2过量,溶解的SO2也能使KMnO4溶液褪色 13 3mol/L E
(2) 酸性条件下、有参与
【分析】为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,再滴加浓硫酸与铜加热反应生成二氧化硫、硫酸铜和水,二氧化硫既有还原性,又有氧化性,进行实验探究;
【详解】(1)①盛装浓硫酸的仪器名称为分液漏斗;②的中心原子N上的价层电子对数为3,中心原子通过sp2杂化轨道与O的2p轨道形成σ键;③SO2具有还原性,酸性条件下或Fe3+均能将SO2氧化为,故白色沉淀为BaSO4.④当SO2与Fe3+反应时,生成的Fe2+能使酸性高锰酸钾溶液褪色,如果在反应中SO2过量,过量的SO2也能使酸性高锰酸钾溶液褪色,因此该结论不正确;⑤如果要论证在酸性条件下是与SO2反应,则需要排除Fe3+的干扰,需要配制与硝酸铁溶液酸性相同,且浓度相同的溶液代替硝酸铁溶液,再验证是否有产生,因此用NaNO3和盐酸配成,浓度为3的溶液,替换装置B中的Fe(NO3)3溶液。⑥含SO2的尾气应用氢氧化钠溶液吸收;
(2)①对比两组实验可知,Cu与SO2在酸性条件下,有Cl 参与时才能发生反应。②由题中实验现象可知Cu、SO2和稀盐酸反应生成和Cu2S,其离子方程式为。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、选择题
1.一种矿石的化学组成为。、、、为原于序数依次增加的短周期元素,且价层电子数之和为15,、、处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
A.与同周期的元素中,第一电离能比大的元素有5种
B.原子半径大小:
C.、的简单氢化物中,中心原子都采取杂化
D.的单质可以和盐酸反应,不能与氢氧化钠溶液反应
2.短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一、丙溶液为二元强酸,上述物质的转化关系如图所示。下列说法正确的是
A.W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物,包含了三种漂白原理
B.K、L、M中键角大小为:K>L>M
C.元素的非金属性:Z>Y>X
D.丙不能由无单质参加的化合反应制得
3.根据价层电子对互斥模型,判断下列分子或离子的空间结构正确的是
编号 分子式 价层电子对互斥模型 分子或离子的空间结构
① AsCl3 四面体形 三角锥形
② HCHO 平面三角形 三角锥形
③ NF3 四面体形 平面三角形
④ 正四面体形 正四面体形
A.①② B.①④ C.②④ D.②③
4.是原子半径依次增大的短周期主族元素,基态原子核外电子有9种空间运动状态,并有2个单电子。由上述六种元素组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如下图所示。下列说法正确的是
A.原子序数:
B.上述六种元素中第一电离能最大的为元素
C.基态原子的价电子排布式为
D.和中原子的杂化方式相同,均为杂化
5.下列化学用语或图示表达错误的是
A.的空间结构模型:
B.键电子云轮廓图:
C.氮原子电子云图:
D.中,碳原子与氧原子之间形成的共价键类型为键
6.氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。下列说法正确的是
A.第一电离能:O>N>C>H
B.该分子中碳原子的杂化类型有sp、sp2和sp3
C.基态氧原子的电子有8种运动状态
D.该物质所含元素中,电负性最大的是N
7.W、X、Y、Z为原子序数依次增大的短周期主族元素,X和Z同主族,基态W原子和Y原子的价层电子数相同,W与X的质子数之和为16。由W、X、Y三种元素组成的一种可应用于阻燃材料和生物材料的化合物M的结构如图所示。下列说法正确的是
A.简单离子半径:Z>Y>W>X
B.最简单氢化物的稳定性:W>X>Y
C.氧化物对应的水化物的酸性:W>Y>Z
D.WX3和YZ3的空间结构均为三角锥形
8.反应应用于石油开采,下列说法正确的是
A.基态N原子的轨道表示式为 B.Cl-的结构示意图为
C.NO2-中N原子杂化类型为sp2 D.H2O的空间填充模型为
9.据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法正确的是
A.O2氧化HBr生成Br2,每消耗11.2L的氧气,转移电子数为2NA
B.1mol中间体HOBr中含有的孤电子对数为4NA
C.pH=1的HBr溶液中含有的Br-数目为0.1NA
D.1mol中间体HOOBr中含有的非极性共价键的数目NA
10.在一定条件下的转化关系如下:
下列叙述错误的是
A.丙分子的空间结构是平面三角形
B.上述过程涉及2个氧化还原反应
C.5mol乙和2mol恰好完全反应
D.甲一定是红色粉末,化学式为
11.NA为阿伏加德罗常数的值。下列叙述错误的是
A.标准状况下,中电子的数目为2NA
B.中杂化的原子数为2NA
C.中的价层电子对数为3NA
D.的醋酸溶液中数目为0.005NA
12.某种离子液体的结构如图所示,其中为原子序数依次增大的短周期元素,基态原子的未成对电子数之比为,基态E原子p能级电子数比能级电子数多1。下列说法不正确的是
A.原子半径: B.第一电离能:
C.简单氢化物沸点: D.和的空间结构均为平面三角形
13.如图所示为氯元素的“价-类”二维图。下列说法正确的是
A.分别蘸有①的浓溶液和浓氨水的玻璃棒互相靠近会产生白烟
B.⑥中阴离子的空间构型为平面四边形
C.④的电子式为
D.明矾与③的净水原理相同
14.化学用语是化学专业术语。下列化学用语错误的是
A.基态V原子的价层电子排布式为3d34s2
B.AsH3分子的VSEPR模型:
C.NH4Br的电子式:
D.2-氨基丁酸的结构简式:CH3CH2CH(NH2)COOH
15.已知反应。下列与该反应有关的说法或化学用语表述正确的是
A.H、D、T表示3种不同的核素
B.甲基的电子式是:
C.基态碳原子2p能级电子的电子云轮廓图为
D.的VSEPR模型为
二、填空题
16.SOCl2(氯化亚砜)是一种重要的化工原料,是常用的氯化剂,也是制造电池的重要原料。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为 。不能表示基态硫原子的价电子轨道表示式,因为违背了 。
②SOCl2的水解方程式为 。
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是 。
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向 极(填“正”或“负”),正极反应式为 。该电池为可充电电池,充电时阴极反应式为 。
17.VSEPR模型与中心原子的杂化轨道类型
VSEPR模型
VSEPR模型名称 直线形 平面三角形 平面三角形 四面体 四面体 正四面体
中心原子的杂化轨道类型
典例 SO2 SO3 H2O NH3 CH4
三、解答题
18.氧化铬()主要用于冶炼金属铬、有机化学合成的催化剂等。工业上以铬铁矿[主要成份:(亚铬酸亚铁),还含有等杂质]为主要原料进行生产,其主要工艺流程如下:
(1)基态的核外电子排布式为 。S8与热的浓NaOH溶液反应的产物之一为Na2S3,S的空间结构为 。
(2)“高温氧化”过程中转化为的化学方程式为 。
(3)“操作1”是将固体冷却、研磨,再加水浸取,其中研磨的目是 。
(4)为获得纯净,需判断是否洗涤干净。该操作是 。
(5)现用FeS模拟工业上处理含铬废水()(浓度),处理后所得滤渣主要成分为FeOOH,,FeS。(已知:S元素被氧化为可溶性硫酸盐)
①将滤渣用蒸馏水洗净后,在低温条件下干燥,将干燥后的固体在空气中加热,测得固体质量随温度的变化如图所示。
说明:780℃以上的残留固体为、的混合物。
A→B固体质量增加的原因是 。
②IL的“废水”可氧化的FeS的质量为 g。
19.某课外兴趣小组为拓展对SO2还原性和氧化性的认识,进行了下列两组探究实验。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示:
已知:室温下1.0的Fe(NO3)3溶液的pH=1;该实验条件下不考虑被酸性KMnO4溶液氧化。
回答下列问题:
①盛装浓硫酸的仪器名称为 。
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成 键。
③如图进行实验,装置B中产生了白色沉淀,其成分是 (填化学式)。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与反应;
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗? (填“是”或“否”)。若不正确,理由是 (正确无需回答)。
⑤请你设计实验验证猜想2,并完成表中内容(提示:在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
实验步骤 预期现象和结论
a.配溶液,用NaNO3和盐酸配成pH= ,浓度为 的溶液,替换装置B中的Fe(NO3)3溶液。 b.打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸并加热。 若装置B中有白色沉淀生成,猜想2成立。 若装置B中无白色沉淀生成,猜想2不成立。
⑥尾气处理装置应选择 (填序号)。
(2)探究SO2与铜反应,实验的相关操作和现象及信息如图所示:
实验I
实验Ⅱ
查阅资料:水溶液显棕色,
①通过上述两组对比实验,SO2与铜反应的条件是 。
②写出SO2在盐酸中和铜反应的离子方程式: 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【分析】X、Z、W处于相邻的主族,X2+和Z3+的电荷与半径之比相近,导致两元素性质相似,则二种元素遵循对角线规则,X为Be,Z为Al;W为ⅣA族元素的Si,同时四种元素价层电子数之和为15,Y为ⅥA族的O;
【详解】A.与Al同周期的元素中,第一电离能比Al大的元素有6种,A错误;
B.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径:,B错误;
C.和中心原子的价层电子对数都为4,都采取杂化,C正确;
D.Be和Al类似,即能与盐酸反应放出氢气,又可以和氢氧化钠溶液反应放出氢气,D项错误;
答案选C。
2.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,则K为SO2,丙溶液为二元强酸,则丙为硫酸,根据流程图,二氧化硫能够与水和氧气反应生成硫酸,因此L为水,乙为氧气,甲为C单质,X为C元素;M为二氧化碳,因此W为H元素、X为C元素、Y为O元素、Z为S元素。
【详解】A.W、X、Y、Z可形成四种常见的具有漂白性的化合物或单质为H2O2、SO2、活性炭、O3,其中H2O2和O3具有强氧化性能使有色物质褪色,活性炭利用吸附性使有色物质褪色,SO2与某些特定化学物质(如品红)化合后可生成不稳定化合物,达到褪色目的,A正确;
B.K为SO2、L为H2O、M为CO2,CO2是中心原子是sp杂化,键角为180°,SO2中心原子价层电子对数为2+=3,中心原子是sp2杂化,H2O中心原子价层电子对数为2+=4,中心原子是sp3杂化,则三者键角关系为:CO2>SO2>H2O,B错误;
C.由分析可知,X为C元素、Y为O元素、Z为S元素,非金属性:O>S>C,C错误;
D.丙为硫酸,SO3和水化合反应生成硫酸,D错误;
故选A。
3.B
【详解】①分子中中心原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,①正确;
②甲醛分子中中心C原子的价层电子对数为3(有1个双键),价层电子对互斥模型为平面三角形,没有孤电子对,分子的空间结构为平面三角形,②错误;
③分子中中心N原子的价层电子对数为4,价层电子对互斥模型为四面体形,含有1个孤电子对,分子的空间结构为三角锥形,③错误;
④中中心N原子的价层电子对数为4,价层电子对互斥模型为正四面体形,没有孤电子对,离子的空间结构为正四面体形,④正确;
故选B。
4.A
【分析】X、Y、Z、W、M、R是原子半径依次增大的前四周期元素,基态R原子核外电子有9种空间运动状态,有9个原子轨道,并有2个单电子,则核外有16个电子,R是S元素;X、Y、Z、W、M原子半径依次增大,X能形成1个共价键,X是H元素;Y形成2个共价键,Y是O元素; W形成4个共价键,W是C元素;Z形成4个共价键带1个正电荷、M形成4个共价键带1个负电荷,Z是N元素、M是B元素。
【详解】A.由分析可知,X是H元素、Y是O元素、Z是N元素、W是C元素、M是B元素、R是S元素,原子序数:,故A正确;
B.同周期从左到右,第一电离能逐渐增大;同族从上到下,第一电离能逐渐减小,第IIIA比相邻的左边的IIA小,VIA比相邻的左边的VA小,则上述六种元素中第一电离能最大的为N元素,故B错误;
C.基态S原子的价电子排布式为,故C错误;
D.BH3中心原子价层电子对数为3+=3,B原子为sp2杂化,故D错误;
故选A。
5.A
【详解】A.的中心原子Cl原子的价层电子对数为,为sp3杂化,空间构型为正四面体形,A错误;
B.键电子云轮廓图为镜面对称,B正确;
C.氮原子电子云为哑铃形,C正确;
D.乙醇中碳、氧均为sp3杂化,碳原子与氧原子之间形成的共价键类型为键,D正确;
故选A。
6.C
【详解】A.同周期元素,从左到右第一电离能呈增大的趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,N元素的第一电离能大于O元素,选项A错误;
B.由结构简式可知,该有机物不含有三键碳原子,碳原子的杂化方式不可能有sp杂化,选项B错误;
C.同一核外没有两个电子的各个参数完全相同,原子核外每个电子的运动状态都是不同的,基态氧原子核外电子数为8,所以电子的运动状态有8种,选项C正确;
D.同周期元素,从左到右第电负性增大,故O元素电负性最大,选项D错误;
答案选C。
7.D
【分析】W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,由图中结构式可知,X形成1个共价键,位于ⅦA族,则X为F元素、Z为Cl元素;Y形成5个共价键,W形成3个共价键,基态W原子和Y原子的价层电子数相同,W与X的质子数之和为16,W、Y原子的最外层电子数都是为5,则W为N元素、Y为P元素,据此分析解题。
【详解】A.由分析可知,W、X、Y、Z分别为N、F、P、Cl,故简单离子半径大小顺序为:P3->Cl->N3->F-即Y > Z>W>X,A错误;
B.由分析可知,W、X、Y分别为N、F、P,非金属性F>N>P,则最简单氢化物的稳定性为HF>NH3>PH3,即X > W>Y,B错误;
C.由分析可知,W、X、Y分别为N、F、P,其中F没有含氧酸,且只有最高价氧化物对应水化物的酸性才与元素的非金属性一致,故无法比较三者氧化物对应的水化物的酸性,C错误;
D.由分析可知,W、X、Y、Z分别为N、F、P、Cl,则WX3即NF3中心原子N周围的价层电子对数为:3+=4,和YZ3即PCl3中心原子P周围的价层电子对数为:3+=4,根据价层电子互斥理论可知,二者的空间结构均为三角锥形,D正确;
故答案为:D。
8.C
【详解】A.基态N原子的轨道表示式为 ,A错误;
B.Cl-的结构示意图:,B错误;
C.NO2-中N原子杂化类型为sp2,C正确;
D.H2O的空间填充模型为,D错误;
本题选C。
9.D
【分析】由图可知,反应①为HBr+O2=HOOBr,反应②为HOOBr+HBr=2HOBr,反应③为HBr+HOBr=H2O+Br2,总反应为O2+4HBr=2Br2+2H2O。
【详解】A.没有说明氧气所处的温度和压强,11.2L氧气的体积不一定为0.5mol,故A错误;
B.HOBr中心原子为O,中心原子孤电子对数为=2,另外Br有3对孤电子,则1mol中间体HOBr中含有的孤电子对数为5NA,故B错误;
C.未说明pH=1的HBr溶液的体积,无法计算含有Br-的数目,故C错误;
D.HOOBr的结构式为H-O-O-Br,1mol中间体HOOBr中含有的非极性共价键的数目NA,故D正确;
故选D。
10.D
【详解】A.在标准状况下呈固态,则固体丙为,原子采用杂化,分子呈平面三角形,A项正确;
B.的分解反应中部分S元素化合价降低,则有元素化合价升高,属于氧化还原反应,与酸性溶液反应属于氧化还原反应,故上述过程涉及2个氧化还原反应,B项正确;
C.,C项正确;
D.根据氧化还原反应规律,甲中铁元素化合价高于+2价,故甲可能是,也可能是或和的混合物,D项错误;
答案选D。
11.B
【详解】A.1个SO3分子中含有40个电子,的物质的量为=0.05mol,则含电子的数目为0.05mol×40×NA mol-1=2NA,A正确;
B.的物质的量为1mol,2个C原子、1个O原子都发生杂化,则发生sp3杂化的原子数为3NA,B错误;
C.SF6分子中,1个S与6个F原子各形成1个共用电子对,则1个SF6分子中,S原子的价层电子对数为6,所以中的价层电子对数为3NA,C正确;
D.的醋酸溶液中,H+浓度为0.01mol/L,则数目为0.01mol/L×0.5L×NA mol-1=0.005NA,D正确;
故选B。
12.D
【分析】为原子序数依次增大的短周期元素,根据某种离子液体的结构得到X有一个价键,X为H,基态原子的未成对电子数之比为,依次为B、C、N,基态E原子p能级电子数比能级电子数多1,E有一个价键,E为F,据此分析;
【详解】A.原子半径:,即,A正确;
B.根据同一周期从左往右第一电离能呈增大趋势,第一电离能:,即,B正确;
C.氨分子间存在氢键,简单氢化物沸点:,C正确;
D.的空间结构为平面三角形,的空间结构为三角锥形,D错误;
故选D。
13.A
【详解】A.如图所示,①是,②是,③是,④是,⑤是次氯酸盐,⑥是。蘸有浓盐酸和浓氨水的玻璃棒靠近会产生白烟,A项正确;
B.中氯原子价层电子对数为4+=4、没有孤电子对,故其空间构型是:正四面体,B项错误;
C.的电子式为,C项错误;
D.明矾和均可用作净水剂,明矾水解生成的氢氧化铝胶体可以吸附水中的悬浮物,达到净水的目的,二氧化氯净水是利用其强氧化性杀死水中的细菌和病毒,原理不同,D项错误;
答案选A。
14.B
【详解】A.V是23号元素,根据构造原理,可知基态V原子的价层电子排布式为3d34s2,A正确;
B.AsH3分子中的中心As原子价层电子对数是3+=4,故该分子的VSEPR模型是四面体形,而不是三角锥形,B错误;
C.NH4Br是离子化合物,阳离子与阴离子Br-通过离子键结合,在阳离子中,N、H元素的原子之间以共价键结合,故该物质的电子式为,C正确;
D.2-氨基丁酸是与羧基直接相连的烃基C原子上的一个H原子被氨基-NH2取代产生的物质,其结构简式为CH3CH2CH(NH2)COOH,D正确;
故合理选项是B。
15.A
【详解】A.核素是具有一定的质子和一定中子的一类原子,H、D、T表示3种不同的核素,A正确;
B.甲基的电子式是:,B错误;
C.基态碳原子2p能级电子的电子云轮廓为哑铃形,不是球形,C错误;
D.的VSEPR模型为正四面体形,没有孤电子对,D错误;
答案选A。
16.(1) 泡利不相容原理和洪特规则 SOCl2遇水既产生HCl气体抑制铝离子的水解,又能除去水,使氯化铝在缺水环境下无法水解;
(2) 正 Li++e-= Li
【详解】(1)①SOCl2分子的中心S原子的价层电子对数为,采用杂化;由轨道表示式可知违背了泡利不相容原理和洪特规则;
②SOCl2的水解得到的溶液中加入AgNO3溶液可得到白色沉淀,可知生成HCl,水解产生的气体能使品红溶液褪色,可知生成二氧化硫气体,则水解方程式为:;
③SOCl2遇水既产生HCl气体抑制铝离子的水解,又能除去水,使氯化铝在缺水环境下无法水解;
(2)原电池中阳离子向正极移动,则Li+移向正极;由总反应可得正极反应式:;充电时阴极反应为负极反应的逆反应,则该电池充电时阴极锂离子得电子生成Li,电极方程式:Li++e-= Li 。
17. sp sp2 sp3 sp2 sp3 sp3 CO2
【详解】CO2:中心原子C原子孤电子对数为×(4-2×2)=0,价层电子对数为2,杂化轨道为sp,VSEPR模型为直线型,无孤电子对,分子空间构型为直线型;
二氧化硫分子(SO2)分子中S和O形成σ键,共有2个σ键,其中心原子(硫原子)的孤电子对数为=1;价层电子对数等于σ键+孤电子对,价层电子对数为2+1=3,该分子的VSEPR模型为平面三角形;孤电子对不占分子形状,则该分子呈V形,根据杂化轨道理论分析,杂化轨道用于成σ键和填充孤电子对,二氧化硫分子的中心原子的杂化类型为sp2;
SO3中,价层电子对个数=σ键个数+孤电子对个数=3+(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;
H2O中价层电子对个数=2+=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子O杂化方式为sp3;
NH3中,价层电子对数=σ 键个数+(a-xb)=3+(5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子形状为三角锥形;
根据价层电子对互斥理论可知,甲烷知碳原子含有的孤对电子对数是(4-1×4)=0,所以甲烷分子的VSEPR模型是正四面体形,其中碳原子是sp3杂化。
18.(1) [Ar]3d3 V
(2)4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2
(3)增大接触面积,提高浸取效率
(4)取最后一次洗涤液少量于试管中,加入BaCl2溶液,若不产生沉淀,则沉淀洗涤干净
(5) FeS被氧化为硫酸盐 0.88
【分析】铬铁矿粉中加入碳酸钠、氧气高温氧化,Fe(CrO2)2转化为Na2CrO4、Fe2O3,Al2O3转化为Na[Al(OH)4],固体物质中含有Na2CrO4、Fe2O3、Na[Al(OH)4],加水Na[Al(OH)4]和Na2CrO4溶解,Fe2O3不溶于水,过滤除去,滤液中加入适量硫酸生成氢氧化铝沉淀过滤除去,得到含有Na2CrO4的滤液,经过处理得到Cr(OH)3沉淀,灼烧得到Cr2O3。
【详解】(1)基态Cr3+的核外电子排布式为[Ar]3d3,Na2S3中与SCl2为等电子体,其价层电子对数为2+=4,有两对孤电子对,空间构型为V形。
(2)高温氧化,Fe(CrO2)2与碳酸钠、氧气反应转化为Na2CrO4、Fe2O3,同时还有二氧化碳生成,化学方程式为4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2。
(3)研磨的目的是将固体磨成更小的颗粒,增大接触面积,提高浸取效率。
(4)除铝时加入了稀硫酸,要检验Cr(OH)3是否洗涤干净,只要检验洗涤液中是否还含有硫酸根离子即可,具体操作为取最后一次洗涤液少量于试管中,加入BaCl2溶液,若不产生沉淀,则沉淀洗涤干净。
(5)①固体加热过程中,先是Cr(OH)3受热分解,固体质量减少,然后是FeS被氧化为硫酸盐,固体质量增大,最后是FeOOH转化为氧化铁,固体质量再减少。故A→B固体质量增加的原因为FeS被氧化为硫酸盐。
②FeS被氧化,S从-2价变为+6价,Fe从+2价变为+3价,Na2CrO4得电子被还原,Cr从+6价转化为+3价,1L废水含有Na2CrO4物质的量为0.03mol,转移电子数为0.09mol,则被氧化的FeS物质的量为0.09mol÷9=0.01mol,质量为0.88g。
19.(1) 分液漏斗 σ BaSO4 否 可能SO2过量,溶解的SO2也能使KMnO4溶液褪色 13 3mol/L E
(2) 酸性条件下、有参与
【分析】为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,再滴加浓硫酸与铜加热反应生成二氧化硫、硫酸铜和水,二氧化硫既有还原性,又有氧化性,进行实验探究;
【详解】(1)①盛装浓硫酸的仪器名称为分液漏斗;②的中心原子N上的价层电子对数为3,中心原子通过sp2杂化轨道与O的2p轨道形成σ键;③SO2具有还原性,酸性条件下或Fe3+均能将SO2氧化为,故白色沉淀为BaSO4.④当SO2与Fe3+反应时,生成的Fe2+能使酸性高锰酸钾溶液褪色,如果在反应中SO2过量,过量的SO2也能使酸性高锰酸钾溶液褪色,因此该结论不正确;⑤如果要论证在酸性条件下是与SO2反应,则需要排除Fe3+的干扰,需要配制与硝酸铁溶液酸性相同,且浓度相同的溶液代替硝酸铁溶液,再验证是否有产生,因此用NaNO3和盐酸配成,浓度为3的溶液,替换装置B中的Fe(NO3)3溶液。⑥含SO2的尾气应用氢氧化钠溶液吸收;
(2)①对比两组实验可知,Cu与SO2在酸性条件下,有Cl 参与时才能发生反应。②由题中实验现象可知Cu、SO2和稀盐酸反应生成和Cu2S,其离子方程式为。
答案第1页,共2页
答案第1页,共2页
