2.3分子结构与物质的性质同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3分子结构与物质的性质同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 13:26:45 | ||
图片预览



文档简介
2.3分子结构与物质的性质同步练习
姓名()班级()学号()
一、选择题
1.臭氧在催化下能将烟气中的分别氧化为和。下列关于元素及其化合物的说法正确的是
A.原子半径: B.第一电离能:
C.沸点: D.电负性:
2.某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是
A.键长:MX3>ZX4 B.沸点:XQC.分子的极性:YQ33.下列陈述Ⅰ和Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 和都是非极性分子 易溶于
B 铁罐车可用于装运浓硝酸 常温下Fe与浓不反应
C 可用作葡萄酒的保鲜 有漂白性
D H-F键键能比H-Cl键大 HF的沸点高于HCl
A.A B.B C.C D.D
4.甲烷催化重整法制甲酸的物质转化过程如图所示。有关分析错误的是
A.反应过程中,既有极性键的断裂与形成,又有非极性键的形成与断裂
B.物质转化总反应为
C.反应Ⅱ前后,物质中所含键的总数未变
D.均为非极性分子,均为极性分子
5.下列有关范德华力的强弱对比正确的是
A.
B.CH3CH2CH2CH2CH3>
C.
D.
6.下列化学用语表示正确的是
A.和之间最强烈的氢键作用:
B.基态的价电子轨道表示式:
C.中Cr的化合价:+6价
D.反式聚异戊二烯的结构简式:
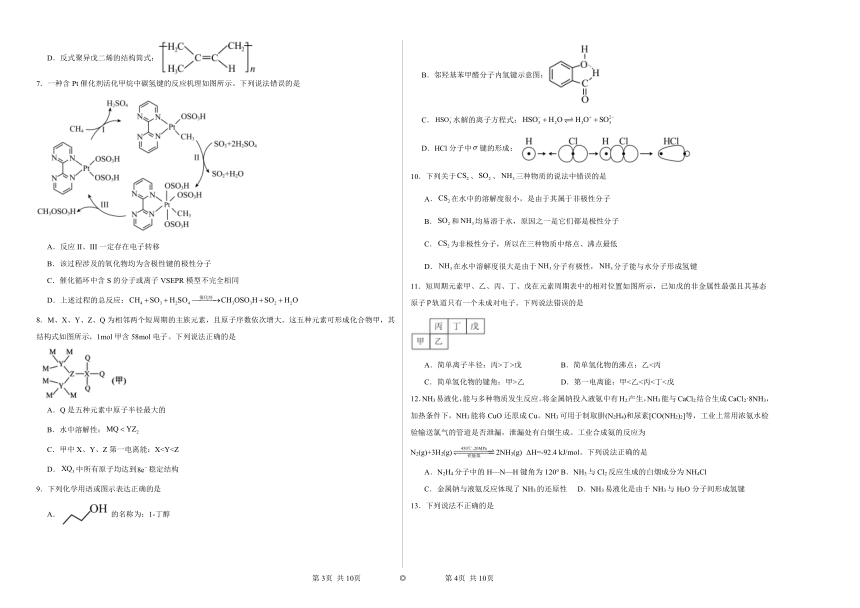
7.一种含Pt催化剂活化甲烷中碳氢键的反应机理如图所示。下列说法错误的是
A.反应II、III一定存在电子转移
B.该过程涉及的氧化物均为含极性键的极性分子
C.催化循环中含S的分子或离子VSEPR模型不完全相同
D.上述过程的总反应:
8.M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。这五种元素可形成化合物甲,其结构式如图所示,1mol甲含58mol电子。下列说法正确的是
A.Q是五种元素中原子半径最大的
B.水中溶解性:
C.甲中X、Y、Z第一电离能:XD.中所有原子均达到稳定结构
9.下列化学用语或图示表达正确的是
A.的名称为:1-丁醇
B.邻羟基苯甲醛分子内氢键示意图:
C.水解的离子方程式:
D.HCl分子中键的形成:
10.下列关于、、三种物质的说法中错误的是
A.在水中的溶解度很小,是由于其属于非极性分子
B.和均易溶于水,原因之一是它们都是极性分子
C.为非极性分子,所以在三种物质中熔点、沸点最低
D.在水中溶解度很大是由于分子有极性,分子能与水分子形成氢键
11.短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示,已知戊的非金属性最强且其基态原子轨道只有一个未成对电子。下列说法错误的是
A.简单离子半径:丙>丁>戊 B.简单氢化物的沸点:乙<丙
C.简单氢化物的键角:甲>乙 D.第一电离能:甲<乙<丙<丁<戊
12.NH3易液化,能与多种物质发生反应。将金属钠投入液氨中有H2产生,NH3能与CaCl2结合生成CaCl2·8NH3,加热条件下,NH3能将CuO还原成Cu。NH3可用于制取肼(N2H4)和尿素[CO(NH2)2]等,工业上常用浓氨水检验输送氯气的管道是否泄漏,泄漏处有白烟生成。工业合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol。下列说法正确的是
A.N2H4分子中的H—N—H键角为120° B.NH3与Cl2反应生成的白烟成分为NH4Cl
C.金属钠与液氨反应体现了NH3的还原性 D.NH3易液化是由于NH3与H2O分子间形成氢键
13.下列说法不正确的是
A.HClO分子空间构型为直线形,沸点:>
B.NCl3和PCl3分子中,电负性:N>P,键角:∠Cl-N-Cl>∠Cl-P-Cl
C.Mg原子的两种激发态[Ne]3s13p1和[Ne]3p2中,前者第二电离能更大
D.O3是空间结构为V形的弱极性分子,水中的溶解度大于O2,基态S原子核外电子的空间运动状态有9种
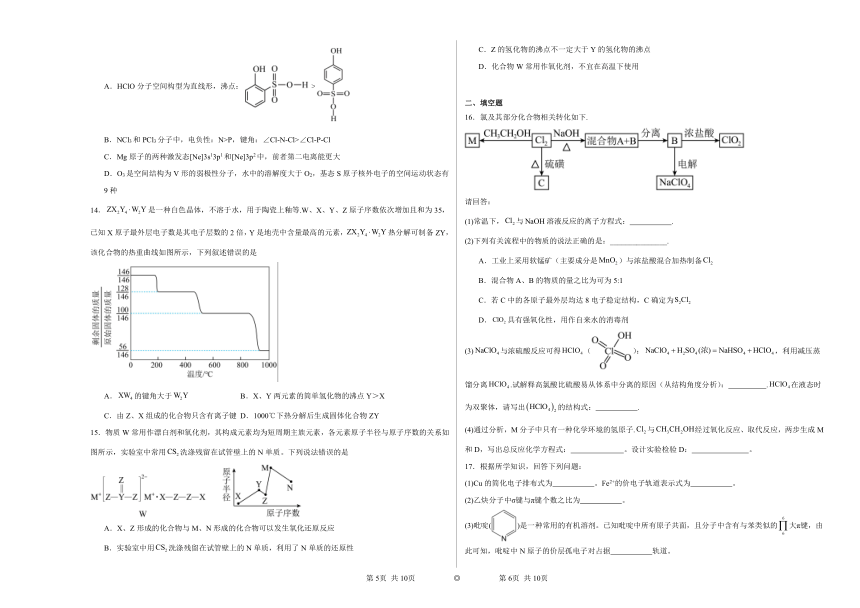
14.是一种白色晶体,不溶于水,用于陶瓷上釉等.W、X、Y、Z原子序数依次增加且和为35,已知X原子最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,热分解可制备ZY,该化合物的热重曲线如图所示,下列叙述错误的是
A.的键角大于 B.X、Y两元素的简单氢化物的沸点Y>X
C.由Z、X组成的化合物只含有离子键 D.1000℃下热分解后生成固体化合物ZY
15.物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,实验室中常用洗涤残留在试管壁上的N单质。下列说法错误的是
A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应
B.实验室中用洗涤残留在试管壁上的N单质,利用了N单质的还原性
C.Z的氢化物的沸点不一定大于Y的氢化物的沸点
D.化合物W常用作氧化剂,不宜在高温下使用
二、填空题
16.氯及其部分化合物相关转化如下.
请回答:
(1)常温下,与溶液反应的离子方程式: .
(2)下列有关流程中的物质的说法正确的是:_______________.
A.工业上采用软锰矿(主要成分是)与浓盐酸混合加热制备
B.混合物A、B的物质的量之比为可为5:1
C.若C中的各原子最外层均达8电子稳定结构,C确定为
D.具有强氧化性,用作自来水的消毒剂
(3)与浓硫酸反应可得():,利用减压蒸馏分离.试解释高氯酸比硫酸易从体系中分离的原因(从结构角度分析): .在液态时为双聚体,请写出的结构式: .
(4)通过分析,M分子中只有一种化学环境的氢原子.与经过氧化反应、取代反应,两步生成M和D,写出总反应化学方程式: 。设计实验检验D: 。
17.根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为 。Fe2+的价电子轨道表示式为 。
(2)乙炔分子中σ键与π键个数之比为 。
(3)吡啶()是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的大π键,由此可知,吡啶中N原子的价层孤电子对占据 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为 。
三、解答题
18.乙二醇单甲醚可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备和的热化学方程式为:
反应Ⅰ.
反应Ⅱ.
(1)已知,和的燃烧热分别为、和,则和直接合成的热化学方程式为 。
(2)在盛有催化剂的压力为恒压密闭容器中,按物质的量之比为充入和发生反应,在温度为区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
①时,反应进行到体系达到平衡状态,则用分压表示的反应速率 ,该温度下,反应Ⅰ的分压平衡常数 。(列出表达式即可)
②区间,和的平衡转化率随温度升高而明显升高的原因为 。
③温度高于时,随着温度的升高和平衡转化率差值逐渐减小的原因为 。
(3)和能够以任意比互溶的原因为 。
(4)通过实验探究催化剂组成对反应Ⅰ、Ⅱ的影响并探讨反应机理。
①通过实验所得如下表格数据分析,在同一生产周期内,在保证的产量的前提下,为尽可能提高的生产效率,应选择的催化剂质量比为 。
催化剂质量比 乙二醇转化率 乙二醇单甲醚选择性
纯 44 55
30 71
27 82
22 87
纯 10 94
②和在上述催化剂表面发生反应的机理如图所示,从结构角度解释结合的原因为 。
19.苯胺焦油是工业上催化制苯胺的副产物,主要成分为苯胺,含有少量铂族贵金属、活性炭和Na、K、Fe。回收其中贵金属Pt、Pd的工艺流程如下:
回答下列问题:
(1)“溶解”时
①溶解的目的是去除焦油中的苯胺,若采用直接焚烧的方法去除苯胺会生成 (写一种),造成环境污染。
②苯胺易溶于乙醇的原因为 。
(2)“还原Ⅰ”时,PtO2、PdO被还原为金属单质。反应前后碳原子的杂化方式由 变为 。
(3)“氧化浸出”时浸出液含、。
①王水是浓盐酸和浓硝酸体积比3:1的混合液,写出生成的离子反应方程式 。
②从原子结构角度分析两种配合物配位数不同的原因是 。
③下图为Pt、Pd浸出率与浸出温度关系图,氧化浸出需对温度适度控制,有关说法正确的是 (选填序号)。
a.温度控制在80℃左右
b.温度控制在120℃左右
c.温度越高浸出率越低的原因可能是挥发导致王水浓度降低
d.40℃时Pt的浸出率远低于Pd是因为温度低王水的氧化性弱
(4)“沉铂”时,已知。
①发生反应的化学反应方程式为 。
②若NH4Cl的投料以固液比0.0535:1(g : mL)时的消耗率为90%(忽略溶液体积变化),“沉铂”所得溶液中Pt元素的物质的量浓度为 mol L-1。
(5)“还原Ⅱ”时氧化产物为无毒气体,则该反应的氧化剂和还原剂的物质的量之比为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.同主族从上到下原子半径增大,同周期从左到右原子半径减小,原子半径:,故A错误;
B.根据第一电离能递变规律,第一电离能:,故B正确;
C.H2O和NH3都能形成分子间氢键,但是H2O中氢键更多,而H2S不能形成氢键,故沸点:,故C错误;
D.金属电负性一般小于非金属,N与O同周期,O的电负性大于N,电负性:,故D错误。
答案选B。
2.C
【分析】X、Y、Z、M、Q为原子序数依次增大的短周期元素,Q为非金属性最强的元素,则Q为F,根据该离子液体的结构知X、Q有一个价键,Z有四个价键,M有三个价键,Y得到一个电子形成四个价键,Z的原子序数等于X、Y原子序数之和,则X为H,Y为B,Z为C,M为N。可以推测出X、Y、Z、M、Q分别为H、B、C、N、F,据此作答。
【详解】A.MX3为NH3,ZX4为CH4,半径:C>N,键长NH3B.XQ为HF,MX3为NH3,均可以形成分子间氢键,F的电负性更大,形成的氢键更强,故沸点为:HF>NH3,故B错误;
C.根据价层电子互斥理论,YQ3为BF3,空间构型为平面三角形,为非极性分子,MQ3即NF3的空间构型为为三角锥形,为极性分子,故分子极性BF3D.M2为N2,存在三键,总键能:N2>F2,D错误;
故答案选C。
3.A
【详解】A.碘和四氯化碳都是非极性分子,由相似相溶原理可知,非极性分子点易溶于非极性分子四氯化碳,故A正确;
B.铁罐车可用于装运浓硝酸是因为铁在浓硝酸中钝化,致密的钝化膜阻碍反应的继续进行,并非不反应,故B错误;
C.二氧化硫可用作葡萄酒的保鲜是因为二氧化硫具有还原性,能防止红酒中的有效成分被氧化而达到延长红酒保质期,故C错误;
D.氟化氢的沸点高于氯化氢是因为氟化氢能形成分子间氢键,氯化氢不能形成分子间氢键,氟化氢的分子间作用力大于氯化氢,与氢氟键的键能大于氢氯键无关,故D错误;
故选A。
4.C
【详解】A.反应过程中,既有极性键C-H、O-H键断裂与形成,又有非极性键H-H键形成与断裂,故A正确;
B.根据流程图和元素守恒,甲烷和水反应生成甲酸和氢气,物质转化总反应为,故B正确;
C.反应Ⅱ是1molCH4和2molH2O反应生成1molCO2和4mol H2,反应前键为8mol,反应后键为6mol,所含键的总数有变化,故C错误;
D.分子结构对称,均为非极性分子;分子结构不对称,均为极性分子,故D正确;
选C。
5.B
【详解】A.CH4和CH3CH3的结构类似,前者的相对分子质量小于后者,故前者的范德华力小于后者,故A错误;
B.CH3CH2CH2CH2CH3与是同分异构体,相对分子质量相同,后者的支链比前者多,前者的分子之间的接触面积大于后者,范德华力也是前者大于后者,故B正确;
C.的极性小于,且两者相对分子质量相同,故的分子间的范德华力大于,故C错误;
D.SO2的相对分子质量大于CO2,且SO2是极性分子,CO2是非极性分子,故SO2的分子间范德华力大于CO2,故D错误;
故选B。
6.C
【详解】A.和之间最强烈的氢键作用:,故A错误;
B.基态的价电子轨道表示式:,故B错误;
C. 中中心原子与氧共用六对电子对,且偏向氧,故Cr的化合价为+6价,故C正确;
D.该结构简式为顺式聚异戊二烯,故D错误;
故选:C。
7.B
【详解】A.反应Ⅱ、Ⅲ过程中有S元素化合价发生改变,发生的是氧化还原反应,故一定有电子转移,A正确;
B.该过程涉及的氧化物有SO2、SO3,SO2为含极性键的极性分子,SO3为含极性键的非极性分子,B错误;
C.SO2、SO3中S原子的价层电子对数都为3,二者VSEPR模型均为平面三角形;而中S的价层电子对数为4,VSEPR模型为四面体形,故催化循环中S的VSEPR模型不完全相同,C正确;
D.根据反应机理图,上述过程的总反应为CH4+SO3+H2SO4 CH3OSO3H+SO2+H2O,D正确;
本题选B。
8.C
【分析】M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。M的原子序数最小,且在化合物甲中形成一个共价键,则M为H;X、Y、Z、Q为第二周期元素。根据它们在化合物甲中形成化学键的个数可知,X为B(形成了一个配位键),Y为C,Z为O(和B形成一个配位键),Q为F,符合1mol甲含58mol电子。
【详解】A.F位于第二周期第ⅦA族,是第二周期元素原子半径最小的(除了稀有气体),故A错误;
B.HF能和水形成氢键,而CO2不能和水形成氢键,所以HF在水中的溶解度大于CO2在水中的溶解度,故B错误;
C.O与C、B处于同周期,同周期元素从左到右第一电离能增强,但第IIA族和VA族反常,所以第一电离能:BD.BF3中B原子没有达到8电子稳定结构,B最外层只有6个电子,故D错误;
故选C。
9.D
【详解】A.的名称为:1-丙醇,A错误;
B.邻羟基苯甲醛分子内氢键应为醛基中氧原子与羟基中氢原子之间形成,B错误;
C.水解的离子方程式:,C错误;
D.HCl分子中键为H的1s轨道和Cl的3p轨道的头碰头重叠,其形成可表示为:,D正确;
故选D。
10.C
【详解】A.H2O是极性分子,CS2是非极性分子,根据相似相溶原理可知,CS2在水中溶解度很小,故A正确;
B.SO2和NH3都是极性分子,水也是极性分子,根据相似相溶原理可知,二者均易溶于水,故B正确;
C.CS2常温下是液体,SO2和NH3常温下都是气体,所以CS2在三种物质中熔点、沸点最高,故C错误;
D.NH3在水中溶解度很大,除了因为NH3分子有极性外,还因为NH3分子能与水反应,NH3分子和H2O分子之间可以形成氢键,故D正确;
故答案为:C。
11.D
【分析】戊的非金属性最强且其基态原子轨道只有一个未成对电子,则电子排布式为1s22s22p5,戊是,则甲是,乙是,丙是,丁是;
【详解】A.具有相同电子层结构的离子,核电荷数越大半径越小,离子半径:,A正确;
B.分子间存在氢键,沸点更高,B正确;
C.两个分子的中心原子都是杂化,有一对孤对电子,键角比的小,C正确;
D.N的2p电子半满为稳定结构,所以第一电离能N>O,D错误;
答案选D。
12.B
【详解】A.N2H4分子中N原子为sp3杂化,且N原子含1对孤对电子,不是平面三角形,H-N-H键角小于120°,故A错误;
B.氨气与氯气反应生成氯化铵与氮气,则白烟成分为NH4Cl,故B正确;
C.钠与氨气反应生成氢气和NaNH2,H元素的化合价降低,则氨气具有氧化性,故C错误;
D.氨气分子间含氢键、沸点高,则氨气易液化,故D错误。
答案选B。
13.A
【详解】A.次氯酸中心氧原子的价层电子对数为=4,含有2对孤电子对,空间构型为V形,形成分子内氢键,降低沸点,形成分子间氢键,升高沸点,故沸点<,A错误;
B.当中心原子的电负性增大时,其孤电子对的吸引力增强,周围原子与中心原子之间的键键距离缩短,形成的化学键变得更紧密,这会导致分子中的键角变大,NCl3和PCl3分子中,电负性:N>P,键角:∠Cl-N-Cl>∠Cl-P-Cl,B正确;
C.Mg的激发态[Ne]3s13p1第二电离能失去3s1,激发态[Ne]3p2中第二电离能失去3p1,3p能量高,需要能量少,则前者第二电离能更大,C正确;
D.臭氧是空间结构为V形的极性分子,氧气是非极性分子,水是极性分子,根据相似相溶规则可知,臭氧在水中的溶解度大于氧气,D正确;
综上所述答案为:A。
14.C
【分析】ZX2Y4·W2Y是一种白色晶体粉末,不溶于水,用于陶瓷上釉等。W、X、Y、Z 为前 20 号元素,已知 X、Y 原子最外层电子数分别是其电子层数的 2 倍、3 倍,则X为C、Y为O,W为H,原子序数依次增加,且加和为 35,则Z原子序数20、为Ca ,ZX2Y4·W2Y 为CaC2O4.H2O ,以此分析;
【详解】A.XW4的为CH4,W2Y为H2O,两个分子均为sp3杂化,H2O分子中存在孤电子对,则键角CH4>H2O,A正确;
B.X为C、Y为O,简单氢化物为CH4、H2O,H2O分子间存在氢键,则沸点高,则沸点H2O>CH4,B正确;
C.ZX2即CaC2属于离子化合物,含有共价键、离子键,C错误;
D.CaC2O4.H2O的相对分子质量为146,CaCO3的相对分子质量为100,由钙元素守恒及图中纵坐标分析可知,热分解可制备CaO,碳酸钙高温分解可得CaO,D正确;
故答案为:C。
15.B
【分析】物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,X位于第一周期,为H元素,Y、Z位于第二周期,M、N位于第三周期;实验室中常用CS2洗涤残留在试管壁上的N单质,则N为S元素;Y形成4个共价键,Z形成2个共价键,M形成的+1价阳离子,则Y为C元素,Z为O元素,M为Na元素,以此分析解答。
【详解】根据分析可知,X为H元素,Y为C元素,Z为O元素,M为Na元素,N为S元素,
A.X、Z形成的化合物为水和过氧化氢,M、N形成的化合物为硫化钠,过氧化氢能够与硫化钠发生氧化还原反应,故A正确;
B.N的单质为硫,硫单质为非极性分子,CS2为非极性溶剂,根据相似相溶原理,硫单质易溶于CS2,所以实验室中用CS2洗涤残留在试管壁上的硫单质,与S单质的还原性无关,故B错误;
C.Y的氢化物为烃,Z的氢化物为水、双氧水,碳原子数较多的烃常温下为固态,其沸点大于水和双氧水,Z的氢化物的沸点不一定大于Y的氢化物的沸点,故C正确;
D.W分子中含有H-O-O-H结构,结合过氧化氢的性质可知,化合物W具有强氧化性,可用作氧化剂,但过氧化氢不稳定,该物质不宜在高温下使用,故D正确。
答案选B。
16.(1)
(2)BD
(3) 分子间氢键比高氯酸多,分子间作用力较大,沸点高于.
(4) 气体D通入紫色石蕊试液,溶液变红,通入硝酸银,生成白色沉淀,则为.
【分析】Cl2与硫黄在加热条件下可以生成SCl2或者S2Cl2,与乙醇发生氧化反应和取代反应,与氢氧化钠溶液加热生成氯酸钠和氯化钠,氯酸钠电解得到高氯酸钠,氯酸钠与浓盐酸反应生成ClO2。
【详解】(1)常温下氯气与氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:;
(2)A.工业上制氯气用电解饱和的食盐水,A错误;
B.B是氯酸钠,Cl2与NaOH加热反应的方程式为3Cl2+6NaOH5NaCl+NaClO3+3H2O,混合物A、B的物质的量之比为可为5:1,B正确;
C.若C中的各原子最外层均达8电子稳定结构,C也可以为SCl2,C错误;
D.中的Cl为+4价,具有强氧化性,用作自来水的消毒剂,D正确;
正确的答案是BD;
(3)H2SO4和HClO4都是分子晶体,分子间氢键比高氯酸多,分子间作用力较大,沸点高于,高氯酸比硫酸易从体系中分离;
在液态时通过氢键形成双聚体,的结构式:;
(4)与经过氧化反应羟基变为醛基,经过取代反应甲基上的氢原子被氯原子取代,由于M分子中只有一种化学环境的氢原子,甲基上三个氢原子全部被取代,M的结构简式为:CCl3CHO,D为HCl,总反应化学方程式:;
证明D为HCl的方法是:气体D通入紫色石蕊试液,溶液变红,通入硝酸银,生成白色沉淀,则为。
17.(1) [Ar]3d104s1
(2)3:2
(3)sp2杂化
(4)NH3>AsH3>PH3
(5)BF3>SiF4>NF3
(6)NH4H+H2O=NH3 H2O+H2↑
【详解】(1)Cu的原子序数为29,其基态简化的电子排布式为[Ar]3d104s1,Fe是第26号元素,其电子排布式为[Ar]3d64s2,则Fe2+的价电子排布式为3d6,轨道表示式为。
(2)乙炔的结构式为H-CC-H,单键为σ键,三键中有一个σ键,两个π键,则乙炔分子中σ键与π键个数之比为3:2。
(3)吡啶中含有与苯类似的大π键,由此可知,吡啶中N原子采取sp2杂化,三条杂化轨道中的两条杂化轨道各有一个电子,分别和两个碳原子形成σ键,另外一个杂化轨道容纳一对电子,未杂化的p轨道和碳原子的未杂化的p轨道形成大π键,所以N原子的价层孤电子对占据sp2杂化轨道。
(4)NH3、PH3、AsH3是同主族元素的氢化物,NH3分子间存在氢键,其沸点最高,PH3和AsH3的沸点由相对分子质量决定,相对分子质量越大,分子间作用力越大,沸点越高,所以NH3、PH3、AsH3按照沸点由高到低排序,依次为NH3>AsH3>PH3。
(5)BF3中B原子的价层电子对数=3+=3,分子空间结构为平面三角形,键角为120°,SiF4中的Si原子的价层电子对数=4+,分子的空间结构为正四面体,键角为109°28′,NF3中的N原子的价层电子对数=3+,VSEPR模型为四面体形,由于中心原子上有一孤电子对,所以分子的空间结构为三角锥形,键角小于109°28′,所以BF3、SiF4、NF3按照键角由大到小排序,依次为BF3>SiF4>NF3。
(6)离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,则该物质阳离子为,阴离子为H-,化学式为NH4H,和水反应生成一种一元弱碱和一种单质气体。该反应的化学方程式为NH4H+H2O=NH3 H2O+H2↑。
18.(1)
(2) 温度升高,变为气体逸出,导致反应Ⅰ正向移动,使得两者的转化率增高 温度高于时,产物主要为,而几乎没有,故此时反应以反应Ⅱ为主,反应中和的系数比为1:1,使得随着温度的升高和平衡转化率差值逐渐减小
(3)均能与水形成氢键
(4) 纯 中羟基氧电负性大且存在孤电子对,氢离子能提供空轨道,两者结合形成共价键
【详解】(1)燃烧热是在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量;则:
①=-
②=-
③=-
④=-
由盖斯定律可知,①+②-③+④得:;
(2)①反应Ⅰ、Ⅱ均为分子数不变的反应,设和投料分别为3mol、1mol;时,反应进行到体系达到平衡状态,转化率为0.6559,则用分压表示的反应速率;
则、、、分别为0.00076mol、1.0323mol、0.03078mol、1.9677mol,反应Ⅰ、Ⅱ均为分子数不变的反应,可以用物质的量代替物质分压,则该温度下,反应Ⅰ的分压平衡常数;
②由图可知,区间,和的平衡转化率随温度升高而明显升高的原因为温度升高,变为气体逸出,导致反应Ⅰ正向移动,使得两者的转化率增高;
③由图可知,温度高于时,产物主要为,而几乎没有,故此时反应以反应Ⅱ为主,反应中和的系数比为1:1,故温度高于时,随着温度的升高和平衡转化率差值逐渐减小;
(3)和能够以任意比互溶的原因为均能与水形成氢键;
(4)①由表可知,纯为催化剂时,得到生产效率最大,故应选择的催化剂质量比为:;
②中羟基氧电负性大且存在孤电子对,氢离子能提供空轨道,两者结合形成共价键,使得在上述催化剂表面发生反应结合。
19.(1) NO、NO2、NOx、粉尘、含碳粉尘等任意一种即可 苯胺与乙醇存在分子间氢键
(2) sp2 sp
(3) 两种配合物中心原子Pt的原子半径比Pd大 bc
(4) 5.2×10-4
(5)1:1
【分析】苯胺焦油是工业上催化制苯胺的副产物,主要成分为苯胺,含有少量铂族贵金属、活性炭和Na、K、Fe。将苯胺焦油中加入乙醇溶解,苯胺溶解在乙醇中,铂族贵金属、活性炭和Na、K、Fe不溶;将不溶物在空气中焚烧,活性炭转化为CO2,Na、K、Fe转化为金属氧化物,Pt、Pd转化为PtO2、PdO等;用HCOOH还原金属氧化物,PtO2、PdO转化为Pt、Pd;用王水氧化浸出,Pt、Pd转化为、和NO等;用NH4Cl沉铂,铂元素转化为(NH4)2PtCl6,用N2H4 H2O进行还原,便可获得海绵铂。
【详解】(1)①溶解的目的是去除焦油中的苯胺,若采用直接焚烧的方法去除苯胺,活性炭燃烧生成二氧化碳,苯胺燃烧生成碳、碳的氧化物、氮的氧化物等,会生成:NO、NO2、NOx、粉尘、含碳粉尘等任意一种即可,造成环境污染。
②苯胺与乙醇分子间能形成氢键,则苯胺易溶于乙醇的原因为:苯胺与乙醇存在分子间氢键。
(2)“还原Ⅰ”时,PtO2、PdO被HCOOH还原为金属单质,同时生成CO2。在HCOOH、CO2中,碳原子的价层电子对数为3、2,则碳原子的杂化方式由sp2变为sp。
(3)①王水是浓盐酸和浓硝酸体积比3:1的混合液,Pd与王水反应,生成等,离子反应方程式为。
②两种配合物、中,由于Pt和Pd的原子半径不同,造成配位数不同,原因是:两种配合物中心原子Pt的原子半径比Pd大。
③a.从图中可以看出,80℃左右Pt、Pd浸出率低于120℃左右Pt、Pd浸出率,a不正确;
b.由a分析可知,温度应控制在120℃左右,b正确;
c.浓盐酸、浓硝酸受热都易挥发,则温度越高浸出率越低的原因可能是挥发导致王水浓度降低,c正确;
d.40℃时Pt的浸出率远低于Pd是因为温度低时,较难形成,d不正确;
故选bc。
(4)①“沉铂”时,NH4Cl与H2[PtCl6]反应,转化为(NH4)2PtCl6和HCl,发生反应的化学反应方程式为。
②若NH4Cl的投料以固液比0.0535:1(g : mL)时,c(NH4Cl)==1mol/L,的消耗率为90%,则溶液中c(NH4Cl)=1mol/L×10%=0.1mol/L,,则0.12×c([PtCl6]2-)=5.2×10-6,c([PtCl6]2-)=5.2×10-4mol L-1,则“沉铂”所得溶液中Pt元素的物质的量浓度为c([PtCl6]2-)=5.2×10-4mol L-1。
(5)“还原Ⅱ”时氧化产物中无毒气体为N2,依据得失电子守恒,可建立关系式:(NH4)2PtCl6—— N2H4 H2O,则该反应的氧化剂和还原剂的物质的量之比为1:1。
【点睛】建立关系式求解,常依据元素守恒或得失电子守恒。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、选择题
1.臭氧在催化下能将烟气中的分别氧化为和。下列关于元素及其化合物的说法正确的是
A.原子半径: B.第一电离能:
C.沸点: D.电负性:
2.某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是
A.键长:MX3>ZX4 B.沸点:XQ
选项 陈述Ⅰ 陈述Ⅱ
A 和都是非极性分子 易溶于
B 铁罐车可用于装运浓硝酸 常温下Fe与浓不反应
C 可用作葡萄酒的保鲜 有漂白性
D H-F键键能比H-Cl键大 HF的沸点高于HCl
A.A B.B C.C D.D
4.甲烷催化重整法制甲酸的物质转化过程如图所示。有关分析错误的是
A.反应过程中,既有极性键的断裂与形成,又有非极性键的形成与断裂
B.物质转化总反应为
C.反应Ⅱ前后,物质中所含键的总数未变
D.均为非极性分子,均为极性分子
5.下列有关范德华力的强弱对比正确的是
A.
B.CH3CH2CH2CH2CH3>
C.
D.
6.下列化学用语表示正确的是
A.和之间最强烈的氢键作用:
B.基态的价电子轨道表示式:
C.中Cr的化合价:+6价
D.反式聚异戊二烯的结构简式:
7.一种含Pt催化剂活化甲烷中碳氢键的反应机理如图所示。下列说法错误的是
A.反应II、III一定存在电子转移
B.该过程涉及的氧化物均为含极性键的极性分子
C.催化循环中含S的分子或离子VSEPR模型不完全相同
D.上述过程的总反应:
8.M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。这五种元素可形成化合物甲,其结构式如图所示,1mol甲含58mol电子。下列说法正确的是
A.Q是五种元素中原子半径最大的
B.水中溶解性:
C.甲中X、Y、Z第一电离能:X
9.下列化学用语或图示表达正确的是
A.的名称为:1-丁醇
B.邻羟基苯甲醛分子内氢键示意图:
C.水解的离子方程式:
D.HCl分子中键的形成:
10.下列关于、、三种物质的说法中错误的是
A.在水中的溶解度很小,是由于其属于非极性分子
B.和均易溶于水,原因之一是它们都是极性分子
C.为非极性分子,所以在三种物质中熔点、沸点最低
D.在水中溶解度很大是由于分子有极性,分子能与水分子形成氢键
11.短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如图所示,已知戊的非金属性最强且其基态原子轨道只有一个未成对电子。下列说法错误的是
A.简单离子半径:丙>丁>戊 B.简单氢化物的沸点:乙<丙
C.简单氢化物的键角:甲>乙 D.第一电离能:甲<乙<丙<丁<戊
12.NH3易液化,能与多种物质发生反应。将金属钠投入液氨中有H2产生,NH3能与CaCl2结合生成CaCl2·8NH3,加热条件下,NH3能将CuO还原成Cu。NH3可用于制取肼(N2H4)和尿素[CO(NH2)2]等,工业上常用浓氨水检验输送氯气的管道是否泄漏,泄漏处有白烟生成。工业合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol。下列说法正确的是
A.N2H4分子中的H—N—H键角为120° B.NH3与Cl2反应生成的白烟成分为NH4Cl
C.金属钠与液氨反应体现了NH3的还原性 D.NH3易液化是由于NH3与H2O分子间形成氢键
13.下列说法不正确的是
A.HClO分子空间构型为直线形,沸点:>
B.NCl3和PCl3分子中,电负性:N>P,键角:∠Cl-N-Cl>∠Cl-P-Cl
C.Mg原子的两种激发态[Ne]3s13p1和[Ne]3p2中,前者第二电离能更大
D.O3是空间结构为V形的弱极性分子,水中的溶解度大于O2,基态S原子核外电子的空间运动状态有9种
14.是一种白色晶体,不溶于水,用于陶瓷上釉等.W、X、Y、Z原子序数依次增加且和为35,已知X原子最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,热分解可制备ZY,该化合物的热重曲线如图所示,下列叙述错误的是
A.的键角大于 B.X、Y两元素的简单氢化物的沸点Y>X
C.由Z、X组成的化合物只含有离子键 D.1000℃下热分解后生成固体化合物ZY
15.物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,实验室中常用洗涤残留在试管壁上的N单质。下列说法错误的是
A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应
B.实验室中用洗涤残留在试管壁上的N单质,利用了N单质的还原性
C.Z的氢化物的沸点不一定大于Y的氢化物的沸点
D.化合物W常用作氧化剂,不宜在高温下使用
二、填空题
16.氯及其部分化合物相关转化如下.
请回答:
(1)常温下,与溶液反应的离子方程式: .
(2)下列有关流程中的物质的说法正确的是:_______________.
A.工业上采用软锰矿(主要成分是)与浓盐酸混合加热制备
B.混合物A、B的物质的量之比为可为5:1
C.若C中的各原子最外层均达8电子稳定结构,C确定为
D.具有强氧化性,用作自来水的消毒剂
(3)与浓硫酸反应可得():,利用减压蒸馏分离.试解释高氯酸比硫酸易从体系中分离的原因(从结构角度分析): .在液态时为双聚体,请写出的结构式: .
(4)通过分析,M分子中只有一种化学环境的氢原子.与经过氧化反应、取代反应,两步生成M和D,写出总反应化学方程式: 。设计实验检验D: 。
17.根据所学知识,回答下列问题:
(1)Cu的简化电子排布式为 。Fe2+的价电子轨道表示式为 。
(2)乙炔分子中σ键与π键个数之比为 。
(3)吡啶()是一种常用的有机溶剂。已知吡啶中所有原子共面,且分子中含有与苯类似的大π键,由此可知,吡啶中N原子的价层孤电子对占据 轨道。
(4)NH3、PH3、AsH3按照沸点由高到低排序,依次为 。
(5)BF3、SiF4、NF3按照键角由大到小排序,依次为 。
(6)科学家合成了一种新型离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,该物质遇水会发生水解,生成一种一元弱碱和一种单质气体。该反应的化学方程式为 。
三、解答题
18.乙二醇单甲醚可用作喷气式飞机燃料的防病添加剂,乙二醇二甲醚作为柴油添加剂,能显著降低污染物的排放量。通过乙二醇和甲醇反应制备和的热化学方程式为:
反应Ⅰ.
反应Ⅱ.
(1)已知,和的燃烧热分别为、和,则和直接合成的热化学方程式为 。
(2)在盛有催化剂的压力为恒压密闭容器中,按物质的量之比为充入和发生反应,在温度为区间内,反应物的平衡转化率及体系气液平衡组成与温度关系分别如图1和图2所示。
①时,反应进行到体系达到平衡状态,则用分压表示的反应速率 ,该温度下,反应Ⅰ的分压平衡常数 。(列出表达式即可)
②区间,和的平衡转化率随温度升高而明显升高的原因为 。
③温度高于时,随着温度的升高和平衡转化率差值逐渐减小的原因为 。
(3)和能够以任意比互溶的原因为 。
(4)通过实验探究催化剂组成对反应Ⅰ、Ⅱ的影响并探讨反应机理。
①通过实验所得如下表格数据分析,在同一生产周期内,在保证的产量的前提下,为尽可能提高的生产效率,应选择的催化剂质量比为 。
催化剂质量比 乙二醇转化率 乙二醇单甲醚选择性
纯 44 55
30 71
27 82
22 87
纯 10 94
②和在上述催化剂表面发生反应的机理如图所示,从结构角度解释结合的原因为 。
19.苯胺焦油是工业上催化制苯胺的副产物,主要成分为苯胺,含有少量铂族贵金属、活性炭和Na、K、Fe。回收其中贵金属Pt、Pd的工艺流程如下:
回答下列问题:
(1)“溶解”时
①溶解的目的是去除焦油中的苯胺,若采用直接焚烧的方法去除苯胺会生成 (写一种),造成环境污染。
②苯胺易溶于乙醇的原因为 。
(2)“还原Ⅰ”时,PtO2、PdO被还原为金属单质。反应前后碳原子的杂化方式由 变为 。
(3)“氧化浸出”时浸出液含、。
①王水是浓盐酸和浓硝酸体积比3:1的混合液,写出生成的离子反应方程式 。
②从原子结构角度分析两种配合物配位数不同的原因是 。
③下图为Pt、Pd浸出率与浸出温度关系图,氧化浸出需对温度适度控制,有关说法正确的是 (选填序号)。
a.温度控制在80℃左右
b.温度控制在120℃左右
c.温度越高浸出率越低的原因可能是挥发导致王水浓度降低
d.40℃时Pt的浸出率远低于Pd是因为温度低王水的氧化性弱
(4)“沉铂”时,已知。
①发生反应的化学反应方程式为 。
②若NH4Cl的投料以固液比0.0535:1(g : mL)时的消耗率为90%(忽略溶液体积变化),“沉铂”所得溶液中Pt元素的物质的量浓度为 mol L-1。
(5)“还原Ⅱ”时氧化产物为无毒气体,则该反应的氧化剂和还原剂的物质的量之比为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.同主族从上到下原子半径增大,同周期从左到右原子半径减小,原子半径:,故A错误;
B.根据第一电离能递变规律,第一电离能:,故B正确;
C.H2O和NH3都能形成分子间氢键,但是H2O中氢键更多,而H2S不能形成氢键,故沸点:,故C错误;
D.金属电负性一般小于非金属,N与O同周期,O的电负性大于N,电负性:,故D错误。
答案选B。
2.C
【分析】X、Y、Z、M、Q为原子序数依次增大的短周期元素,Q为非金属性最强的元素,则Q为F,根据该离子液体的结构知X、Q有一个价键,Z有四个价键,M有三个价键,Y得到一个电子形成四个价键,Z的原子序数等于X、Y原子序数之和,则X为H,Y为B,Z为C,M为N。可以推测出X、Y、Z、M、Q分别为H、B、C、N、F,据此作答。
【详解】A.MX3为NH3,ZX4为CH4,半径:C>N,键长NH3
C.根据价层电子互斥理论,YQ3为BF3,空间构型为平面三角形,为非极性分子,MQ3即NF3的空间构型为为三角锥形,为极性分子,故分子极性BF3
故答案选C。
3.A
【详解】A.碘和四氯化碳都是非极性分子,由相似相溶原理可知,非极性分子点易溶于非极性分子四氯化碳,故A正确;
B.铁罐车可用于装运浓硝酸是因为铁在浓硝酸中钝化,致密的钝化膜阻碍反应的继续进行,并非不反应,故B错误;
C.二氧化硫可用作葡萄酒的保鲜是因为二氧化硫具有还原性,能防止红酒中的有效成分被氧化而达到延长红酒保质期,故C错误;
D.氟化氢的沸点高于氯化氢是因为氟化氢能形成分子间氢键,氯化氢不能形成分子间氢键,氟化氢的分子间作用力大于氯化氢,与氢氟键的键能大于氢氯键无关,故D错误;
故选A。
4.C
【详解】A.反应过程中,既有极性键C-H、O-H键断裂与形成,又有非极性键H-H键形成与断裂,故A正确;
B.根据流程图和元素守恒,甲烷和水反应生成甲酸和氢气,物质转化总反应为,故B正确;
C.反应Ⅱ是1molCH4和2molH2O反应生成1molCO2和4mol H2,反应前键为8mol,反应后键为6mol,所含键的总数有变化,故C错误;
D.分子结构对称,均为非极性分子;分子结构不对称,均为极性分子,故D正确;
选C。
5.B
【详解】A.CH4和CH3CH3的结构类似,前者的相对分子质量小于后者,故前者的范德华力小于后者,故A错误;
B.CH3CH2CH2CH2CH3与是同分异构体,相对分子质量相同,后者的支链比前者多,前者的分子之间的接触面积大于后者,范德华力也是前者大于后者,故B正确;
C.的极性小于,且两者相对分子质量相同,故的分子间的范德华力大于,故C错误;
D.SO2的相对分子质量大于CO2,且SO2是极性分子,CO2是非极性分子,故SO2的分子间范德华力大于CO2,故D错误;
故选B。
6.C
【详解】A.和之间最强烈的氢键作用:,故A错误;
B.基态的价电子轨道表示式:,故B错误;
C. 中中心原子与氧共用六对电子对,且偏向氧,故Cr的化合价为+6价,故C正确;
D.该结构简式为顺式聚异戊二烯,故D错误;
故选:C。
7.B
【详解】A.反应Ⅱ、Ⅲ过程中有S元素化合价发生改变,发生的是氧化还原反应,故一定有电子转移,A正确;
B.该过程涉及的氧化物有SO2、SO3,SO2为含极性键的极性分子,SO3为含极性键的非极性分子,B错误;
C.SO2、SO3中S原子的价层电子对数都为3,二者VSEPR模型均为平面三角形;而中S的价层电子对数为4,VSEPR模型为四面体形,故催化循环中S的VSEPR模型不完全相同,C正确;
D.根据反应机理图,上述过程的总反应为CH4+SO3+H2SO4 CH3OSO3H+SO2+H2O,D正确;
本题选B。
8.C
【分析】M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。M的原子序数最小,且在化合物甲中形成一个共价键,则M为H;X、Y、Z、Q为第二周期元素。根据它们在化合物甲中形成化学键的个数可知,X为B(形成了一个配位键),Y为C,Z为O(和B形成一个配位键),Q为F,符合1mol甲含58mol电子。
【详解】A.F位于第二周期第ⅦA族,是第二周期元素原子半径最小的(除了稀有气体),故A错误;
B.HF能和水形成氢键,而CO2不能和水形成氢键,所以HF在水中的溶解度大于CO2在水中的溶解度,故B错误;
C.O与C、B处于同周期,同周期元素从左到右第一电离能增强,但第IIA族和VA族反常,所以第一电离能:B
故选C。
9.D
【详解】A.的名称为:1-丙醇,A错误;
B.邻羟基苯甲醛分子内氢键应为醛基中氧原子与羟基中氢原子之间形成,B错误;
C.水解的离子方程式:,C错误;
D.HCl分子中键为H的1s轨道和Cl的3p轨道的头碰头重叠,其形成可表示为:,D正确;
故选D。
10.C
【详解】A.H2O是极性分子,CS2是非极性分子,根据相似相溶原理可知,CS2在水中溶解度很小,故A正确;
B.SO2和NH3都是极性分子,水也是极性分子,根据相似相溶原理可知,二者均易溶于水,故B正确;
C.CS2常温下是液体,SO2和NH3常温下都是气体,所以CS2在三种物质中熔点、沸点最高,故C错误;
D.NH3在水中溶解度很大,除了因为NH3分子有极性外,还因为NH3分子能与水反应,NH3分子和H2O分子之间可以形成氢键,故D正确;
故答案为:C。
11.D
【分析】戊的非金属性最强且其基态原子轨道只有一个未成对电子,则电子排布式为1s22s22p5,戊是,则甲是,乙是,丙是,丁是;
【详解】A.具有相同电子层结构的离子,核电荷数越大半径越小,离子半径:,A正确;
B.分子间存在氢键,沸点更高,B正确;
C.两个分子的中心原子都是杂化,有一对孤对电子,键角比的小,C正确;
D.N的2p电子半满为稳定结构,所以第一电离能N>O,D错误;
答案选D。
12.B
【详解】A.N2H4分子中N原子为sp3杂化,且N原子含1对孤对电子,不是平面三角形,H-N-H键角小于120°,故A错误;
B.氨气与氯气反应生成氯化铵与氮气,则白烟成分为NH4Cl,故B正确;
C.钠与氨气反应生成氢气和NaNH2,H元素的化合价降低,则氨气具有氧化性,故C错误;
D.氨气分子间含氢键、沸点高,则氨气易液化,故D错误。
答案选B。
13.A
【详解】A.次氯酸中心氧原子的价层电子对数为=4,含有2对孤电子对,空间构型为V形,形成分子内氢键,降低沸点,形成分子间氢键,升高沸点,故沸点<,A错误;
B.当中心原子的电负性增大时,其孤电子对的吸引力增强,周围原子与中心原子之间的键键距离缩短,形成的化学键变得更紧密,这会导致分子中的键角变大,NCl3和PCl3分子中,电负性:N>P,键角:∠Cl-N-Cl>∠Cl-P-Cl,B正确;
C.Mg的激发态[Ne]3s13p1第二电离能失去3s1,激发态[Ne]3p2中第二电离能失去3p1,3p能量高,需要能量少,则前者第二电离能更大,C正确;
D.臭氧是空间结构为V形的极性分子,氧气是非极性分子,水是极性分子,根据相似相溶规则可知,臭氧在水中的溶解度大于氧气,D正确;
综上所述答案为:A。
14.C
【分析】ZX2Y4·W2Y是一种白色晶体粉末,不溶于水,用于陶瓷上釉等。W、X、Y、Z 为前 20 号元素,已知 X、Y 原子最外层电子数分别是其电子层数的 2 倍、3 倍,则X为C、Y为O,W为H,原子序数依次增加,且加和为 35,则Z原子序数20、为Ca ,ZX2Y4·W2Y 为CaC2O4.H2O ,以此分析;
【详解】A.XW4的为CH4,W2Y为H2O,两个分子均为sp3杂化,H2O分子中存在孤电子对,则键角CH4>H2O,A正确;
B.X为C、Y为O,简单氢化物为CH4、H2O,H2O分子间存在氢键,则沸点高,则沸点H2O>CH4,B正确;
C.ZX2即CaC2属于离子化合物,含有共价键、离子键,C错误;
D.CaC2O4.H2O的相对分子质量为146,CaCO3的相对分子质量为100,由钙元素守恒及图中纵坐标分析可知,热分解可制备CaO,碳酸钙高温分解可得CaO,D正确;
故答案为:C。
15.B
【分析】物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,X位于第一周期,为H元素,Y、Z位于第二周期,M、N位于第三周期;实验室中常用CS2洗涤残留在试管壁上的N单质,则N为S元素;Y形成4个共价键,Z形成2个共价键,M形成的+1价阳离子,则Y为C元素,Z为O元素,M为Na元素,以此分析解答。
【详解】根据分析可知,X为H元素,Y为C元素,Z为O元素,M为Na元素,N为S元素,
A.X、Z形成的化合物为水和过氧化氢,M、N形成的化合物为硫化钠,过氧化氢能够与硫化钠发生氧化还原反应,故A正确;
B.N的单质为硫,硫单质为非极性分子,CS2为非极性溶剂,根据相似相溶原理,硫单质易溶于CS2,所以实验室中用CS2洗涤残留在试管壁上的硫单质,与S单质的还原性无关,故B错误;
C.Y的氢化物为烃,Z的氢化物为水、双氧水,碳原子数较多的烃常温下为固态,其沸点大于水和双氧水,Z的氢化物的沸点不一定大于Y的氢化物的沸点,故C正确;
D.W分子中含有H-O-O-H结构,结合过氧化氢的性质可知,化合物W具有强氧化性,可用作氧化剂,但过氧化氢不稳定,该物质不宜在高温下使用,故D正确。
答案选B。
16.(1)
(2)BD
(3) 分子间氢键比高氯酸多,分子间作用力较大,沸点高于.
(4) 气体D通入紫色石蕊试液,溶液变红,通入硝酸银,生成白色沉淀,则为.
【分析】Cl2与硫黄在加热条件下可以生成SCl2或者S2Cl2,与乙醇发生氧化反应和取代反应,与氢氧化钠溶液加热生成氯酸钠和氯化钠,氯酸钠电解得到高氯酸钠,氯酸钠与浓盐酸反应生成ClO2。
【详解】(1)常温下氯气与氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:;
(2)A.工业上制氯气用电解饱和的食盐水,A错误;
B.B是氯酸钠,Cl2与NaOH加热反应的方程式为3Cl2+6NaOH5NaCl+NaClO3+3H2O,混合物A、B的物质的量之比为可为5:1,B正确;
C.若C中的各原子最外层均达8电子稳定结构,C也可以为SCl2,C错误;
D.中的Cl为+4价,具有强氧化性,用作自来水的消毒剂,D正确;
正确的答案是BD;
(3)H2SO4和HClO4都是分子晶体,分子间氢键比高氯酸多,分子间作用力较大,沸点高于,高氯酸比硫酸易从体系中分离;
在液态时通过氢键形成双聚体,的结构式:;
(4)与经过氧化反应羟基变为醛基,经过取代反应甲基上的氢原子被氯原子取代,由于M分子中只有一种化学环境的氢原子,甲基上三个氢原子全部被取代,M的结构简式为:CCl3CHO,D为HCl,总反应化学方程式:;
证明D为HCl的方法是:气体D通入紫色石蕊试液,溶液变红,通入硝酸银,生成白色沉淀,则为。
17.(1) [Ar]3d104s1
(2)3:2
(3)sp2杂化
(4)NH3>AsH3>PH3
(5)BF3>SiF4>NF3
(6)NH4H+H2O=NH3 H2O+H2↑
【详解】(1)Cu的原子序数为29,其基态简化的电子排布式为[Ar]3d104s1,Fe是第26号元素,其电子排布式为[Ar]3d64s2,则Fe2+的价电子排布式为3d6,轨道表示式为。
(2)乙炔的结构式为H-CC-H,单键为σ键,三键中有一个σ键,两个π键,则乙炔分子中σ键与π键个数之比为3:2。
(3)吡啶中含有与苯类似的大π键,由此可知,吡啶中N原子采取sp2杂化,三条杂化轨道中的两条杂化轨道各有一个电子,分别和两个碳原子形成σ键,另外一个杂化轨道容纳一对电子,未杂化的p轨道和碳原子的未杂化的p轨道形成大π键,所以N原子的价层孤电子对占据sp2杂化轨道。
(4)NH3、PH3、AsH3是同主族元素的氢化物,NH3分子间存在氢键,其沸点最高,PH3和AsH3的沸点由相对分子质量决定,相对分子质量越大,分子间作用力越大,沸点越高,所以NH3、PH3、AsH3按照沸点由高到低排序,依次为NH3>AsH3>PH3。
(5)BF3中B原子的价层电子对数=3+=3,分子空间结构为平面三角形,键角为120°,SiF4中的Si原子的价层电子对数=4+,分子的空间结构为正四面体,键角为109°28′,NF3中的N原子的价层电子对数=3+,VSEPR模型为四面体形,由于中心原子上有一孤电子对,所以分子的空间结构为三角锥形,键角小于109°28′,所以BF3、SiF4、NF3按照键角由大到小排序,依次为BF3>SiF4>NF3。
(6)离子化合物NH5,其所有原子最外层都符合相应稀有气体原子电子层结构,则该物质阳离子为,阴离子为H-,化学式为NH4H,和水反应生成一种一元弱碱和一种单质气体。该反应的化学方程式为NH4H+H2O=NH3 H2O+H2↑。
18.(1)
(2) 温度升高,变为气体逸出,导致反应Ⅰ正向移动,使得两者的转化率增高 温度高于时,产物主要为,而几乎没有,故此时反应以反应Ⅱ为主,反应中和的系数比为1:1,使得随着温度的升高和平衡转化率差值逐渐减小
(3)均能与水形成氢键
(4) 纯 中羟基氧电负性大且存在孤电子对,氢离子能提供空轨道,两者结合形成共价键
【详解】(1)燃烧热是在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量;则:
①=-
②=-
③=-
④=-
由盖斯定律可知,①+②-③+④得:;
(2)①反应Ⅰ、Ⅱ均为分子数不变的反应,设和投料分别为3mol、1mol;时,反应进行到体系达到平衡状态,转化率为0.6559,则用分压表示的反应速率;
则、、、分别为0.00076mol、1.0323mol、0.03078mol、1.9677mol,反应Ⅰ、Ⅱ均为分子数不变的反应,可以用物质的量代替物质分压,则该温度下,反应Ⅰ的分压平衡常数;
②由图可知,区间,和的平衡转化率随温度升高而明显升高的原因为温度升高,变为气体逸出,导致反应Ⅰ正向移动,使得两者的转化率增高;
③由图可知,温度高于时,产物主要为,而几乎没有,故此时反应以反应Ⅱ为主,反应中和的系数比为1:1,故温度高于时,随着温度的升高和平衡转化率差值逐渐减小;
(3)和能够以任意比互溶的原因为均能与水形成氢键;
(4)①由表可知,纯为催化剂时,得到生产效率最大,故应选择的催化剂质量比为:;
②中羟基氧电负性大且存在孤电子对,氢离子能提供空轨道,两者结合形成共价键,使得在上述催化剂表面发生反应结合。
19.(1) NO、NO2、NOx、粉尘、含碳粉尘等任意一种即可 苯胺与乙醇存在分子间氢键
(2) sp2 sp
(3) 两种配合物中心原子Pt的原子半径比Pd大 bc
(4) 5.2×10-4
(5)1:1
【分析】苯胺焦油是工业上催化制苯胺的副产物,主要成分为苯胺,含有少量铂族贵金属、活性炭和Na、K、Fe。将苯胺焦油中加入乙醇溶解,苯胺溶解在乙醇中,铂族贵金属、活性炭和Na、K、Fe不溶;将不溶物在空气中焚烧,活性炭转化为CO2,Na、K、Fe转化为金属氧化物,Pt、Pd转化为PtO2、PdO等;用HCOOH还原金属氧化物,PtO2、PdO转化为Pt、Pd;用王水氧化浸出,Pt、Pd转化为、和NO等;用NH4Cl沉铂,铂元素转化为(NH4)2PtCl6,用N2H4 H2O进行还原,便可获得海绵铂。
【详解】(1)①溶解的目的是去除焦油中的苯胺,若采用直接焚烧的方法去除苯胺,活性炭燃烧生成二氧化碳,苯胺燃烧生成碳、碳的氧化物、氮的氧化物等,会生成:NO、NO2、NOx、粉尘、含碳粉尘等任意一种即可,造成环境污染。
②苯胺与乙醇分子间能形成氢键,则苯胺易溶于乙醇的原因为:苯胺与乙醇存在分子间氢键。
(2)“还原Ⅰ”时,PtO2、PdO被HCOOH还原为金属单质,同时生成CO2。在HCOOH、CO2中,碳原子的价层电子对数为3、2,则碳原子的杂化方式由sp2变为sp。
(3)①王水是浓盐酸和浓硝酸体积比3:1的混合液,Pd与王水反应,生成等,离子反应方程式为。
②两种配合物、中,由于Pt和Pd的原子半径不同,造成配位数不同,原因是:两种配合物中心原子Pt的原子半径比Pd大。
③a.从图中可以看出,80℃左右Pt、Pd浸出率低于120℃左右Pt、Pd浸出率,a不正确;
b.由a分析可知,温度应控制在120℃左右,b正确;
c.浓盐酸、浓硝酸受热都易挥发,则温度越高浸出率越低的原因可能是挥发导致王水浓度降低,c正确;
d.40℃时Pt的浸出率远低于Pd是因为温度低时,较难形成,d不正确;
故选bc。
(4)①“沉铂”时,NH4Cl与H2[PtCl6]反应,转化为(NH4)2PtCl6和HCl,发生反应的化学反应方程式为。
②若NH4Cl的投料以固液比0.0535:1(g : mL)时,c(NH4Cl)==1mol/L,的消耗率为90%,则溶液中c(NH4Cl)=1mol/L×10%=0.1mol/L,,则0.12×c([PtCl6]2-)=5.2×10-6,c([PtCl6]2-)=5.2×10-4mol L-1,则“沉铂”所得溶液中Pt元素的物质的量浓度为c([PtCl6]2-)=5.2×10-4mol L-1。
(5)“还原Ⅱ”时氧化产物中无毒气体为N2,依据得失电子守恒,可建立关系式:(NH4)2PtCl6—— N2H4 H2O,则该反应的氧化剂和还原剂的物质的量之比为1:1。
【点睛】建立关系式求解,常依据元素守恒或得失电子守恒。
答案第1页,共2页
答案第1页,共2页
