3.3金属晶体与离子晶体同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3金属晶体与离子晶体同步练习(含解析)2023——2024学年高中化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 13:31:17 | ||
图片预览

文档简介
3.3金属晶体与离子晶体同步练习
姓名()班级()学号()
一、选择题
1.超氧化钾被称为“化学氧自救剂”,可用于煤矿井下急救。如图为超氧化钾晶体的一个晶胞。下列有关说法正确的是
A.K+位于O构成的八面体空隙中
B.超氧化钾的化学式为K2O2
C.晶体中K+的配位数是8
D.超氧化钾晶体中只存在离子键
2.铁和碳形成的一种晶体的晶胞结构如图所示。为阿伏加德罗常数的值,晶胞边长为,下列说法中错误的是
A.该晶体的化学式为 B.原子位于原子围成的正四面体空隙中
C.原子周围有12个紧邻的原子 D.该晶体密度为
3.化学处处呈现美,宏观世界的美是由微观结构决定的。下列化学用语表达错误的是
A.NaCl的晶胞:
B.中键的形成:
C.的VSEPR模型:
D.Cl—Cl的p-p键电子云轮廓图:
4.锂硒电池是一种能量密度很高的新型可充电电池,其正极材料的晶胞结构如图。已知晶胞参数为a pm,下列说法不正确的是
A.Se位于元素周期表中的p区 B.基态最外层电子的电子云轮廓图为哑铃型
C.每个周围距离相等且最近的有4个 D.与之间最近的距离为pm
5.下列化学用语或图示不正确的是
A.1-丁烯的实验式:
B.的空间填充模型:
C.P原子的结构示意图:
D.用电子式表示的形成:
6.下列实验操作、现象和结论都正确的是
选项 实验操作 现象和结论
A 室温下分别测定溶液和溶液的 两者都大于7,且溶液的大,说明的水解能力强于
B 取两份新制氯水,分别滴加溶液和淀粉溶液 前者有白色沉淀,后者溶液变蓝色,说明与反应存在限度
C 测定均为离子化合物的和的熔点 的熔点更高,说明中离子键强于
D 向溶液中先滴加4滴溶液,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀。说明转化为,溶解度小于
A.A B.B C.C D.D
7.是一种压电材料。以为原料,采用下列路线可制备粉状。已知“焙烧”后固体产物有、易溶于水的BaS和微溶于水的CaS;“沉淀”步骤中生成的沉淀化学式为。
下列说法中错误的是
A.“焙烧”步骤中碳粉的主要作用是将还原
B.“浸取”步骤中的滤渣为CaS:“酸化”步骤中的酸可用盐酸或稀硫酸
C.“沉淀”步骤中发生反应的化学方程式为
D.的熔点低于
8.某离子型铁的氧化物立方晶胞如图所示(由组成),该离子型铁的氧化物晶体的晶胞参数为。设阿伏加德罗常数的值为,下列说法错误的是
A.基态原子价层电子排布式为 B.该晶体中
C.该晶胞中有处于体心 D.该晶体的密度为
9.一种镁铜合金的晶胞拉维斯结构如图(a),该晶胞可看成由8个小立方体构成,其中4个小立方体体心填入Mg,另外4个小立方体的体心填入以四面体方式排列的Cu,其余Mg占据晶胞的顶点和面心。图(b)是对图(a)沿立方格子对角面取得的截图。设阿伏加德罗常数的值为,下列说法错误的是
A.基态Mg原子核外电子有12种不同的运动状态
B.
C.上述合金的组成可表示为MgCu2
D.上述合金晶体的密度为
10.已知R、X、Y、Z均是短周期元素,原子序数依次增大。R与Z同主族,X、Y、Z同周期,其中只有X是金属元素。下列说法一定正确的是
A.原子半径:X>Y>Z>R
B.R的含氧酸酸性一定比Z的含氧酸酸性强
C.R的气态氢化物沸点低于Z的气态氢化物沸点
D.若R和X的原子序数相差5,则形成的化合物属于分子晶体
11.六方ZnS的晶胞结构如图甲所示(高为cnm),其晶胞的上表面如图乙所示,已知、半径分别为、,且,下列说法错误的是
A.ZnS的熔点低于ZnO
B.晶胞的空间利用率为
C.该晶体中占据了构成的正四面体空隙
D.在晶体中离最近且等距的有12个
12.下列说法正确的是
A.图A冠中O原子电负性大带负电荷,通过离子键与作用,体现了超分子“分子识别"的特征
B.图B物质较摩尔质量更大,比具有更高的熔沸点
C.图B中,该物质含有键数目为
D.图C中,表示硅氧四面体,该结构是无限延伸层状多硅酸根,则化学式为
13.将盐酸、溶液与溶液各,预热后混合,保持恒温,发生反应:,反应至时测得的浓度为设为阿伏加德罗常数的值,下列说法正确的是
A.溶液中离子的数目为
B.内的平均反应速率为
C.在标准状况下反应生成时转移电子数为
D.晶体中共价键与离子键数量之比为
14.镁铝合金具有优异的性能,其晶胞结构如图所示。下列说法不正确的是
A.镁铝合金的化学式为
B.熔点:氧化铝<氧化镁
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是(表示阿伏加德罗常数的值)
15.某和形成的金属化合物的立方晶胞结构如下。
下列说法正确的是
A.该晶体属于离子化合物
B.周围距离最近的原子个数为8
C.该晶胞沿x轴、y轴、z轴的投影图完全相同
D.该晶体在高温时导电能力更强
二、填空题
16.随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第 周期第 族。
(2)写出粉料中的通过“浸出还原”得到含、、、溶液的化学反应方程式: 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为 ,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素: 。
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式 。
(5)“共沉淀”后的滤液中含有大量,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1: 、 、洗涤、干燥。
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为 ;已知晶胞参数为,晶胞密度为,据此推断阿伏加德罗常数 。(列出计算式)
17.N、P、均为氮族元素,这些元素与人们的生活息息相关。N与金属可形成氮化物,如的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。
(1)晶胞中,含有的Al、N原子个数均是 。
(2)若设该氮化铁的化学式为,可替代晶胞中不同位置的,形成替代型的化学式是,而转化为两种替代型产物的能量变化如图丙所示,替代晶胞中的形成化学式为的氮化物不稳定,则a位置表示晶胞中的 。
(3)通常认为是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据 (填“能”或“不能”)计算出原子的第一电离能,的晶格能为 。
三、解答题
18.氧缺位体(CuFe2O4-δ)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(CuFeS2,含Al2O3、SiO2等杂质)、为原料制备CuFe2O4-δ的流程如图:
已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
金属氢氧化物 Fe(OH)3 Al(OH)3 Cu(OH)2 Fe(OH)2
开始沉淀的pH 1.9 3.4 6.4 7.0
完全沉淀的pH 3.2 4.7 7.6 9.0
请回答下列问题:
(1)Cu位于元素周期表第四周期第 族, 区。
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为 。
(3)加Cu“还原”的目的是 。
(4)滤渣2的主要成分为 。
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是 。
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ= 。
氧缺位体分解水制氢分两步:
第一步 (完成方程式);
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
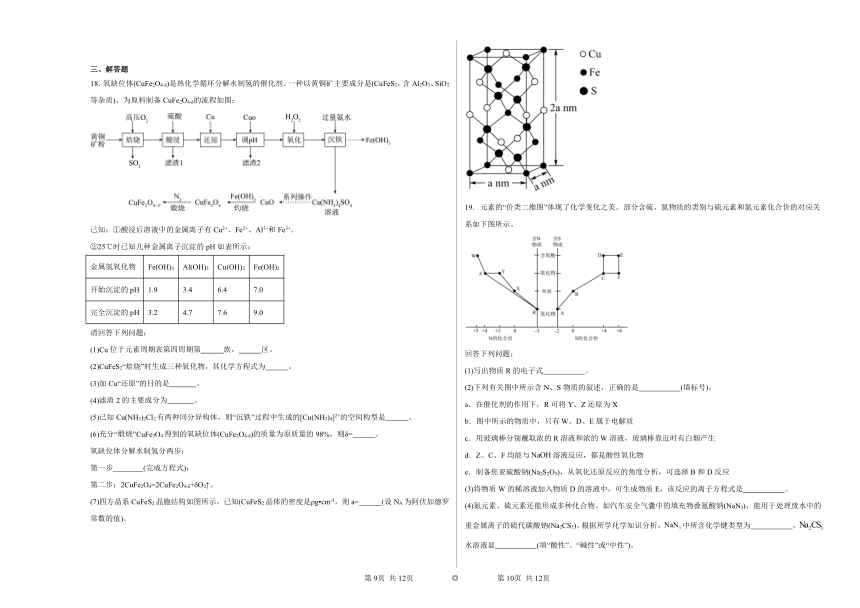
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg cm-3,则a= (设NA为阿伏加德罗常数的值)。
19.元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
回答下列问题:
(1)写出物质R的电子式 。
(2)下列有关图中所示含N、S物质的叙述,正确的是 (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,中所含化学键类型为 ,水溶液显 (填“酸性”、“碱性”或“中性”)。
(5)(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入的溶液中,可制得该物质:,上述反应中,物质R体现的性质有 ,该反应每生成转移电子 mol。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.由晶胞结构可知,K+位于O构成的八面体空隙中,A正确;
B.据“均摊法”,晶胞中含个K+、个O,则超氧化钾的化学式为KO2,B错误;
C.距离K+最近的O的个数为6,C错误;
D.超氧化钾晶体中两个氧原子之间存在共价键,D错误;
故选A。
2.B
【分析】铁原子在8个顶点和6个面心,均摊下来为,碳原子在12条棱心和体心,均摊下来为,所以晶体的化学式为FeC,据此回答。
【详解】A.根据分析可知晶体的化学式为FeC,A正确;
B.Fe 原子位于C原子围成的正八面体空隙中,B错误;
C.单看Fe原子可以发现,Fe原子为面心立方堆积,所以1个Fe原子周围有12个紧邻的Fe原子,C正确;
D.晶胞的质量为g,晶胞的体积为a3,所以晶体密度为g cm 3,D正确;
故选B。
3.A
【详解】A.晶胞是描述晶体结构的基本结构单元,晶体中晶胞的排列为“无隙并置”,而该结构不能进行“无隙并置”, NaCl的晶胞为,A错误;
B.中键为键,其形成为,B正确;
C.的中心原子价层电子对数为4,其中键数为2,孤电子对数为2,杂化方式为杂化,VSEPR模型为,C正确;
D.的p-p键电子云为轴对称,电子云轮廓图为,D正确;
答案选A。
4.B
【详解】A.Se位于第4周期第Ⅵ族,位于周期表P区,A正确;
B.锂离子电子排布式1S2,最外层电子位于S轨道,球形,B错误;
C.根据晶胞结构以及均摊法计算出:Se2-位于顶点及面心,Li+位于体心,则距Li+最近的Se2-位于顶点及3个面心,共4个,C正确;
D. Li+位于体对角线处,且与顶点处Se2-距离最近,二者距离为,D正确;
故答案选B。
5.B
【详解】A.1-丁烯的分子式为C4H8,实验式:,故A正确;
B.的结构和H2O2类似,空间填充模型为: ,故B错误;
C.P是15号元素,原子的结构示意图为:,故C正确;
D.是离子化合物,用电子式表示的形成:,故D正确;
故选B。
6.C
【详解】A.Na2CO3溶液、NaHCO3溶液的浓度未知,无法判断,A项错误;
B.新制氯水中加入AgNO3溶液产生白色沉淀,说明新制氯水中有Cl-,新制氯水中加入淀粉KI溶液,溶液变蓝,说明I-被氧化成I2,HClO和Cl2都能将I-氧化,不能说明新制氯水中一定有Cl2,不能说明Cl2与H2O的反应存在限度,B项错误;
C.离子化合物熔点的高低与离子键强度有关,离子键越强、离子化合物熔点越高,C项正确;
D.向2mL0.1mol/LAgNO3溶液中先滴加4滴0.1mol/LKCl溶液,产生白色AgCl沉淀后AgNO3过量,再滴加4滴0.1mol/LKI溶液与过量Ag+直接反应生成AgI沉淀,不能说明发生了沉淀的转化和比较溶解度的大小,D项错误;
答案选C。
7.B
【分析】由流程和题中信息可知,与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、、易溶于水的BaS和微溶于水的CaS;烧渣经水浸取后过滤,滤渣中碳粉和CaS,滤液中有BaS和;滤液经酸化后浓缩结晶得到BaCl2晶体;BaCl2晶体溶于水后,加入TiCl4和将钡离子充分沉淀得到;经热分解得到。
【详解】A.与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、、易溶于水的BaS和微溶于水的CaS,硫元素化合价降低,碳粉做还原剂将还原,A正确;
B.“浸取”步骤中的滤渣为CaS和碳粉;“酸化”步骤中的酸可用盐酸,稀硫酸会加入杂质离子不可用,B错误;
C.BaCl2晶体溶于水后,加入TiCl4和将钡离子充分沉淀得到,“沉淀”步骤中发生反应的化学方程式为,C正确;
D.二者都为离子晶体,钡离子半径大于钙离子,晶格能较小,故的熔点低于,D正确;
故选B。
8.B
【详解】A.为26号元素,基态原子价层电子排布式为,项正确;
B.晶胞中共有16,该晶体中,B项错误;
C.将XY组装起来可知有处于体心,项正确;
D.晶胞中,该晶体的密度为,D项正确。
故选B。
9.B
【分析】该晶胞中 Mg原子有8个位于顶点上、6个面心上,4个在晶胞内部,则Mg的个数为个,16个Cu 原子都位于晶胞内部,由图(b)可知,x等于立方体面对角线长度,根据图(a)、(b)分析可知,y等于立方体体对角线长度,据此回答。
【详解】A.Mg核外有12个电子,所以基态Mg原子核外电子有12种不同的运动状态,A正确;
B.由图(b)可知,x等于立方体面对角线长度的,即4x=a,则x=a,根据图(a)、(b)分析可知,y等于立方体体对角线长度的,即4y=a,则y=a,,B错误;
C.根据分析可知,则有8个Mg,16个Cu,合金的组成可表示为MgCu2,C正确;
D.晶胞的质量为g,晶胞的体积为cm3,则晶胞的密度为g cm 3,D正确;
故选B。
10.A
【分析】分析可知X、Y、Z为第三周期的元素,且从左往右排列,R与Z同主族说明Z位于第二周期。
【详解】A.同周期主族元素,从左往右原子半径逐渐减小,同主族从上往下原子半径递增,故原子半径:X>Y>Z>R,A正确;
B.若R、Z非氧族元素,R的最高价含氧酸酸性一定比Z的最高价含氧酸酸性强,B错误;
C.若R、Z为氧族元素或氮族元素,因分子间氢键的存在,使得R的气态氢化物沸点高于Z的气态氢化物沸点,C错误;
D.若R和X分别为O、Al,则形成的化合物属于离子晶体,D错误。
故选A。
11.B
【详解】A.ZnS和ZnO均为离子晶体,离子半径,A正确;
B.由均摊法可知,一个晶胞含有两个和两个,空间利用率为,B错误;
C.由晶胞结构可知,离等距且最近的数为4,这4个构成正四面体,位于正四面体的体心,C正确;
D.与之间间隔,每个均连接4个,所以最近且等距的有个,D正确;
故选:B。
12.D
【详解】A.A中冠醚与K+之间并非离子键,而是通过配位键结合,A错误;
B.B中物质阳离子基团较大,离子键较弱,较NaBF4熔沸点更低,B错误;
C.根据图B中物质的结构可知,1mol该物质含有σ键19mol,数目为19NA,C错误;
D.六边形边上的氧原子被两个六边形所共有,一共有6个,六边形顶点的氧原子被三个六边形共有,一共有,加起来一共5个氧,六边形顶点的硅原子被三个六边形共有,一共有 6 × =2个,再根据硅化合价为+4价,氧化合价为-2价,其结构通式为,D正确;
故选D。
13.B
【详解】A.由于铵根离子会发生水解,所以溶液中离子的数目小于,A错误;
B.内的平均反应速率为,B正确;
C.标准状况下,生成2.24L氮气,氮气的物质的量为0.1mol,转移电子数目为0.3NA,C错误;
D.1个铵根离子中有4个共价键,而在氯化铵晶体中与1个铵根离子形成离子键的氯离子数目大于1,因此1个铵根离子形成的离子键数目大于1,所以氯化铵晶体中共价键与离子键数量之比不是4:1,D错误;
故选B。
14.B
【详解】A.依据均推法,晶胞中镁原子共有个,铝原子共有8个,化学式为,A正确;
B.氧化铝、氧化镁均为离子晶体,半径比半径小,且所带电荷比多,氧化铝的熔点更高,B错误;
C.合金属于金属晶体,晶体中存在的化学键类型为金属键,C正确;
D.一个晶胞中含有4个“”,其质量为,D正确;
故选B。
15.B
【详解】A.和为金属元素,形成的化合物为金属晶体,A错误;
B.原子位于晶胞的8个顶点,1个体心,体心周围距离最近且相等的原子个数是8个顶点的,故周围距离最近的原子个数为8,B正确;
C.晶胞沿x轴、z轴的投影图完全相同,投影图为,与晶胞沿y轴投影图不同,C错误;
D.高温时,金属的电阻增加,导电能力减弱,D错误;
故答案为:B。
16.(1) 四 VⅢ
(2)
(3) 70 120 用量
(4)
(5) 蒸发结晶 趁热过滤
(6) 或 或
【分析】经过放电处理后, 负极Li放电形成 最终转移到正极材料中, 可提高Li元素的回收率, 经过浸出还原, 正极材料中相关元素转化为 加入NaOH调节pH至11,可将 转化为沉淀除去, 最终在滤液中加入 得到 产品, 正极材料前驱体在空气中煅烧得到终端产品
【详解】(1)镍是第28号元素,位于元素周期表第四周期第Ⅷ族。
(2)粉料中的被过氧化氢氧化,相关元素转化为,化合价由+3价变为+2价,氧元素由-1价变为0价,故相关化学方程式为
(3)①由图可知,当温度为70℃、浸出时间为120min时金属的浸出率较高,再提高温度和浸出时间,金属的浸出率几乎不变,所以最佳的温度为70℃、最佳的浸出时间为120min。
②影响浸出率的因素除了温度时间外,还包括反应物浓度,故答案为用量
(4)与发生相互促进的完全双水解反应:
(5)由于碳酸锂的溶解度随温度升高而减小,沉淀完成后从溶液中得到的操作有蒸发结晶、趁热过滤、洗涤、干燥。
(6)①该晶胞中Co的原子个数为1,Ni的原子个数为 ,O的原子个数为,故该晶体的化学式为或。
②因为晶胞棱长为,故晶胞体积为,晶胞密度为,则或
17.(1)6
(2)顶点
(3) 不能 5643
【详解】(1)晶胞中,有4个Al原子位于内部,6个位于棱上,棱上的原子对晶胞的贡献率为,则每个晶胞中含Al原子个;晶胞中,有3个N原子位于内部,2个位于面心,面心的原子对晶胞的贡献率为,12个位于顶点,顶点的原子对晶胞的贡献率为,则每个晶胞中含N原子个,含有的Al、N原子个数均是6;
(2)由氮化铁的晶胞结构图可知,N位于体心,每个晶胞中含1个N原子,Fe位于面心和顶点,每个晶胞中含4个Fe原子,晶胞化学式为Fe4N,可替代晶胞中不同位置的,替代晶胞中顶点上的形成化学式为的氮化物,替代晶胞中面心上的形成化学式为的氮化物,化学式为的氮化物不稳定,物质能量越高越不稳定,则能量比高,则a位置表示顶点,b位置表示面心;
(3)第一电离能是指基态的气态原子失去最外层的一个电子变为气态离子所需的能量,图中无此过程的数据,故不能计算出原子的第一电离能;的晶格能为。
18.(1) IB ds
(2)6CuFeS2+19O26CuO+2Fe3O4+12SO2
(3)将Fe3+还原为Fe2+,防止Fe3+在调pH时变成Fe(OH)3而除去
(4)Al(OH)3
(5)平面正方形或平面四边形或平行四边形
(6) 0.3 CuFe2O4-δ+δH2O=CuFe2O4+δH2↑
(7)×107
【分析】氧气具有氧化性,已知,酸浸后溶液中的金属离子有、、和,“焙烧”时生成三种氧化物,结合质量守恒可知,“焙烧”中黄铜矿的与氧气反应生成SO2、CuO、,反应为,加入硫酸将金属氧化物转化相应硫酸盐溶液,滤渣1为不反应的二氧化硅,加入Cu还原铁离子为Fe2+,加入CuO调pH使Al3+完全沉淀,而Cu2+、Fe2+不沉淀,滤渣2主要成分是氢氧化铝沉淀,含少量铜、氧化铜;加入过氧化氢将亚铁离子氧化为铁离子,加入过量氨水反应生成Cu(NH3)4SO4,Fe3+与弱碱氨水反应生成Fe(OH)3沉淀,Cu(NH3)4SO4经系列操作生成CuO,灼烧时CuO与氢氧化铁反应生成CuFe2O4,在氮气做保护气下煅烧生成。
【详解】(1)Cu为29号元素,位于元素周期表第四周期第IB族;属于ds区;
(2)由分析可知,“焙烧”时反应化学方程式为;
(3)还原流程后调pH使得Al3+完全沉淀,而Cu2+、Fe2+不沉淀;由于铁离子会较铝离子首先沉淀,故加Cu“还原”的目是将还原为,防止在调pH时变成而除去;
(4)由分析可知,滤渣2的主要成分为;
(5)已知有两种同分异构体,则可知其结构不是四面体结构,而是平面四边形结构,故的空间构型为平面正方形或平面四边形或平行四边形;
(6)铁酸铜()制备氧缺位体(),质量减少量就是生成氧气的质量,,0.3;氧缺位体分解水制氢总反应为,结合第二步反应,可知第一步反应为;
(7)根据“均摊法”,晶胞中含个Cu、个Fe 、8个S,则晶体密度为,a=nm。
19.(1)
(2)ac
(3)
(4) 离子键、非极性共价键 碱性
(5) 碱性、还原性 1
【分析】结合“价类二维图”的横、纵坐标,可以确定各物质为:A是H2S、B是S、C是SO2、D是H2SO3、E是H2SO4、F是SO3、R是NH3、X是N2、Y是NO、Z是NO2、W是HNO3。
【详解】(1)物质R为NH3,其电子式为;
(2)a.R是NH3,N元素化合价为-3价,具有还原性,在催化剂的作用下,可将NO、NO2还原为N2,故a正确;
b.图中所示的物质中,A是H2S,也属于电解质,故b错误;
c.W是HNO3,浓硝酸具有挥发性,用玻璃棒分别蘸取浓HNO3和浓氨水,玻璃棒靠近时有白烟产生,故c正确;
d.NO2不是酸性氧化物,故d错误;
e.B是S,D是H2SO3,H2SO3中S化合价为+4价,焦亚硫酸钠(Na2S2O5) 中S化合价也为+4价,从氧化还原反应的角度分析,不可制备焦亚硫酸钠,故e错误;
故答案为:ac;
(3)物质W是HNO3,将其稀溶液加入H2SO3的溶液中,可生成H2SO4,该反应的离子方程式为;
(4)NaN3中存在Na+和离子之间形成的离子键,还有中氮氮原子之间形成的共价键,所含化学键类型为离子键和共价键;Na2CS3是强碱弱酸盐,水溶液显碱性;
(5)据S4N4(S是+2价)可知N是-2价,R是NH3,其中氮元素是-3价,所以反应中,一部分NH3由-3价变为-2价,体现还原性,还有一部分化合价没有变化,生成氯化铵,体现的是碱性;S2Cl2中+1价的硫元素,一部分变为S4N4中+2价,一部分变为零价的S8,所以S8-8e-,即32gS8转移电子物质的量为1mol。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、选择题
1.超氧化钾被称为“化学氧自救剂”,可用于煤矿井下急救。如图为超氧化钾晶体的一个晶胞。下列有关说法正确的是
A.K+位于O构成的八面体空隙中
B.超氧化钾的化学式为K2O2
C.晶体中K+的配位数是8
D.超氧化钾晶体中只存在离子键
2.铁和碳形成的一种晶体的晶胞结构如图所示。为阿伏加德罗常数的值,晶胞边长为,下列说法中错误的是
A.该晶体的化学式为 B.原子位于原子围成的正四面体空隙中
C.原子周围有12个紧邻的原子 D.该晶体密度为
3.化学处处呈现美,宏观世界的美是由微观结构决定的。下列化学用语表达错误的是
A.NaCl的晶胞:
B.中键的形成:
C.的VSEPR模型:
D.Cl—Cl的p-p键电子云轮廓图:
4.锂硒电池是一种能量密度很高的新型可充电电池,其正极材料的晶胞结构如图。已知晶胞参数为a pm,下列说法不正确的是
A.Se位于元素周期表中的p区 B.基态最外层电子的电子云轮廓图为哑铃型
C.每个周围距离相等且最近的有4个 D.与之间最近的距离为pm
5.下列化学用语或图示不正确的是
A.1-丁烯的实验式:
B.的空间填充模型:
C.P原子的结构示意图:
D.用电子式表示的形成:
6.下列实验操作、现象和结论都正确的是
选项 实验操作 现象和结论
A 室温下分别测定溶液和溶液的 两者都大于7,且溶液的大,说明的水解能力强于
B 取两份新制氯水,分别滴加溶液和淀粉溶液 前者有白色沉淀,后者溶液变蓝色,说明与反应存在限度
C 测定均为离子化合物的和的熔点 的熔点更高,说明中离子键强于
D 向溶液中先滴加4滴溶液,再滴加4滴溶液 先产生白色沉淀,再产生黄色沉淀。说明转化为,溶解度小于
A.A B.B C.C D.D
7.是一种压电材料。以为原料,采用下列路线可制备粉状。已知“焙烧”后固体产物有、易溶于水的BaS和微溶于水的CaS;“沉淀”步骤中生成的沉淀化学式为。
下列说法中错误的是
A.“焙烧”步骤中碳粉的主要作用是将还原
B.“浸取”步骤中的滤渣为CaS:“酸化”步骤中的酸可用盐酸或稀硫酸
C.“沉淀”步骤中发生反应的化学方程式为
D.的熔点低于
8.某离子型铁的氧化物立方晶胞如图所示(由组成),该离子型铁的氧化物晶体的晶胞参数为。设阿伏加德罗常数的值为,下列说法错误的是
A.基态原子价层电子排布式为 B.该晶体中
C.该晶胞中有处于体心 D.该晶体的密度为
9.一种镁铜合金的晶胞拉维斯结构如图(a),该晶胞可看成由8个小立方体构成,其中4个小立方体体心填入Mg,另外4个小立方体的体心填入以四面体方式排列的Cu,其余Mg占据晶胞的顶点和面心。图(b)是对图(a)沿立方格子对角面取得的截图。设阿伏加德罗常数的值为,下列说法错误的是
A.基态Mg原子核外电子有12种不同的运动状态
B.
C.上述合金的组成可表示为MgCu2
D.上述合金晶体的密度为
10.已知R、X、Y、Z均是短周期元素,原子序数依次增大。R与Z同主族,X、Y、Z同周期,其中只有X是金属元素。下列说法一定正确的是
A.原子半径:X>Y>Z>R
B.R的含氧酸酸性一定比Z的含氧酸酸性强
C.R的气态氢化物沸点低于Z的气态氢化物沸点
D.若R和X的原子序数相差5,则形成的化合物属于分子晶体
11.六方ZnS的晶胞结构如图甲所示(高为cnm),其晶胞的上表面如图乙所示,已知、半径分别为、,且,下列说法错误的是
A.ZnS的熔点低于ZnO
B.晶胞的空间利用率为
C.该晶体中占据了构成的正四面体空隙
D.在晶体中离最近且等距的有12个
12.下列说法正确的是
A.图A冠中O原子电负性大带负电荷,通过离子键与作用,体现了超分子“分子识别"的特征
B.图B物质较摩尔质量更大,比具有更高的熔沸点
C.图B中,该物质含有键数目为
D.图C中,表示硅氧四面体,该结构是无限延伸层状多硅酸根,则化学式为
13.将盐酸、溶液与溶液各,预热后混合,保持恒温,发生反应:,反应至时测得的浓度为设为阿伏加德罗常数的值,下列说法正确的是
A.溶液中离子的数目为
B.内的平均反应速率为
C.在标准状况下反应生成时转移电子数为
D.晶体中共价键与离子键数量之比为
14.镁铝合金具有优异的性能,其晶胞结构如图所示。下列说法不正确的是
A.镁铝合金的化学式为
B.熔点:氧化铝<氧化镁
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是(表示阿伏加德罗常数的值)
15.某和形成的金属化合物的立方晶胞结构如下。
下列说法正确的是
A.该晶体属于离子化合物
B.周围距离最近的原子个数为8
C.该晶胞沿x轴、y轴、z轴的投影图完全相同
D.该晶体在高温时导电能力更强
二、填空题
16.随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第 周期第 族。
(2)写出粉料中的通过“浸出还原”得到含、、、溶液的化学反应方程式: 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为 ,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素: 。
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式 。
(5)“共沉淀”后的滤液中含有大量,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1: 、 、洗涤、干燥。
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为 ;已知晶胞参数为,晶胞密度为,据此推断阿伏加德罗常数 。(列出计算式)
17.N、P、均为氮族元素,这些元素与人们的生活息息相关。N与金属可形成氮化物,如的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。
(1)晶胞中,含有的Al、N原子个数均是 。
(2)若设该氮化铁的化学式为,可替代晶胞中不同位置的,形成替代型的化学式是,而转化为两种替代型产物的能量变化如图丙所示,替代晶胞中的形成化学式为的氮化物不稳定,则a位置表示晶胞中的 。
(3)通常认为是离子晶体,其晶格能可通过Born-Haber循环计算得到,通过图中数据 (填“能”或“不能”)计算出原子的第一电离能,的晶格能为 。
三、解答题
18.氧缺位体(CuFe2O4-δ)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(CuFeS2,含Al2O3、SiO2等杂质)、为原料制备CuFe2O4-δ的流程如图:
已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
金属氢氧化物 Fe(OH)3 Al(OH)3 Cu(OH)2 Fe(OH)2
开始沉淀的pH 1.9 3.4 6.4 7.0
完全沉淀的pH 3.2 4.7 7.6 9.0
请回答下列问题:
(1)Cu位于元素周期表第四周期第 族, 区。
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为 。
(3)加Cu“还原”的目的是 。
(4)滤渣2的主要成分为 。
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是 。
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ= 。
氧缺位体分解水制氢分两步:
第一步 (完成方程式);
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg cm-3,则a= (设NA为阿伏加德罗常数的值)。
19.元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
回答下列问题:
(1)写出物质R的电子式 。
(2)下列有关图中所示含N、S物质的叙述,正确的是 (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,中所含化学键类型为 ,水溶液显 (填“酸性”、“碱性”或“中性”)。
(5)(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入的溶液中,可制得该物质:,上述反应中,物质R体现的性质有 ,该反应每生成转移电子 mol。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.由晶胞结构可知,K+位于O构成的八面体空隙中,A正确;
B.据“均摊法”,晶胞中含个K+、个O,则超氧化钾的化学式为KO2,B错误;
C.距离K+最近的O的个数为6,C错误;
D.超氧化钾晶体中两个氧原子之间存在共价键,D错误;
故选A。
2.B
【分析】铁原子在8个顶点和6个面心,均摊下来为,碳原子在12条棱心和体心,均摊下来为,所以晶体的化学式为FeC,据此回答。
【详解】A.根据分析可知晶体的化学式为FeC,A正确;
B.Fe 原子位于C原子围成的正八面体空隙中,B错误;
C.单看Fe原子可以发现,Fe原子为面心立方堆积,所以1个Fe原子周围有12个紧邻的Fe原子,C正确;
D.晶胞的质量为g,晶胞的体积为a3,所以晶体密度为g cm 3,D正确;
故选B。
3.A
【详解】A.晶胞是描述晶体结构的基本结构单元,晶体中晶胞的排列为“无隙并置”,而该结构不能进行“无隙并置”, NaCl的晶胞为,A错误;
B.中键为键,其形成为,B正确;
C.的中心原子价层电子对数为4,其中键数为2,孤电子对数为2,杂化方式为杂化,VSEPR模型为,C正确;
D.的p-p键电子云为轴对称,电子云轮廓图为,D正确;
答案选A。
4.B
【详解】A.Se位于第4周期第Ⅵ族,位于周期表P区,A正确;
B.锂离子电子排布式1S2,最外层电子位于S轨道,球形,B错误;
C.根据晶胞结构以及均摊法计算出:Se2-位于顶点及面心,Li+位于体心,则距Li+最近的Se2-位于顶点及3个面心,共4个,C正确;
D. Li+位于体对角线处,且与顶点处Se2-距离最近,二者距离为,D正确;
故答案选B。
5.B
【详解】A.1-丁烯的分子式为C4H8,实验式:,故A正确;
B.的结构和H2O2类似,空间填充模型为: ,故B错误;
C.P是15号元素,原子的结构示意图为:,故C正确;
D.是离子化合物,用电子式表示的形成:,故D正确;
故选B。
6.C
【详解】A.Na2CO3溶液、NaHCO3溶液的浓度未知,无法判断,A项错误;
B.新制氯水中加入AgNO3溶液产生白色沉淀,说明新制氯水中有Cl-,新制氯水中加入淀粉KI溶液,溶液变蓝,说明I-被氧化成I2,HClO和Cl2都能将I-氧化,不能说明新制氯水中一定有Cl2,不能说明Cl2与H2O的反应存在限度,B项错误;
C.离子化合物熔点的高低与离子键强度有关,离子键越强、离子化合物熔点越高,C项正确;
D.向2mL0.1mol/LAgNO3溶液中先滴加4滴0.1mol/LKCl溶液,产生白色AgCl沉淀后AgNO3过量,再滴加4滴0.1mol/LKI溶液与过量Ag+直接反应生成AgI沉淀,不能说明发生了沉淀的转化和比较溶解度的大小,D项错误;
答案选C。
7.B
【分析】由流程和题中信息可知,与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、、易溶于水的BaS和微溶于水的CaS;烧渣经水浸取后过滤,滤渣中碳粉和CaS,滤液中有BaS和;滤液经酸化后浓缩结晶得到BaCl2晶体;BaCl2晶体溶于水后,加入TiCl4和将钡离子充分沉淀得到;经热分解得到。
【详解】A.与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、、易溶于水的BaS和微溶于水的CaS,硫元素化合价降低,碳粉做还原剂将还原,A正确;
B.“浸取”步骤中的滤渣为CaS和碳粉;“酸化”步骤中的酸可用盐酸,稀硫酸会加入杂质离子不可用,B错误;
C.BaCl2晶体溶于水后,加入TiCl4和将钡离子充分沉淀得到,“沉淀”步骤中发生反应的化学方程式为,C正确;
D.二者都为离子晶体,钡离子半径大于钙离子,晶格能较小,故的熔点低于,D正确;
故选B。
8.B
【详解】A.为26号元素,基态原子价层电子排布式为,项正确;
B.晶胞中共有16,该晶体中,B项错误;
C.将XY组装起来可知有处于体心,项正确;
D.晶胞中,该晶体的密度为,D项正确。
故选B。
9.B
【分析】该晶胞中 Mg原子有8个位于顶点上、6个面心上,4个在晶胞内部,则Mg的个数为个,16个Cu 原子都位于晶胞内部,由图(b)可知,x等于立方体面对角线长度,根据图(a)、(b)分析可知,y等于立方体体对角线长度,据此回答。
【详解】A.Mg核外有12个电子,所以基态Mg原子核外电子有12种不同的运动状态,A正确;
B.由图(b)可知,x等于立方体面对角线长度的,即4x=a,则x=a,根据图(a)、(b)分析可知,y等于立方体体对角线长度的,即4y=a,则y=a,,B错误;
C.根据分析可知,则有8个Mg,16个Cu,合金的组成可表示为MgCu2,C正确;
D.晶胞的质量为g,晶胞的体积为cm3,则晶胞的密度为g cm 3,D正确;
故选B。
10.A
【分析】分析可知X、Y、Z为第三周期的元素,且从左往右排列,R与Z同主族说明Z位于第二周期。
【详解】A.同周期主族元素,从左往右原子半径逐渐减小,同主族从上往下原子半径递增,故原子半径:X>Y>Z>R,A正确;
B.若R、Z非氧族元素,R的最高价含氧酸酸性一定比Z的最高价含氧酸酸性强,B错误;
C.若R、Z为氧族元素或氮族元素,因分子间氢键的存在,使得R的气态氢化物沸点高于Z的气态氢化物沸点,C错误;
D.若R和X分别为O、Al,则形成的化合物属于离子晶体,D错误。
故选A。
11.B
【详解】A.ZnS和ZnO均为离子晶体,离子半径,A正确;
B.由均摊法可知,一个晶胞含有两个和两个,空间利用率为,B错误;
C.由晶胞结构可知,离等距且最近的数为4,这4个构成正四面体,位于正四面体的体心,C正确;
D.与之间间隔,每个均连接4个,所以最近且等距的有个,D正确;
故选:B。
12.D
【详解】A.A中冠醚与K+之间并非离子键,而是通过配位键结合,A错误;
B.B中物质阳离子基团较大,离子键较弱,较NaBF4熔沸点更低,B错误;
C.根据图B中物质的结构可知,1mol该物质含有σ键19mol,数目为19NA,C错误;
D.六边形边上的氧原子被两个六边形所共有,一共有6个,六边形顶点的氧原子被三个六边形共有,一共有,加起来一共5个氧,六边形顶点的硅原子被三个六边形共有,一共有 6 × =2个,再根据硅化合价为+4价,氧化合价为-2价,其结构通式为,D正确;
故选D。
13.B
【详解】A.由于铵根离子会发生水解,所以溶液中离子的数目小于,A错误;
B.内的平均反应速率为,B正确;
C.标准状况下,生成2.24L氮气,氮气的物质的量为0.1mol,转移电子数目为0.3NA,C错误;
D.1个铵根离子中有4个共价键,而在氯化铵晶体中与1个铵根离子形成离子键的氯离子数目大于1,因此1个铵根离子形成的离子键数目大于1,所以氯化铵晶体中共价键与离子键数量之比不是4:1,D错误;
故选B。
14.B
【详解】A.依据均推法,晶胞中镁原子共有个,铝原子共有8个,化学式为,A正确;
B.氧化铝、氧化镁均为离子晶体,半径比半径小,且所带电荷比多,氧化铝的熔点更高,B错误;
C.合金属于金属晶体,晶体中存在的化学键类型为金属键,C正确;
D.一个晶胞中含有4个“”,其质量为,D正确;
故选B。
15.B
【详解】A.和为金属元素,形成的化合物为金属晶体,A错误;
B.原子位于晶胞的8个顶点,1个体心,体心周围距离最近且相等的原子个数是8个顶点的,故周围距离最近的原子个数为8,B正确;
C.晶胞沿x轴、z轴的投影图完全相同,投影图为,与晶胞沿y轴投影图不同,C错误;
D.高温时,金属的电阻增加,导电能力减弱,D错误;
故答案为:B。
16.(1) 四 VⅢ
(2)
(3) 70 120 用量
(4)
(5) 蒸发结晶 趁热过滤
(6) 或 或
【分析】经过放电处理后, 负极Li放电形成 最终转移到正极材料中, 可提高Li元素的回收率, 经过浸出还原, 正极材料中相关元素转化为 加入NaOH调节pH至11,可将 转化为沉淀除去, 最终在滤液中加入 得到 产品, 正极材料前驱体在空气中煅烧得到终端产品
【详解】(1)镍是第28号元素,位于元素周期表第四周期第Ⅷ族。
(2)粉料中的被过氧化氢氧化,相关元素转化为,化合价由+3价变为+2价,氧元素由-1价变为0价,故相关化学方程式为
(3)①由图可知,当温度为70℃、浸出时间为120min时金属的浸出率较高,再提高温度和浸出时间,金属的浸出率几乎不变,所以最佳的温度为70℃、最佳的浸出时间为120min。
②影响浸出率的因素除了温度时间外,还包括反应物浓度,故答案为用量
(4)与发生相互促进的完全双水解反应:
(5)由于碳酸锂的溶解度随温度升高而减小,沉淀完成后从溶液中得到的操作有蒸发结晶、趁热过滤、洗涤、干燥。
(6)①该晶胞中Co的原子个数为1,Ni的原子个数为 ,O的原子个数为,故该晶体的化学式为或。
②因为晶胞棱长为,故晶胞体积为,晶胞密度为,则或
17.(1)6
(2)顶点
(3) 不能 5643
【详解】(1)晶胞中,有4个Al原子位于内部,6个位于棱上,棱上的原子对晶胞的贡献率为,则每个晶胞中含Al原子个;晶胞中,有3个N原子位于内部,2个位于面心,面心的原子对晶胞的贡献率为,12个位于顶点,顶点的原子对晶胞的贡献率为,则每个晶胞中含N原子个,含有的Al、N原子个数均是6;
(2)由氮化铁的晶胞结构图可知,N位于体心,每个晶胞中含1个N原子,Fe位于面心和顶点,每个晶胞中含4个Fe原子,晶胞化学式为Fe4N,可替代晶胞中不同位置的,替代晶胞中顶点上的形成化学式为的氮化物,替代晶胞中面心上的形成化学式为的氮化物,化学式为的氮化物不稳定,物质能量越高越不稳定,则能量比高,则a位置表示顶点,b位置表示面心;
(3)第一电离能是指基态的气态原子失去最外层的一个电子变为气态离子所需的能量,图中无此过程的数据,故不能计算出原子的第一电离能;的晶格能为。
18.(1) IB ds
(2)6CuFeS2+19O26CuO+2Fe3O4+12SO2
(3)将Fe3+还原为Fe2+,防止Fe3+在调pH时变成Fe(OH)3而除去
(4)Al(OH)3
(5)平面正方形或平面四边形或平行四边形
(6) 0.3 CuFe2O4-δ+δH2O=CuFe2O4+δH2↑
(7)×107
【分析】氧气具有氧化性,已知,酸浸后溶液中的金属离子有、、和,“焙烧”时生成三种氧化物,结合质量守恒可知,“焙烧”中黄铜矿的与氧气反应生成SO2、CuO、,反应为,加入硫酸将金属氧化物转化相应硫酸盐溶液,滤渣1为不反应的二氧化硅,加入Cu还原铁离子为Fe2+,加入CuO调pH使Al3+完全沉淀,而Cu2+、Fe2+不沉淀,滤渣2主要成分是氢氧化铝沉淀,含少量铜、氧化铜;加入过氧化氢将亚铁离子氧化为铁离子,加入过量氨水反应生成Cu(NH3)4SO4,Fe3+与弱碱氨水反应生成Fe(OH)3沉淀,Cu(NH3)4SO4经系列操作生成CuO,灼烧时CuO与氢氧化铁反应生成CuFe2O4,在氮气做保护气下煅烧生成。
【详解】(1)Cu为29号元素,位于元素周期表第四周期第IB族;属于ds区;
(2)由分析可知,“焙烧”时反应化学方程式为;
(3)还原流程后调pH使得Al3+完全沉淀,而Cu2+、Fe2+不沉淀;由于铁离子会较铝离子首先沉淀,故加Cu“还原”的目是将还原为,防止在调pH时变成而除去;
(4)由分析可知,滤渣2的主要成分为;
(5)已知有两种同分异构体,则可知其结构不是四面体结构,而是平面四边形结构,故的空间构型为平面正方形或平面四边形或平行四边形;
(6)铁酸铜()制备氧缺位体(),质量减少量就是生成氧气的质量,,0.3;氧缺位体分解水制氢总反应为,结合第二步反应,可知第一步反应为;
(7)根据“均摊法”,晶胞中含个Cu、个Fe 、8个S,则晶体密度为,a=nm。
19.(1)
(2)ac
(3)
(4) 离子键、非极性共价键 碱性
(5) 碱性、还原性 1
【分析】结合“价类二维图”的横、纵坐标,可以确定各物质为:A是H2S、B是S、C是SO2、D是H2SO3、E是H2SO4、F是SO3、R是NH3、X是N2、Y是NO、Z是NO2、W是HNO3。
【详解】(1)物质R为NH3,其电子式为;
(2)a.R是NH3,N元素化合价为-3价,具有还原性,在催化剂的作用下,可将NO、NO2还原为N2,故a正确;
b.图中所示的物质中,A是H2S,也属于电解质,故b错误;
c.W是HNO3,浓硝酸具有挥发性,用玻璃棒分别蘸取浓HNO3和浓氨水,玻璃棒靠近时有白烟产生,故c正确;
d.NO2不是酸性氧化物,故d错误;
e.B是S,D是H2SO3,H2SO3中S化合价为+4价,焦亚硫酸钠(Na2S2O5) 中S化合价也为+4价,从氧化还原反应的角度分析,不可制备焦亚硫酸钠,故e错误;
故答案为:ac;
(3)物质W是HNO3,将其稀溶液加入H2SO3的溶液中,可生成H2SO4,该反应的离子方程式为;
(4)NaN3中存在Na+和离子之间形成的离子键,还有中氮氮原子之间形成的共价键,所含化学键类型为离子键和共价键;Na2CS3是强碱弱酸盐,水溶液显碱性;
(5)据S4N4(S是+2价)可知N是-2价,R是NH3,其中氮元素是-3价,所以反应中,一部分NH3由-3价变为-2价,体现还原性,还有一部分化合价没有变化,生成氯化铵,体现的是碱性;S2Cl2中+1价的硫元素,一部分变为S4N4中+2价,一部分变为零价的S8,所以S8-8e-,即32gS8转移电子物质的量为1mol。
答案第1页,共2页
答案第1页,共2页
