2023-2024学年高一下学期人教版(2019)化学必修第二册第6章化学反应与能量单元测试(含解析)
文档属性
| 名称 | 2023-2024学年高一下学期人教版(2019)化学必修第二册第6章化学反应与能量单元测试(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 13:38:53 | ||
图片预览




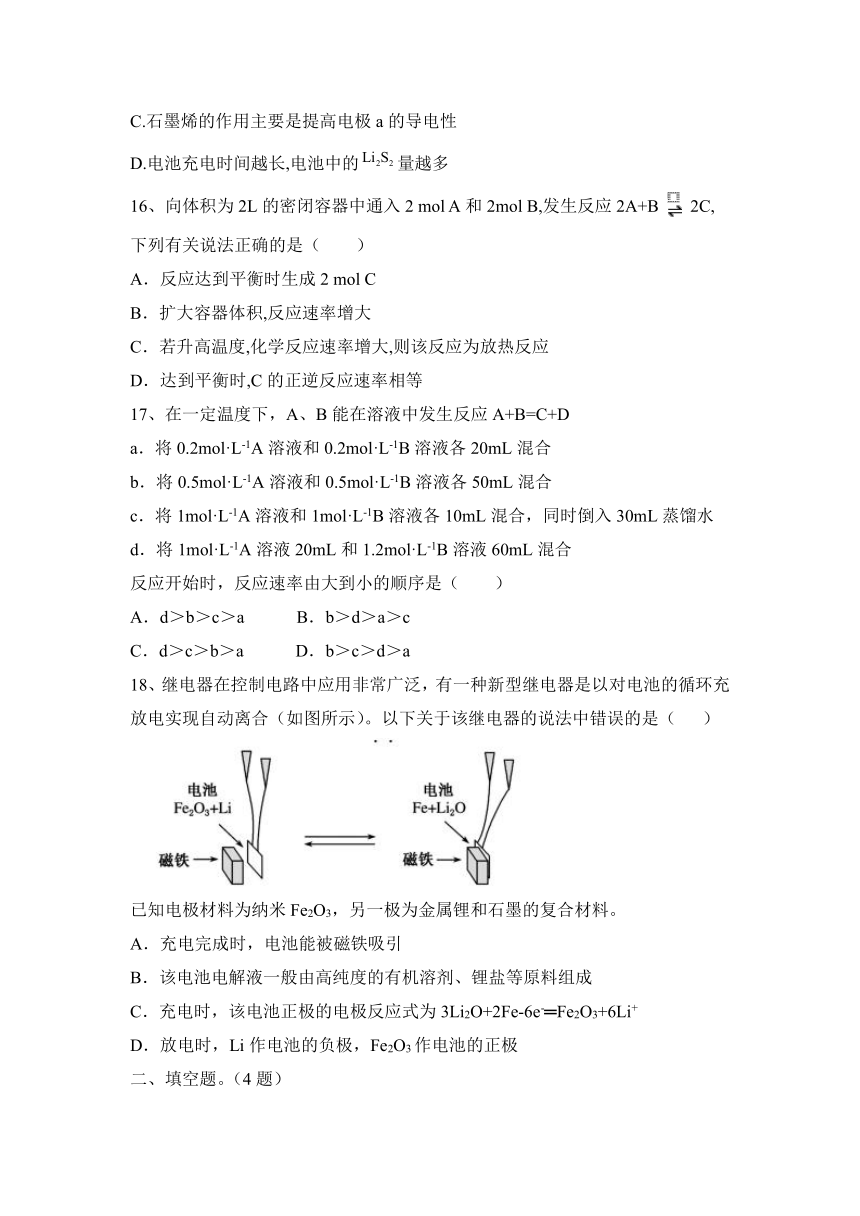
文档简介
第6章 化学反应与能量
一、选择题。
1、下列各装置能构成原电池的是( )
2、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
3、下列电池工作时,O2在正极得电子的是( )
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
4、(双选)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A.该电池的负极反应式为:CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为:O2+2H2O+4e-===4OH-
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
5、为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是( )
A.电池放电时,H2发生还原反应 B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应. D.电池充电时,NiO(OH)发生还原反应
6、100mL6mol/LH2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH(s) C.K2SO4溶液 D.(NH4)2SO4(s)
7、对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
8、把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如右图所示。最能影响该反应速率的两个因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
9、下列有关反应2SO2+O22SO3的说法中不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
10、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气,其中某一电极反应式为。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的与的物质的量之比为2 : 7
D.溶液中的向负极移动
11、下列说法正确的是( )
A.缩小体积增大压强,活化分子百分数增加,化学反应速率增大
B.升高温度,单位体积内分子总数不变,但活化分子数增加了,化学反应速率增大
C.使用催化剂,增加了分子的能量,活化分子百分数增加,化学反应速率增大
D.增大反应物浓度,活化分子百分数增加,化学反应速率增大
12、下列关于甲、乙两装置的说法中不正确的是( )
A.甲装置中Cu电极的电极反应式为
B.甲装置中电子由Cu经外电路流向Zn
C.乙装置放电时锌筒被消耗
D.乙装置无法将化学能完全转化为电能
13、如图所示是金属镁和卤素单质反应的能量变化示意图。下列说法不正确的是( )
A.由制取Mg是吸热过程
B.热稳定性:
C.常温下还原性:
D.由图知此温度下 与 反应的热化学方程式为:
14、在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
A.2s B.2 min C.3s D.3 min
15、全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯材料,电池反应为:。下列说法错误的是( )
A.电池工作时,正极可发生反应:
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的量越多
16、向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )
A.反应达到平衡时生成2 mol C
B.扩大容器体积,反应速率增大
C.若升高温度,化学反应速率增大,则该反应为放热反应
D.达到平衡时,C的正逆反应速率相等
17、在一定温度下,A、B能在溶液中发生反应A+B=C+D
a.将0.2mol·L-1A溶液和0.2mol·L-1B溶液各20mL混合
b.将0.5mol·L-1A溶液和0.5mol·L-1B溶液各50mL混合
c.将1mol·L-1A溶液和1mol·L-1B溶液各10mL混合,同时倒入30mL蒸馏水
d.将1mol·L-1A溶液20mL和1.2mol·L-1B溶液60mL混合
反应开始时,反应速率由大到小的顺序是( )
A.d>b>c>a B.b>d>a>c
C.d>c>b>a D.b>c>d>a
18、继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液一般由高纯度的有机溶剂、锂盐等原料组成
C.充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+
D.放电时,Li作电池的负极,Fe2O3作电池的正极
二、填空题。(4题)
19、已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳,____________放出热量多。
20、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:该反应的化学方程式为_____________________。
反应开始至2 min时,用Z表示的平均反应速率为____________。
21、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
22、一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率 (A.变快 B.不变 C变慢,填字母代号);该反应向 (填正移、逆移或不移).
三、实验题。(2题)
23、I、如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像回答问题:
(1)2min内,用C表示的反应速率为______________。
(2)该反应的方程式为______________ 。
(3)在其他条件下,测得A的反应速率为0.05 mol/(L·s),此时的反应与800℃时相比,________。
A.比800℃ 时快 B.比800℃ 时慢 C.和800℃ 时速率一样
Ⅱ、学习小组甲利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如表实验:
实验序号 实验温度/K 有关物质 溶液颜色褪至无色所需时间/s
酸性KMnO4溶液 H2C2O4溶液 H2O
V/mL c/mol L-1 V/mL c/mol L-1 V/mL
A 293 2 0.02 4 0.1 0 t1
B T1 2 0.02 3 0.1 V1 8
C 313 2 0.02 V2 0.1 1 t2
(4)通过实验A、B,可探究出___________(填外部因素)的改变对化学反应速率的影响,其中V1=_____、T1=_____;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_______,t2_______8 (填写“=”、“>”或“<”)。
(5)若t1<8,则由此实验可以得出的结论是_______ 。
24、图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
甲 乙
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____;乙为_____。
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A. B.
C. D.
第6章 化学反应与能量 复习优题2023-2024学年高一下学期人教版(2019)化学必修第二册(含答案)
一、选择题。
1、下列各装置能构成原电池的是( )
【答案】B
2、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
【答案】D。
3、下列电池工作时,O2在正极得电子的是( )
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
【答案】C
4、(双选)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A.该电池的负极反应式为:CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为:O2+2H2O+4e-===4OH-
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
【答案】AB
5、为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是( )
A.电池放电时,H2发生还原反应 B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应. D.电池充电时,NiO(OH)发生还原反应
【答案】C
6、100mL6mol/LH2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH(s) C.K2SO4溶液 D.(NH4)2SO4(s)
【答案】C
7、对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
【答案】C
8、把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如右图所示。最能影响该反应速率的两个因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
【答案】C
9、下列有关反应2SO2+O22SO3的说法中不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
【答案】B
10、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气,其中某一电极反应式为。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的与的物质的量之比为2 : 7
D.溶液中的向负极移动
【答案】C
11、下列说法正确的是( )
A.缩小体积增大压强,活化分子百分数增加,化学反应速率增大
B.升高温度,单位体积内分子总数不变,但活化分子数增加了,化学反应速率增大
C.使用催化剂,增加了分子的能量,活化分子百分数增加,化学反应速率增大
D.增大反应物浓度,活化分子百分数增加,化学反应速率增大
【答案】B
12、下列关于甲、乙两装置的说法中不正确的是( )
A.甲装置中Cu电极的电极反应式为
B.甲装置中电子由Cu经外电路流向Zn
C.乙装置放电时锌筒被消耗
D.乙装置无法将化学能完全转化为电能
【答案】B
13、如图所示是金属镁和卤素单质反应的能量变化示意图。下列说法不正确的是( )
A.由制取Mg是吸热过程
B.热稳定性:
C.常温下还原性:
D.由图知此温度下 与 反应的热化学方程式为:
【答案】B
14、在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
A.2s B.2 min C.3s D.3 min
【答案】A
15、全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯材料,电池反应为:。下列说法错误的是( )
A.电池工作时,正极可发生反应:
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的量越多
【答案】D
16、向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )
A.反应达到平衡时生成2 mol C
B.扩大容器体积,反应速率增大
C.若升高温度,化学反应速率增大,则该反应为放热反应
D.达到平衡时,C的正逆反应速率相等
【答案】D
17、在一定温度下,A、B能在溶液中发生反应A+B=C+D
a.将0.2mol·L-1A溶液和0.2mol·L-1B溶液各20mL混合
b.将0.5mol·L-1A溶液和0.5mol·L-1B溶液各50mL混合
c.将1mol·L-1A溶液和1mol·L-1B溶液各10mL混合,同时倒入30mL蒸馏水
d.将1mol·L-1A溶液20mL和1.2mol·L-1B溶液60mL混合
反应开始时,反应速率由大到小的顺序是( )
A.d>b>c>a B.b>d>a>c
C.d>c>b>a D.b>c>d>a
【答案】A
18、继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液一般由高纯度的有机溶剂、锂盐等原料组成
C.充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+
D.放电时,Li作电池的负极,Fe2O3作电池的正极
【答案】A
二、填空题。(4题)
19、已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳,____________放出热量多。
【答案】弱 金刚石
20、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:该反应的化学方程式为_____________________。
反应开始至2 min时,用Z表示的平均反应速率为____________。
【答案】3X+Y===2Z 0.05 mol·(L·min)-1
21、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
【答案】(1)是 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc
22、一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率 (A.变快 B.不变 C变慢,填字母代号);该反应向 (填正移、逆移或不移).
【答案】C;不移
三、实验题。(2题)
23、I、如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像回答问题:
(1)2min内,用C表示的反应速率为______________。
(2)该反应的方程式为______________ 。
(3)在其他条件下,测得A的反应速率为0.05 mol/(L·s),此时的反应与800℃时相比,________。
A.比800℃ 时快 B.比800℃ 时慢 C.和800℃ 时速率一样
Ⅱ、学习小组甲利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如表实验:
实验序号 实验温度/K 有关物质 溶液颜色褪至无色所需时间/s
酸性KMnO4溶液 H2C2O4溶液 H2O
V/mL c/mol L-1 V/mL c/mol L-1 V/mL
A 293 2 0.02 4 0.1 0 t1
B T1 2 0.02 3 0.1 V1 8
C 313 2 0.02 V2 0.1 1 t2
(4)通过实验A、B,可探究出___________(填外部因素)的改变对化学反应速率的影响,其中V1=_____、T1=_____;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_______,t2_______8 (填写“=”、“>”或“<”)。
(5)若t1<8,则由此实验可以得出的结论是_______ 。
【答案】(1)0.05 mol L 1 min 1 (2)2A2B + C (3)A
(4) H2C2O4浓度 1 293 B、C 3 <
(5)其他条件不变时,H2C2O4溶液浓度越大,该反应的速率越快
24、图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
甲 乙
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____;乙为_____。
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A. B.
C. D.
【答案】CD 化学能转化为热能 化学能转变为电能 C
一、选择题。
1、下列各装置能构成原电池的是( )
2、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
3、下列电池工作时,O2在正极得电子的是( )
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
4、(双选)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A.该电池的负极反应式为:CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为:O2+2H2O+4e-===4OH-
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
5、为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是( )
A.电池放电时,H2发生还原反应 B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应. D.电池充电时,NiO(OH)发生还原反应
6、100mL6mol/LH2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH(s) C.K2SO4溶液 D.(NH4)2SO4(s)
7、对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
8、把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如右图所示。最能影响该反应速率的两个因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
9、下列有关反应2SO2+O22SO3的说法中不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
10、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气,其中某一电极反应式为。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的与的物质的量之比为2 : 7
D.溶液中的向负极移动
11、下列说法正确的是( )
A.缩小体积增大压强,活化分子百分数增加,化学反应速率增大
B.升高温度,单位体积内分子总数不变,但活化分子数增加了,化学反应速率增大
C.使用催化剂,增加了分子的能量,活化分子百分数增加,化学反应速率增大
D.增大反应物浓度,活化分子百分数增加,化学反应速率增大
12、下列关于甲、乙两装置的说法中不正确的是( )
A.甲装置中Cu电极的电极反应式为
B.甲装置中电子由Cu经外电路流向Zn
C.乙装置放电时锌筒被消耗
D.乙装置无法将化学能完全转化为电能
13、如图所示是金属镁和卤素单质反应的能量变化示意图。下列说法不正确的是( )
A.由制取Mg是吸热过程
B.热稳定性:
C.常温下还原性:
D.由图知此温度下 与 反应的热化学方程式为:
14、在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
A.2s B.2 min C.3s D.3 min
15、全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯材料,电池反应为:。下列说法错误的是( )
A.电池工作时,正极可发生反应:
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的量越多
16、向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )
A.反应达到平衡时生成2 mol C
B.扩大容器体积,反应速率增大
C.若升高温度,化学反应速率增大,则该反应为放热反应
D.达到平衡时,C的正逆反应速率相等
17、在一定温度下,A、B能在溶液中发生反应A+B=C+D
a.将0.2mol·L-1A溶液和0.2mol·L-1B溶液各20mL混合
b.将0.5mol·L-1A溶液和0.5mol·L-1B溶液各50mL混合
c.将1mol·L-1A溶液和1mol·L-1B溶液各10mL混合,同时倒入30mL蒸馏水
d.将1mol·L-1A溶液20mL和1.2mol·L-1B溶液60mL混合
反应开始时,反应速率由大到小的顺序是( )
A.d>b>c>a B.b>d>a>c
C.d>c>b>a D.b>c>d>a
18、继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液一般由高纯度的有机溶剂、锂盐等原料组成
C.充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+
D.放电时,Li作电池的负极,Fe2O3作电池的正极
二、填空题。(4题)
19、已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳,____________放出热量多。
20、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:该反应的化学方程式为_____________________。
反应开始至2 min时,用Z表示的平均反应速率为____________。
21、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
22、一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率 (A.变快 B.不变 C变慢,填字母代号);该反应向 (填正移、逆移或不移).
三、实验题。(2题)
23、I、如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像回答问题:
(1)2min内,用C表示的反应速率为______________。
(2)该反应的方程式为______________ 。
(3)在其他条件下,测得A的反应速率为0.05 mol/(L·s),此时的反应与800℃时相比,________。
A.比800℃ 时快 B.比800℃ 时慢 C.和800℃ 时速率一样
Ⅱ、学习小组甲利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如表实验:
实验序号 实验温度/K 有关物质 溶液颜色褪至无色所需时间/s
酸性KMnO4溶液 H2C2O4溶液 H2O
V/mL c/mol L-1 V/mL c/mol L-1 V/mL
A 293 2 0.02 4 0.1 0 t1
B T1 2 0.02 3 0.1 V1 8
C 313 2 0.02 V2 0.1 1 t2
(4)通过实验A、B,可探究出___________(填外部因素)的改变对化学反应速率的影响,其中V1=_____、T1=_____;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_______,t2_______8 (填写“=”、“>”或“<”)。
(5)若t1<8,则由此实验可以得出的结论是_______ 。
24、图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
甲 乙
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____;乙为_____。
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A. B.
C. D.
第6章 化学反应与能量 复习优题2023-2024学年高一下学期人教版(2019)化学必修第二册(含答案)
一、选择题。
1、下列各装置能构成原电池的是( )
【答案】B
2、为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
【答案】D。
3、下列电池工作时,O2在正极得电子的是( )
A B C D
锌锰电池 铅酸蓄电池 氢氧燃料电池 镍镉电池
【答案】C
4、(双选)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A.该电池的负极反应式为:CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为:O2+2H2O+4e-===4OH-
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
【答案】AB
5、为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是( )
A.电池放电时,H2发生还原反应 B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应. D.电池充电时,NiO(OH)发生还原反应
【答案】C
6、100mL6mol/LH2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH(s) C.K2SO4溶液 D.(NH4)2SO4(s)
【答案】C
7、对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
【答案】C
8、把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如右图所示。最能影响该反应速率的两个因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
【答案】C
9、下列有关反应2SO2+O22SO3的说法中不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
【答案】B
10、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气,其中某一电极反应式为。有关此电池的推断不正确的是( )
A.通入乙烷的电极为负极
B.放电一段时间后,KOH的物质的量浓度将下降
C.参加反应的与的物质的量之比为2 : 7
D.溶液中的向负极移动
【答案】C
11、下列说法正确的是( )
A.缩小体积增大压强,活化分子百分数增加,化学反应速率增大
B.升高温度,单位体积内分子总数不变,但活化分子数增加了,化学反应速率增大
C.使用催化剂,增加了分子的能量,活化分子百分数增加,化学反应速率增大
D.增大反应物浓度,活化分子百分数增加,化学反应速率增大
【答案】B
12、下列关于甲、乙两装置的说法中不正确的是( )
A.甲装置中Cu电极的电极反应式为
B.甲装置中电子由Cu经外电路流向Zn
C.乙装置放电时锌筒被消耗
D.乙装置无法将化学能完全转化为电能
【答案】B
13、如图所示是金属镁和卤素单质反应的能量变化示意图。下列说法不正确的是( )
A.由制取Mg是吸热过程
B.热稳定性:
C.常温下还原性:
D.由图知此温度下 与 反应的热化学方程式为:
【答案】B
14、在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用H2表示的平均反应速率为0.45mol/(L·s)。则反应所经过的时间是( )
A.2s B.2 min C.3s D.3 min
【答案】A
15、全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯材料,电池反应为:。下列说法错误的是( )
A.电池工作时,正极可发生反应:
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的量越多
【答案】D
16、向体积为2L的密闭容器中通入2 mol A和2mol B,发生反应2A+B 2C,下列有关说法正确的是( )
A.反应达到平衡时生成2 mol C
B.扩大容器体积,反应速率增大
C.若升高温度,化学反应速率增大,则该反应为放热反应
D.达到平衡时,C的正逆反应速率相等
【答案】D
17、在一定温度下,A、B能在溶液中发生反应A+B=C+D
a.将0.2mol·L-1A溶液和0.2mol·L-1B溶液各20mL混合
b.将0.5mol·L-1A溶液和0.5mol·L-1B溶液各50mL混合
c.将1mol·L-1A溶液和1mol·L-1B溶液各10mL混合,同时倒入30mL蒸馏水
d.将1mol·L-1A溶液20mL和1.2mol·L-1B溶液60mL混合
反应开始时,反应速率由大到小的顺序是( )
A.d>b>c>a B.b>d>a>c
C.d>c>b>a D.b>c>d>a
【答案】A
18、继电器在控制电路中应用非常广泛,有一种新型继电器是以对电池的循环充放电实现自动离合(如图所示)。以下关于该继电器的说法中错误的是( )
已知电极材料为纳米Fe2O3,另一极为金属锂和石墨的复合材料。
A.充电完成时,电池能被磁铁吸引
B.该电池电解液一般由高纯度的有机溶剂、锂盐等原料组成
C.充电时,该电池正极的电极反应式为3Li2O+2Fe-6e-═Fe2O3+6Li+
D.放电时,Li作电池的负极,Fe2O3作电池的正极
【答案】A
二、填空题。(4题)
19、已知一定条件下,金刚石转化为石墨释放出能量,则金刚石比石墨稳定性______(填“强”、“弱”),等质量的金刚石和石墨充分燃烧均生成二氧化碳,____________放出热量多。
【答案】弱 金刚石
20、某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:该反应的化学方程式为_____________________。
反应开始至2 min时,用Z表示的平均反应速率为____________。
【答案】3X+Y===2Z 0.05 mol·(L·min)-1
21、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
【答案】(1)是 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc
22、一定温度下,反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率 (A.变快 B.不变 C变慢,填字母代号);该反应向 (填正移、逆移或不移).
【答案】C;不移
三、实验题。(2题)
23、I、如图所示,800℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像回答问题:
(1)2min内,用C表示的反应速率为______________。
(2)该反应的方程式为______________ 。
(3)在其他条件下,测得A的反应速率为0.05 mol/(L·s),此时的反应与800℃时相比,________。
A.比800℃ 时快 B.比800℃ 时慢 C.和800℃ 时速率一样
Ⅱ、学习小组甲利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如表实验:
实验序号 实验温度/K 有关物质 溶液颜色褪至无色所需时间/s
酸性KMnO4溶液 H2C2O4溶液 H2O
V/mL c/mol L-1 V/mL c/mol L-1 V/mL
A 293 2 0.02 4 0.1 0 t1
B T1 2 0.02 3 0.1 V1 8
C 313 2 0.02 V2 0.1 1 t2
(4)通过实验A、B,可探究出___________(填外部因素)的改变对化学反应速率的影响,其中V1=_____、T1=_____;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_______,t2_______8 (填写“=”、“>”或“<”)。
(5)若t1<8,则由此实验可以得出的结论是_______ 。
【答案】(1)0.05 mol L 1 min 1 (2)2A2B + C (3)A
(4) H2C2O4浓度 1 293 B、C 3 <
(5)其他条件不变时,H2C2O4溶液浓度越大,该反应的速率越快
24、图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
甲 乙
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____;乙为_____。
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A. B.
C. D.
【答案】CD 化学能转化为热能 化学能转变为电能 C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
