科粤版化学九下同步测试:7.3溶液浓稀的表示(含解析)
文档属性
| 名称 | 科粤版化学九下同步测试:7.3溶液浓稀的表示(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 181.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 16:41:05 | ||
图片预览



文档简介
7.3 溶液浓稀的表示
一、单选题
1.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
2.如图是甲、乙、丙三种物质的溶解度曲线图,下列说法正确的的是
①20℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙;
②将丙的饱和溶液变为不饱和溶液,可采用降低温度的方法;
③40℃时,甲物质的饱和溶液的溶质质量分数约为28.6%;
④将相同质量的甲、乙、丙的饱和溶液分别从50℃降温至10℃析出晶体的质量由小到大的顺序为:丙<乙<甲;
A.①②③④ B.①②③ C.②③④ D.①②④
3.下列关于溶液的说法中正确的是
A.水中滴入少量菜油后用力振荡后可形成溶液 B.饱和溶液一定是一种浓溶液
C.饱和溶液就是不能再溶解任何物质的溶液 D.溶质可以是固体,也可以是液体或气体
4.如图所示是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.t1℃时,把30g丙放入50g水中能得到80g丙的不饱和溶液
B.t2℃时,甲、乙两物质的饱和溶液中含有相等质量的溶质
C.将t1℃时三种物质的饱和溶液升温至t2℃时,所得溶液中溶质的质量分数依次为丙<甲=乙
D.t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙
5.已知:20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g。配制20℃时的如下四种溶液:
溶液 ① ② ③ ④
固体种类 KCl KCl KNO3 KNO3
加入固体的质量/g 20 35 20 35
水的质量/g 100 100 100 100
下列有关溶液①~④的说法不正确的是A.属于饱和溶液的是②④
B.溶液的质量②=④
C.溶液中溶质的质量分数①=③
D.②中溶质与溶剂的质量比为17:50
6.现用98%的浓硫酸配制490g20%的稀硫酸,需水的质量为
A.98g B.100g C.390g D.392g
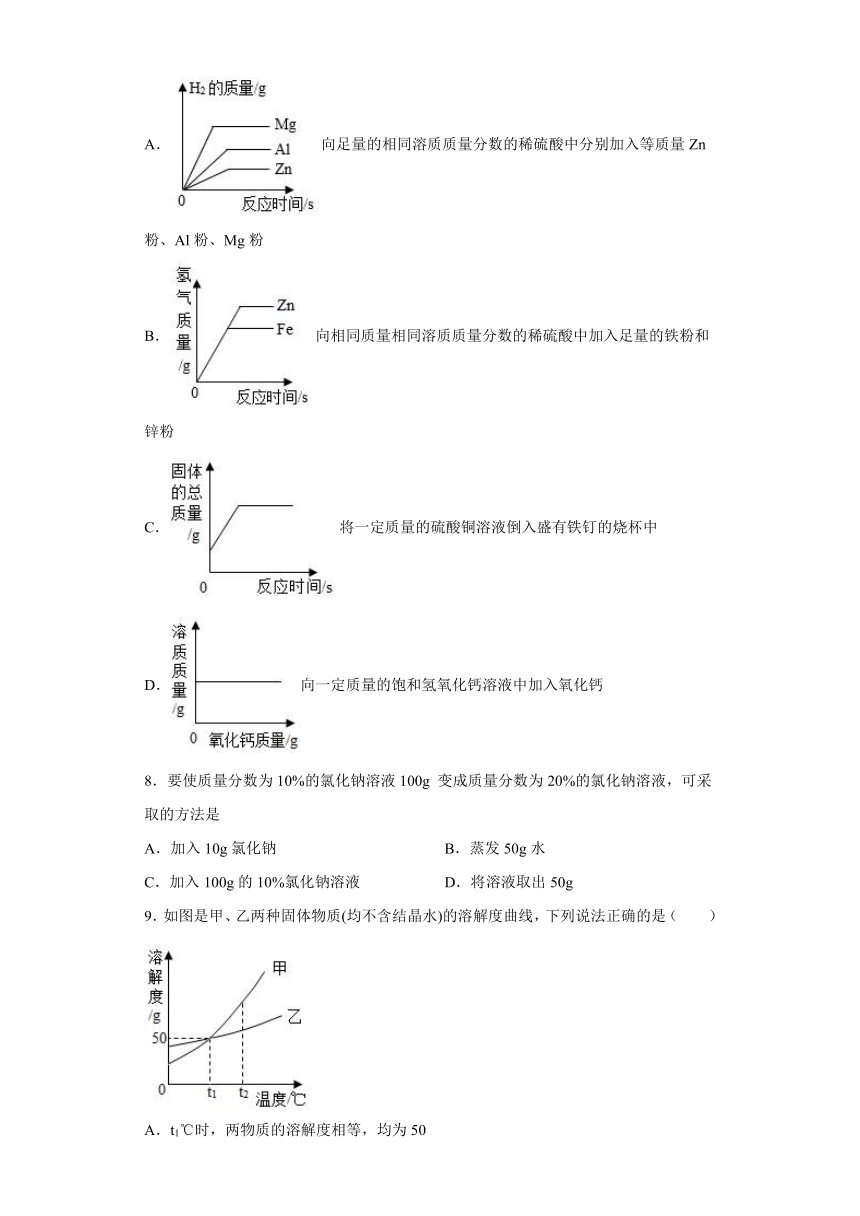
7.图像能直观表达化学中各种变化的关系,加深对化学知识的理解。有关下列图像的描述,正确的一项是
A.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
B.向相同质量相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉
C.将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
D.向一定质量的饱和氢氧化钙溶液中加入氧化钙
8.要使质量分数为10%的氯化钠溶液100g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入10g氯化钠 B.蒸发50g水
C.加入100g的10%氯化钠溶液 D.将溶液取出50g
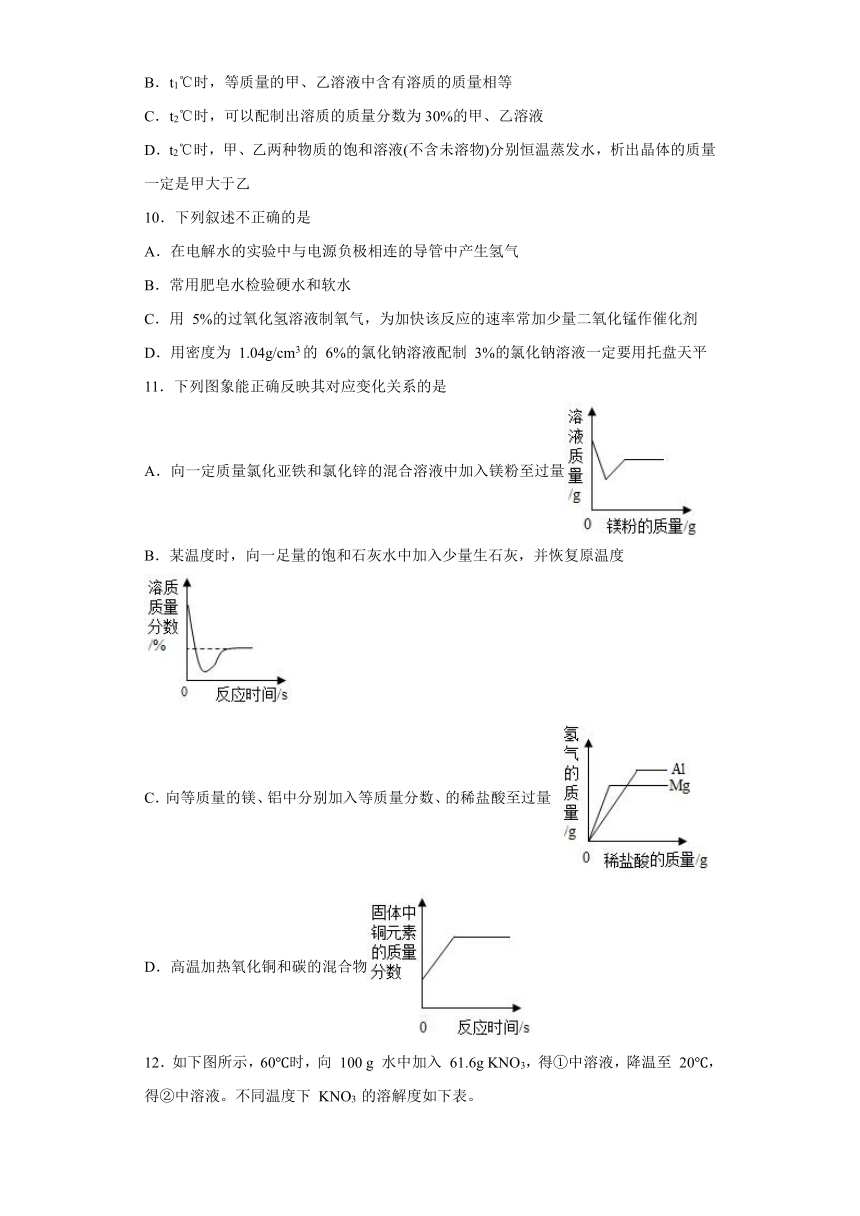
9.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t1℃时,两物质的溶解度相等,均为50
B.t1℃时,等质量的甲、乙溶液中含有溶质的质量相等
C.t2℃时,可以配制出溶质的质量分数为30%的甲、乙溶液
D.t2℃时,甲、乙两种物质的饱和溶液(不含未溶物)分别恒温蒸发水,析出晶体的质量一定是甲大于乙
10.下列叙述不正确的是
A.在电解水的实验中与电源负极相连的导管中产生氢气
B.常用肥皂水检验硬水和软水
C.用 5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
D.用密度为 1.04g/cm3的 6%的氯化钠溶液配制 3%的氯化钠溶液一定要用托盘天平
11.下列图象能正确反映其对应变化关系的是
A.向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量
B.某温度时,向一足量的饱和石灰水中加入少量生石灰,并恢复原温度
C.向等质量的镁、铝中分别加入等质量分数、的稀盐酸至过量
D.高温加热氧化铜和碳的混合物
12.如下图所示,60℃时,向 100 g 水中加入 61.6g KNO3,得①中溶液,降温至 20℃,得②中溶液。不同温度下 KNO3 的溶解度如下表。
温度/℃ 20 30 40 50 60
溶解度/g 31.6 45.8 63.9 85.5 110
下列说法正确的是A.①中溶液是 KNO3 饱和溶液 B.开始析出固体时的温度为 20℃
C.②中析出固体的质量为 30 g D.②中溶液的溶质质量分数为 31.6%
二、填空题
13.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
(1)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是_____的溶液。
(2)t2℃时,将25g氯化钾加入盛有50g水的烧杯中,充分溶解后,得到氯化钾溶液的质量是_____g.保持温度不变,往该烧杯中再加入5g水,充分搅拌后,氯化钾溶液的溶质的质量分数:_____(选填“变大”“不变”或“变小”)。
(3)当硝酸钾中混有少量氯化钾时,可用_____的方法提纯硝酸钾。
14.请回答下列问题。
(1)2012年3月22日是第二十届“世界水日”.水与人类的生活和生产密切相关.
①节约用水、防治水污染应成为我们的自觉行为.下列有关叙述中不正确的是_____.
A.生活中养成良好的用水习惯,尽可能充分利用每一滴水
B.工业废水经过处理达标后再排放
C.水体污染会危害人体健康
D.大量使用农药、化肥,不会造成水体污染
②水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是_____.
A.植物油 B.醋酸 C.蔗糖 D.高锰酸钾
③区分软水和硬水常用的物质是_____.
(2)20℃时,NaCl溶解于水的实验数据如表。
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
A 100 20 120
B 100 30 130
C 100 40 136
D 100 50 136
①A所得溶液的溶质质量分数______20%;(填“>”、“<”、“=”)
②B所得的溶液_____(填“是”或“否”)饱和;
③C所得溶液的溶质质量分数_____(填“>”、 “<”、“=”)D所得溶液的溶质质量分数。
15.水在地球上储量很大,分布范围也很广,但可供人类直接利用的淡水却非常少.
(1)自来水厂净水过程中用到活性炭,其作用是__________ , 由于该过程不能将硬水转化成软水,所以生活中常用_______________的方法将硬水软化;
(2)远离陆地的海岛可以利用图示的“太阳能海水淡化装置”缓解淡水不足的问题.
①水变成水蒸气的过程中,不发生变化的是___________(填序号);
A、分子质量 B、分子种类 C、分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________(填“变大”“变小”或“不变”)
16.青海省柴达木盆地的察尔汗盐湖是我国最大的天然内陆咸水湖,当地农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。
(1)“夏天晒盐”中的“盐”其溶解度可用图中________来表示(填“a ”、或“b ”、或“c ”)。
(2)在t1℃时,三种物质的溶解度大小关系是________。
(3)在t2℃时,将40g 的a放入50g 水中充分搅拌,所得溶液质量为________g 。
(4)将t2℃ 时 的饱和溶液降温至 时,溶质的质量分数由大到小的顺序为________。
17.甲、乙、丙三种物质的溶解度曲线如下图所示。据图回答:
(1)要使乙从其浓溶液中大量析出,应采用 ________ 结晶法;
(2)甲、乙、丙三种物质中常温下可能是气体物质的是 _____ ;
(3)30℃时,向一支盛有4 g甲的烧杯内加入10mL水,充分搅拌后,静置,得到 _________ 溶液(填“饱和”或“不饱和”);
(4)50℃质量分数为25%的乙溶液,降温至10℃, ______ 晶体析出(填“有”或“无”) 。
三、实验题
18.某同学将甲、乙固体各30g分别加入100g水中后,进行了如图所示的实验。请回答:
(1) 甲、乙两种固体的溶解度曲线如图所示,图中能表示乙物质的溶解度曲线的是_______(填“a”或“b”);
(2)图中m的取值范围是___________;
(3)40℃时,取等质量的甲、乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃,溶液中溶剂的质量:甲______乙(填“>”、“<”或“=”,下同);若再降温到20℃时,溶液的溶质质量分数:甲______乙。
19.现有三支试管,分别加入不同温度和体积的水,试管编号及相关数据如下表.
试管编号 A B C
水的体积/mL 5 10 10
水的温度/℃ 20 20 50
(1)向三支试管中各加入0.5 g硫酸铜粉末,完全溶解.溶液颜色最深的是________.
(2)再向B、C两支试管中加硫酸铜粉末至饱和,则B中溶液的颜色较C中的________.
(3)由此实验可得出:①溶质的质量分数越大,有色溶液的颜色越________;②________.
20.请回答下列问题
【气体制备】
(1)装置B中的玻璃仪器有分液漏斗、导管和______(填仪器名称)
(2)实验室常用加热一种暗紫色固体的方法制取氧气,该反应的化学方程式_______;若用F装置收集氧气,当观察到______时,将导管伸入集气瓶中。
(3)某同学用锌粒和稀盐酸制取氢气,反应的化学方程式为______;制得的氢气含有少量的水蒸气和HCl气体.若要得到干燥、纯净的氢气,需要将气体依次通过装置D和装置C,然后再进行收集。则C中盛放的试剂名称为______;装置E是用排空气法收集氢气的装置,气体应由______进(填导管口序号)。
(4)实验室常用加热NH4Cl和Ca(OH)2两种固体混合物的方法制取氨气,选用的发生装置______;该反应的化学方程式______;结合该反应分析,铵态氮肥______(填“能”或“不能”)和熟石灰等碱性物质混用,防止降低肥效。
【溶液配制】为预防“新冠肺炎”公共场所可用0.5%的过氧乙酸(化学式为C2H4O3)溶液来消毒。现用质量分数为20%的过氧乙酸溶液配制100g0.5%的过氧乙酸溶液。
(5)实验的主要步骤是计算、______、混匀、装瓶贴标签。稀释时需加水______mL。
(6)若用量筒量取水时俯视凹液面的最低处,则配制溶液的质量分数偏______(填“大”或“小”)。
21.根据下列实验装置图,回答有关问题。
(1)装置图中仪器a的名称为___________。
(2)实验室想用A装置制取一瓶氧气并用于铁丝燃烧实验,则应选用的收集装置为___________(填序号),A装置中反应的化学方程式为___________。
(3)若用B装置制取CO2的化学方程式为___________,如果用F装置收集CO2,气体应从___________(填“b”或“e”)端通入;若实验中产生气泡的速度太慢,采取的方法是___________。
(4)兴趣小组同学阅读产品标答发现,某市售高锰酸钾药品纯度高达99.5%,含水量可忽略不计。小组同学设计了直立型装置制取氧气,并与传统装置相比较,分别放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值记录如下:
装置类型 收集一瓶气体所需时间 反应生成氧气总体积
直立型 39.3s 552mL
传统型 52.2s 456mL
①小组同学用直立型装置制取氧气时,不需在试管口放一团棉花的原因是___________。
②等质量的高锰酸钾充分反应,传统型装置收集到的氧气较少的主要原因是___________。
(5)某学习小组选用98%的浓硫酸(密度1.84g/cm3)配制100g9.8%的稀硫酸主要步骤:
①计算:需要浓硫酸约为5.43mL,需要水___________mL;
②量取:量取浓硫酸和水,如果量取浓硫酸时俯视读数,会导致所配稀硫酸的溶质的质量分数___________9.8%(选填“大于”“小于”或“等于”);
③稀释;
④装瓶贴标签:将配制好的稀硫酸装入___________(填仪器名称)中,并贴上标签。
四、计算题
22.贝壳的主要成分是碳酸钙。现将100稀盐酸加入30g贝壳样品中(杂质不溶于水也不参与反应)恰好完全反应,称得剩余物质的质量为121.2g。请计算:
(1)贝壳样品中碳酸钙的质量。
(2)所用稀盐酸的溶质质量分数。
参考答案
1.C
【详解】溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。A.该温度下,KNO3的溶解度为= ,x=50g,故A错误;B. 乙溶液的质量分数为×100%=33.3%,故B错误;C. 降低温度,可以使甲溶液变成饱和溶液,硝酸钾溶解度随温度升高而增大,故C正确;D. 硝酸钾溶解度随温度升高而增大,升高温度,甲、乙两溶液的质量分数都不变,故D错误。
点睛∶硝酸钾溶解度随温度升高而增大,影响固体溶解度的因素是温度,溶质和溶剂本身的性质。
2.A
【详解】①由图可知,20℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙,故①正确;
②丙物质的溶解度随温度的升高而减小,将丙的饱和溶液变为不饱和溶液,可采用降低温度的方法,故②正确;
③40℃时,甲物质的溶解度为40g,甲物质的饱和溶液的溶质质量分数约为,故③正确;
④50℃降温至10℃,甲和乙物质的溶解度随温度的降低而减少,甲物质的溶解度减少的比乙物质的溶解度减少的更多,故等质量的甲、乙饱和溶液降温析出晶体的质量甲大于乙;丙物质的溶解度随温度的减少而增大,故丙物质的饱和溶液降温不会析出晶体;将相同质量的甲、乙、丙的饱和溶液分别从50℃降温至10℃析出晶体的质量由小到大的顺序为:丙<乙<甲,故④正确;
故选:A。
3.D
【解析】溶质可以是固体,也可以是液体或气体。
【详解】A、菜油不溶于水,与水混合形成的是乳浊液,不符合题意;
B、饱和溶液不一定是一种浓溶液,不符合题意;
C、饱和溶液是指在某一温度不能再溶解某一溶质的溶液,还可以溶解其它物质,不符合题意;
D、溶质可以是固体,也可以是液体或气体,符合题意。故选D。
【点睛】溶质可以是固体,也可以是液体或气体,并且一种或多种物质可以同时溶解在同一溶剂中。
4.D
【详解】A、t1℃时,丙的溶解度是40g,即100g水中最多能溶解40g丙,则把30g丙放入50g水中能得到70g丙的饱和溶液,错误;
B、t2℃时,甲、乙两物质的饱和溶液中的溶质质量分数相等,但是没有给出饱和溶液的质量,则含有溶质的质量无法计算,错误;
C、甲、乙的溶解度随温度的升高而增大,将t1℃时甲、乙物质的饱和溶液升温至t2℃时,溶液变得不饱和,但是溶液的组成不变,溶质的质量分数以t1℃时甲、乙物质的溶解度计算,t1℃时物质的溶解度乙大于甲,则饱和溶液溶质的质量分数乙大于甲;丙的溶解度随温度升高而降低,析出晶体,t1℃时甲的溶解度大于t2℃时丙的溶解度,则饱和溶液溶质的质量分数甲大于丙;则三种物质的饱和溶液这溶质质量分数:乙>甲>丙;错误;
D、根据图像,t3℃时三种物质的溶解度:甲>乙>丙,则等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙,正确。
故选D。
5.B
【详解】A、20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g,故①加入20g氯化钾全部溶解为不饱和溶液②加入35g氯化钾部分溶解,为饱和溶液③20g硝酸钾全部溶解为不饱和溶液④35g硝酸钾部分溶解,为饱和溶液,故A正确。
B、20℃时,氯化钾溶解度34g溶液②加入35g氯化钾只能溶解34g溶液质量34g+100g=134g,硝酸钾溶解31.6g,溶液④加入35g硝酸钾只能溶解31.6g,溶液质量31.6g+100g=131.6g,故溶液的质量②≠④,故B错误。
C、20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g,溶液①③20g溶质均全部溶解,溶液①③溶质质量相等,溶剂质量相等,故溶质的质量分数①=③,故C正确。
D、20℃时,氯化钾溶解度34g,故35g氯化钾只能溶解34g,溶质溶剂质量比34g:100g=17:50,故D正确。
故选:B。
6.C
【详解】溶液稀释前后溶质的质量不变。设需要98%的浓硫酸的质量为x,则有,解得x=100g,所以需要水的质量为。
故选C。
7.C
【详解】A、向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉,每65份质量的锌生成2份质量的氢气,每54份质量的铝生成6份质量的氢气,每24份质量的镁生成2份质量的氢气,生成氢气质量的顺序为Al>Mg>Zn,故不符合题意;
B、向相同质量、相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉,采用以少定多的原则,生成氢气的质量跟酸的质量有关,酸的质量相等,最终生成氢气的质量相等,故不符合题意;
C、硫酸铜溶液和铁反应,56份质量的铁置换出64份质量的铜,固体的总质量增加,故符合题意;
D、氧化钙会和水反应,消耗了水,且放热,温度升高,氢氧化钙会析出,饱和氢氧化钙溶液的质量会减少,故不符合题意。
故选B。
8.B
【详解】A. 加入10g氯化钠,所得溶液质量分数为 ,错误;
B. 蒸发50g水,所得溶液质量分数为 ,正确;
C. 溶液是均一稳定的,加入100g的10%氯化钠溶液,所得溶液质量分数仍为10% ,错误;
D. 溶液是均一稳定的,将溶液取出50g,所得溶液质量分数仍为10% ,错误;
故选B。
9.C
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】A、通过分析溶解度曲线可知,t1℃时,两物质的溶解度相等,均为50g,故A错误;
B、t1℃时,甲、乙两物质的溶解度相等,但等质量的甲、乙溶液的状态不能确定,所以溶液中含有溶质的质量不能确定,故B错误;
C、t1℃时,甲乙饱和溶液的质量分数大于,t2℃时,可以配制出溶质的质量分数为30%的甲、乙溶液,故C正确;
D、t2℃时,甲物质的溶解度大于乙物质的溶解度,所以给甲、乙两种物质的饱和溶液(不含未溶物)分别恒温蒸发等质量的水,析出晶体的质量一定是甲大于乙,题干没有说明蒸发等质量的水,故D错误。
故选C。
10.D
【详解】A、在电解水实验中,“正氧负氢”,故与电源负极相连的导管中产生氢气,不符合题意;
B、通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,不符合题意;
C、用 5%的过氧化氢溶液制氧气,在该反应中,可加入少量二氧化锰作催化剂,加快化学反应速率,不符合题意;
D、用浓溶液配制稀溶液,实验步骤及所需仪器为:计算、量取(量筒、胶头滴管)、混匀(烧杯、玻璃棒)、装瓶贴标签,无需托盘天平,符合题意。
故选D。
11.D
【详解】A、向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量,镁先与氯化亚铁反应生成氯化镁和铁,24份质量的镁置换出56份质量的铁,随着反应进行,溶液质量减小,反应完后,镁和氯化锌反应生成氯化镁和锌,24份质量的镁置换出65份质量的锌,随着反应的进行,溶液质量减小更明显,故A不正确;
B、温度不变时,物质的溶解度不变,向一定量的饱和石灰水中加入少量生石灰,生石灰和水反应生成氢氧化钙同时放出大量的热,且饱和石灰水的溶解度随温度的升高而降低,则饱和溶液中溶质质量分数先减小,一段时间后恢复原温度,溶液仍饱和,溶质质量分数恢复到原来数值,故B不正确;
C、向等质量的镁、铝中分别加入等质量分数的稀盐酸至过量,在金属未完全反应时,消耗等质量硫酸产生的氢气质量相等,故开始在同一直线,当金属完全反应时,54份质量的铝生成6份质量的氢气,24份质量的镁生成2份质量的氢气,两种金属质量相等的情况下,铝生成的氢气较多,故C不正确;
D、高温加热氧化铜和碳的混合物,生成单质铜和二氧化碳气体,原本固体中的碳元素和氧元素减少,铜元素质量不变,铜的质量分数增大,待氧化铜或碳耗尽,铜的质量分数停止增长,故D正确。
故选D。
12.C
【详解】A.60℃时KNO3的溶解度是110g,向 100g 水中加入 61.6g KNO3,得①溶液,则①溶液是 KNO3 不饱和溶液,此选项错误;
B. 30℃时,KNO3的溶解度是45.8g,40℃时,KNO3的溶解度是63.9g,则开始析出固体时的温度在30℃~40℃,此选项错误;
C. 20℃,KNO3的溶解度是31.6g,则②中析出固体的质量为:61.6g-31.6g=30g,此选项正确;
D. ②中溶液有未溶解的固体物质,则该溶液是 20℃时的饱和溶液,其溶质质量分数为:=24%,此选项错误。
故选C。
13.(1)硝酸钾
(2) 70 不变
(3)冷却热饱和溶液法(降温结晶法)
【详解】(1)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是硝酸钾,因为硝酸钾的溶解度随温度的升高比氯化钾大;
(2)t2℃时,将25g氯化钾加入盛有50g水的烧杯中,充分溶解后,得到氯化钾溶液的质量=20g+50g=70g;保持温度不变,往该烧杯中再加入5g水,充分搅拌后,氯化钾溶液的溶质的质量分数不变,因为它还是饱和溶液;
(3))当硝酸钾中混有少量氯化钾时,可用降温结晶的方法提纯硝酸钾,因为硝酸钾受温度的影响变化大。
14.(1) D A 肥皂水
(2) < 否 =
【分析】(1)
①A 生活中养成良好的用水习惯,尽可能充分利用每一滴水,能够节约水资源,选项正确;
B 工业废水经过处理达标后再排放,能够避免水污染,选项正确;
C 水体污染会危害人体健康,选项正确;
D 大量使用农药、化肥,残留的农药、化肥污染水体,选项错误;
故填D。
②A 植物油不能溶于水,与水混合后形成乳浊液,选项错误;
B 醋酸能够溶于水,与水混合后形成溶液,选项正确;
C 蔗糖能够溶于水,与水混合后形成溶液,选项正确;
D 高锰酸钾能够溶于水,与水混合后形成溶液,选项正确;
故填A。
③硬水遇到肥皂水产生浮渣,软水遇到肥皂水产生泡沫,所以区分软水和硬水常用的物质是肥皂水,故填肥皂水。
(2)
①A所得溶液的溶质质量分数=×100%≈16.7%< 20%,故填<。
②由图中C、D可知,20℃时,100g水中最多溶解36g氯化钠,B所得的溶液中含有100g水和30g氯化钠,所以所得溶液不是饱和溶液,故填否。
③由图可知,溶液C和溶液D中的溶剂都为100g,溶液的质量均为136g,则两种溶液中的溶质氯化钠的质量都为36g,所以C所得溶液的溶质质量分数=D所得溶液的溶质质量分数,故填=。
15. 吸附色素和异味 煮沸 AB 变大
【详解】(1)由于活性炭具有吸附性,自来水厂净水过程中用到活性炭,其作用是吸附色素和异味;由于该过程不能将硬水转化成软水,所以生活中常用煮沸的方法将硬水软化;
(2)①水变成水蒸气的过程中,只是水的状态发生了变化,无新物质生成,属于物理变化,故分子种类、分子质量不变,水变成水蒸气,温度升高,分子间隔变大,故选AB;
②利用“太阳能海水淡化装置”将一定量的海水暴晒一段时间后,由于溶剂的质量减小,所以剩余海水中氯化钠的质量分数会变大。
16. b b=c>a 80 b>a>c
【详解】(1)“夏天晒盐”中的“盐”是指氯化钠,其溶解度随温度的升高而增大,但是受温度影响很小,可用图中b来表示;
(2)在t1℃时,三种物质的溶解度大小关系是b=c>a;
(3)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。在t2℃时,a的溶解度为60g,将40g 的a放入50g 水中充分搅拌,溶解30ga物质,所得溶液质量为80g;
(4),将t2℃ 时 的饱和溶液降温至t1℃时,a、b溶解度变小,得饱和溶液,t1℃时a的溶解度比b的小,饱和溶液溶质的质量分数比b的小,降温时,c的溶解度变大,溶质不析出,溶质的质量分数不变,与t2℃ 时饱和溶液质量分数相同,t2℃ 时c的溶解度比t1℃ 时a的溶解度小,质量分数比a的小,溶质的质量分数由大到小的顺序为b>a>c。
【点睛】审题标记,紧扣题意,分析图示,分步推写,数形结合,回看题意,逐项判断。
17. 蒸发 丙 饱和 有
【详解】(1)由乙的溶解度曲线可知,乙物质的溶解度随温度的升高变化不大,故采用蒸发结晶的方法提纯;
(2)气体物质的溶解度与温度的关系是:温度越高,溶解度越小,故丙可能是气体的溶解度曲线;
(3)30℃时,甲的溶解度约为30g,即该温度下100g水中最多溶解30g达到饱和状态,故4g甲溶解在10mL水中形成的是饱和溶液;
(4)由乙物质的溶解度曲线可知:乙物质的溶解度随温度的升高而增大;在10℃时,乙物质的溶解度是30g。所以,此温度时,饱和溶液中溶质的质量分数是:≈23%<25%。所以,50℃质量分数为25%的乙溶液,降温至10℃,有晶体析出。
18. a 2<m≤40 > =
【详解】(1)由图可知,甲、乙两物质的溶解度都随温度的升高而增大,且乙受温度的影响更大,故图中能表示乙物质的溶解度曲线的是a;
(2)由溶解度曲线可知,乙物质在t2℃时的溶解度是70g,甲物质的溶解度是32g。由题干可知,已加入30g乙物质,且温度恢复到40℃时,烧杯中无未溶解的乙晶体,有未溶解的甲固体。故m的取值范围是:2<m≤40;
(3)由溶解度曲线可知,40℃时,甲的溶解度小于乙的溶解度。故等质量的甲、乙两种物质的饱和溶液中,溶质甲的质量少于乙的质量(即溶液甲中的水比乙溶液中多),分别蒸发等量的水后,恢复到40℃,溶液中溶剂的质量:甲>乙;由溶解度曲线可知,20℃时,甲、乙的溶解度相等。若再降温到20℃时,溶液的溶质质量分数:甲=乙。
19. A 浅 深 温度越高,硫酸铜的溶解度越大(或温度不同,硫酸铜的溶解度不同)
【详解】(1)0.5 g硫酸铜粉末加入到5g的水中时,溶液中溶质的质量分数最大,故颜色最深;
(2)B中的水的温度比C中的低,而B和C中水的质量相等,故B中溶解硫酸铜的质量少,故颜色较浅;
(3)溶质的质量分数越高,浓度越大,颜色越深;硫酸铜的溶解度随温度的升高而升高;
20.(1)锥形瓶
(2)
气泡连续均匀的冒出
(3)
浓硫酸 ⑥
(4) A
不能
(5) 量取 97.5
(6)大
【解析】(1)
装置B中的玻璃仪器有分液漏斗、导管和锥形瓶;
(2)
暗紫色固体是高锰酸钾,高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:;F装置为排水法收集氧气,当观察到气泡连续均匀的冒出时,将导管伸入集气瓶中;
(3)
锌粒和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:;制得的氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,需要将气体依次通过装置D和装置C,先通过装置D除去氯化氢气体,然后装置C除去水蒸气,则C中盛放的试剂名称为浓硫酸溶液;用E装置收集密度比空气小的氢气,气体应该是短进长出,气体应由⑥进;
(4)
加热氯化铵和熟石灰两种固体混合物来制取氨气,属于固体加热型,故选发生装置A,反应的化学方程式为:,所以铵态氮肥不能和熟石灰等碱性物质混用,防止降低肥效;
(5)
实验的主要步骤是计算、量取、混匀、装瓶贴标签;由于稀释前后溶质质量不变,设需要加水质量为x,(100g-x) ×20%=100g×0. 5%,x=97. 5g,即97. 5mL;
(6)
若用量筒量取水时俯视凹液面的最低处,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。
21.(1)水槽
(2) C
(3) b 加快盐酸的滴加速度
(4) 试管直立,粉末不易进入导管 高锰酸钾被吹到试管口
(5) 90 小于 细口瓶
【详解】(1)由图可知,仪器a为水槽。
(2)铁丝燃烧时集气瓶中需留少量水,且氧气不易溶于水,则收集装置选排水法收集,即装置C;
A装置为加热固体的装置,且试管口没有塞棉花,适用于氯酸钾制取氧气,氯酸钾在二氧化锰催化并加热条件下生成氯化钾和氧气,反应的化学方程式为。
(3)实验室用大理石和稀盐酸制取二氧化碳,大理石中的碳酸钙能与盐酸反应生成氯化钙和水,反应的化学方程式为;
二氧化碳密度比空气大,则用F装置收集时,气体应从b端通入;
过氧化氢可控制液体的滴加速度,若实验中产生气泡的速度太慢,则应加快稀盐酸的滴加速度。
(4)①试管中棉花的作用为:防止固体粉末进入导管,堵塞导管,而试管直立时,粉末不易进入导管中。
②传统型装置中,由于部分高锰酸钾粉末被吹到了试管口,则收集到的氧气较少。
(5)①需要浓硫酸约为5.43mL,则所需浓硫酸的质量为5.43mL×1.84g/cm3≈10g,则需要水的质量为100g-10g=90g,体积为。
②量取浓硫酸时俯视读数,会使浓硫酸的质量偏少,则会导致所配稀硫酸的溶质的质量分数会小于9.8%。
④稀硫酸为液体,液体应装入细口瓶中。
22.(1)设:生成8.8g二氧化碳需碳酸钙的质量为x。
x=20g。
答:贝壳样品中碳酸钙的质量为20g。
(2)设:所用稀盐酸的溶质质量分数为y。
y=14.6%。
答:所用稀盐酸的溶质质量分数为14.6%。
【详解】(1)根据质量守恒定律,反应生成的二氧化碳质量=100g+30g-121.2g=8.8g。详见答案。
(2)详见答案。
一、单选题
1.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
2.如图是甲、乙、丙三种物质的溶解度曲线图,下列说法正确的的是
①20℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙;
②将丙的饱和溶液变为不饱和溶液,可采用降低温度的方法;
③40℃时,甲物质的饱和溶液的溶质质量分数约为28.6%;
④将相同质量的甲、乙、丙的饱和溶液分别从50℃降温至10℃析出晶体的质量由小到大的顺序为:丙<乙<甲;
A.①②③④ B.①②③ C.②③④ D.①②④
3.下列关于溶液的说法中正确的是
A.水中滴入少量菜油后用力振荡后可形成溶液 B.饱和溶液一定是一种浓溶液
C.饱和溶液就是不能再溶解任何物质的溶液 D.溶质可以是固体,也可以是液体或气体
4.如图所示是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.t1℃时,把30g丙放入50g水中能得到80g丙的不饱和溶液
B.t2℃时,甲、乙两物质的饱和溶液中含有相等质量的溶质
C.将t1℃时三种物质的饱和溶液升温至t2℃时,所得溶液中溶质的质量分数依次为丙<甲=乙
D.t3℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙
5.已知:20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g。配制20℃时的如下四种溶液:
溶液 ① ② ③ ④
固体种类 KCl KCl KNO3 KNO3
加入固体的质量/g 20 35 20 35
水的质量/g 100 100 100 100
下列有关溶液①~④的说法不正确的是A.属于饱和溶液的是②④
B.溶液的质量②=④
C.溶液中溶质的质量分数①=③
D.②中溶质与溶剂的质量比为17:50
6.现用98%的浓硫酸配制490g20%的稀硫酸,需水的质量为
A.98g B.100g C.390g D.392g
7.图像能直观表达化学中各种变化的关系,加深对化学知识的理解。有关下列图像的描述,正确的一项是
A.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
B.向相同质量相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉
C.将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中
D.向一定质量的饱和氢氧化钙溶液中加入氧化钙
8.要使质量分数为10%的氯化钠溶液100g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入10g氯化钠 B.蒸发50g水
C.加入100g的10%氯化钠溶液 D.将溶液取出50g
9.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.t1℃时,两物质的溶解度相等,均为50
B.t1℃时,等质量的甲、乙溶液中含有溶质的质量相等
C.t2℃时,可以配制出溶质的质量分数为30%的甲、乙溶液
D.t2℃时,甲、乙两种物质的饱和溶液(不含未溶物)分别恒温蒸发水,析出晶体的质量一定是甲大于乙
10.下列叙述不正确的是
A.在电解水的实验中与电源负极相连的导管中产生氢气
B.常用肥皂水检验硬水和软水
C.用 5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
D.用密度为 1.04g/cm3的 6%的氯化钠溶液配制 3%的氯化钠溶液一定要用托盘天平
11.下列图象能正确反映其对应变化关系的是
A.向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量
B.某温度时,向一足量的饱和石灰水中加入少量生石灰,并恢复原温度
C.向等质量的镁、铝中分别加入等质量分数、的稀盐酸至过量
D.高温加热氧化铜和碳的混合物
12.如下图所示,60℃时,向 100 g 水中加入 61.6g KNO3,得①中溶液,降温至 20℃,得②中溶液。不同温度下 KNO3 的溶解度如下表。
温度/℃ 20 30 40 50 60
溶解度/g 31.6 45.8 63.9 85.5 110
下列说法正确的是A.①中溶液是 KNO3 饱和溶液 B.开始析出固体时的温度为 20℃
C.②中析出固体的质量为 30 g D.②中溶液的溶质质量分数为 31.6%
二、填空题
13.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
(1)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是_____的溶液。
(2)t2℃时,将25g氯化钾加入盛有50g水的烧杯中,充分溶解后,得到氯化钾溶液的质量是_____g.保持温度不变,往该烧杯中再加入5g水,充分搅拌后,氯化钾溶液的溶质的质量分数:_____(选填“变大”“不变”或“变小”)。
(3)当硝酸钾中混有少量氯化钾时,可用_____的方法提纯硝酸钾。
14.请回答下列问题。
(1)2012年3月22日是第二十届“世界水日”.水与人类的生活和生产密切相关.
①节约用水、防治水污染应成为我们的自觉行为.下列有关叙述中不正确的是_____.
A.生活中养成良好的用水习惯,尽可能充分利用每一滴水
B.工业废水经过处理达标后再排放
C.水体污染会危害人体健康
D.大量使用农药、化肥,不会造成水体污染
②水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是_____.
A.植物油 B.醋酸 C.蔗糖 D.高锰酸钾
③区分软水和硬水常用的物质是_____.
(2)20℃时,NaCl溶解于水的实验数据如表。
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
A 100 20 120
B 100 30 130
C 100 40 136
D 100 50 136
①A所得溶液的溶质质量分数______20%;(填“>”、“<”、“=”)
②B所得的溶液_____(填“是”或“否”)饱和;
③C所得溶液的溶质质量分数_____(填“>”、 “<”、“=”)D所得溶液的溶质质量分数。
15.水在地球上储量很大,分布范围也很广,但可供人类直接利用的淡水却非常少.
(1)自来水厂净水过程中用到活性炭,其作用是__________ , 由于该过程不能将硬水转化成软水,所以生活中常用_______________的方法将硬水软化;
(2)远离陆地的海岛可以利用图示的“太阳能海水淡化装置”缓解淡水不足的问题.
①水变成水蒸气的过程中,不发生变化的是___________(填序号);
A、分子质量 B、分子种类 C、分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会________(填“变大”“变小”或“不变”)
16.青海省柴达木盆地的察尔汗盐湖是我国最大的天然内陆咸水湖,当地农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。
(1)“夏天晒盐”中的“盐”其溶解度可用图中________来表示(填“a ”、或“b ”、或“c ”)。
(2)在t1℃时,三种物质的溶解度大小关系是________。
(3)在t2℃时,将40g 的a放入50g 水中充分搅拌,所得溶液质量为________g 。
(4)将t2℃ 时 的饱和溶液降温至 时,溶质的质量分数由大到小的顺序为________。
17.甲、乙、丙三种物质的溶解度曲线如下图所示。据图回答:
(1)要使乙从其浓溶液中大量析出,应采用 ________ 结晶法;
(2)甲、乙、丙三种物质中常温下可能是气体物质的是 _____ ;
(3)30℃时,向一支盛有4 g甲的烧杯内加入10mL水,充分搅拌后,静置,得到 _________ 溶液(填“饱和”或“不饱和”);
(4)50℃质量分数为25%的乙溶液,降温至10℃, ______ 晶体析出(填“有”或“无”) 。
三、实验题
18.某同学将甲、乙固体各30g分别加入100g水中后,进行了如图所示的实验。请回答:
(1) 甲、乙两种固体的溶解度曲线如图所示,图中能表示乙物质的溶解度曲线的是_______(填“a”或“b”);
(2)图中m的取值范围是___________;
(3)40℃时,取等质量的甲、乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃,溶液中溶剂的质量:甲______乙(填“>”、“<”或“=”,下同);若再降温到20℃时,溶液的溶质质量分数:甲______乙。
19.现有三支试管,分别加入不同温度和体积的水,试管编号及相关数据如下表.
试管编号 A B C
水的体积/mL 5 10 10
水的温度/℃ 20 20 50
(1)向三支试管中各加入0.5 g硫酸铜粉末,完全溶解.溶液颜色最深的是________.
(2)再向B、C两支试管中加硫酸铜粉末至饱和,则B中溶液的颜色较C中的________.
(3)由此实验可得出:①溶质的质量分数越大,有色溶液的颜色越________;②________.
20.请回答下列问题
【气体制备】
(1)装置B中的玻璃仪器有分液漏斗、导管和______(填仪器名称)
(2)实验室常用加热一种暗紫色固体的方法制取氧气,该反应的化学方程式_______;若用F装置收集氧气,当观察到______时,将导管伸入集气瓶中。
(3)某同学用锌粒和稀盐酸制取氢气,反应的化学方程式为______;制得的氢气含有少量的水蒸气和HCl气体.若要得到干燥、纯净的氢气,需要将气体依次通过装置D和装置C,然后再进行收集。则C中盛放的试剂名称为______;装置E是用排空气法收集氢气的装置,气体应由______进(填导管口序号)。
(4)实验室常用加热NH4Cl和Ca(OH)2两种固体混合物的方法制取氨气,选用的发生装置______;该反应的化学方程式______;结合该反应分析,铵态氮肥______(填“能”或“不能”)和熟石灰等碱性物质混用,防止降低肥效。
【溶液配制】为预防“新冠肺炎”公共场所可用0.5%的过氧乙酸(化学式为C2H4O3)溶液来消毒。现用质量分数为20%的过氧乙酸溶液配制100g0.5%的过氧乙酸溶液。
(5)实验的主要步骤是计算、______、混匀、装瓶贴标签。稀释时需加水______mL。
(6)若用量筒量取水时俯视凹液面的最低处,则配制溶液的质量分数偏______(填“大”或“小”)。
21.根据下列实验装置图,回答有关问题。
(1)装置图中仪器a的名称为___________。
(2)实验室想用A装置制取一瓶氧气并用于铁丝燃烧实验,则应选用的收集装置为___________(填序号),A装置中反应的化学方程式为___________。
(3)若用B装置制取CO2的化学方程式为___________,如果用F装置收集CO2,气体应从___________(填“b”或“e”)端通入;若实验中产生气泡的速度太慢,采取的方法是___________。
(4)兴趣小组同学阅读产品标答发现,某市售高锰酸钾药品纯度高达99.5%,含水量可忽略不计。小组同学设计了直立型装置制取氧气,并与传统装置相比较,分别放入5g高锰酸钾,用同一酒精灯分别加热,每组进行五次实验后取平均值记录如下:
装置类型 收集一瓶气体所需时间 反应生成氧气总体积
直立型 39.3s 552mL
传统型 52.2s 456mL
①小组同学用直立型装置制取氧气时,不需在试管口放一团棉花的原因是___________。
②等质量的高锰酸钾充分反应,传统型装置收集到的氧气较少的主要原因是___________。
(5)某学习小组选用98%的浓硫酸(密度1.84g/cm3)配制100g9.8%的稀硫酸主要步骤:
①计算:需要浓硫酸约为5.43mL,需要水___________mL;
②量取:量取浓硫酸和水,如果量取浓硫酸时俯视读数,会导致所配稀硫酸的溶质的质量分数___________9.8%(选填“大于”“小于”或“等于”);
③稀释;
④装瓶贴标签:将配制好的稀硫酸装入___________(填仪器名称)中,并贴上标签。
四、计算题
22.贝壳的主要成分是碳酸钙。现将100稀盐酸加入30g贝壳样品中(杂质不溶于水也不参与反应)恰好完全反应,称得剩余物质的质量为121.2g。请计算:
(1)贝壳样品中碳酸钙的质量。
(2)所用稀盐酸的溶质质量分数。
参考答案
1.C
【详解】溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。A.该温度下,KNO3的溶解度为= ,x=50g,故A错误;B. 乙溶液的质量分数为×100%=33.3%,故B错误;C. 降低温度,可以使甲溶液变成饱和溶液,硝酸钾溶解度随温度升高而增大,故C正确;D. 硝酸钾溶解度随温度升高而增大,升高温度,甲、乙两溶液的质量分数都不变,故D错误。
点睛∶硝酸钾溶解度随温度升高而增大,影响固体溶解度的因素是温度,溶质和溶剂本身的性质。
2.A
【详解】①由图可知,20℃时,三种物质的溶解度由大到小的顺序是乙>甲>丙,故①正确;
②丙物质的溶解度随温度的升高而减小,将丙的饱和溶液变为不饱和溶液,可采用降低温度的方法,故②正确;
③40℃时,甲物质的溶解度为40g,甲物质的饱和溶液的溶质质量分数约为,故③正确;
④50℃降温至10℃,甲和乙物质的溶解度随温度的降低而减少,甲物质的溶解度减少的比乙物质的溶解度减少的更多,故等质量的甲、乙饱和溶液降温析出晶体的质量甲大于乙;丙物质的溶解度随温度的减少而增大,故丙物质的饱和溶液降温不会析出晶体;将相同质量的甲、乙、丙的饱和溶液分别从50℃降温至10℃析出晶体的质量由小到大的顺序为:丙<乙<甲,故④正确;
故选:A。
3.D
【解析】溶质可以是固体,也可以是液体或气体。
【详解】A、菜油不溶于水,与水混合形成的是乳浊液,不符合题意;
B、饱和溶液不一定是一种浓溶液,不符合题意;
C、饱和溶液是指在某一温度不能再溶解某一溶质的溶液,还可以溶解其它物质,不符合题意;
D、溶质可以是固体,也可以是液体或气体,符合题意。故选D。
【点睛】溶质可以是固体,也可以是液体或气体,并且一种或多种物质可以同时溶解在同一溶剂中。
4.D
【详解】A、t1℃时,丙的溶解度是40g,即100g水中最多能溶解40g丙,则把30g丙放入50g水中能得到70g丙的饱和溶液,错误;
B、t2℃时,甲、乙两物质的饱和溶液中的溶质质量分数相等,但是没有给出饱和溶液的质量,则含有溶质的质量无法计算,错误;
C、甲、乙的溶解度随温度的升高而增大,将t1℃时甲、乙物质的饱和溶液升温至t2℃时,溶液变得不饱和,但是溶液的组成不变,溶质的质量分数以t1℃时甲、乙物质的溶解度计算,t1℃时物质的溶解度乙大于甲,则饱和溶液溶质的质量分数乙大于甲;丙的溶解度随温度升高而降低,析出晶体,t1℃时甲的溶解度大于t2℃时丙的溶解度,则饱和溶液溶质的质量分数甲大于丙;则三种物质的饱和溶液这溶质质量分数:乙>甲>丙;错误;
D、根据图像,t3℃时三种物质的溶解度:甲>乙>丙,则等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙,正确。
故选D。
5.B
【详解】A、20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g,故①加入20g氯化钾全部溶解为不饱和溶液②加入35g氯化钾部分溶解,为饱和溶液③20g硝酸钾全部溶解为不饱和溶液④35g硝酸钾部分溶解,为饱和溶液,故A正确。
B、20℃时,氯化钾溶解度34g溶液②加入35g氯化钾只能溶解34g溶液质量34g+100g=134g,硝酸钾溶解31.6g,溶液④加入35g硝酸钾只能溶解31.6g,溶液质量31.6g+100g=131.6g,故溶液的质量②≠④,故B错误。
C、20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g,溶液①③20g溶质均全部溶解,溶液①③溶质质量相等,溶剂质量相等,故溶质的质量分数①=③,故C正确。
D、20℃时,氯化钾溶解度34g,故35g氯化钾只能溶解34g,溶质溶剂质量比34g:100g=17:50,故D正确。
故选:B。
6.C
【详解】溶液稀释前后溶质的质量不变。设需要98%的浓硫酸的质量为x,则有,解得x=100g,所以需要水的质量为。
故选C。
7.C
【详解】A、向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉,每65份质量的锌生成2份质量的氢气,每54份质量的铝生成6份质量的氢气,每24份质量的镁生成2份质量的氢气,生成氢气质量的顺序为Al>Mg>Zn,故不符合题意;
B、向相同质量、相同溶质质量分数的稀硫酸中加入足量的铁粉和锌粉,采用以少定多的原则,生成氢气的质量跟酸的质量有关,酸的质量相等,最终生成氢气的质量相等,故不符合题意;
C、硫酸铜溶液和铁反应,56份质量的铁置换出64份质量的铜,固体的总质量增加,故符合题意;
D、氧化钙会和水反应,消耗了水,且放热,温度升高,氢氧化钙会析出,饱和氢氧化钙溶液的质量会减少,故不符合题意。
故选B。
8.B
【详解】A. 加入10g氯化钠,所得溶液质量分数为 ,错误;
B. 蒸发50g水,所得溶液质量分数为 ,正确;
C. 溶液是均一稳定的,加入100g的10%氯化钠溶液,所得溶液质量分数仍为10% ,错误;
D. 溶液是均一稳定的,将溶液取出50g,所得溶液质量分数仍为10% ,错误;
故选B。
9.C
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】A、通过分析溶解度曲线可知,t1℃时,两物质的溶解度相等,均为50g,故A错误;
B、t1℃时,甲、乙两物质的溶解度相等,但等质量的甲、乙溶液的状态不能确定,所以溶液中含有溶质的质量不能确定,故B错误;
C、t1℃时,甲乙饱和溶液的质量分数大于,t2℃时,可以配制出溶质的质量分数为30%的甲、乙溶液,故C正确;
D、t2℃时,甲物质的溶解度大于乙物质的溶解度,所以给甲、乙两种物质的饱和溶液(不含未溶物)分别恒温蒸发等质量的水,析出晶体的质量一定是甲大于乙,题干没有说明蒸发等质量的水,故D错误。
故选C。
10.D
【详解】A、在电解水实验中,“正氧负氢”,故与电源负极相连的导管中产生氢气,不符合题意;
B、通常用肥皂水来区分硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,不符合题意;
C、用 5%的过氧化氢溶液制氧气,在该反应中,可加入少量二氧化锰作催化剂,加快化学反应速率,不符合题意;
D、用浓溶液配制稀溶液,实验步骤及所需仪器为:计算、量取(量筒、胶头滴管)、混匀(烧杯、玻璃棒)、装瓶贴标签,无需托盘天平,符合题意。
故选D。
11.D
【详解】A、向一定质量氯化亚铁和氯化锌的混合溶液中加入镁粉至过量,镁先与氯化亚铁反应生成氯化镁和铁,24份质量的镁置换出56份质量的铁,随着反应进行,溶液质量减小,反应完后,镁和氯化锌反应生成氯化镁和锌,24份质量的镁置换出65份质量的锌,随着反应的进行,溶液质量减小更明显,故A不正确;
B、温度不变时,物质的溶解度不变,向一定量的饱和石灰水中加入少量生石灰,生石灰和水反应生成氢氧化钙同时放出大量的热,且饱和石灰水的溶解度随温度的升高而降低,则饱和溶液中溶质质量分数先减小,一段时间后恢复原温度,溶液仍饱和,溶质质量分数恢复到原来数值,故B不正确;
C、向等质量的镁、铝中分别加入等质量分数的稀盐酸至过量,在金属未完全反应时,消耗等质量硫酸产生的氢气质量相等,故开始在同一直线,当金属完全反应时,54份质量的铝生成6份质量的氢气,24份质量的镁生成2份质量的氢气,两种金属质量相等的情况下,铝生成的氢气较多,故C不正确;
D、高温加热氧化铜和碳的混合物,生成单质铜和二氧化碳气体,原本固体中的碳元素和氧元素减少,铜元素质量不变,铜的质量分数增大,待氧化铜或碳耗尽,铜的质量分数停止增长,故D正确。
故选D。
12.C
【详解】A.60℃时KNO3的溶解度是110g,向 100g 水中加入 61.6g KNO3,得①溶液,则①溶液是 KNO3 不饱和溶液,此选项错误;
B. 30℃时,KNO3的溶解度是45.8g,40℃时,KNO3的溶解度是63.9g,则开始析出固体时的温度在30℃~40℃,此选项错误;
C. 20℃,KNO3的溶解度是31.6g,则②中析出固体的质量为:61.6g-31.6g=30g,此选项正确;
D. ②中溶液有未溶解的固体物质,则该溶液是 20℃时的饱和溶液,其溶质质量分数为:=24%,此选项错误。
故选C。
13.(1)硝酸钾
(2) 70 不变
(3)冷却热饱和溶液法(降温结晶法)
【详解】(1)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是硝酸钾,因为硝酸钾的溶解度随温度的升高比氯化钾大;
(2)t2℃时,将25g氯化钾加入盛有50g水的烧杯中,充分溶解后,得到氯化钾溶液的质量=20g+50g=70g;保持温度不变,往该烧杯中再加入5g水,充分搅拌后,氯化钾溶液的溶质的质量分数不变,因为它还是饱和溶液;
(3))当硝酸钾中混有少量氯化钾时,可用降温结晶的方法提纯硝酸钾,因为硝酸钾受温度的影响变化大。
14.(1) D A 肥皂水
(2) < 否 =
【分析】(1)
①A 生活中养成良好的用水习惯,尽可能充分利用每一滴水,能够节约水资源,选项正确;
B 工业废水经过处理达标后再排放,能够避免水污染,选项正确;
C 水体污染会危害人体健康,选项正确;
D 大量使用农药、化肥,残留的农药、化肥污染水体,选项错误;
故填D。
②A 植物油不能溶于水,与水混合后形成乳浊液,选项错误;
B 醋酸能够溶于水,与水混合后形成溶液,选项正确;
C 蔗糖能够溶于水,与水混合后形成溶液,选项正确;
D 高锰酸钾能够溶于水,与水混合后形成溶液,选项正确;
故填A。
③硬水遇到肥皂水产生浮渣,软水遇到肥皂水产生泡沫,所以区分软水和硬水常用的物质是肥皂水,故填肥皂水。
(2)
①A所得溶液的溶质质量分数=×100%≈16.7%< 20%,故填<。
②由图中C、D可知,20℃时,100g水中最多溶解36g氯化钠,B所得的溶液中含有100g水和30g氯化钠,所以所得溶液不是饱和溶液,故填否。
③由图可知,溶液C和溶液D中的溶剂都为100g,溶液的质量均为136g,则两种溶液中的溶质氯化钠的质量都为36g,所以C所得溶液的溶质质量分数=D所得溶液的溶质质量分数,故填=。
15. 吸附色素和异味 煮沸 AB 变大
【详解】(1)由于活性炭具有吸附性,自来水厂净水过程中用到活性炭,其作用是吸附色素和异味;由于该过程不能将硬水转化成软水,所以生活中常用煮沸的方法将硬水软化;
(2)①水变成水蒸气的过程中,只是水的状态发生了变化,无新物质生成,属于物理变化,故分子种类、分子质量不变,水变成水蒸气,温度升高,分子间隔变大,故选AB;
②利用“太阳能海水淡化装置”将一定量的海水暴晒一段时间后,由于溶剂的质量减小,所以剩余海水中氯化钠的质量分数会变大。
16. b b=c>a 80 b>a>c
【详解】(1)“夏天晒盐”中的“盐”是指氯化钠,其溶解度随温度的升高而增大,但是受温度影响很小,可用图中b来表示;
(2)在t1℃时,三种物质的溶解度大小关系是b=c>a;
(3)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。在t2℃时,a的溶解度为60g,将40g 的a放入50g 水中充分搅拌,溶解30ga物质,所得溶液质量为80g;
(4),将t2℃ 时 的饱和溶液降温至t1℃时,a、b溶解度变小,得饱和溶液,t1℃时a的溶解度比b的小,饱和溶液溶质的质量分数比b的小,降温时,c的溶解度变大,溶质不析出,溶质的质量分数不变,与t2℃ 时饱和溶液质量分数相同,t2℃ 时c的溶解度比t1℃ 时a的溶解度小,质量分数比a的小,溶质的质量分数由大到小的顺序为b>a>c。
【点睛】审题标记,紧扣题意,分析图示,分步推写,数形结合,回看题意,逐项判断。
17. 蒸发 丙 饱和 有
【详解】(1)由乙的溶解度曲线可知,乙物质的溶解度随温度的升高变化不大,故采用蒸发结晶的方法提纯;
(2)气体物质的溶解度与温度的关系是:温度越高,溶解度越小,故丙可能是气体的溶解度曲线;
(3)30℃时,甲的溶解度约为30g,即该温度下100g水中最多溶解30g达到饱和状态,故4g甲溶解在10mL水中形成的是饱和溶液;
(4)由乙物质的溶解度曲线可知:乙物质的溶解度随温度的升高而增大;在10℃时,乙物质的溶解度是30g。所以,此温度时,饱和溶液中溶质的质量分数是:≈23%<25%。所以,50℃质量分数为25%的乙溶液,降温至10℃,有晶体析出。
18. a 2<m≤40 > =
【详解】(1)由图可知,甲、乙两物质的溶解度都随温度的升高而增大,且乙受温度的影响更大,故图中能表示乙物质的溶解度曲线的是a;
(2)由溶解度曲线可知,乙物质在t2℃时的溶解度是70g,甲物质的溶解度是32g。由题干可知,已加入30g乙物质,且温度恢复到40℃时,烧杯中无未溶解的乙晶体,有未溶解的甲固体。故m的取值范围是:2<m≤40;
(3)由溶解度曲线可知,40℃时,甲的溶解度小于乙的溶解度。故等质量的甲、乙两种物质的饱和溶液中,溶质甲的质量少于乙的质量(即溶液甲中的水比乙溶液中多),分别蒸发等量的水后,恢复到40℃,溶液中溶剂的质量:甲>乙;由溶解度曲线可知,20℃时,甲、乙的溶解度相等。若再降温到20℃时,溶液的溶质质量分数:甲=乙。
19. A 浅 深 温度越高,硫酸铜的溶解度越大(或温度不同,硫酸铜的溶解度不同)
【详解】(1)0.5 g硫酸铜粉末加入到5g的水中时,溶液中溶质的质量分数最大,故颜色最深;
(2)B中的水的温度比C中的低,而B和C中水的质量相等,故B中溶解硫酸铜的质量少,故颜色较浅;
(3)溶质的质量分数越高,浓度越大,颜色越深;硫酸铜的溶解度随温度的升高而升高;
20.(1)锥形瓶
(2)
气泡连续均匀的冒出
(3)
浓硫酸 ⑥
(4) A
不能
(5) 量取 97.5
(6)大
【解析】(1)
装置B中的玻璃仪器有分液漏斗、导管和锥形瓶;
(2)
暗紫色固体是高锰酸钾,高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:;F装置为排水法收集氧气,当观察到气泡连续均匀的冒出时,将导管伸入集气瓶中;
(3)
锌粒和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:;制得的氢气含有少量的水蒸气和HCl气体,若要得到干燥、纯净的氢气,需要将气体依次通过装置D和装置C,先通过装置D除去氯化氢气体,然后装置C除去水蒸气,则C中盛放的试剂名称为浓硫酸溶液;用E装置收集密度比空气小的氢气,气体应该是短进长出,气体应由⑥进;
(4)
加热氯化铵和熟石灰两种固体混合物来制取氨气,属于固体加热型,故选发生装置A,反应的化学方程式为:,所以铵态氮肥不能和熟石灰等碱性物质混用,防止降低肥效;
(5)
实验的主要步骤是计算、量取、混匀、装瓶贴标签;由于稀释前后溶质质量不变,设需要加水质量为x,(100g-x) ×20%=100g×0. 5%,x=97. 5g,即97. 5mL;
(6)
若用量筒量取水时俯视凹液面的最低处,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。
21.(1)水槽
(2) C
(3) b 加快盐酸的滴加速度
(4) 试管直立,粉末不易进入导管 高锰酸钾被吹到试管口
(5) 90 小于 细口瓶
【详解】(1)由图可知,仪器a为水槽。
(2)铁丝燃烧时集气瓶中需留少量水,且氧气不易溶于水,则收集装置选排水法收集,即装置C;
A装置为加热固体的装置,且试管口没有塞棉花,适用于氯酸钾制取氧气,氯酸钾在二氧化锰催化并加热条件下生成氯化钾和氧气,反应的化学方程式为。
(3)实验室用大理石和稀盐酸制取二氧化碳,大理石中的碳酸钙能与盐酸反应生成氯化钙和水,反应的化学方程式为;
二氧化碳密度比空气大,则用F装置收集时,气体应从b端通入;
过氧化氢可控制液体的滴加速度,若实验中产生气泡的速度太慢,则应加快稀盐酸的滴加速度。
(4)①试管中棉花的作用为:防止固体粉末进入导管,堵塞导管,而试管直立时,粉末不易进入导管中。
②传统型装置中,由于部分高锰酸钾粉末被吹到了试管口,则收集到的氧气较少。
(5)①需要浓硫酸约为5.43mL,则所需浓硫酸的质量为5.43mL×1.84g/cm3≈10g,则需要水的质量为100g-10g=90g,体积为。
②量取浓硫酸时俯视读数,会使浓硫酸的质量偏少,则会导致所配稀硫酸的溶质的质量分数会小于9.8%。
④稀硫酸为液体,液体应装入细口瓶中。
22.(1)设:生成8.8g二氧化碳需碳酸钙的质量为x。
x=20g。
答:贝壳样品中碳酸钙的质量为20g。
(2)设:所用稀盐酸的溶质质量分数为y。
y=14.6%。
答:所用稀盐酸的溶质质量分数为14.6%。
【详解】(1)根据质量守恒定律,反应生成的二氧化碳质量=100g+30g-121.2g=8.8g。详见答案。
(2)详见答案。
