科粤版化学九下同步测试:7.4结晶现象(含解析)
文档属性
| 名称 | 科粤版化学九下同步测试:7.4结晶现象(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 267.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-13 16:43:27 | ||
图片预览


文档简介
7.4 结晶现象
一、单选题
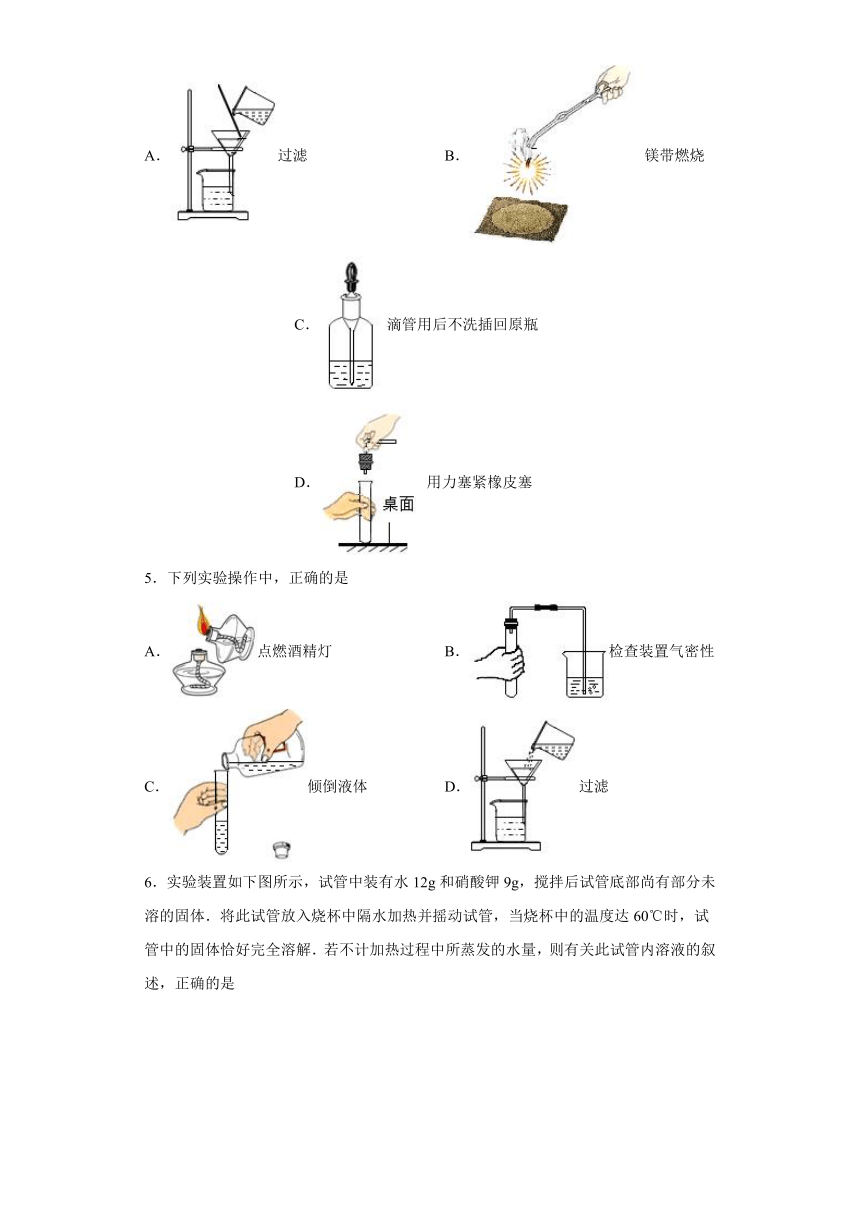
1.下图是a、b两种固体物质的溶解度曲线。下列说法中错误的是
A.a中含有少量b时,用降温结晶的方法提纯a
B.t℃时,等质量的a、b饱和溶液中含有相同质量的溶质
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大,b物质的溶解度受温度变化的影响较小
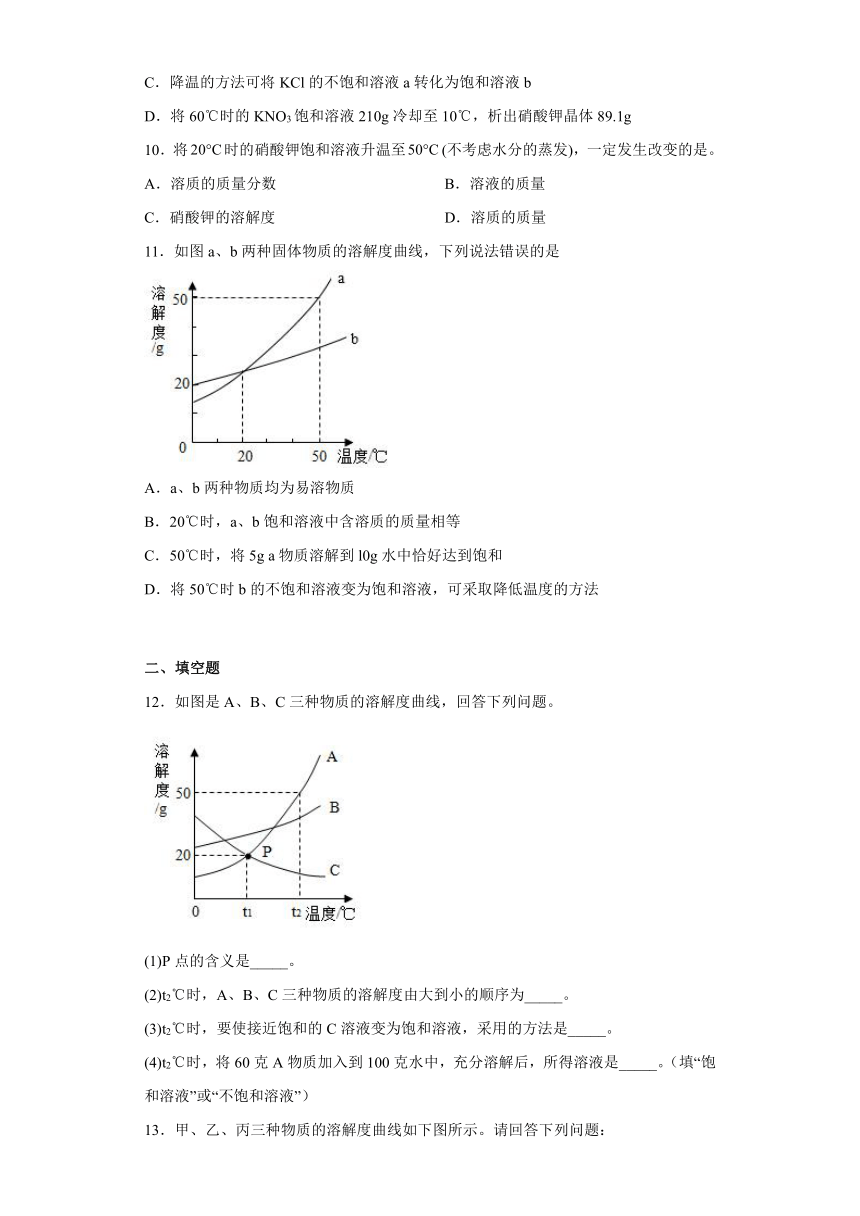
2.下列化学实验操作正确的是
A.蒸发食盐水制食盐时,当水蒸干后停止加热
B.称量氢氧化钠固体时,需要在托盘天平两端各垫一张干净的滤纸
C.用胶头滴管吸取液体时,要先在试剂瓶外把滴管内的空气挤出
D.过滤时,为加快过滤速度,可用玻璃棒在过滤器里搅拌
3.如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )
A.a点表示的含义:t℃,KNO3和NaCl的溶解度相等
B.KNO3饱和溶液中含有少量的NaCl,可采用降温结晶法提纯KNO3
C.20℃,向50 g水中加入16 g KNO3,可得到66 g KNO3溶液
D.将t℃时两种物质的饱和溶液降温到20℃,所得溶液的质量分数NaCl大于KNO3
4.实验操作中错误的是( )
A.过滤 B.镁带燃烧 C.滴管用后不洗插回原瓶 D.用力塞紧橡皮塞
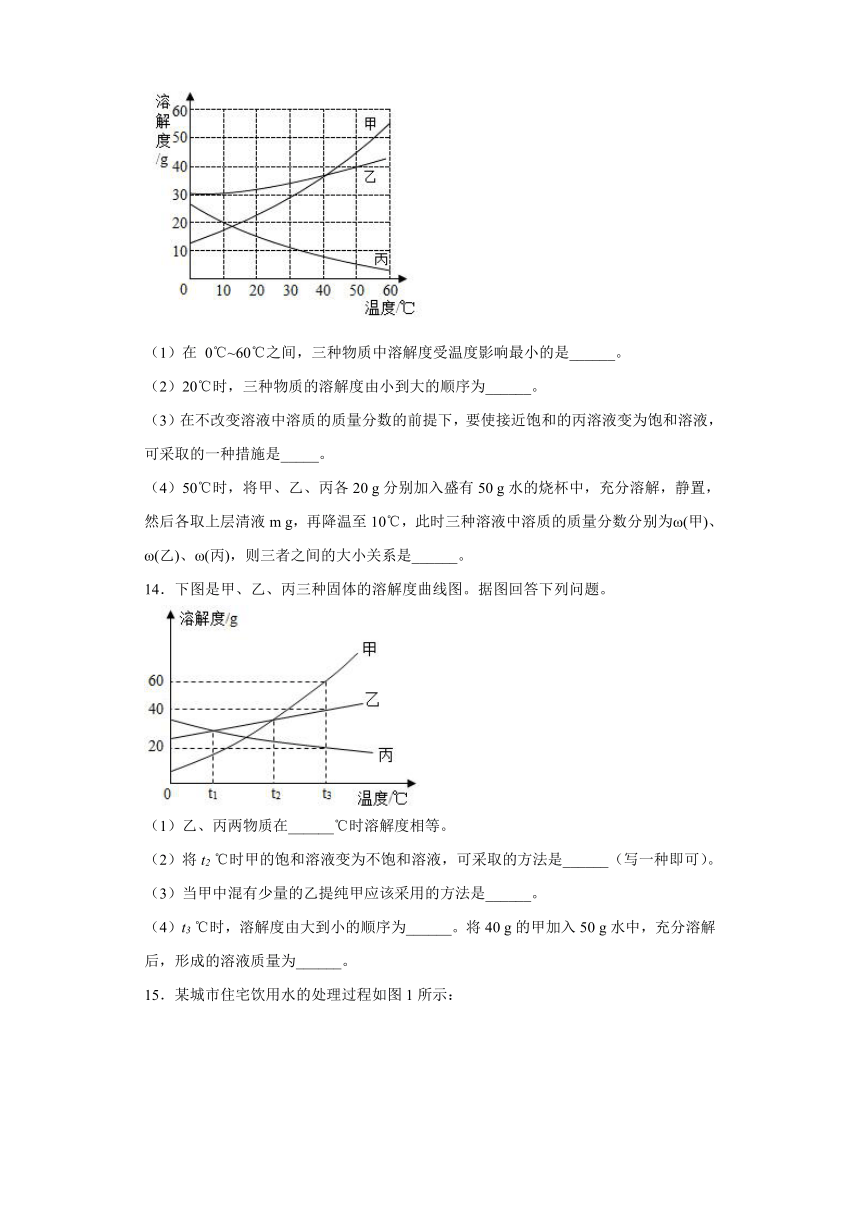
5.下列实验操作中,正确的是
A.点燃酒精灯 B.检查装置气密性
C.倾倒液体 D.过滤
6.实验装置如下图所示,试管中装有水12g和硝酸钾9g,搅拌后试管底部尚有部分未溶的固体.将此试管放入烧杯中隔水加热并摇动试管,当烧杯中的温度达60℃时,试管中的固体恰好完全溶解.若不计加热过程中所蒸发的水量,则有关此试管内溶液的叙述,正确的是
A.加热前此溶液是不饱和溶液
B.由室温加热至60℃的过程中,此溶液的质量分数不变
C.在60℃时此溶液的质量分数为75%
D.若继续加热至65℃时此溶液的质量分数不变 ,但溶液已达到了不饱和状态
7.下列关于溶液的说法正确的是
A.某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同
B.溶质质量分数为10%的200毫升某溶液,密度为1.2克/厘米3,其中含溶质24克
C.饱和溶液析出晶体后,溶质的质量分数一定减少
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
8.下列说法正确的是
A.植物油与水混合一定形成溶液
B.将100g10%的氯化钠溶液倒掉一半,剩余溶液的质量分数变为5%
C.降温可使氢氧化钙的不饱和溶液变成饱和溶液
D.生活中利用洗涤剂清洗油污属于乳化现象
9.已知KNO3和KCl的溶解度曲线如图所示。下列说法正确的是
A.KCl的溶解度小于KNO3的溶解度
B.T1℃时,KNO3、KCI两溶液中溶质的质量分数一定相等
C.降温的方法可将KCl的不饱和溶液a转化为饱和溶液b
D.将60℃时的KNO3饱和溶液210g冷却至10℃,析出硝酸钾晶体89.1g
10.将时的硝酸钾饱和溶液升温至(不考虑水分的蒸发),一定发生改变的是。
A.溶质的质量分数 B.溶液的质量
C.硝酸钾的溶解度 D.溶质的质量
11.如图a、b两种固体物质的溶解度曲线,下列说法错误的是
A.a、b两种物质均为易溶物质
B.20℃时,a、b饱和溶液中含溶质的质量相等
C.50℃时,将5g a物质溶解到l0g水中恰好达到饱和
D.将50℃时b的不饱和溶液变为饱和溶液,可采取降低温度的方法
二、填空题
12.如图是A、B、C三种物质的溶解度曲线,回答下列问题。
(1)P点的含义是_____。
(2)t2℃时,A、B、C三种物质的溶解度由大到小的顺序为_____。
(3)t2℃时,要使接近饱和的C溶液变为饱和溶液,采用的方法是_____。
(4)t2℃时,将60克A物质加入到100克水中,充分溶解后,所得溶液是_____。(填“饱和溶液”或“不饱和溶液”)
13.甲、乙、丙三种物质的溶解度曲线如下图所示。请回答下列问题:
(1)在 0℃~60℃之间,三种物质中溶解度受温度影响最小的是______。
(2)20℃时,三种物质的溶解度由小到大的顺序为______。
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是_____。
(4)50℃时,将甲、乙、丙各20 g分别加入盛有50 g水的烧杯中,充分溶解,静置,然后各取上层清液m g,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是______。
14.下图是甲、乙、丙三种固体的溶解度曲线图。据图回答下列问题。
(1)乙、丙两物质在______℃时溶解度相等。
(2)将t2 ℃时甲的饱和溶液变为不饱和溶液,可采取的方法是______(写一种即可)。
(3)当甲中混有少量的乙提纯甲应该采用的方法是______。
(4)t3 ℃时,溶解度由大到小的顺序为______。将40 g的甲加入50 g水中,充分溶解后,形成的溶液质量为______。
15.某城市住宅饮用水的处理过程如图1所示:
(1)步骤①网格净水原理和步骤_______类似(填②、③或④等序号)。
(2)在沉降池中,一般会加入明矾等絮凝剂,其作用是_______。
(3)在⑤的步骤中,用简单的方法检验水样是否为硬水,可选用的试剂是_______。
(4)在饮用自来水前一般要进行煮沸,煮沸的目的是_______。
(5)某同学用图2装置模拟过滤池对河水进行过滤,经过过滤后,滤液仍浑浊,原因可能是____(写一条即可)。
三、实验题
16.实验室利用下图实验装置进行有关化学实验,回答下列问题:
(1)写出图中仪器甲、乙的名称:甲________________,乙________________。
(2)实验室用高锰酸钾制取氧气,发生装置可选择图中的________________(填标号),写出该反应的化学方程式________________,用充满水的装置C收集氧气,则氧气需从________________(填“a”或“b”)端通入。
(3)实验室用装置C收集二氧化碳,验满时,燃着木条应放在________________(填“a”或“b”)端,检验二氧化碳的试剂是________________。
(4)用上述制取二氧化碳实验后的固液残留物进行过滤、蒸发的操作训练。对固液残留物进行过滤,应选择图中________________(填标号)装置,过滤时玻璃棒的作用是________________。
17.下面是净化水的装置,请回答下列问题。
(1) 如图1所示的净水装置中用玻璃棒引流的作用是______________,若该操作后滤液仍然浑浊,原因是________(答一点即可)
(2)如图2所示是实验室制取蒸馏水的装置
写出仪器的名称: X__________;冷凝管上冷水进水口是_________(填字母),在X中加一些碎瓷片的作用____________________。
18.如图所示为过滤的操作实验,请按要求回答下列问题:
(1)该操作还缺少一种仪器_________,其作用是__________。
(2)指出图中的一处错误:_________________________(除(1)外)
(3)过滤后发现仍然浑浊,可能的原因是___________________________(写一条即可)
(4)过滤后得到的水是__________(填“纯净物”或“混合物”),其原因是_________。若要制取纯水,还需要采用的净化方法是_____________。
19.(1)根据如图所示的实验回答问题。
①甲实验中,进行粗盐提纯实验时,过滤的目的是_____。
②乙实验中,验证人体呼出气体中二氧化碳含量比空气中多时,在温度和压强相同的条件下,除了待检验的两种气体样品体积相同外,还要控制_____相同,实验现象是_____。
③丙实验用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸,则测得结果与实际值相比_____(选择“偏大”、“偏小”或“相等”)。
(2)利用如图装置分别进行两组实验.
①验证二氧化碳是否与水反应.
A中盛放干燥的紫色石蕊纸花,B中盛放_____,关闭K1、打开K2,从a处通入二氧化碳气体,若观察到_____现象,则可以证明二氧化碳与水发生了化学反应。
②除去氧气中混有的少量二氧化碳气体.
实验小组的同学在讨论实验方案时出现了分歧.小刚方案:A中盛放澄清的石灰水,打开K1、关闭K2,从a处通入混合气体,在b处放带火星的木条,若带火星的木条复燃,则二氧化碳已除去.A中反应的化学方程式为_____。小丽认为该方案不够严谨,对此进行了改进.她的方案是_____。
四、计算题
20.下图是KNO3和NaCl的溶解度曲线。
(1)20℃时,在100g水中加入40gNaCl固体,所形成的溶液是_______(填“饱和”或“不饱和”)溶液。
(2)50℃时,KNO3溶液的质量分数最大值是____________(只列计算式)。
(3)将50℃KNO3的饱和溶液降温到20℃,其溶液质量分数_______(填“变大”或“变小”或“不变”)。
(4)欲从NaCl溶液中获得大量的NaCl晶体,采用的方法是___________________。
参考答案
1.C
【详解】A.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,b物质的溶解度受温度影响不大,故a中含有少量b时,可采取降温结晶的方法来提纯a,正确;
B.由溶解度曲线可知t℃时,二者的溶解度相等,所以该温度下,等质量的饱和溶液中含有等质量的溶质,正确;
C.当温度大于t℃时,a的饱和溶液中溶质的质量分数大于b的饱和溶液中溶质的质量分数,不明确溶液是否饱和,是无法比较的,错误;
D.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,b物质的溶解度受温度影响不大,正确;
故选:C。
2.C
【详解】A.蒸发食盐水制食盐时,当蒸发皿内出现大量晶体时停止加热,利用余热将剩余的水分蒸干,选项错误;
B.氢氧化钠具有腐蚀性,称量氢氧化钠固体时,应将氢氧化钠固体放到小烧杯中称量,选项错误;
C.用胶头滴管吸取液体时,要先在试剂瓶外把滴管内的空气挤出,避免在瓶内捏瘪胶头使液体从滴瓶内溢出,选项正确;
D.过滤时,用玻璃棒在过滤器里搅拌会戳破滤纸,会使浊液沿滤纸与漏斗内壁之间的缝隙流下,导致滤液仍浑浊,选项错误,故选C。
3.C
【详解】A.a点表示的含义为t℃时,KNO3和NaCl的溶解度相等,因为在该温度下,它们有交点,A选项说法正确,不符合题意;
B.硝酸钾的溶解度受温度的影响变化比较大,KNO3饱和溶液中含有少量NaCl,可采用降温结晶法提纯KNO3,B选项说法正确,不符合题意;
C.20℃时,硝酸钾的溶解度是31.6g,50g水中最多溶解硝酸钾的质量为,向50g水中加入16gKNO3固体有剩余,可得到KNO3溶液的质量为50g+15.8g=65.8g,C选项说法不正确,符合题意;
D.t℃时两种物质的溶解度相等,20℃氯化钠的溶解度大于硝酸钾的溶解度,将t℃时两种物质的饱和溶液降温到20℃,所得溶液的质量分数NaCl大于KNO3正确,D选项说法正确,不符合题意。故选C。
【点睛】本题考查溶解度曲线及其应用、结晶的方法等,通过溶解度曲线我们可以获得的信息包括:物质在某温度时溶解度的大小,物质溶解度随温度的变化趋势等;还考查了有关溶液质量和溶质质量分数的变化,结合曲线图上的数据和变化趋势进行计算和分析。
4.D
【详解】A.过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确,不符合题意。
B.镁带燃烧,可用坩埚钳夹持,图中所示操作正确,不符合题意。
C.滴瓶上的滴管使用后直接插回原瓶,不能用水清洗,否则试剂瓶中的溶液将被稀释,图中所示操作正确,不符合题意。
D.把橡皮塞慢慢转动着塞进试管口,切不可把试管放在桌上在使劲塞进塞子,以免压破试管,图中所示操作错误,符合题意。
故选D。
5.B
【详解】A.点燃酒精灯不能用燃着的酒精灯的去引燃,否则容易引起失火,A错误;
B.检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,B正确;
C.倾倒液体时,试剂瓶的瓶盖应倒放在桌面上,试管稍倾斜,C错误;
D.过滤操作应用玻璃棒进行引流,D错误。
故选B。
6.D
【详解】A.加热前溶液中有未溶解的溶质,是饱和溶液,错误;
B.由室温加热至60℃的过程中,试管中的固体恰好完全溶解,溶质的质量增加了,此溶液的质量分数也增加,错误;
C.在60℃时,试管中的固体恰好完全溶解,此溶液的质量分数=,错误;
D.因为温度达60℃时,试管中的固体恰好完全溶解,所以若继续加热至65℃时,此溶液的质量分数不变 ,但溶液为不饱和状态,正确。
故选D。
7.B
【详解】试题分析:A.溶质的质量分数=×100%,两种溶液的溶质质量分数相等,可能溶解度不同,等量的水溶解等量的溶质造成,若是饱和溶液,则该说法成立,但不知溶液是否饱和,故错误;
B.溶质质量分数为10%的200毫升某溶液,密度为1.2克/厘米3,其中含溶质200毫升×1.2克/厘米3×10%=24克,正确;
C.若恒温蒸发溶剂,物质的溶解度不变,则饱和溶液析出晶体后,溶质的质量分数不变,故错误;
D.不饱和溶液变为饱和溶液的常用方法是加入溶质、蒸发溶剂、降温,若采取降温恰好饱和的方法,溶质、溶剂不变,则溶质的质量发生不变,故错误;
故选B.
考点:溶质的质量分数;饱和溶液和不饱和溶液相互转变的方法;晶体和结晶的概念与现象.
点评:了解溶质质量分数的计算方法,饱和溶液中溶质的质量分数=×100%,以及不饱和溶液变为饱和溶液 方法等,并能依据所学知识灵活分析解答问题是解决此题的关键.
8.D
【详解】A.植物油难溶于水,植物油与水混合不能形成溶液,故选项说法错误。
B.溶液具有均一性,将100g 10%的氯化钠溶液倒掉一半,剩余溶液的质量分数仍为10%,故选项说法错误。
C.氢氧化钙的溶解度随温度的升高而降低,故升高温度可以使氢氧化钙的不饱和溶液变成饱和溶液,故错误。
D.洗涤剂清具有乳化作用,生活中利用洗涤剂清洗油污属于乳化现象,故选项说法正确。
故选:D
9.D
【详解】A.固体物质的溶解度随温度变化,所以比较溶解度必须指明温度,该选项未指明温度,无法比较溶解度,说法错误;
B.由溶解度曲线可知,T1℃时,KNO3和KCl的溶解度相等,饱和溶液的溶质质量分数相等,此选项未指明溶液是否饱和,无法比较,说法错误;
C.溶液a、b分别为T1℃时KCl的不饱和溶液、饱和溶液,可以通过增加溶质或恒温蒸发溶剂的方法使KCl的不饱和溶液a转化为饱和溶液b,降温的方法温度会改变,无法实现转化,说法错误;
D.60℃时,KNO3的溶解度为110g,表示100g水中最多溶解110gKNO3,得到饱和溶液210g,冷却至10℃,硝酸钾的溶解度为20.9g,则100g水中最多溶解20.9g硝酸钾,会析出硝酸钾晶体:,说法正确。
故选D。
10.C
【详解】由于硝酸钾的溶解度随温度的升高而增大,所以,升高温度(不考虑水分的蒸发)溶液变成不饱和溶液,而溶质、溶液的质量和溶质的质量分数都不改变,改变的是硝酸钾的溶解度。故选C。
11.B
【详解】A.根据溶解曲线可知,它们在20℃时的溶解度都大于10g,a、b两种物质均为易溶物质,说法正确,不符合题意;
B.没有指明溶液的质量,不能确定20℃时,a、b饱和溶液中含溶质的质量相等,说法错误,符合题意;
C.根据溶解曲线可知,a的溶解度是50g,根据溶解度概念可知,50℃时,将5ga物质溶解到l0g水中恰好达到饱和,说法正确,不符合题意;
D.根据溶解曲线可知,b 溶解度随温度降低而降低,将50℃时b的不饱和溶液变为饱和溶液,可采取降低温度的方法,说法正确,不符合题意。故选B。
12.(1)t1℃时A、C两物质的溶解度相同
(2)ABC
(3)升高温度等
(4)饱和溶液
【解析】(1)
由图可知,t1℃时,A、C的溶解度曲线相交于P点,P点的含义是t1℃时A、C两物质的溶解度相同;
(2)
根据溶解度曲线图可知,t2℃时,A、B、C三种物质的溶解度由大到小的顺序为A>B>C;
(3)
由于物质C的溶解度随温度的升高而减小,要使接近饱和的C溶液变为饱和溶液,采用的方法是升高温度等;
(4)
t2℃时,A物质的溶解度为50g,100g水中最多溶解50gA物质。将60克A物质加入到100克水中,充分溶解后,所得溶液是饱和溶液。
13. 乙 丙<甲<乙(丙甲乙) 升温(加热) ω(乙)>ω(甲)>ω(丙)
【详解】(1)在0℃~60℃之间,三种物质中溶解度受温度影响最小的是乙;故填:乙
(2)20℃时,三种物质的溶解度由小到大的顺序为丙<甲<乙;故填:丙<甲<乙
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是升高温度;故填:升温(加热)
(4)50℃时,将甲、乙、丙各20g分别加入盛有50g水的烧杯中,充分溶解,静置,然后各取上层清液mg,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是:ω(乙)>ω(甲)>ω(丙),因为降温后乙的溶解度大于甲,丙的质量分数不变,还是最小;故填:ω(乙)>ω(甲)>ω(丙)
【点睛】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等。
14. t1 升温(合理即可) 降温结晶 甲>乙>丙 80g
【详解】(1)由图分析可知,乙、丙两物质在t1℃时溶解度相等;
(2)由图可知升高温度甲的溶解度增大,可变为不饱和溶液;
(3)由图知甲的渗解度受温度影响比乙大,降低温近固体析出;
(4)当t3 ℃时,溶解度大小为:甲>乙>丙,甲的溶解度为60g,即100g水中最多溶解60g甲,现有50g水,故能溶解30g甲,再加机水的质量50g,所以溶液的质量=溶质质量+溶剂质量=30+50=80g。
故答案为:①t1;②升温;③降温结晶;④甲>乙>丙;⑤80g。
15.(1)③
(2)吸附水中悬浮杂质,使之沉降
(3)肥皂水
(4)杀菌消毒,降低水的硬度
(5)滤纸破损
【详解】(1)过滤能将难溶性固体与液体分离,所以步骤①网格净水原理和步骤类似于过滤,故填:③。
(2)为吸附水中悬浮杂质,使之沉降,在沉降池中,一般会加入明矾等絮凝剂。故填:吸附水中悬浮杂质,使之沉降。
(3)由于肥皂水可区分软水、硬水,所以用简单的办法检验水样是不是硬水,可选用的试剂是肥皂水。故填:肥皂水。
(4)为杀菌消毒,降低水的硬度,在饮用自来水前一般要进行煮沸。故填:杀菌消毒,降低水的硬度。
(5)过滤后发现滤液仍然呈浑浊,可能的原因是滤纸破损(或漏斗内的液面高于滤纸的边缘,或接液烧杯不干净)等。
16.(1) 酒精灯 烧杯
(2) A a
(3) a 澄清石灰水
(4) D 引流
【详解】(1)图中仪器甲、乙的名称:甲:酒精灯,乙:烧杯;
(2)实验室用高锰酸钾制取氧气,高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,反应条件是加热,发生装置可选择图中的A,该反应化学方程式:,用充满水的装置C收集氧气,氧气密度比水小处于水面以上,因此则氧气需从a端通入,集气瓶中的水从b端流出;
(3)实验室用装置C收集二氧化碳,二氧化碳的密度比空气大,二氧化碳从b端通入,集气瓶中的空气从a端逸出,集气瓶中的二氧化碳收集满,二氧化碳气体从a端逸出,燃着的木条放在a端,二氧化碳能使澄清石灰水变浑浊,检验二氧化碳的试剂是澄清石灰水;
(4)对固液残留物进行过滤,应选择图中D,过滤是实现固液分离的操作,过滤时玻璃棒的作用是引流,防止过滤时液体溅出。
17. 防止液体击穿滤纸,避免液滴飞溅 滤纸破损(或过滤时,液面高于滤纸边缘或盛接滤液的烧杯不干净) 蒸馏烧瓶 b 均匀加热,防止暴沸
【详解】(1)过滤操作中玻璃棒的作用是引流,防止液体击穿滤纸,避免液滴飞溅;若该操作后滤液仍然浑浊,原因可能是滤纸破损(或过滤时,液面高于滤纸边缘或盛接滤液的烧杯不干净);
(2)仪器的名称: X蒸馏烧瓶;
冷凝管上冷水进水口是b,使冷水与蒸气充分接触,冷凝效果更好;
在X中加一些碎瓷片的作用均匀加热,防止暴沸。
18.(1) 玻璃棒 引流
(2)漏斗下端未紧靠烧杯内壁
(3)滤纸破损等
(4) 混合物 水中含有可溶性杂质 蒸馏
【解析】(1)
过滤时需要用玻璃棒引流,故缺少了玻璃棒,其作用是引流;
(2)
根据过滤操作的注意事项“三靠、两低、一贴”分析,漏斗下端没有紧靠烧杯的内壁;
(3)
用改正后的装置进行过滤后,滤液仍浑浊的原因可能是:滤纸破损、过滤器内的液面高于滤纸边缘,都会导致待滤液不经过滤直接进入下面的烧杯中,从而出现浑浊;还有,盛装滤液的烧杯不洁净,也会造成滤液仍浑浊;
(4)
过滤只除去了水中的不溶性杂质,未除去可溶性杂质,故过滤后得到的水是混合物;若要得到纯水,可采用蒸馏的方法,蒸馏可以除去可溶性杂质得到纯水。
【点睛】净化水的方法有沉淀、过滤、吸附、蒸馏。沉淀包括静止沉淀和吸附沉淀,吸附沉淀时水中要加明矾,作用是明矾溶于水形成胶状物吸附杂质,使杂质沉降,达到净水的目的;过滤可将固体和液体分离,但只除去了难溶性物质;净水程度最高的是蒸馏,得到的水是纯净物。
19. 除去粗盐中的不溶性杂质 滴加石灰水的滴数 呼出气体中石灰水变浑浊,空气中不变浑浊 偏大 紫色石蕊试液 紫色石蕊试液变红 Ca(OH)2+CO2=CaCO3↓+H2O A、B中都盛放澄清石灰水,关闭K1、打开K2,从a处通入混合气体,若B中无明显变化,则可以说明氧气中的二氧化碳杂质已经除尽
【详解】①甲实验中,进行粗盐提纯实验时,过滤的目的是除去粗盐中的不溶性杂质。
②要验证人体呼出气体中二氧化碳含量比空气中多时,在温度和压强相同的条件下,待检验的两种气体样品体积相同,还要控制滴加石灰水的滴数,可以观察到呼出气体中石灰水变浑浊,空气中不变浑浊;故填:滴加石灰水的滴数;呼出气体中石灰水变浑浊,空气中不变浑浊;
③用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸,则酸性减弱,则测得结果与实际值相比偏大,故填:偏大。
(2)①二氧化碳与水发生了化学的方程式为 H2O+CO2=H2CO3,碳酸能使紫色石蕊变红.
把二氧化碳通过干燥的紫色石蕊试纸,石蕊不变红,证明二氧化碳不能使石蕊变红;B中盛放紫色石蕊试液,若紫色石蕊试液变红,说明二氧化碳与水发生了化学反应生成了酸.
②小刚方案:二氧化碳能使澄清石灰水变浑浊,氧气能使带火星的木条复燃,故反应现象是澄清石灰水变浑浊且带火星的木条复燃;二氧化碳和石灰水的化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O.
小丽方案:A、B中都盛放澄清石灰水,关闭K1、打开K2,从a处通入混合气体,若B中无明显变化,则可以说明氧气中的二氧化碳杂质已经除尽.
20.(1)饱和(2) 100%(3)变小(4)蒸发(溶剂)结晶
【详解】(1)由溶解度曲线可知,20℃时氯化钠的溶解度是36.0g,故向100g的水中加入40g的氯化钠后,不能完全溶解,故所得的溶液是饱和溶液;
(2)50℃时,KNO3的溶解度是85.5g,故该温度下硝酸钾的饱和溶液的质量分数最大,质量分数为 100%;
(3)硝酸钾的溶解度随温度的升高而升高,故50℃时,KNO3的饱和溶液降温至20℃时,仍然是饱和溶液,并且有硝酸钾晶体析出,故降温后其溶液中溶质的质量分数变小;
(4)NaCl的溶解度随温度的升高而升高,随温度的变化不大,故应该采用蒸发结晶的方法获得大量的NaCl晶体。
一、单选题
1.下图是a、b两种固体物质的溶解度曲线。下列说法中错误的是
A.a中含有少量b时,用降温结晶的方法提纯a
B.t℃时,等质量的a、b饱和溶液中含有相同质量的溶质
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大,b物质的溶解度受温度变化的影响较小
2.下列化学实验操作正确的是
A.蒸发食盐水制食盐时,当水蒸干后停止加热
B.称量氢氧化钠固体时,需要在托盘天平两端各垫一张干净的滤纸
C.用胶头滴管吸取液体时,要先在试剂瓶外把滴管内的空气挤出
D.过滤时,为加快过滤速度,可用玻璃棒在过滤器里搅拌
3.如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )
A.a点表示的含义:t℃,KNO3和NaCl的溶解度相等
B.KNO3饱和溶液中含有少量的NaCl,可采用降温结晶法提纯KNO3
C.20℃,向50 g水中加入16 g KNO3,可得到66 g KNO3溶液
D.将t℃时两种物质的饱和溶液降温到20℃,所得溶液的质量分数NaCl大于KNO3
4.实验操作中错误的是( )
A.过滤 B.镁带燃烧 C.滴管用后不洗插回原瓶 D.用力塞紧橡皮塞
5.下列实验操作中,正确的是
A.点燃酒精灯 B.检查装置气密性
C.倾倒液体 D.过滤
6.实验装置如下图所示,试管中装有水12g和硝酸钾9g,搅拌后试管底部尚有部分未溶的固体.将此试管放入烧杯中隔水加热并摇动试管,当烧杯中的温度达60℃时,试管中的固体恰好完全溶解.若不计加热过程中所蒸发的水量,则有关此试管内溶液的叙述,正确的是
A.加热前此溶液是不饱和溶液
B.由室温加热至60℃的过程中,此溶液的质量分数不变
C.在60℃时此溶液的质量分数为75%
D.若继续加热至65℃时此溶液的质量分数不变 ,但溶液已达到了不饱和状态
7.下列关于溶液的说法正确的是
A.某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同
B.溶质质量分数为10%的200毫升某溶液,密度为1.2克/厘米3,其中含溶质24克
C.饱和溶液析出晶体后,溶质的质量分数一定减少
D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大
8.下列说法正确的是
A.植物油与水混合一定形成溶液
B.将100g10%的氯化钠溶液倒掉一半,剩余溶液的质量分数变为5%
C.降温可使氢氧化钙的不饱和溶液变成饱和溶液
D.生活中利用洗涤剂清洗油污属于乳化现象
9.已知KNO3和KCl的溶解度曲线如图所示。下列说法正确的是
A.KCl的溶解度小于KNO3的溶解度
B.T1℃时,KNO3、KCI两溶液中溶质的质量分数一定相等
C.降温的方法可将KCl的不饱和溶液a转化为饱和溶液b
D.将60℃时的KNO3饱和溶液210g冷却至10℃,析出硝酸钾晶体89.1g
10.将时的硝酸钾饱和溶液升温至(不考虑水分的蒸发),一定发生改变的是。
A.溶质的质量分数 B.溶液的质量
C.硝酸钾的溶解度 D.溶质的质量
11.如图a、b两种固体物质的溶解度曲线,下列说法错误的是
A.a、b两种物质均为易溶物质
B.20℃时,a、b饱和溶液中含溶质的质量相等
C.50℃时,将5g a物质溶解到l0g水中恰好达到饱和
D.将50℃时b的不饱和溶液变为饱和溶液,可采取降低温度的方法
二、填空题
12.如图是A、B、C三种物质的溶解度曲线,回答下列问题。
(1)P点的含义是_____。
(2)t2℃时,A、B、C三种物质的溶解度由大到小的顺序为_____。
(3)t2℃时,要使接近饱和的C溶液变为饱和溶液,采用的方法是_____。
(4)t2℃时,将60克A物质加入到100克水中,充分溶解后,所得溶液是_____。(填“饱和溶液”或“不饱和溶液”)
13.甲、乙、丙三种物质的溶解度曲线如下图所示。请回答下列问题:
(1)在 0℃~60℃之间,三种物质中溶解度受温度影响最小的是______。
(2)20℃时,三种物质的溶解度由小到大的顺序为______。
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是_____。
(4)50℃时,将甲、乙、丙各20 g分别加入盛有50 g水的烧杯中,充分溶解,静置,然后各取上层清液m g,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是______。
14.下图是甲、乙、丙三种固体的溶解度曲线图。据图回答下列问题。
(1)乙、丙两物质在______℃时溶解度相等。
(2)将t2 ℃时甲的饱和溶液变为不饱和溶液,可采取的方法是______(写一种即可)。
(3)当甲中混有少量的乙提纯甲应该采用的方法是______。
(4)t3 ℃时,溶解度由大到小的顺序为______。将40 g的甲加入50 g水中,充分溶解后,形成的溶液质量为______。
15.某城市住宅饮用水的处理过程如图1所示:
(1)步骤①网格净水原理和步骤_______类似(填②、③或④等序号)。
(2)在沉降池中,一般会加入明矾等絮凝剂,其作用是_______。
(3)在⑤的步骤中,用简单的方法检验水样是否为硬水,可选用的试剂是_______。
(4)在饮用自来水前一般要进行煮沸,煮沸的目的是_______。
(5)某同学用图2装置模拟过滤池对河水进行过滤,经过过滤后,滤液仍浑浊,原因可能是____(写一条即可)。
三、实验题
16.实验室利用下图实验装置进行有关化学实验,回答下列问题:
(1)写出图中仪器甲、乙的名称:甲________________,乙________________。
(2)实验室用高锰酸钾制取氧气,发生装置可选择图中的________________(填标号),写出该反应的化学方程式________________,用充满水的装置C收集氧气,则氧气需从________________(填“a”或“b”)端通入。
(3)实验室用装置C收集二氧化碳,验满时,燃着木条应放在________________(填“a”或“b”)端,检验二氧化碳的试剂是________________。
(4)用上述制取二氧化碳实验后的固液残留物进行过滤、蒸发的操作训练。对固液残留物进行过滤,应选择图中________________(填标号)装置,过滤时玻璃棒的作用是________________。
17.下面是净化水的装置,请回答下列问题。
(1) 如图1所示的净水装置中用玻璃棒引流的作用是______________,若该操作后滤液仍然浑浊,原因是________(答一点即可)
(2)如图2所示是实验室制取蒸馏水的装置
写出仪器的名称: X__________;冷凝管上冷水进水口是_________(填字母),在X中加一些碎瓷片的作用____________________。
18.如图所示为过滤的操作实验,请按要求回答下列问题:
(1)该操作还缺少一种仪器_________,其作用是__________。
(2)指出图中的一处错误:_________________________(除(1)外)
(3)过滤后发现仍然浑浊,可能的原因是___________________________(写一条即可)
(4)过滤后得到的水是__________(填“纯净物”或“混合物”),其原因是_________。若要制取纯水,还需要采用的净化方法是_____________。
19.(1)根据如图所示的实验回答问题。
①甲实验中,进行粗盐提纯实验时,过滤的目的是_____。
②乙实验中,验证人体呼出气体中二氧化碳含量比空气中多时,在温度和压强相同的条件下,除了待检验的两种气体样品体积相同外,还要控制_____相同,实验现象是_____。
③丙实验用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸,则测得结果与实际值相比_____(选择“偏大”、“偏小”或“相等”)。
(2)利用如图装置分别进行两组实验.
①验证二氧化碳是否与水反应.
A中盛放干燥的紫色石蕊纸花,B中盛放_____,关闭K1、打开K2,从a处通入二氧化碳气体,若观察到_____现象,则可以证明二氧化碳与水发生了化学反应。
②除去氧气中混有的少量二氧化碳气体.
实验小组的同学在讨论实验方案时出现了分歧.小刚方案:A中盛放澄清的石灰水,打开K1、关闭K2,从a处通入混合气体,在b处放带火星的木条,若带火星的木条复燃,则二氧化碳已除去.A中反应的化学方程式为_____。小丽认为该方案不够严谨,对此进行了改进.她的方案是_____。
四、计算题
20.下图是KNO3和NaCl的溶解度曲线。
(1)20℃时,在100g水中加入40gNaCl固体,所形成的溶液是_______(填“饱和”或“不饱和”)溶液。
(2)50℃时,KNO3溶液的质量分数最大值是____________(只列计算式)。
(3)将50℃KNO3的饱和溶液降温到20℃,其溶液质量分数_______(填“变大”或“变小”或“不变”)。
(4)欲从NaCl溶液中获得大量的NaCl晶体,采用的方法是___________________。
参考答案
1.C
【详解】A.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,b物质的溶解度受温度影响不大,故a中含有少量b时,可采取降温结晶的方法来提纯a,正确;
B.由溶解度曲线可知t℃时,二者的溶解度相等,所以该温度下,等质量的饱和溶液中含有等质量的溶质,正确;
C.当温度大于t℃时,a的饱和溶液中溶质的质量分数大于b的饱和溶液中溶质的质量分数,不明确溶液是否饱和,是无法比较的,错误;
D.由溶解度曲线可知,a物质的溶解度随温度的升高而明显增大,b物质的溶解度受温度影响不大,正确;
故选:C。
2.C
【详解】A.蒸发食盐水制食盐时,当蒸发皿内出现大量晶体时停止加热,利用余热将剩余的水分蒸干,选项错误;
B.氢氧化钠具有腐蚀性,称量氢氧化钠固体时,应将氢氧化钠固体放到小烧杯中称量,选项错误;
C.用胶头滴管吸取液体时,要先在试剂瓶外把滴管内的空气挤出,避免在瓶内捏瘪胶头使液体从滴瓶内溢出,选项正确;
D.过滤时,用玻璃棒在过滤器里搅拌会戳破滤纸,会使浊液沿滤纸与漏斗内壁之间的缝隙流下,导致滤液仍浑浊,选项错误,故选C。
3.C
【详解】A.a点表示的含义为t℃时,KNO3和NaCl的溶解度相等,因为在该温度下,它们有交点,A选项说法正确,不符合题意;
B.硝酸钾的溶解度受温度的影响变化比较大,KNO3饱和溶液中含有少量NaCl,可采用降温结晶法提纯KNO3,B选项说法正确,不符合题意;
C.20℃时,硝酸钾的溶解度是31.6g,50g水中最多溶解硝酸钾的质量为,向50g水中加入16gKNO3固体有剩余,可得到KNO3溶液的质量为50g+15.8g=65.8g,C选项说法不正确,符合题意;
D.t℃时两种物质的溶解度相等,20℃氯化钠的溶解度大于硝酸钾的溶解度,将t℃时两种物质的饱和溶液降温到20℃,所得溶液的质量分数NaCl大于KNO3正确,D选项说法正确,不符合题意。故选C。
【点睛】本题考查溶解度曲线及其应用、结晶的方法等,通过溶解度曲线我们可以获得的信息包括:物质在某温度时溶解度的大小,物质溶解度随温度的变化趋势等;还考查了有关溶液质量和溶质质量分数的变化,结合曲线图上的数据和变化趋势进行计算和分析。
4.D
【详解】A.过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确,不符合题意。
B.镁带燃烧,可用坩埚钳夹持,图中所示操作正确,不符合题意。
C.滴瓶上的滴管使用后直接插回原瓶,不能用水清洗,否则试剂瓶中的溶液将被稀释,图中所示操作正确,不符合题意。
D.把橡皮塞慢慢转动着塞进试管口,切不可把试管放在桌上在使劲塞进塞子,以免压破试管,图中所示操作错误,符合题意。
故选D。
5.B
【详解】A.点燃酒精灯不能用燃着的酒精灯的去引燃,否则容易引起失火,A错误;
B.检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,B正确;
C.倾倒液体时,试剂瓶的瓶盖应倒放在桌面上,试管稍倾斜,C错误;
D.过滤操作应用玻璃棒进行引流,D错误。
故选B。
6.D
【详解】A.加热前溶液中有未溶解的溶质,是饱和溶液,错误;
B.由室温加热至60℃的过程中,试管中的固体恰好完全溶解,溶质的质量增加了,此溶液的质量分数也增加,错误;
C.在60℃时,试管中的固体恰好完全溶解,此溶液的质量分数=,错误;
D.因为温度达60℃时,试管中的固体恰好完全溶解,所以若继续加热至65℃时,此溶液的质量分数不变 ,但溶液为不饱和状态,正确。
故选D。
7.B
【详解】试题分析:A.溶质的质量分数=×100%,两种溶液的溶质质量分数相等,可能溶解度不同,等量的水溶解等量的溶质造成,若是饱和溶液,则该说法成立,但不知溶液是否饱和,故错误;
B.溶质质量分数为10%的200毫升某溶液,密度为1.2克/厘米3,其中含溶质200毫升×1.2克/厘米3×10%=24克,正确;
C.若恒温蒸发溶剂,物质的溶解度不变,则饱和溶液析出晶体后,溶质的质量分数不变,故错误;
D.不饱和溶液变为饱和溶液的常用方法是加入溶质、蒸发溶剂、降温,若采取降温恰好饱和的方法,溶质、溶剂不变,则溶质的质量发生不变,故错误;
故选B.
考点:溶质的质量分数;饱和溶液和不饱和溶液相互转变的方法;晶体和结晶的概念与现象.
点评:了解溶质质量分数的计算方法,饱和溶液中溶质的质量分数=×100%,以及不饱和溶液变为饱和溶液 方法等,并能依据所学知识灵活分析解答问题是解决此题的关键.
8.D
【详解】A.植物油难溶于水,植物油与水混合不能形成溶液,故选项说法错误。
B.溶液具有均一性,将100g 10%的氯化钠溶液倒掉一半,剩余溶液的质量分数仍为10%,故选项说法错误。
C.氢氧化钙的溶解度随温度的升高而降低,故升高温度可以使氢氧化钙的不饱和溶液变成饱和溶液,故错误。
D.洗涤剂清具有乳化作用,生活中利用洗涤剂清洗油污属于乳化现象,故选项说法正确。
故选:D
9.D
【详解】A.固体物质的溶解度随温度变化,所以比较溶解度必须指明温度,该选项未指明温度,无法比较溶解度,说法错误;
B.由溶解度曲线可知,T1℃时,KNO3和KCl的溶解度相等,饱和溶液的溶质质量分数相等,此选项未指明溶液是否饱和,无法比较,说法错误;
C.溶液a、b分别为T1℃时KCl的不饱和溶液、饱和溶液,可以通过增加溶质或恒温蒸发溶剂的方法使KCl的不饱和溶液a转化为饱和溶液b,降温的方法温度会改变,无法实现转化,说法错误;
D.60℃时,KNO3的溶解度为110g,表示100g水中最多溶解110gKNO3,得到饱和溶液210g,冷却至10℃,硝酸钾的溶解度为20.9g,则100g水中最多溶解20.9g硝酸钾,会析出硝酸钾晶体:,说法正确。
故选D。
10.C
【详解】由于硝酸钾的溶解度随温度的升高而增大,所以,升高温度(不考虑水分的蒸发)溶液变成不饱和溶液,而溶质、溶液的质量和溶质的质量分数都不改变,改变的是硝酸钾的溶解度。故选C。
11.B
【详解】A.根据溶解曲线可知,它们在20℃时的溶解度都大于10g,a、b两种物质均为易溶物质,说法正确,不符合题意;
B.没有指明溶液的质量,不能确定20℃时,a、b饱和溶液中含溶质的质量相等,说法错误,符合题意;
C.根据溶解曲线可知,a的溶解度是50g,根据溶解度概念可知,50℃时,将5ga物质溶解到l0g水中恰好达到饱和,说法正确,不符合题意;
D.根据溶解曲线可知,b 溶解度随温度降低而降低,将50℃时b的不饱和溶液变为饱和溶液,可采取降低温度的方法,说法正确,不符合题意。故选B。
12.(1)t1℃时A、C两物质的溶解度相同
(2)ABC
(3)升高温度等
(4)饱和溶液
【解析】(1)
由图可知,t1℃时,A、C的溶解度曲线相交于P点,P点的含义是t1℃时A、C两物质的溶解度相同;
(2)
根据溶解度曲线图可知,t2℃时,A、B、C三种物质的溶解度由大到小的顺序为A>B>C;
(3)
由于物质C的溶解度随温度的升高而减小,要使接近饱和的C溶液变为饱和溶液,采用的方法是升高温度等;
(4)
t2℃时,A物质的溶解度为50g,100g水中最多溶解50gA物质。将60克A物质加入到100克水中,充分溶解后,所得溶液是饱和溶液。
13. 乙 丙<甲<乙(丙甲乙) 升温(加热) ω(乙)>ω(甲)>ω(丙)
【详解】(1)在0℃~60℃之间,三种物质中溶解度受温度影响最小的是乙;故填:乙
(2)20℃时,三种物质的溶解度由小到大的顺序为丙<甲<乙;故填:丙<甲<乙
(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是升高温度;故填:升温(加热)
(4)50℃时,将甲、乙、丙各20g分别加入盛有50g水的烧杯中,充分溶解,静置,然后各取上层清液mg,再降温至10℃,此时三种溶液中溶质的质量分数分别为ω(甲)、ω(乙)、ω(丙),则三者之间的大小关系是:ω(乙)>ω(甲)>ω(丙),因为降温后乙的溶解度大于甲,丙的质量分数不变,还是最小;故填:ω(乙)>ω(甲)>ω(丙)
【点睛】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等。
14. t1 升温(合理即可) 降温结晶 甲>乙>丙 80g
【详解】(1)由图分析可知,乙、丙两物质在t1℃时溶解度相等;
(2)由图可知升高温度甲的溶解度增大,可变为不饱和溶液;
(3)由图知甲的渗解度受温度影响比乙大,降低温近固体析出;
(4)当t3 ℃时,溶解度大小为:甲>乙>丙,甲的溶解度为60g,即100g水中最多溶解60g甲,现有50g水,故能溶解30g甲,再加机水的质量50g,所以溶液的质量=溶质质量+溶剂质量=30+50=80g。
故答案为:①t1;②升温;③降温结晶;④甲>乙>丙;⑤80g。
15.(1)③
(2)吸附水中悬浮杂质,使之沉降
(3)肥皂水
(4)杀菌消毒,降低水的硬度
(5)滤纸破损
【详解】(1)过滤能将难溶性固体与液体分离,所以步骤①网格净水原理和步骤类似于过滤,故填:③。
(2)为吸附水中悬浮杂质,使之沉降,在沉降池中,一般会加入明矾等絮凝剂。故填:吸附水中悬浮杂质,使之沉降。
(3)由于肥皂水可区分软水、硬水,所以用简单的办法检验水样是不是硬水,可选用的试剂是肥皂水。故填:肥皂水。
(4)为杀菌消毒,降低水的硬度,在饮用自来水前一般要进行煮沸。故填:杀菌消毒,降低水的硬度。
(5)过滤后发现滤液仍然呈浑浊,可能的原因是滤纸破损(或漏斗内的液面高于滤纸的边缘,或接液烧杯不干净)等。
16.(1) 酒精灯 烧杯
(2) A a
(3) a 澄清石灰水
(4) D 引流
【详解】(1)图中仪器甲、乙的名称:甲:酒精灯,乙:烧杯;
(2)实验室用高锰酸钾制取氧气,高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,反应条件是加热,发生装置可选择图中的A,该反应化学方程式:,用充满水的装置C收集氧气,氧气密度比水小处于水面以上,因此则氧气需从a端通入,集气瓶中的水从b端流出;
(3)实验室用装置C收集二氧化碳,二氧化碳的密度比空气大,二氧化碳从b端通入,集气瓶中的空气从a端逸出,集气瓶中的二氧化碳收集满,二氧化碳气体从a端逸出,燃着的木条放在a端,二氧化碳能使澄清石灰水变浑浊,检验二氧化碳的试剂是澄清石灰水;
(4)对固液残留物进行过滤,应选择图中D,过滤是实现固液分离的操作,过滤时玻璃棒的作用是引流,防止过滤时液体溅出。
17. 防止液体击穿滤纸,避免液滴飞溅 滤纸破损(或过滤时,液面高于滤纸边缘或盛接滤液的烧杯不干净) 蒸馏烧瓶 b 均匀加热,防止暴沸
【详解】(1)过滤操作中玻璃棒的作用是引流,防止液体击穿滤纸,避免液滴飞溅;若该操作后滤液仍然浑浊,原因可能是滤纸破损(或过滤时,液面高于滤纸边缘或盛接滤液的烧杯不干净);
(2)仪器的名称: X蒸馏烧瓶;
冷凝管上冷水进水口是b,使冷水与蒸气充分接触,冷凝效果更好;
在X中加一些碎瓷片的作用均匀加热,防止暴沸。
18.(1) 玻璃棒 引流
(2)漏斗下端未紧靠烧杯内壁
(3)滤纸破损等
(4) 混合物 水中含有可溶性杂质 蒸馏
【解析】(1)
过滤时需要用玻璃棒引流,故缺少了玻璃棒,其作用是引流;
(2)
根据过滤操作的注意事项“三靠、两低、一贴”分析,漏斗下端没有紧靠烧杯的内壁;
(3)
用改正后的装置进行过滤后,滤液仍浑浊的原因可能是:滤纸破损、过滤器内的液面高于滤纸边缘,都会导致待滤液不经过滤直接进入下面的烧杯中,从而出现浑浊;还有,盛装滤液的烧杯不洁净,也会造成滤液仍浑浊;
(4)
过滤只除去了水中的不溶性杂质,未除去可溶性杂质,故过滤后得到的水是混合物;若要得到纯水,可采用蒸馏的方法,蒸馏可以除去可溶性杂质得到纯水。
【点睛】净化水的方法有沉淀、过滤、吸附、蒸馏。沉淀包括静止沉淀和吸附沉淀,吸附沉淀时水中要加明矾,作用是明矾溶于水形成胶状物吸附杂质,使杂质沉降,达到净水的目的;过滤可将固体和液体分离,但只除去了难溶性物质;净水程度最高的是蒸馏,得到的水是纯净物。
19. 除去粗盐中的不溶性杂质 滴加石灰水的滴数 呼出气体中石灰水变浑浊,空气中不变浑浊 偏大 紫色石蕊试液 紫色石蕊试液变红 Ca(OH)2+CO2=CaCO3↓+H2O A、B中都盛放澄清石灰水,关闭K1、打开K2,从a处通入混合气体,若B中无明显变化,则可以说明氧气中的二氧化碳杂质已经除尽
【详解】①甲实验中,进行粗盐提纯实验时,过滤的目的是除去粗盐中的不溶性杂质。
②要验证人体呼出气体中二氧化碳含量比空气中多时,在温度和压强相同的条件下,待检验的两种气体样品体积相同,还要控制滴加石灰水的滴数,可以观察到呼出气体中石灰水变浑浊,空气中不变浑浊;故填:滴加石灰水的滴数;呼出气体中石灰水变浑浊,空气中不变浑浊;
③用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸,则酸性减弱,则测得结果与实际值相比偏大,故填:偏大。
(2)①二氧化碳与水发生了化学的方程式为 H2O+CO2=H2CO3,碳酸能使紫色石蕊变红.
把二氧化碳通过干燥的紫色石蕊试纸,石蕊不变红,证明二氧化碳不能使石蕊变红;B中盛放紫色石蕊试液,若紫色石蕊试液变红,说明二氧化碳与水发生了化学反应生成了酸.
②小刚方案:二氧化碳能使澄清石灰水变浑浊,氧气能使带火星的木条复燃,故反应现象是澄清石灰水变浑浊且带火星的木条复燃;二氧化碳和石灰水的化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O.
小丽方案:A、B中都盛放澄清石灰水,关闭K1、打开K2,从a处通入混合气体,若B中无明显变化,则可以说明氧气中的二氧化碳杂质已经除尽.
20.(1)饱和(2) 100%(3)变小(4)蒸发(溶剂)结晶
【详解】(1)由溶解度曲线可知,20℃时氯化钠的溶解度是36.0g,故向100g的水中加入40g的氯化钠后,不能完全溶解,故所得的溶液是饱和溶液;
(2)50℃时,KNO3的溶解度是85.5g,故该温度下硝酸钾的饱和溶液的质量分数最大,质量分数为 100%;
(3)硝酸钾的溶解度随温度的升高而升高,故50℃时,KNO3的饱和溶液降温至20℃时,仍然是饱和溶液,并且有硝酸钾晶体析出,故降温后其溶液中溶质的质量分数变小;
(4)NaCl的溶解度随温度的升高而升高,随温度的变化不大,故应该采用蒸发结晶的方法获得大量的NaCl晶体。
