化学人教版(2019)选择性必修3 3.3.1乙醛 醛类(共63张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.3.1乙醛 醛类(共63张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 100.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 08:28:47 | ||
图片预览





文档简介
(共63张PPT)
第三节 醛 酮
第一课时
乙醛
第三章 烃的衍生物
新课导入
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌 。
新装修的房子,甲醛超标易诱发儿童白血病
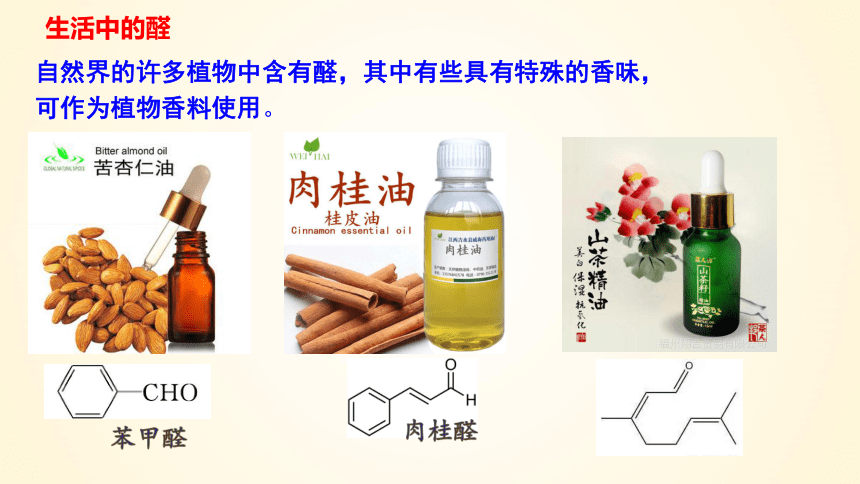
生活中的醛
自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。
生活中的醛
苯甲醛
肉桂醛
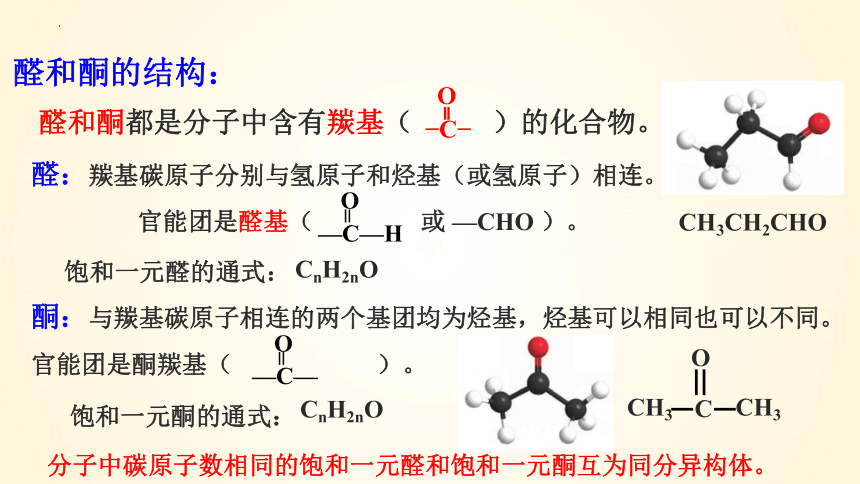
醛:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 —CHO )。
醛和酮都是分子中含有羰基( )的化合物。
酮:与羰基碳原子相连的两个基团均为烃基,烃基可以相同也可以不同。
官能团是酮羰基( )。
C
O
醛和酮的结构:
O
=
—C—H
饱和一元醛的通式:
CnH2nO
CH3CH2CHO
O
=
—C—
CH3 CH3
C
O
饱和一元酮的通式:
CnH2nO
分子中碳原子数相同的饱和一元醛和饱和一元酮互为同分异构体。
结构式:
分子式:
结构简式:
或
H
H
H
H
C
C
O
=
C2H4O
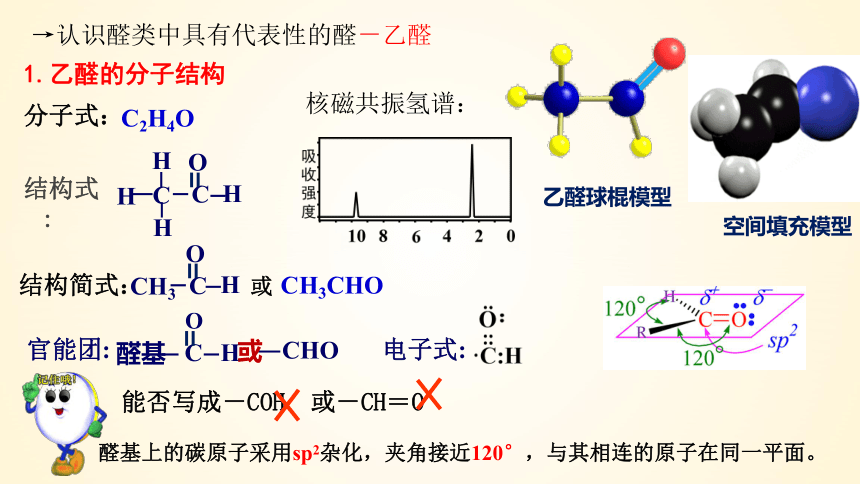
1.乙醛的分子结构
CH3CHO
H
CH3
C
O
=
官能团:
醛基
CHO
或
乙醛球棍模型
C
H
O
=
能否写成-COH 或-CH=O
空间填充模型
→认识醛类中具有代表性的醛-乙醛
电子式:
醛基上的碳原子采用sp2杂化,夹角接近120°,与其相连的原子在同一平面。
核磁共振氢谱:
一、乙醛
2、乙醛的物理性质
①无色、有刺激性气味的液体;
②密度比水小,沸点是20.8℃;
③易挥发,易燃烧;
④易溶于水、乙醇、乙醚、氯仿等有机溶剂。
思考:乙醛为什么易溶于水?随着碳原子数的增多,醛的溶解性如何变化?
随着碳原子数的增多,醛的溶解度逐渐减小。在水中微溶或不溶。
(乙醛与水分子间存在氢键)
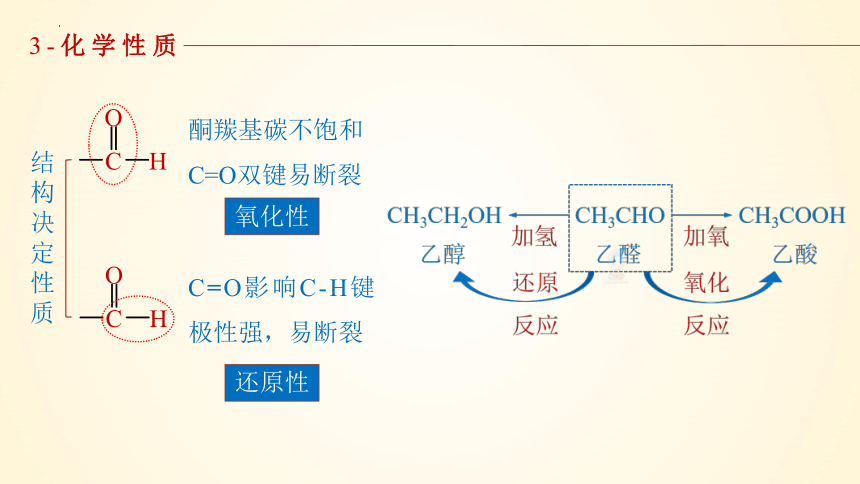
3-化学性质
结构决定性质
C=O影响C-H键极性强,易断裂
酮羰基碳不饱和C=O双键易断裂
氧化性
O
C
H
O
C
H
还原性
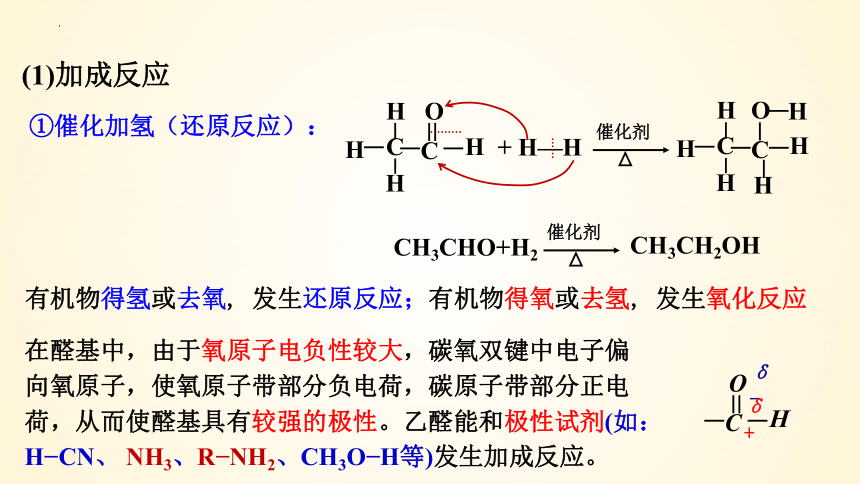
(1)加成反应
①催化加氢(还原反应):
催化剂
C
C
O
H
H
H
H
+ H—H
C
C
O
H
H
H
H
H
H
CH3CHO+H2
CH3CH2OH
催化剂
在醛基中,由于氧原子电负性较大,碳氧双键中电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛能和极性试剂(如:H CN、 NH3、R NH2、CH3O H等)发生加成反应。
C
O
H
δ-
δ+
有机物得氢或去氧, 发生还原反应;有机物得氧或去氢, 发生氧化反应
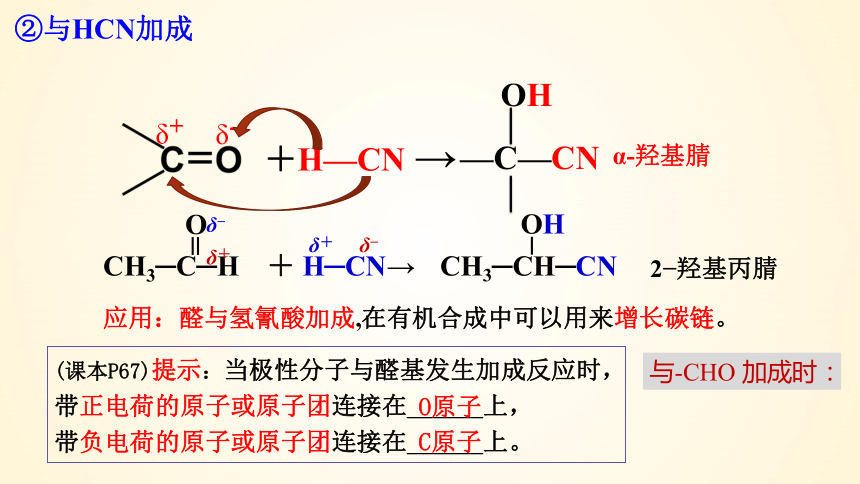
②与HCN加成
δ+
δ-
+H—CN →
—C—CN
OH
α-羟基腈
应用:醛与氢氰酸加成,在有机合成中可以用来增长碳链。
CH3─C─H
O
δ+
δ
+ H─CN→
δ
δ+
CH3─CH─CN
OH
2 羟基丙腈
(课本P67)提示:当极性分子与醛基发生加成反应时,
带正电荷的原子或原子团连接在______上,
带负电荷的原子或原子团连接在______上。
O原子
C原子
与-CHO 加成时:
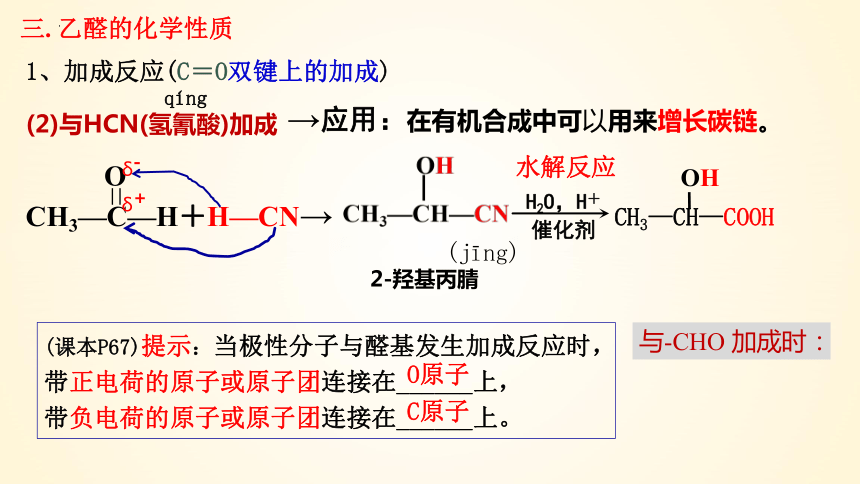
1、加成反应(C=O双键上的加成)
三. 乙醛的化学性质
(2)与HCN(氢氰酸)加成
CH3—C—H+H—CN→
O
=
→应用:在有机合成中可以用来增长碳链。
2-羟基丙腈
δ-
δ+
(课本P67)提示:当极性分子与醛基发生加成反应时,
带正电荷的原子或原子团连接在______上,
带负电荷的原子或原子团连接在______上。
O原子
C原子
CH3—CH—COOH
OH
水解反应
qíng
(jīng)
H2O,H+
催化剂
与-CHO 加成时:
③与NH3、RNH2(胺)加成:
C
O
H
CH3
+ H—NH2
δ-
δ+
δ-
δ+
C
OH
H
CH3
NH2
2-羟基乙胺
④与醇类加成:
C
O
H
CH3
+ H—NHCH3
δ-
δ+
δ-
δ+
C
OH
H
CH3
NHCH3
C
O
H
CH3
+ H—OCH2CH3
δ-
δ+
δ-
δ+
C
OH
H
CH3
OCH2CH3
注意 :①乙醛不能与X2、HX、H2O进行加成反应②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
写出下列物质发生加成反应的化学方程式。
C
HO
+ H2
CH2OH
H
CH3
C
O
+ CH3OH
H
CH3
C
OH
OCH3
Ni
△
Ni
△
醛基(-CHO)具有较强还原性,易被氧化,产物通常为相应的羧酸
(2)与银氨溶液的反应
(5)与溴水的反应
(4)与KMnO4(H+)、 K2Cr2O7(H+)溶液的反应
(3)与新制Cu(OH)2悬浊液反应
(1)与 O2 的反应
弱氧化剂
2. 乙醛的氧化反应
三. 乙醛的化学性质
H
CH3
C
O
=
O
C
H
O
=
CH3
[O]
2CH3CHO+5O2 4CO2+4H2O
点燃
①可燃性
②催化氧化
在催化剂作用下,被空气中的氧气氧化为乙酸
(1)与O2的反应
2CH3CHO+O2 2CH3COOH
催化剂
小结:CH3CH2OH CH3CHO CH3COOH
氧化
还原
氧化
2. 乙醛的氧化反应
三. 乙醛的化学性质
(淡蓝色火焰)
应用:工业制备乙酸
被溴水氧化
被酸性KMnO4 、
酸性K2Cr2O7 氧化
3) 被溴水氧化:
4) 被酸性KMnO4 / K2Cr2O7 氧化:
CH3CHO + Br2 + H2O →
CH3COOH + 2HBr
溶液 褪色
R-C—O—H
=
O
R-C—H
=
O
被氧化
酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等
被强氧化剂氧化:
[提示]必须是溴水,溴的CCl4溶液不会氧化醛基,因为其中不含氧
实验方案:在洁净的试管中加入1 ml 2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】P67
(2)与银氨溶液的反应(银镜反应)
2. 乙醛的氧化反应
三. 乙醛的化学性质
(2)氧化反应
【实验3-7】
实验操作
实验现象 向①中滴加氨水,现象为 ,加入乙醛,水浴加热一段时间后,试管内壁出现一层___________
先产生白色沉淀后变澄清
光亮的银镜
Ⅰ.银镜反应
配制银氨溶液
不可反滴
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
反应生成羧酸铵,还有一水二银三个氨
巧记
相关反应化学方程式:
氢氧化二氨合银
改写为离子方程式:
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
Ag++NH3·H2O=AgOH ↓+ NH4+
(银氨络离子)
CH3CHO + 2 [Ag(NH3)2]++2OH- CH3COO-+NH4 ++ 2Ag↓+ 3NH3 + H2O
△
实质:
乙醛中的醛基被银氨溶液+1价的银氧化成羧基,又和氨气反应生成铵盐,表现醛基具有还原性 。
无↑,因NH3极易溶于水
应用:
⑴试管内壁应洁净(先用热NaOH溶液,再用蒸馏水);
⑵须用新配制的银氨溶液(因久置的银氨溶液会生成易爆炸的叠氮化银AgN3),配制银氨溶液时,氨水要稍过量,以保证反应在弱碱性条件下进行(不能太多否则会生成易爆炸的雷酸银);
⑶必须用水浴加热(60℃),不能用酒精灯加热,加热时不可振荡或摇动试管;
问题:如何处理试管内壁上的银?
银镜用稀HNO3浸泡,再清洗
Ag +
HNO3
=
AgNO3
+ NO↑
+ H2O
(稀)
3 4 3 2
实验注意事项:
1)此反应可以用于检验醛基的存在和测定醛基的个数
2)制镜或保温瓶胆
(实际用含醛基的葡萄糖)
定量:
1mol -CHO ~ 2mol [Ag(NH3)2]OH ~ 2mol Ag
课堂练习1、下列有关银镜反应实验的说法不正确的是( )
A.实验前先用热的烧碱溶液洗涤有油脂的试管,再用蒸馏水洗涤
B.向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,
配得银氨溶液
C.采用水浴加热,不能直接加热
D.可用浓盐酸洗去银镜
D
实验方案:在试管里加入2 ml10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 ml乙醛溶液,加热。观察实验现象。
【实验3-8】P67
(3)与新制的Cu(OH)2悬浊液反应
2. 乙醛的氧化反应
三. 乙醛的化学性质
【实验3-8】
Ⅱ.乙醛与新制的氢氧化铜反应
实验操作
实验现象 A中溶液出现 ,滴入乙醛,加热至沸腾后,C中溶液有产生 。
蓝色絮状沉淀
砖红色沉淀
相关反应化学方程式:
CuSO4+ 2NaOH = Cu(OH)2 ↓ +Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
砖红色
蓝色絮状沉淀
离子方程式:
Cu2++ 2OH- = Cu(OH)2↓
CH3CHO + 2Cu(OH)2 + 2OH- CH3COO- + Cu2O↓ + 3H2O
△
实质:
乙醛中的醛基被新制备的氢氧化铜中+2价的铜氧化成羧基,又和过量的氢氧化钠反应生成钠盐,表现醛基具有还原性 。
a、必须用新制的Cu(OH)2:
一方面,新制的Cu(OH)2为絮状物,跟醛的接触面积大
另一方面,久置的Cu(OH)2,易转变成Cu2(OH)2CO3
b、制备Cu(OH)2时,NaOH必须过量,且质量分数要大些,这样形成的Cu(OH)2能加快乙醛的氧化使现象明显
c、该反应必须加热到沸腾,才有明显的红色沉淀产生,但不能太久,否则会有黑色的沉淀CuO生成
实验注意事项及应用:
2)医学上检验病人是否患糖尿病(检查葡萄糖的醛基)
应用:
思考:该反应有什么用途?
1)检验醛基并测定醛基的个数
+ NaOH
CH3CHO +2Cu(OH)2
△
CH3COONa + Cu2O↓+ H2O
3
定量:
1mol —CHO → 2mol Cu(OH)2 → 1mol Cu2O
糖尿病患者的糖代谢功能紊乱,其血液或尿液中的葡萄糖含量会超出正常范围。通过检测患者血液或尿液中葡萄糖的含量,可诊断患者的病情。在医院中可用仪器测量,在家中可根据葡萄糖特征反应原理制备的试纸对尿液进行检验。
资料卡片
小结:醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
(3)加热至沸腾,但温度不能过高
知识归纳:
如何检验醛基的存在?
(1)与新制的银氨溶液反应有光亮的银镜生成
如何检验苯酚的存在?
方法一:苯酚与浓溴水取代反应;
方法二:苯酚与FeCl3的显色反应。
(2)与新制的Cu(OH)2共热煮沸有砖红色沉淀生成
知识回顾:
课堂练习2、某学生做乙醛的还原性实验时,取1 mol/LCuSO4溶液和0.5 mol/L NaOH溶液各1 ml,在一支洁净的试管内混合后,向其中又加入0.5 ml 40%的乙醛溶液,加热,结果无砖红色沉淀出现。导致该实验失败的原因可能是( )
A.加入NaOH溶液的量不够 B.加入乙醛的量太少
C.加入CuSO4溶液的量不够 D.加入乙醛的量太多
A
【思考与讨论】 乙醇、乙醛和乙酸三者之间的转化关系如下图所示,请结合具体反应和三者的分子结构、官能团的变化情况,谈谈有机反应中的氧化反应和还原反应的特点。
氧化
乙醛
还原
乙醇
氧化
乙酸
O—H
H
H—C—C—
H
H
H
H—C—C=O
H
H
H
C
O
H
CH3
C
O
H
CH3
O
C
C
O
H
H
H
H
C
C
O
H
H
H
H
H
H
氧化
氧化
还原
脱氢
加氧
加氢
有机氧化反应:
加氧脱氢
有机还原反应:
加氢脱氧
课堂练习3(课本P72 T6):用化学方法鉴别下列各组物质。
(1)溴乙烷、乙醇、乙醛;
(2)苯、甲苯、乙醇、1-己烯、乙醛溶液、苯酚溶液
操作 现象 溴乙烷 乙醇 乙醛
加入新制的氢氧化铜,加热 分层 无明显现象 砖红色沉淀
加入酸性K2Cr2O7溶液、振荡 分层 变色 —
操作 现象 苯 甲苯 乙醇 1-己烯 乙醛溶液 苯酚溶液
加入饱和溴水,振荡 分层 分层 混溶 褪色 褪色 白色沉淀
加入酸性KMnO4溶液、振荡 分层 褪色 — 褪色 褪色 —
加入新制的氢氧化铜,加热 — — — — 砖红色沉淀 —
(1)燃烧
氧化反应
(2)催化氧化
(3)被弱氧化剂氧化
工业制乙酸:
①与银氨溶液
②与新制
Cu(OH)2
银氨溶液
AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3,
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
Δ
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
注意;醛基的检验必须在碱性环境下进行
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
Δ
(4)被强氧化剂氧化
可被酸性KMnO4溶液、酸性K2Cr2O7溶液、 溴水等氧化。
使溴水、酸性KMnO4溶液褪色的有机物
官能团试剂 碳碳双键 碳碳三键 苯的同系物 醇 酚 醛
溴水
酸性KMnO4溶液
注:“√”代表能褪色,“×”代表不能褪色。
√
√
√
√
√
√
√
√
√
√
×
×
→乙醛是有机合成工业中的重要原料,
3、乙醛的用途
主要用来生产乙酸、丁醇、乙酸乙酯等。如:
H
CH3
C
O
=
2
催化剂
△
+ O2
C
H
O
=
2CH3
O
CH≡CH + H2O
催化剂
△
CH3-CHO
2CH2=CH2 + O2
催化剂
2CH3-CHO
加热、加压
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
Cu
△
(1)乙醇氧化法:
(2)乙炔水化法:
(3)乙烯氧化法:
4、乙醛的工业制法:
还原(加H)
氧化(失H)
氧化(加O)
课堂练习4:分别写出以下转化反应的方程式。
乙醛
乙醇
乙酸
溴乙烷
CH3CH2 Br +NaOH → CH3CH2 OH +NaBr
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
CH3 CHO + H2 CH3 CH2OH
催化剂
△
2CH3CHO + O2 2CH3COOH
催化剂
△
取代(水解)
△
水
课堂练习5:(1)做乙醛被新制的氢氧化铜氧化的实验时,下列各步操作中:
①振荡后加入0.5 mL乙醛溶液;②加入10%的氢氧化钠溶液2 mL;③加入5%的CuSO4溶液4~5滴;④加热试管。正确的顺序是 。
(2)实验室配制少量银氨溶液的方法是:先向试管中加入 ,然后 ,其反应的化学方程为 、 ,向银氨溶液中滴加少量的乙醛, ,片刻即可在试管内壁形成银镜,化学方程式为 。
②③①④
少量的硝酸银溶液
边振荡试管逐滴滴加稀氨水使生成的沉淀恰好溶解为止
振荡后将试管放在热水浴中
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
醛的化学性质
R C C H
H
H
O
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜悬浊液)
d
+
d
-
课堂小结
乙醛
结构
物理性质
化学性质
加成反应
氧化反应
与氧气的反应:燃烧、催化氧化
被弱氧化剂(银氨溶液、新制的氢氧化铜)氧化
被强氧化剂(酸性高锰酸钾溶液或溴水)氧化
与H2、HCN、 NH3、R NH2、CH3O H等)反应
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
官能团:
醛基:
CHO
或
C
H
O
课堂达标
1.下列混合溶液可以用分液漏斗分离的一组是( )
A.乙醛和水 B.乙醛和乙醇 C.乙醇和水 D.苯和水
D
2.在实验室里不宜长期放置,应在使用前配置的溶液是( )
①酚酞试剂 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液 ⑤酸化的FeCl3溶液 ⑥硫化氢水溶液
C
A、只有②和④ B、除①之外 C、只有②④⑥ D、全部
3.有下列八种物质:
①乙酸 ②苯 ③聚乙烯 ④苯酚 ⑤2—丁炔 ⑥甲醛 ⑦邻二甲苯 ⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑧ B.④⑦⑧
C.④⑤⑥⑧ D.③④⑤⑦⑧
C
4.下列说法正确的是( )
A.间二氯苯只有一种,说明苯分子不存在单双键交替的结构
B.当极性分子与醛基加成时,带正电荷的原子与碳原子相连,带负电荷的原子与氧原子相连
C.实验室配制银氨溶液的方法是向稀氨水中逐滴滴入硝酸银溶液至过量
D.能发生银镜反应的有机物不一定是醛类
D
5.有机化合物A在一定条件下可发生以下转化:
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体。
(1)A、B、C的结构简式和名称依次是 、 、
。
(2)写出下列反应的化学方程式:
①A→B的化学方程式为 ;
②B→C的化学方程式为 ;
③B→A的化学方程式为 。
CH3CH2OH,乙醇 CH3CHO,乙醛
CH3COOH,乙酸
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
催化剂
△
2CH3CHO+O2
2CH3COOH
CH3CHO+H2
CH3CH2OH
催化剂
1mol-CHO ~ 2mol Ag
乙醛的性质
【知识回顾】
1mol-CHO ~ 1mol Cu2O
R—CHO
1.定义:
二、醛类
CH3CHO
H-CHO
OHC-CHO
OHC-CH2-CHO
注意:—CHO一定在碳链的一端
甲醛
CH3CH2-CHO
CH3CH2CH2-CHO
丁醛
乙二醛
丙二醛
CHO
苯甲醛
CH2=CH-CHO
丙烯醛
分子里由烃基(或氢原子)跟醛基相连而构成的化合物
丙醛
R
乙醛
1)据含醛基数目
一元醛
二元醛
多元醛
2)据含烃基
饱和脂肪醛
不饱和脂肪醛
脂肪醛
芳香醛
2.醛的分类
CH3CHO
OHC-CHO
苯甲醛
乙二醛
HCHO
甲醛
饱和一元醛的通式:
CnH2n+1-CHO
CnH2nO ( n≥1)
CHO
CH2=CH2-CHO
或者:
3、醛类的物理性质
加成反应
氧化反应
②催化氧化化为羧酸
羧酸(盐)
③被弱氧化剂氧化
①燃烧
CO2、H2O
银镜反应
新制Cu(OH)2
④能使酸性高锰酸钾、溴水褪色
(类似乙醛)
4.醛类的化学通性
(碳氧双键上的加成)
----还原反应
RCHO
+ H2
催化剂
△
RCH2OH
H
R
C
O
=
2
催化剂
△
+ O2
C
H
O
=
2R
O
—生成醇
醛+H2→醇
醛+HCN→羟基腈
-CHO、Ag、Cu2O的物质的量的关系
-CHO----- 2 Ag
1
2
1
R-CHO R-COOH
[O]
-CHO----Cu2O
1
强调:醛类在氧化反应中有关计量关系
二、醛类
1、甲醛(又称蚁醛)
无色、有强烈刺激性气味气体,易溶于水和有机溶剂,有毒。
常温下,烃的含氧衍生物中唯一的气态物质
2)物性:
1)分子式:
CH2O
结构式:
结构简式:
HCHO
空间构型:
平面三角形(4个原子共面)
福尔马林:
质量分数为35%~40%的甲醛水溶液(混合物)
3)用途:
4)危害:
具有防腐和杀菌能力。
②重要的有机合成原料:制药,香料,燃料、合成酚醛树脂。
①甲醛的水溶液(福尔马林)可用于消毒和浸制标本
福尔马林浸泡的鱼标本
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌。
新装修的房子,甲醛超标易诱发儿童白血病
——与乙醛相似
特殊点:
H—C—H
O=
甲醛中相当于有2个-CHO可被氧化。
5)甲醛的化学性质
结构决定性质
加成反应
H—C—H
O=
H—C-O-H
O=
[O]
[H2CO3]
甲醛的化学性质
③能起银镜反应,能与新制的氢氧化铜反应
①能被还原成甲醇
②能被氧化成甲酸(HCOOH)或碳酸
④能使酸性高锰酸钾、溴水褪色
H-O-C-O-H
O=
[O]
甲酸
HCHO + 2Ag(NH3)2OH HCOONH4 + 2Ag↓+ 3NH3 + H2O
△
HCHO + 2Cu(OH)2 + NaOH HCOONa + Cu2O↓+ 3H2O
△
HCHO + 4Ag(NH3)2OH (NH3)2CO3 + 4Ag↓+ 6NH3 + 2H2O
△
1mol甲醛发生银镜反应时最多可生成4molAg。
②甲醛与新制氢氧化铜反应
HCHO + 4Cu(OH)2 + 2NaOH Na2CO3 + 2Cu2O↓+ 6H2O
△
1mol甲醛与新制的氢氧化铜反应最多可生成2molCu2O
①甲醛发生银镜反应
(1)氧化反应:
酚醛缩聚反应
n
+ n HCHO
(水浴加热)
催化剂
OH
〔 〕
n
+(n-1)H2O
OH
CH2
H
OH
酚醛树脂
(3)与苯酚反应:
+ HCHO
OH
再缩聚
(2)加成反应:
HCHO+H2 CH3OH
催化剂
△
2、苯甲醛(俗称苦杏仁油)
1)组成和结构:
分子式:C6H7O
结构简式:
2)物理性质:
最简单的芳香醛,是一种有苦杏仁气味的无色液体
3)用途:
苯甲醛是制造染料、香料及药物的重要原料。
4)化学性质:
①加成反应(还原反应):与H2、HCN反应;
②氧化反应:
I、燃烧
II、被高锰酸钾、溴水等强氧化剂氧化
III、被银氨溶液、新制氢氧化铜等若氧化剂氧化
杏仁中含苯甲醛
【思考与讨论】
(1)由丙醛如何得到1﹣丙醇或丙酸?
(2)苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么?
CH3CH2CHO+H2
CH3CH2CH2OH
催化剂
2CH3CH2CHO+O2
2CH3CH2COOH
催化剂
△
+O2
CHO
2
COOH
2
苯甲醛中醛基受到苯环的影响,导致C一H键极性增强,易被空气中的O2氧化为羧基。
②再证明有碳碳双键:在加银氨溶液氧化-CHO后,调pH至酸性再加入溴水,溴水褪色。
课堂练习2:如何检验肉桂醛( )中醛基和碳碳双键?
-CH=CH-CHO
①先证明有醛基:加入银氨溶液后,水浴加热有银镜生成或加入新制Cu(OH)2后,加热后有砖红色沉淀生成,
-CH=CH-COONH4
+2Ag(NH3)2OH→
+2Ag↓+3NH3+H2O
-CH=CH-CHO
△
-CH=CH-COOH
+Br2→
-CHBrCHBr-COOH
-CH=CH-COONa
+2Cu(OH)2+NaOH→
+Cu2O↓+3H2O
-CH=CH-CHO
△
小结:醛类的化学性质
(与 H2 、HCN、氨及氨的衍生物、醇类等加成)
R C C H
H
H
O
加成反应
氧化反应
d
+
d
-
(1)加成反应
(2)氧化反应
Ⅰ.银镜反应
Ⅱ.与新制的氢氧化铜反应
③被弱氧化剂氧化
①燃烧
②催化氧化成羧酸
④使酸性KMnO4溶液、溴水褪色
含醛基类化合物的重要反应规律
醛的氧化与还原规律
R-CH2OH
R-CHO
R-CHOOH
催化氧化(O2)
氧化
还原(H2)
伯醇
相关定量计算
一元醛发生银镜反应或与新制的Cu(OH)2反应时,量的关系如下:
醛
4.下列混合溶液可以用分液漏斗分离的一组是( ) A.乙醛和水 B.乙醛和乙醇
C.乙醇和水 D.苯和水
D
5.在2HCHO+NaOH HCOONa + CH3OH中,HCHO ( )
A.仅被氧化 B.未被氧化,未被还原
C.仅被还原 D.既被氧化,又被还原
D
⑴含有碳碳双键、三键的有机物;
⑵ 苯的同系物的侧链被氧化成羧基而使其褪色;
⑶含有羟基、醛基的物质能发生氧化反应而使其褪色。
①能使酸性KMnO4溶液褪色的有机物:
知识点小结
②使溴水褪色的有机物有:
⑶与苯酚发生取代反应生成白色沉淀使溴水褪色。
⑵含有醛基的有机物发生氧化反应而褪色;
⑴含有碳碳双键、三键的有机物发生加成反应而褪色;
氧化反应
第三节 醛 酮
第一课时
乙醛
第三章 烃的衍生物
新课导入
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌 。
新装修的房子,甲醛超标易诱发儿童白血病
生活中的醛
自然界的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用。
生活中的醛
苯甲醛
肉桂醛
醛:羰基碳原子分别与氢原子和烃基(或氢原子)相连。
官能团是醛基( 或 —CHO )。
醛和酮都是分子中含有羰基( )的化合物。
酮:与羰基碳原子相连的两个基团均为烃基,烃基可以相同也可以不同。
官能团是酮羰基( )。
C
O
醛和酮的结构:
O
=
—C—H
饱和一元醛的通式:
CnH2nO
CH3CH2CHO
O
=
—C—
CH3 CH3
C
O
饱和一元酮的通式:
CnH2nO
分子中碳原子数相同的饱和一元醛和饱和一元酮互为同分异构体。
结构式:
分子式:
结构简式:
或
H
H
H
H
C
C
O
=
C2H4O
1.乙醛的分子结构
CH3CHO
H
CH3
C
O
=
官能团:
醛基
CHO
或
乙醛球棍模型
C
H
O
=
能否写成-COH 或-CH=O
空间填充模型
→认识醛类中具有代表性的醛-乙醛
电子式:
醛基上的碳原子采用sp2杂化,夹角接近120°,与其相连的原子在同一平面。
核磁共振氢谱:
一、乙醛
2、乙醛的物理性质
①无色、有刺激性气味的液体;
②密度比水小,沸点是20.8℃;
③易挥发,易燃烧;
④易溶于水、乙醇、乙醚、氯仿等有机溶剂。
思考:乙醛为什么易溶于水?随着碳原子数的增多,醛的溶解性如何变化?
随着碳原子数的增多,醛的溶解度逐渐减小。在水中微溶或不溶。
(乙醛与水分子间存在氢键)
3-化学性质
结构决定性质
C=O影响C-H键极性强,易断裂
酮羰基碳不饱和C=O双键易断裂
氧化性
O
C
H
O
C
H
还原性
(1)加成反应
①催化加氢(还原反应):
催化剂
C
C
O
H
H
H
H
+ H—H
C
C
O
H
H
H
H
H
H
CH3CHO+H2
CH3CH2OH
催化剂
在醛基中,由于氧原子电负性较大,碳氧双键中电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛能和极性试剂(如:H CN、 NH3、R NH2、CH3O H等)发生加成反应。
C
O
H
δ-
δ+
有机物得氢或去氧, 发生还原反应;有机物得氧或去氢, 发生氧化反应
②与HCN加成
δ+
δ-
+H—CN →
—C—CN
OH
α-羟基腈
应用:醛与氢氰酸加成,在有机合成中可以用来增长碳链。
CH3─C─H
O
δ+
δ
+ H─CN→
δ
δ+
CH3─CH─CN
OH
2 羟基丙腈
(课本P67)提示:当极性分子与醛基发生加成反应时,
带正电荷的原子或原子团连接在______上,
带负电荷的原子或原子团连接在______上。
O原子
C原子
与-CHO 加成时:
1、加成反应(C=O双键上的加成)
三. 乙醛的化学性质
(2)与HCN(氢氰酸)加成
CH3—C—H+H—CN→
O
=
→应用:在有机合成中可以用来增长碳链。
2-羟基丙腈
δ-
δ+
(课本P67)提示:当极性分子与醛基发生加成反应时,
带正电荷的原子或原子团连接在______上,
带负电荷的原子或原子团连接在______上。
O原子
C原子
CH3—CH—COOH
OH
水解反应
qíng
(jīng)
H2O,H+
催化剂
与-CHO 加成时:
③与NH3、RNH2(胺)加成:
C
O
H
CH3
+ H—NH2
δ-
δ+
δ-
δ+
C
OH
H
CH3
NH2
2-羟基乙胺
④与醇类加成:
C
O
H
CH3
+ H—NHCH3
δ-
δ+
δ-
δ+
C
OH
H
CH3
NHCH3
C
O
H
CH3
+ H—OCH2CH3
δ-
δ+
δ-
δ+
C
OH
H
CH3
OCH2CH3
注意 :①乙醛不能与X2、HX、H2O进行加成反应②酯基(-COO-)和羧基 (-COOH) 中的C=O不能与H2发生加成反应
写出下列物质发生加成反应的化学方程式。
C
HO
+ H2
CH2OH
H
CH3
C
O
+ CH3OH
H
CH3
C
OH
OCH3
Ni
△
Ni
△
醛基(-CHO)具有较强还原性,易被氧化,产物通常为相应的羧酸
(2)与银氨溶液的反应
(5)与溴水的反应
(4)与KMnO4(H+)、 K2Cr2O7(H+)溶液的反应
(3)与新制Cu(OH)2悬浊液反应
(1)与 O2 的反应
弱氧化剂
2. 乙醛的氧化反应
三. 乙醛的化学性质
H
CH3
C
O
=
O
C
H
O
=
CH3
[O]
2CH3CHO+5O2 4CO2+4H2O
点燃
①可燃性
②催化氧化
在催化剂作用下,被空气中的氧气氧化为乙酸
(1)与O2的反应
2CH3CHO+O2 2CH3COOH
催化剂
小结:CH3CH2OH CH3CHO CH3COOH
氧化
还原
氧化
2. 乙醛的氧化反应
三. 乙醛的化学性质
(淡蓝色火焰)
应用:工业制备乙酸
被溴水氧化
被酸性KMnO4 、
酸性K2Cr2O7 氧化
3) 被溴水氧化:
4) 被酸性KMnO4 / K2Cr2O7 氧化:
CH3CHO + Br2 + H2O →
CH3COOH + 2HBr
溶液 褪色
R-C—O—H
=
O
R-C—H
=
O
被氧化
酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等
被强氧化剂氧化:
[提示]必须是溴水,溴的CCl4溶液不会氧化醛基,因为其中不含氧
实验方案:在洁净的试管中加入1 ml 2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】P67
(2)与银氨溶液的反应(银镜反应)
2. 乙醛的氧化反应
三. 乙醛的化学性质
(2)氧化反应
【实验3-7】
实验操作
实验现象 向①中滴加氨水,现象为 ,加入乙醛,水浴加热一段时间后,试管内壁出现一层___________
先产生白色沉淀后变澄清
光亮的银镜
Ⅰ.银镜反应
配制银氨溶液
不可反滴
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
反应生成羧酸铵,还有一水二银三个氨
巧记
相关反应化学方程式:
氢氧化二氨合银
改写为离子方程式:
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
Ag++NH3·H2O=AgOH ↓+ NH4+
(银氨络离子)
CH3CHO + 2 [Ag(NH3)2]++2OH- CH3COO-+NH4 ++ 2Ag↓+ 3NH3 + H2O
△
实质:
乙醛中的醛基被银氨溶液+1价的银氧化成羧基,又和氨气反应生成铵盐,表现醛基具有还原性 。
无↑,因NH3极易溶于水
应用:
⑴试管内壁应洁净(先用热NaOH溶液,再用蒸馏水);
⑵须用新配制的银氨溶液(因久置的银氨溶液会生成易爆炸的叠氮化银AgN3),配制银氨溶液时,氨水要稍过量,以保证反应在弱碱性条件下进行(不能太多否则会生成易爆炸的雷酸银);
⑶必须用水浴加热(60℃),不能用酒精灯加热,加热时不可振荡或摇动试管;
问题:如何处理试管内壁上的银?
银镜用稀HNO3浸泡,再清洗
Ag +
HNO3
=
AgNO3
+ NO↑
+ H2O
(稀)
3 4 3 2
实验注意事项:
1)此反应可以用于检验醛基的存在和测定醛基的个数
2)制镜或保温瓶胆
(实际用含醛基的葡萄糖)
定量:
1mol -CHO ~ 2mol [Ag(NH3)2]OH ~ 2mol Ag
课堂练习1、下列有关银镜反应实验的说法不正确的是( )
A.实验前先用热的烧碱溶液洗涤有油脂的试管,再用蒸馏水洗涤
B.向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,
配得银氨溶液
C.采用水浴加热,不能直接加热
D.可用浓盐酸洗去银镜
D
实验方案:在试管里加入2 ml10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 ml乙醛溶液,加热。观察实验现象。
【实验3-8】P67
(3)与新制的Cu(OH)2悬浊液反应
2. 乙醛的氧化反应
三. 乙醛的化学性质
【实验3-8】
Ⅱ.乙醛与新制的氢氧化铜反应
实验操作
实验现象 A中溶液出现 ,滴入乙醛,加热至沸腾后,C中溶液有产生 。
蓝色絮状沉淀
砖红色沉淀
相关反应化学方程式:
CuSO4+ 2NaOH = Cu(OH)2 ↓ +Na2SO4
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
砖红色
蓝色絮状沉淀
离子方程式:
Cu2++ 2OH- = Cu(OH)2↓
CH3CHO + 2Cu(OH)2 + 2OH- CH3COO- + Cu2O↓ + 3H2O
△
实质:
乙醛中的醛基被新制备的氢氧化铜中+2价的铜氧化成羧基,又和过量的氢氧化钠反应生成钠盐,表现醛基具有还原性 。
a、必须用新制的Cu(OH)2:
一方面,新制的Cu(OH)2为絮状物,跟醛的接触面积大
另一方面,久置的Cu(OH)2,易转变成Cu2(OH)2CO3
b、制备Cu(OH)2时,NaOH必须过量,且质量分数要大些,这样形成的Cu(OH)2能加快乙醛的氧化使现象明显
c、该反应必须加热到沸腾,才有明显的红色沉淀产生,但不能太久,否则会有黑色的沉淀CuO生成
实验注意事项及应用:
2)医学上检验病人是否患糖尿病(检查葡萄糖的醛基)
应用:
思考:该反应有什么用途?
1)检验醛基并测定醛基的个数
+ NaOH
CH3CHO +2Cu(OH)2
△
CH3COONa + Cu2O↓+ H2O
3
定量:
1mol —CHO → 2mol Cu(OH)2 → 1mol Cu2O
糖尿病患者的糖代谢功能紊乱,其血液或尿液中的葡萄糖含量会超出正常范围。通过检测患者血液或尿液中葡萄糖的含量,可诊断患者的病情。在医院中可用仪器测量,在家中可根据葡萄糖特征反应原理制备的试纸对尿液进行检验。
资料卡片
小结:醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
(3)加热至沸腾,但温度不能过高
知识归纳:
如何检验醛基的存在?
(1)与新制的银氨溶液反应有光亮的银镜生成
如何检验苯酚的存在?
方法一:苯酚与浓溴水取代反应;
方法二:苯酚与FeCl3的显色反应。
(2)与新制的Cu(OH)2共热煮沸有砖红色沉淀生成
知识回顾:
课堂练习2、某学生做乙醛的还原性实验时,取1 mol/LCuSO4溶液和0.5 mol/L NaOH溶液各1 ml,在一支洁净的试管内混合后,向其中又加入0.5 ml 40%的乙醛溶液,加热,结果无砖红色沉淀出现。导致该实验失败的原因可能是( )
A.加入NaOH溶液的量不够 B.加入乙醛的量太少
C.加入CuSO4溶液的量不够 D.加入乙醛的量太多
A
【思考与讨论】 乙醇、乙醛和乙酸三者之间的转化关系如下图所示,请结合具体反应和三者的分子结构、官能团的变化情况,谈谈有机反应中的氧化反应和还原反应的特点。
氧化
乙醛
还原
乙醇
氧化
乙酸
O—H
H
H—C—C—
H
H
H
H—C—C=O
H
H
H
C
O
H
CH3
C
O
H
CH3
O
C
C
O
H
H
H
H
C
C
O
H
H
H
H
H
H
氧化
氧化
还原
脱氢
加氧
加氢
有机氧化反应:
加氧脱氢
有机还原反应:
加氢脱氧
课堂练习3(课本P72 T6):用化学方法鉴别下列各组物质。
(1)溴乙烷、乙醇、乙醛;
(2)苯、甲苯、乙醇、1-己烯、乙醛溶液、苯酚溶液
操作 现象 溴乙烷 乙醇 乙醛
加入新制的氢氧化铜,加热 分层 无明显现象 砖红色沉淀
加入酸性K2Cr2O7溶液、振荡 分层 变色 —
操作 现象 苯 甲苯 乙醇 1-己烯 乙醛溶液 苯酚溶液
加入饱和溴水,振荡 分层 分层 混溶 褪色 褪色 白色沉淀
加入酸性KMnO4溶液、振荡 分层 褪色 — 褪色 褪色 —
加入新制的氢氧化铜,加热 — — — — 砖红色沉淀 —
(1)燃烧
氧化反应
(2)催化氧化
(3)被弱氧化剂氧化
工业制乙酸:
①与银氨溶液
②与新制
Cu(OH)2
银氨溶液
AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3,
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
Δ
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
注意;醛基的检验必须在碱性环境下进行
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
Δ
(4)被强氧化剂氧化
可被酸性KMnO4溶液、酸性K2Cr2O7溶液、 溴水等氧化。
使溴水、酸性KMnO4溶液褪色的有机物
官能团试剂 碳碳双键 碳碳三键 苯的同系物 醇 酚 醛
溴水
酸性KMnO4溶液
注:“√”代表能褪色,“×”代表不能褪色。
√
√
√
√
√
√
√
√
√
√
×
×
→乙醛是有机合成工业中的重要原料,
3、乙醛的用途
主要用来生产乙酸、丁醇、乙酸乙酯等。如:
H
CH3
C
O
=
2
催化剂
△
+ O2
C
H
O
=
2CH3
O
CH≡CH + H2O
催化剂
△
CH3-CHO
2CH2=CH2 + O2
催化剂
2CH3-CHO
加热、加压
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
Cu
△
(1)乙醇氧化法:
(2)乙炔水化法:
(3)乙烯氧化法:
4、乙醛的工业制法:
还原(加H)
氧化(失H)
氧化(加O)
课堂练习4:分别写出以下转化反应的方程式。
乙醛
乙醇
乙酸
溴乙烷
CH3CH2 Br +NaOH → CH3CH2 OH +NaBr
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
CH3 CHO + H2 CH3 CH2OH
催化剂
△
2CH3CHO + O2 2CH3COOH
催化剂
△
取代(水解)
△
水
课堂练习5:(1)做乙醛被新制的氢氧化铜氧化的实验时,下列各步操作中:
①振荡后加入0.5 mL乙醛溶液;②加入10%的氢氧化钠溶液2 mL;③加入5%的CuSO4溶液4~5滴;④加热试管。正确的顺序是 。
(2)实验室配制少量银氨溶液的方法是:先向试管中加入 ,然后 ,其反应的化学方程为 、 ,向银氨溶液中滴加少量的乙醛, ,片刻即可在试管内壁形成银镜,化学方程式为 。
②③①④
少量的硝酸银溶液
边振荡试管逐滴滴加稀氨水使生成的沉淀恰好溶解为止
振荡后将试管放在热水浴中
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
醛的化学性质
R C C H
H
H
O
加成反应
(与 H2 、HCN、氨及氨的衍生物、醇类等)
氧化反应
(酸性 KMnO4 溶液)
( O2,催化剂)
(银氨溶液)
(新制氢氧化铜悬浊液)
d
+
d
-
课堂小结
乙醛
结构
物理性质
化学性质
加成反应
氧化反应
与氧气的反应:燃烧、催化氧化
被弱氧化剂(银氨溶液、新制的氢氧化铜)氧化
被强氧化剂(酸性高锰酸钾溶液或溴水)氧化
与H2、HCN、 NH3、R NH2、CH3O H等)反应
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓ + 3H2O
△
CH3CHO + 2Ag(NH3)2OH CH3COONH4 + 2Ag↓+ 3NH3 + H2O
△
官能团:
醛基:
CHO
或
C
H
O
课堂达标
1.下列混合溶液可以用分液漏斗分离的一组是( )
A.乙醛和水 B.乙醛和乙醇 C.乙醇和水 D.苯和水
D
2.在实验室里不宜长期放置,应在使用前配置的溶液是( )
①酚酞试剂 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液 ⑤酸化的FeCl3溶液 ⑥硫化氢水溶液
C
A、只有②和④ B、除①之外 C、只有②④⑥ D、全部
3.有下列八种物质:
①乙酸 ②苯 ③聚乙烯 ④苯酚 ⑤2—丁炔 ⑥甲醛 ⑦邻二甲苯 ⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑧ B.④⑦⑧
C.④⑤⑥⑧ D.③④⑤⑦⑧
C
4.下列说法正确的是( )
A.间二氯苯只有一种,说明苯分子不存在单双键交替的结构
B.当极性分子与醛基加成时,带正电荷的原子与碳原子相连,带负电荷的原子与氧原子相连
C.实验室配制银氨溶液的方法是向稀氨水中逐滴滴入硝酸银溶液至过量
D.能发生银镜反应的有机物不一定是醛类
D
5.有机化合物A在一定条件下可发生以下转化:
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体。
(1)A、B、C的结构简式和名称依次是 、 、
。
(2)写出下列反应的化学方程式:
①A→B的化学方程式为 ;
②B→C的化学方程式为 ;
③B→A的化学方程式为 。
CH3CH2OH,乙醇 CH3CHO,乙醛
CH3COOH,乙酸
2CH3CH2OH + O2 + 2H2O
2CH3-CHO
催化剂
△
2CH3CHO+O2
2CH3COOH
CH3CHO+H2
CH3CH2OH
催化剂
1mol-CHO ~ 2mol Ag
乙醛的性质
【知识回顾】
1mol-CHO ~ 1mol Cu2O
R—CHO
1.定义:
二、醛类
CH3CHO
H-CHO
OHC-CHO
OHC-CH2-CHO
注意:—CHO一定在碳链的一端
甲醛
CH3CH2-CHO
CH3CH2CH2-CHO
丁醛
乙二醛
丙二醛
CHO
苯甲醛
CH2=CH-CHO
丙烯醛
分子里由烃基(或氢原子)跟醛基相连而构成的化合物
丙醛
R
乙醛
1)据含醛基数目
一元醛
二元醛
多元醛
2)据含烃基
饱和脂肪醛
不饱和脂肪醛
脂肪醛
芳香醛
2.醛的分类
CH3CHO
OHC-CHO
苯甲醛
乙二醛
HCHO
甲醛
饱和一元醛的通式:
CnH2n+1-CHO
CnH2nO ( n≥1)
CHO
CH2=CH2-CHO
或者:
3、醛类的物理性质
加成反应
氧化反应
②催化氧化化为羧酸
羧酸(盐)
③被弱氧化剂氧化
①燃烧
CO2、H2O
银镜反应
新制Cu(OH)2
④能使酸性高锰酸钾、溴水褪色
(类似乙醛)
4.醛类的化学通性
(碳氧双键上的加成)
----还原反应
RCHO
+ H2
催化剂
△
RCH2OH
H
R
C
O
=
2
催化剂
△
+ O2
C
H
O
=
2R
O
—生成醇
醛+H2→醇
醛+HCN→羟基腈
-CHO、Ag、Cu2O的物质的量的关系
-CHO----- 2 Ag
1
2
1
R-CHO R-COOH
[O]
-CHO----Cu2O
1
强调:醛类在氧化反应中有关计量关系
二、醛类
1、甲醛(又称蚁醛)
无色、有强烈刺激性气味气体,易溶于水和有机溶剂,有毒。
常温下,烃的含氧衍生物中唯一的气态物质
2)物性:
1)分子式:
CH2O
结构式:
结构简式:
HCHO
空间构型:
平面三角形(4个原子共面)
福尔马林:
质量分数为35%~40%的甲醛水溶液(混合物)
3)用途:
4)危害:
具有防腐和杀菌能力。
②重要的有机合成原料:制药,香料,燃料、合成酚醛树脂。
①甲醛的水溶液(福尔马林)可用于消毒和浸制标本
福尔马林浸泡的鱼标本
为求延长保质期 不良奸商竟然给冰鲜鱼浸甲醛保鲜,食用甲醛过量会休克和致癌。
新装修的房子,甲醛超标易诱发儿童白血病
——与乙醛相似
特殊点:
H—C—H
O=
甲醛中相当于有2个-CHO可被氧化。
5)甲醛的化学性质
结构决定性质
加成反应
H—C—H
O=
H—C-O-H
O=
[O]
[H2CO3]
甲醛的化学性质
③能起银镜反应,能与新制的氢氧化铜反应
①能被还原成甲醇
②能被氧化成甲酸(HCOOH)或碳酸
④能使酸性高锰酸钾、溴水褪色
H-O-C-O-H
O=
[O]
甲酸
HCHO + 2Ag(NH3)2OH HCOONH4 + 2Ag↓+ 3NH3 + H2O
△
HCHO + 2Cu(OH)2 + NaOH HCOONa + Cu2O↓+ 3H2O
△
HCHO + 4Ag(NH3)2OH (NH3)2CO3 + 4Ag↓+ 6NH3 + 2H2O
△
1mol甲醛发生银镜反应时最多可生成4molAg。
②甲醛与新制氢氧化铜反应
HCHO + 4Cu(OH)2 + 2NaOH Na2CO3 + 2Cu2O↓+ 6H2O
△
1mol甲醛与新制的氢氧化铜反应最多可生成2molCu2O
①甲醛发生银镜反应
(1)氧化反应:
酚醛缩聚反应
n
+ n HCHO
(水浴加热)
催化剂
OH
〔 〕
n
+(n-1)H2O
OH
CH2
H
OH
酚醛树脂
(3)与苯酚反应:
+ HCHO
OH
再缩聚
(2)加成反应:
HCHO+H2 CH3OH
催化剂
△
2、苯甲醛(俗称苦杏仁油)
1)组成和结构:
分子式:C6H7O
结构简式:
2)物理性质:
最简单的芳香醛,是一种有苦杏仁气味的无色液体
3)用途:
苯甲醛是制造染料、香料及药物的重要原料。
4)化学性质:
①加成反应(还原反应):与H2、HCN反应;
②氧化反应:
I、燃烧
II、被高锰酸钾、溴水等强氧化剂氧化
III、被银氨溶液、新制氢氧化铜等若氧化剂氧化
杏仁中含苯甲醛
【思考与讨论】
(1)由丙醛如何得到1﹣丙醇或丙酸?
(2)苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么?
CH3CH2CHO+H2
CH3CH2CH2OH
催化剂
2CH3CH2CHO+O2
2CH3CH2COOH
催化剂
△
+O2
CHO
2
COOH
2
苯甲醛中醛基受到苯环的影响,导致C一H键极性增强,易被空气中的O2氧化为羧基。
②再证明有碳碳双键:在加银氨溶液氧化-CHO后,调pH至酸性再加入溴水,溴水褪色。
课堂练习2:如何检验肉桂醛( )中醛基和碳碳双键?
-CH=CH-CHO
①先证明有醛基:加入银氨溶液后,水浴加热有银镜生成或加入新制Cu(OH)2后,加热后有砖红色沉淀生成,
-CH=CH-COONH4
+2Ag(NH3)2OH→
+2Ag↓+3NH3+H2O
-CH=CH-CHO
△
-CH=CH-COOH
+Br2→
-CHBrCHBr-COOH
-CH=CH-COONa
+2Cu(OH)2+NaOH→
+Cu2O↓+3H2O
-CH=CH-CHO
△
小结:醛类的化学性质
(与 H2 、HCN、氨及氨的衍生物、醇类等加成)
R C C H
H
H
O
加成反应
氧化反应
d
+
d
-
(1)加成反应
(2)氧化反应
Ⅰ.银镜反应
Ⅱ.与新制的氢氧化铜反应
③被弱氧化剂氧化
①燃烧
②催化氧化成羧酸
④使酸性KMnO4溶液、溴水褪色
含醛基类化合物的重要反应规律
醛的氧化与还原规律
R-CH2OH
R-CHO
R-CHOOH
催化氧化(O2)
氧化
还原(H2)
伯醇
相关定量计算
一元醛发生银镜反应或与新制的Cu(OH)2反应时,量的关系如下:
醛
4.下列混合溶液可以用分液漏斗分离的一组是( ) A.乙醛和水 B.乙醛和乙醇
C.乙醇和水 D.苯和水
D
5.在2HCHO+NaOH HCOONa + CH3OH中,HCHO ( )
A.仅被氧化 B.未被氧化,未被还原
C.仅被还原 D.既被氧化,又被还原
D
⑴含有碳碳双键、三键的有机物;
⑵ 苯的同系物的侧链被氧化成羧基而使其褪色;
⑶含有羟基、醛基的物质能发生氧化反应而使其褪色。
①能使酸性KMnO4溶液褪色的有机物:
知识点小结
②使溴水褪色的有机物有:
⑶与苯酚发生取代反应生成白色沉淀使溴水褪色。
⑵含有醛基的有机物发生氧化反应而褪色;
⑴含有碳碳双键、三键的有机物发生加成反应而褪色;
氧化反应
