化学人教版(2019)选择性必修2 3.3.3金属晶体与离子晶体(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.3金属晶体与离子晶体(共28张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 00:34:34 | ||
图片预览




文档简介
(共28张PPT)
第三节 金属晶体与离子晶体
第三课时
过渡晶体与混合型晶体
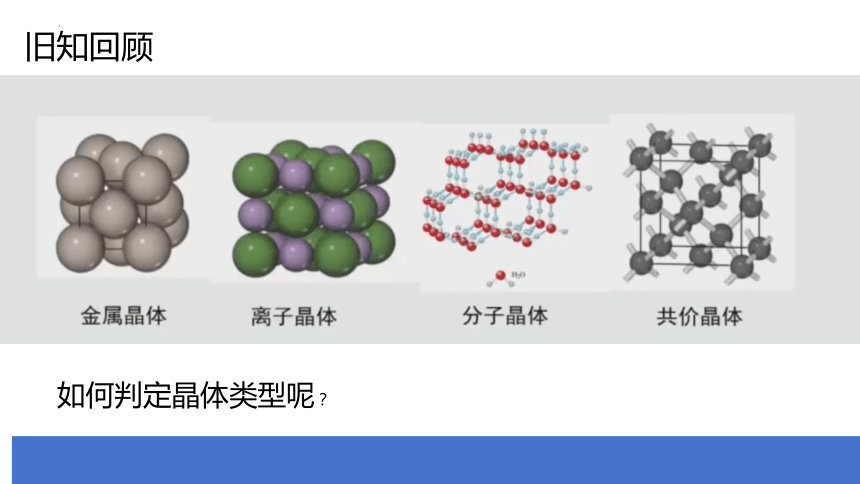
旧知回顾
如何判定晶体类型呢?
1.根据晶体的概念判断
离子晶体 通过阴、阳离子相互作用形成的晶体
分子晶体 由分子通过分子间作用力形成的晶体
共价晶体 由原子通过共价键形成的晶体
金属晶体 由金属阳离子和自由电子通过金属键形成的晶体
2.根据物质的类别判断
离子晶体 金属氧化物、强碱和绝大多数盐类
分子晶体 大部分非金属单质(除金刚石、石墨、晶体硅、晶体硼等外)、气态氢化物、非金属氧化物(除SiO2外)、酸和大多数有机物(除有机盐外)
共价晶体 金刚石、晶体硼、SiC和SiO2等
金属晶体 纯金属、大量的合金
3.根据晶体的特征性质判断
离子晶体 熔、沸点较高,且在熔融状态下导电的化合物
分子晶体 熔、沸点较低且不导电的单质和化合物,溶解性符合“相似相溶”规律
共价晶体 熔、沸点很高,硬度很大,不导电,不溶于一般溶剂的物质
金属晶体 有延展性、导电性、导热性,熔、沸点一般较高
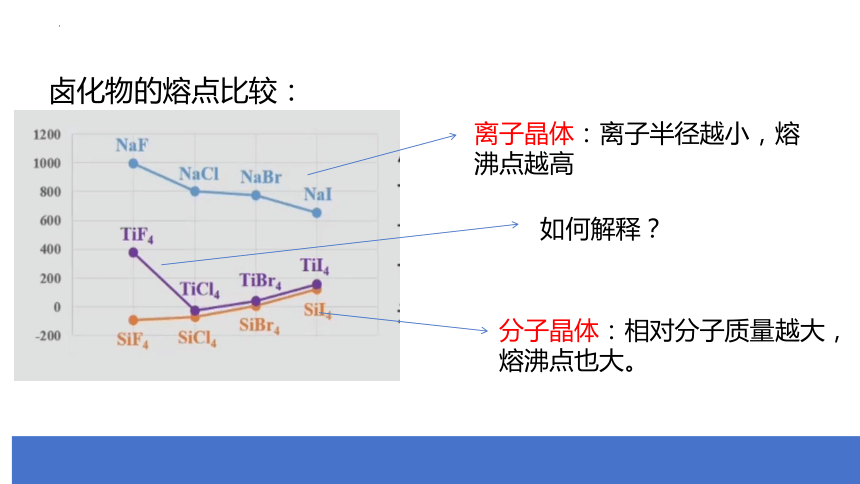
卤化物的熔点比较:
离子晶体:离子半径越小,熔沸点越高
分子晶体:相对分子质量越大,熔沸点也大。
如何解释?
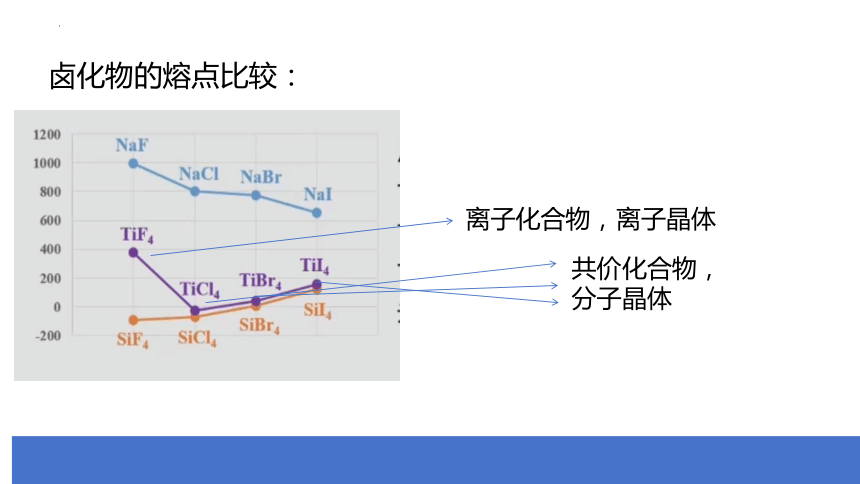
卤化物的熔点比较:
离子化合物,离子晶体
共价化合物,
分子晶体
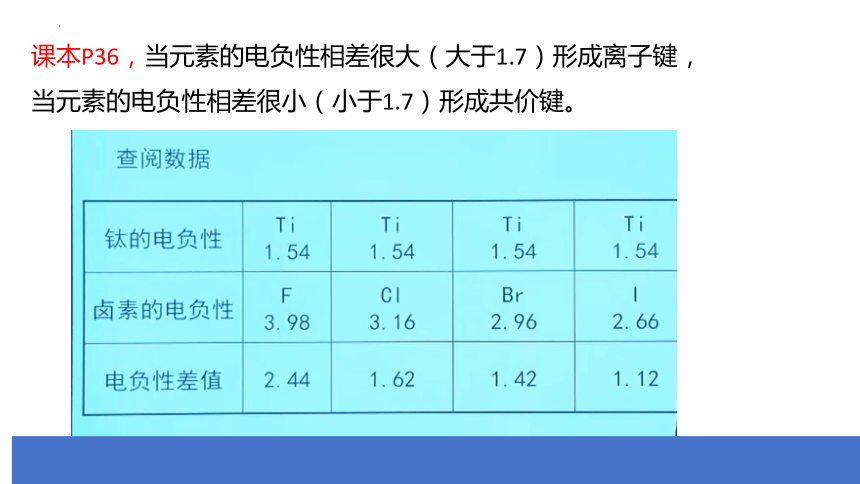
课本P36,当元素的电负性相差很大(大于1.7)形成离子键,
当元素的电负性相差很小(小于1.7)形成共价键。
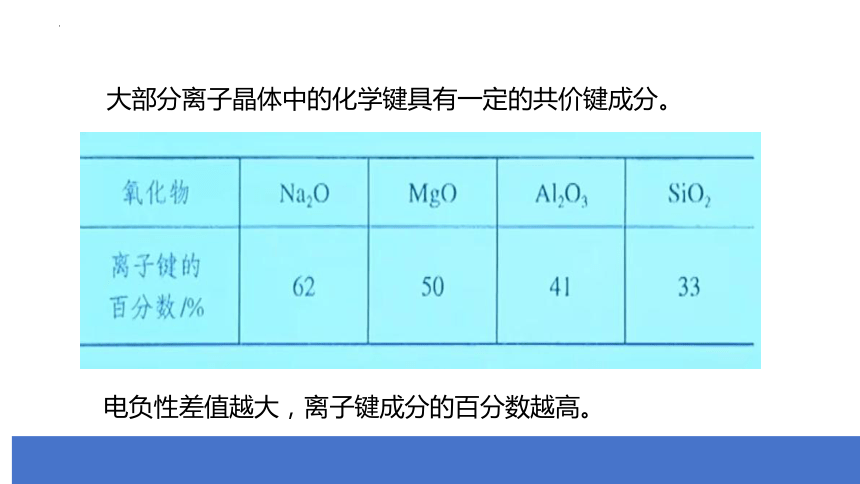
大部分离子晶体中的化学键具有一定的共价键成分。
电负性差值越大,离子键成分的百分数越高。
过渡晶体
离子晶体
共价晶体
分子晶体
Na2O
离子
晶体
MgO
离子
晶体
Al2O3
共价
晶体
SiO2
共价晶体
P2O5
分子
晶体
SO3
分子
晶体
Cl2O7
分子
晶体
Al2O3的熔点是2054,AlCl3的熔点是192.6,请问AlCl3是什么晶体?
AlCl3的导电性随温度变化曲线
氯化铝处于熔融态时,以二聚体Al2Cl6的形式存在
结论:AlCl3为过渡晶体
混合型晶体——
石墨晶体的结构与特性
1.石墨晶体具有层状结构(如图所示)
2.每个碳原子用sp2杂化轨道与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构;
3.每个碳原子还有1个与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,因此能够形成遍及整个平面的大π键。
4.电子可以在整个六边形网状平面上运动,因此石墨的大π键具有金属键的性质,这就是石墨沿层的平行方向导电性强的原因。
5.这些网络状的平面结构以范德华力结合形成层状结构,这样,石墨晶体中既有共价键,又有范德华力,同时还有类似金属键的作用力。因此石墨晶体是一种混合型晶体。
在石墨晶体中,每个碳原子参与了3个C—C键的形成,每个C—C键被2个碳原子共用,每个碳原子被3个正六边形共用,故每个正六边形平均占有的碳原子数为6×3(1)=2,碳原子个数与C—C键键数之比为1∶(3×2(1))=2∶3。
石墨晶体独特的性质
(1)导电性:石墨的导电性只能沿着石墨平面的方向。
(2)润滑性:用作润滑剂、铅笔笔芯等。
(3)石墨的熔、沸点很高,石墨的熔点比金刚石还高。
归纳总结
1.(2023·全国乙卷节选)已知一些物质的熔点数据如下表:
物质 熔点/℃
NaCl 800.7
SiCl4 -68.8
GeCl4 -51.5
SnCl4 -34.1
[练4] 中科院的科学家已研制出一种高性能超级电容器电极材料——氮掺杂有序介孔石墨烯,该材料可用作电动车的“超强电池”,充电只需7秒钟,即可续航35公里。下面有关石墨晶体的说法错误的是( )
A.石墨晶体中既有共价键又有分子间作用力
B.石墨晶体熔、沸点很高,硬度很大
C.石墨晶体中每个六边形平均含2个完整碳原子
D.石墨晶体中,每个C原子被3个六元环共用
答案
解析
[练5] 金刚石、石墨、C60和石墨烯的结构示意图分别如图所示,下列说法不正确的是( )
A.金刚石和石墨烯中碳原子的杂化方式不同
B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体
C.这四种物质完全燃烧后的产物都是CO2
D.石墨与C60的晶体类型相同
答案
解析 C60是分子晶体,石墨是混合型晶体。
解析
[练6] 石墨的片层结构如图所示,请回答下列问题。
(1)一个六元环实际含有________个碳原子。
(2)石墨晶体每一层内碳原子数与C—C键数、
六元环数之比是________。
(3)设NA为阿伏加德罗常数的值。n g碳原子形成如图所示的六元环的个数为________。
答案
2
2∶3∶1
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________________________________。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因________________________
______________________________________________________________________________________________________________________________________________________________________________________。SiCl4的空间结构为_________,其中Si的轨道杂化形式为________。
答案
氯化钠为离子晶体,而SiCl4为分子晶体
随着同族元素的电子层数的增多,其熔点依次升高,其原因是:SiCl4、GeCl4、SnCl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大
正四面体
sp3
2.(2022·全国乙卷节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为________。解释X的熔点比Y高的原因________________________________。
答案
CsCl
CsCl为离子晶体,ICl为分子晶体
解析
解析 CsICl2发生非氧化还原反应,各元素化合价不变,生成无色晶体和红棕色液体,则无色晶体为CsCl,红棕色液体为ICl,而CsCl为离子晶体,熔化时克服的是离子键,ICl为分子晶体,熔化时克服的是分子间作用力,因此CsCl的熔点比ICl高。
3.(2021·山东高考节选)O、F、Cl电负性由大到小的顺序为______________;OF2分子的空间构型为________;OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是________________________
___________________________________________________。
答案
F>O>Cl
角(V)形
低于
OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高
解析
4.(1)(2020·全国卷Ⅱ节选)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_________________________________________________________________________________________________。
答案
TiF4为离子晶体,熔点高,其他三种均为分子晶体,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)(2020·山东高考节选)NH3、PH3、AsH3的沸点由高到低的顺序为__________________(填化学式,下同),还原性由强到弱的顺序为__________________。
T NH3、AsH3、PH3
AsH3、PH3、NH3
解析
答案
第三节 金属晶体与离子晶体
第三课时
过渡晶体与混合型晶体
旧知回顾
如何判定晶体类型呢?
1.根据晶体的概念判断
离子晶体 通过阴、阳离子相互作用形成的晶体
分子晶体 由分子通过分子间作用力形成的晶体
共价晶体 由原子通过共价键形成的晶体
金属晶体 由金属阳离子和自由电子通过金属键形成的晶体
2.根据物质的类别判断
离子晶体 金属氧化物、强碱和绝大多数盐类
分子晶体 大部分非金属单质(除金刚石、石墨、晶体硅、晶体硼等外)、气态氢化物、非金属氧化物(除SiO2外)、酸和大多数有机物(除有机盐外)
共价晶体 金刚石、晶体硼、SiC和SiO2等
金属晶体 纯金属、大量的合金
3.根据晶体的特征性质判断
离子晶体 熔、沸点较高,且在熔融状态下导电的化合物
分子晶体 熔、沸点较低且不导电的单质和化合物,溶解性符合“相似相溶”规律
共价晶体 熔、沸点很高,硬度很大,不导电,不溶于一般溶剂的物质
金属晶体 有延展性、导电性、导热性,熔、沸点一般较高
卤化物的熔点比较:
离子晶体:离子半径越小,熔沸点越高
分子晶体:相对分子质量越大,熔沸点也大。
如何解释?
卤化物的熔点比较:
离子化合物,离子晶体
共价化合物,
分子晶体
课本P36,当元素的电负性相差很大(大于1.7)形成离子键,
当元素的电负性相差很小(小于1.7)形成共价键。
大部分离子晶体中的化学键具有一定的共价键成分。
电负性差值越大,离子键成分的百分数越高。
过渡晶体
离子晶体
共价晶体
分子晶体
Na2O
离子
晶体
MgO
离子
晶体
Al2O3
共价
晶体
SiO2
共价晶体
P2O5
分子
晶体
SO3
分子
晶体
Cl2O7
分子
晶体
Al2O3的熔点是2054,AlCl3的熔点是192.6,请问AlCl3是什么晶体?
AlCl3的导电性随温度变化曲线
氯化铝处于熔融态时,以二聚体Al2Cl6的形式存在
结论:AlCl3为过渡晶体
混合型晶体——
石墨晶体的结构与特性
1.石墨晶体具有层状结构(如图所示)
2.每个碳原子用sp2杂化轨道与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构;
3.每个碳原子还有1个与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,因此能够形成遍及整个平面的大π键。
4.电子可以在整个六边形网状平面上运动,因此石墨的大π键具有金属键的性质,这就是石墨沿层的平行方向导电性强的原因。
5.这些网络状的平面结构以范德华力结合形成层状结构,这样,石墨晶体中既有共价键,又有范德华力,同时还有类似金属键的作用力。因此石墨晶体是一种混合型晶体。
在石墨晶体中,每个碳原子参与了3个C—C键的形成,每个C—C键被2个碳原子共用,每个碳原子被3个正六边形共用,故每个正六边形平均占有的碳原子数为6×3(1)=2,碳原子个数与C—C键键数之比为1∶(3×2(1))=2∶3。
石墨晶体独特的性质
(1)导电性:石墨的导电性只能沿着石墨平面的方向。
(2)润滑性:用作润滑剂、铅笔笔芯等。
(3)石墨的熔、沸点很高,石墨的熔点比金刚石还高。
归纳总结
1.(2023·全国乙卷节选)已知一些物质的熔点数据如下表:
物质 熔点/℃
NaCl 800.7
SiCl4 -68.8
GeCl4 -51.5
SnCl4 -34.1
[练4] 中科院的科学家已研制出一种高性能超级电容器电极材料——氮掺杂有序介孔石墨烯,该材料可用作电动车的“超强电池”,充电只需7秒钟,即可续航35公里。下面有关石墨晶体的说法错误的是( )
A.石墨晶体中既有共价键又有分子间作用力
B.石墨晶体熔、沸点很高,硬度很大
C.石墨晶体中每个六边形平均含2个完整碳原子
D.石墨晶体中,每个C原子被3个六元环共用
答案
解析
[练5] 金刚石、石墨、C60和石墨烯的结构示意图分别如图所示,下列说法不正确的是( )
A.金刚石和石墨烯中碳原子的杂化方式不同
B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体
C.这四种物质完全燃烧后的产物都是CO2
D.石墨与C60的晶体类型相同
答案
解析 C60是分子晶体,石墨是混合型晶体。
解析
[练6] 石墨的片层结构如图所示,请回答下列问题。
(1)一个六元环实际含有________个碳原子。
(2)石墨晶体每一层内碳原子数与C—C键数、
六元环数之比是________。
(3)设NA为阿伏加德罗常数的值。n g碳原子形成如图所示的六元环的个数为________。
答案
2
2∶3∶1
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________________________________。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因________________________
______________________________________________________________________________________________________________________________________________________________________________________。SiCl4的空间结构为_________,其中Si的轨道杂化形式为________。
答案
氯化钠为离子晶体,而SiCl4为分子晶体
随着同族元素的电子层数的增多,其熔点依次升高,其原因是:SiCl4、GeCl4、SnCl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大
正四面体
sp3
2.(2022·全国乙卷节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为________。解释X的熔点比Y高的原因________________________________。
答案
CsCl
CsCl为离子晶体,ICl为分子晶体
解析
解析 CsICl2发生非氧化还原反应,各元素化合价不变,生成无色晶体和红棕色液体,则无色晶体为CsCl,红棕色液体为ICl,而CsCl为离子晶体,熔化时克服的是离子键,ICl为分子晶体,熔化时克服的是分子间作用力,因此CsCl的熔点比ICl高。
3.(2021·山东高考节选)O、F、Cl电负性由大到小的顺序为______________;OF2分子的空间构型为________;OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是________________________
___________________________________________________。
答案
F>O>Cl
角(V)形
低于
OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高
解析
4.(1)(2020·全国卷Ⅱ节选)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_________________________________________________________________________________________________。
答案
TiF4为离子晶体,熔点高,其他三种均为分子晶体,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
化合物 TiF4 TiCl4 TiBr4 TiI4
熔点/℃ 377 -24.12 38.3 155
(2)(2020·山东高考节选)NH3、PH3、AsH3的沸点由高到低的顺序为__________________(填化学式,下同),还原性由强到弱的顺序为__________________。
T NH3、AsH3、PH3
AsH3、PH3、NH3
解析
答案
