9.2溶解度同步练习人教版化学九年级下册(含答案)
文档属性
| 名称 | 9.2溶解度同步练习人教版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 534.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 19:44:40 | ||
图片预览


文档简介
9.2溶解度 同步练习
一、多选题
1.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲、乙的溶解度都随温度的升高而增大
B.20℃时,甲、乙两种溶液的溶质质量分数相等
C.40℃时,可以配制溶质质量分数为38%的甲溶液
D.40℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液中先有固体结晶析出
2.下表是KC1、NH4Cl、KNO3三种物质在不同温度时的溶解度。
温度/℃ 0 20 40 60 80 100
溶解度/g KC1 27.6 34.0 40.0 45.5 51.1 56.7
NH4C1 29.4 37.2 45.8 55.2 65.6 77.3
KNO3 13.3 31.6 63.9 110 169 246
根据表格信息,可以推知( )
A.三种物质中溶解度最小的是KCl
B.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
C.三种物质中,溶解度受温度变化影响最大的是KNO3
D.在0℃-100℃以内的相同温度下,KCl和NH4Cl的溶解度可能相等
3.溶液对人类生产、生活都有很重要的意义。下列说法合理的是
A.饱和溶液一定比不饱和溶液浓度大
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数不一定减小
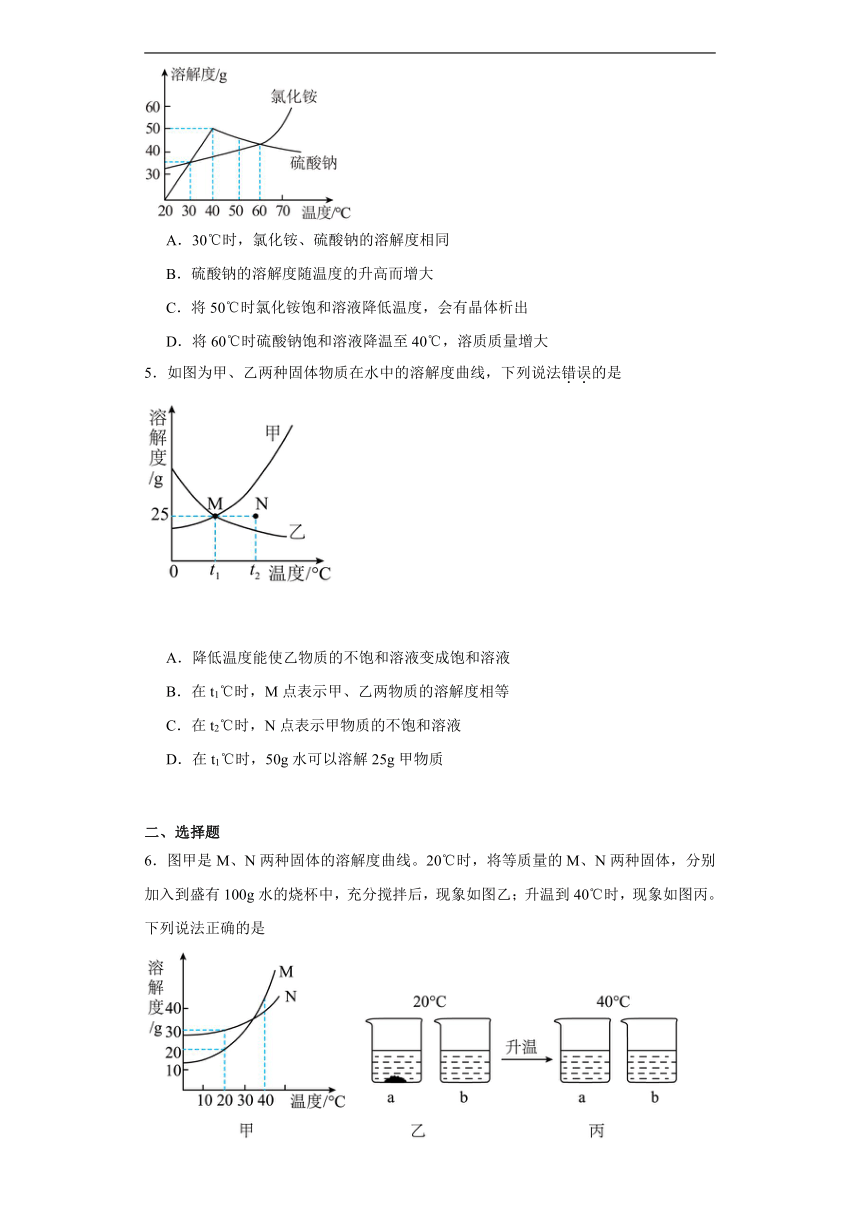
4.右图为氯化铵和硫酸钠的溶解度曲线,下列说法中正确的是
A.30℃时,氯化铵、硫酸钠的溶解度相同
B.硫酸钠的溶解度随温度的升高而增大
C.将50℃时氯化铵饱和溶液降低温度,会有晶体析出
D.将60℃时硫酸钠饱和溶液降温至40℃,溶质质量增大
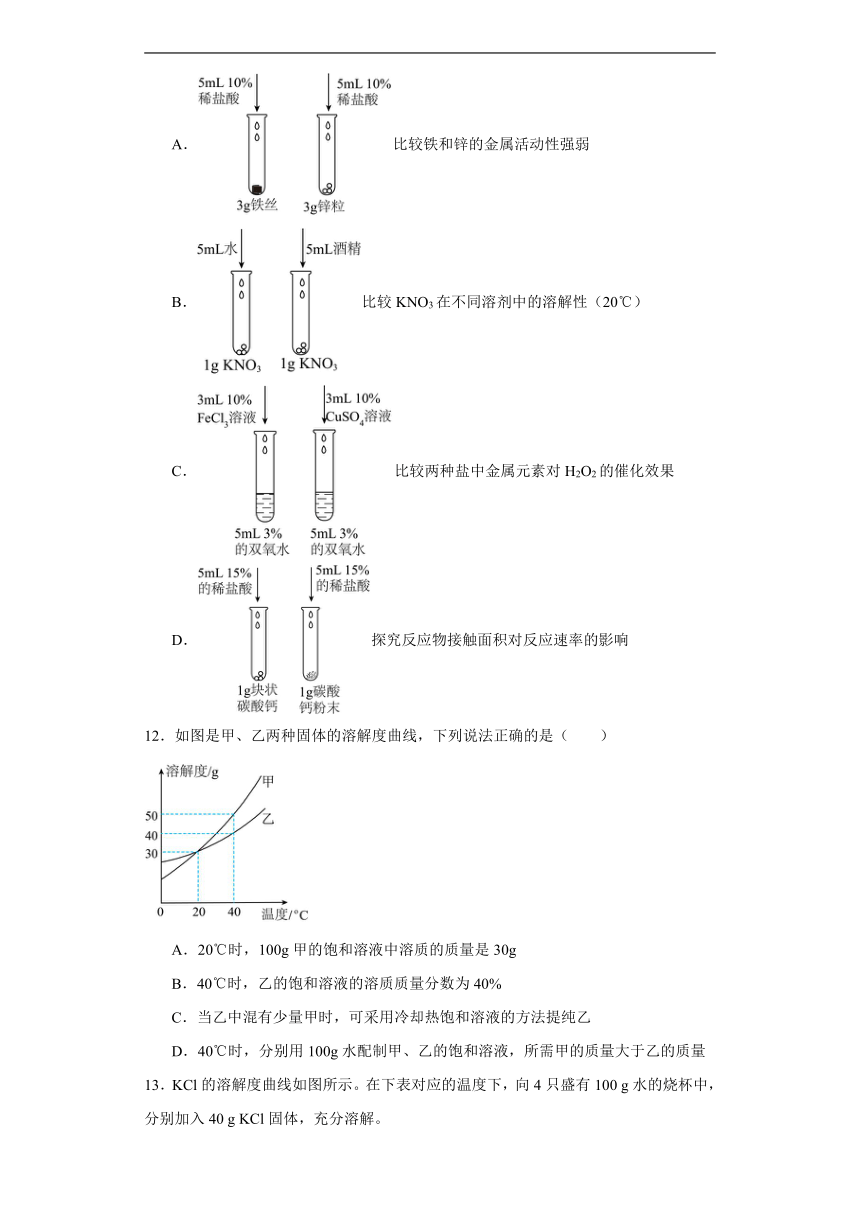
5.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.在t1℃时,M点表示甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,50g水可以溶解25g甲物质
二、选择题
6.图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是
A.烧杯a中加入的固体为N B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液 D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
7.下列物质溶解或稀释过程中,溶液温度明显降低的是
A.NaOH B.浓硫酸 C.NH4NO3 D.NaCl
8.某化学学习小组的同学辨析以下说法,其中正确的是
A.喝汽水后打嗝,压强减小气体的溶解度变小
B.废弃电池埋到土壤中,减少对环境的污染
C.将适量的硝酸铵固体溶于水,会使溶液的温度显著升高
D.被雨水淋湿的自行车,须先用干布擦净后才能用带油的布擦
9.如图甲可表示M与N的并列关系,图乙可表示M属于N的从属关系。下列概念间的关系符合图丙所示关系的是( )
选项 X Y Z
A 溶液 悬浊液 液体
B 悬浊液 乳浊液 溶液
C 溶质 溶剂 溶液
D 饱和溶液 不饱和溶液 浓溶液
A.A B.B C.C D.D
10.下列有关溶液的说法中,正确的是
A.均一稳定的液体一定是溶液
B.在一定温度下,某物质的饱和溶液不能再溶解任何物质
C.在一定温度下,氯化钠的饱和溶液所含的溶质一定比氯化钠的不饱和溶液所含的溶质更多
D.有时某一物质的溶液是稀溶液,同时也可能是饱和溶液
11.能达到实验目的的方案是
A.比较铁和锌的金属活动性强弱
B.比较KNO3在不同溶剂中的溶解性(20℃)
C.比较两种盐中金属元素对H2O2的催化效果
D.探究反应物接触面积对反应速率的影响
12.如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲的饱和溶液中溶质的质量是30g
B.40℃时,乙的饱和溶液的溶质质量分数为40%
C.当乙中混有少量甲时,可采用冷却热饱和溶液的方法提纯乙
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
13.KCl的溶解度曲线如图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
烧杯序号 ① ② ③ ④
温度(℃) 20 30 50 60
下列关于①~④所得溶液的说法不正确的是
A.溶质质量:①<②
B.溶液质量:②<③
C.溶质质量分数:③<④
D.④中溶质与溶剂的质量比为2: 5
14.KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是
温度℃ 20 30 40 50
溶解度S/g KC1 34.0 37.0 40.0 42.6
KNO3 31.6 45.8 63.9 85.5
A.甲表示KNO3溶解度曲线
B.将等质量50℃的甲、乙饱和溶液降温到30℃时,析出的晶体甲一定比乙多
C.40℃时,5gKC1加入10g水中,可得到33.3%的溶液
D.50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
15.溶液用途广泛,与人们的生活息息相关。下列说法正确的是
A.碘酒中的溶剂是碘
B.溶液不一定是无色透明的液体
C.均一、稳定的液体一定是溶液
D.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
三、综合应用题
16.我们周围的气体:
根据图中的实验装置回答:
(1)仪器 a 的名称是 。
(2)B 装置中发生反应的化学方程式 。
(3)如果用装置 C 收集 CO2,气体应从导管口 (填“b”或“c”)通入。
(4)“二氧化碳排放力争于 2030 年前达到峰值,努力争取 2060 年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
控制 CO2的排放,目的是为减缓 效应。加压水洗法可捕集 CO2,是因为压强增大时 CO2在水中的溶解度 。
(5)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于 变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇合成时,若碳元素全部来自于二氧化碳,则制取 10 吨甲醇需要消耗二氧化碳 吨。(二氧化碳转化成甲醇的方程式为: )
17.如图是a、b、c三种固体物质的溶解度曲线:请回答下列问题:
(1)t1℃时a物质的饱和溶液中溶液质量与溶剂质量的比(最简比) 。
(2)三种物质的结晶方法与海水晒盐相同的是 (填“a”“b”或“c”)
(3)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,充分溶解后恢复至t3℃,所得溶液的溶质质量分数大小关系为 (填字母,下同)再将溶液降低到t1℃时所得溶液质量大小关系为 。
(4)t1℃时a、b、c三种物质的饱和溶液同时升温到t2℃此时溶液中溶质的质量分数大小关系是 。
18.海水提取氯化钠的大致过程如图:
(1)图中①是 (填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的 (填“饱和”或“不饱和”)溶液;
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:
Ⅰ.溶解Ⅱ. (填操作名称) Ⅲ.蒸发
上述三个步骤中,用到的同一种玻璃仪器的名称是 ,该仪器在步骤Ⅲ中的作用是 。
(4)用上述实验提取的氯化钠配制100g10%的NaCl溶液,实验步骤如下:
① 计算:m(NaCl)= g,V(H2O)=90mL。
② 称量:分别用电子天平、量筒称量实验所需氯化钠质量和水的体积。
③ 溶解:将称量的氯化钠和水在烧杯中溶解,并用玻璃棒搅拌。
④ 装瓶:配好的溶液应装于 (填仪器名称)中。
⑤ 贴标签:请完成所配溶液标签的书写。
(5)取此氯化钠溶液测pH值,pH 7(填“>”、“<”或“=”)。
参考答案:
1.
2.CD
3.BD
4.AC
5.AD
6.C
7.C
8.D
9.C
10.D
11.B
12.D
13.C
14.C
15.B
16.(1)锥形瓶
(2)
(3)b
(4) 温室 增大
(5) 化学 13.75
17. 6:5 b a>b>c b>a=c b>a>c
18. 蒸发池 饱和 过滤 玻璃棒 搅拌,使液体均匀受热,防止飞溅 细口瓶 氯化钠溶液 10% =
一、多选题
1.甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲、乙的溶解度都随温度的升高而增大
B.20℃时,甲、乙两种溶液的溶质质量分数相等
C.40℃时,可以配制溶质质量分数为38%的甲溶液
D.40℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液中先有固体结晶析出
2.下表是KC1、NH4Cl、KNO3三种物质在不同温度时的溶解度。
温度/℃ 0 20 40 60 80 100
溶解度/g KC1 27.6 34.0 40.0 45.5 51.1 56.7
NH4C1 29.4 37.2 45.8 55.2 65.6 77.3
KNO3 13.3 31.6 63.9 110 169 246
根据表格信息,可以推知( )
A.三种物质中溶解度最小的是KCl
B.40℃时,100g KNO3饱和溶液中含有63.9g KNO3
C.三种物质中,溶解度受温度变化影响最大的是KNO3
D.在0℃-100℃以内的相同温度下,KCl和NH4Cl的溶解度可能相等
3.溶液对人类生产、生活都有很重要的意义。下列说法合理的是
A.饱和溶液一定比不饱和溶液浓度大
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数不一定减小
4.右图为氯化铵和硫酸钠的溶解度曲线,下列说法中正确的是
A.30℃时,氯化铵、硫酸钠的溶解度相同
B.硫酸钠的溶解度随温度的升高而增大
C.将50℃时氯化铵饱和溶液降低温度,会有晶体析出
D.将60℃时硫酸钠饱和溶液降温至40℃,溶质质量增大
5.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是
A.降低温度能使乙物质的不饱和溶液变成饱和溶液
B.在t1℃时,M点表示甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,50g水可以溶解25g甲物质
二、选择题
6.图甲是M、N两种固体的溶解度曲线。20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙;升温到40℃时,现象如图丙。下列说法正确的是
A.烧杯a中加入的固体为N B.20℃时,烧杯a中为饱和溶液,b中为不饱和溶液
C.40℃时,烧杯a、b中均为不饱和溶液 D.40℃时,烧杯a、b中溶液的溶质质量分数不相等
7.下列物质溶解或稀释过程中,溶液温度明显降低的是
A.NaOH B.浓硫酸 C.NH4NO3 D.NaCl
8.某化学学习小组的同学辨析以下说法,其中正确的是
A.喝汽水后打嗝,压强减小气体的溶解度变小
B.废弃电池埋到土壤中,减少对环境的污染
C.将适量的硝酸铵固体溶于水,会使溶液的温度显著升高
D.被雨水淋湿的自行车,须先用干布擦净后才能用带油的布擦
9.如图甲可表示M与N的并列关系,图乙可表示M属于N的从属关系。下列概念间的关系符合图丙所示关系的是( )
选项 X Y Z
A 溶液 悬浊液 液体
B 悬浊液 乳浊液 溶液
C 溶质 溶剂 溶液
D 饱和溶液 不饱和溶液 浓溶液
A.A B.B C.C D.D
10.下列有关溶液的说法中,正确的是
A.均一稳定的液体一定是溶液
B.在一定温度下,某物质的饱和溶液不能再溶解任何物质
C.在一定温度下,氯化钠的饱和溶液所含的溶质一定比氯化钠的不饱和溶液所含的溶质更多
D.有时某一物质的溶液是稀溶液,同时也可能是饱和溶液
11.能达到实验目的的方案是
A.比较铁和锌的金属活动性强弱
B.比较KNO3在不同溶剂中的溶解性(20℃)
C.比较两种盐中金属元素对H2O2的催化效果
D.探究反应物接触面积对反应速率的影响
12.如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲的饱和溶液中溶质的质量是30g
B.40℃时,乙的饱和溶液的溶质质量分数为40%
C.当乙中混有少量甲时,可采用冷却热饱和溶液的方法提纯乙
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
13.KCl的溶解度曲线如图所示。在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。
烧杯序号 ① ② ③ ④
温度(℃) 20 30 50 60
下列关于①~④所得溶液的说法不正确的是
A.溶质质量:①<②
B.溶液质量:②<③
C.溶质质量分数:③<④
D.④中溶质与溶剂的质量比为2: 5
14.KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是
温度℃ 20 30 40 50
溶解度S/g KC1 34.0 37.0 40.0 42.6
KNO3 31.6 45.8 63.9 85.5
A.甲表示KNO3溶解度曲线
B.将等质量50℃的甲、乙饱和溶液降温到30℃时,析出的晶体甲一定比乙多
C.40℃时,5gKC1加入10g水中,可得到33.3%的溶液
D.50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
15.溶液用途广泛,与人们的生活息息相关。下列说法正确的是
A.碘酒中的溶剂是碘
B.溶液不一定是无色透明的液体
C.均一、稳定的液体一定是溶液
D.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
三、综合应用题
16.我们周围的气体:
根据图中的实验装置回答:
(1)仪器 a 的名称是 。
(2)B 装置中发生反应的化学方程式 。
(3)如果用装置 C 收集 CO2,气体应从导管口 (填“b”或“c”)通入。
(4)“二氧化碳排放力争于 2030 年前达到峰值,努力争取 2060 年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
控制 CO2的排放,目的是为减缓 效应。加压水洗法可捕集 CO2,是因为压强增大时 CO2在水中的溶解度 。
(5)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于 变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇合成时,若碳元素全部来自于二氧化碳,则制取 10 吨甲醇需要消耗二氧化碳 吨。(二氧化碳转化成甲醇的方程式为: )
17.如图是a、b、c三种固体物质的溶解度曲线:请回答下列问题:
(1)t1℃时a物质的饱和溶液中溶液质量与溶剂质量的比(最简比) 。
(2)三种物质的结晶方法与海水晒盐相同的是 (填“a”“b”或“c”)
(3)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,充分溶解后恢复至t3℃,所得溶液的溶质质量分数大小关系为 (填字母,下同)再将溶液降低到t1℃时所得溶液质量大小关系为 。
(4)t1℃时a、b、c三种物质的饱和溶液同时升温到t2℃此时溶液中溶质的质量分数大小关系是 。
18.海水提取氯化钠的大致过程如图:
(1)图中①是 (填“蒸发池”或“冷却池”);
(2)析出晶体后的母液是氯化钠的 (填“饱和”或“不饱和”)溶液;
(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:
Ⅰ.溶解Ⅱ. (填操作名称) Ⅲ.蒸发
上述三个步骤中,用到的同一种玻璃仪器的名称是 ,该仪器在步骤Ⅲ中的作用是 。
(4)用上述实验提取的氯化钠配制100g10%的NaCl溶液,实验步骤如下:
① 计算:m(NaCl)= g,V(H2O)=90mL。
② 称量:分别用电子天平、量筒称量实验所需氯化钠质量和水的体积。
③ 溶解:将称量的氯化钠和水在烧杯中溶解,并用玻璃棒搅拌。
④ 装瓶:配好的溶液应装于 (填仪器名称)中。
⑤ 贴标签:请完成所配溶液标签的书写。
(5)取此氯化钠溶液测pH值,pH 7(填“>”、“<”或“=”)。
参考答案:
1.
2.CD
3.BD
4.AC
5.AD
6.C
7.C
8.D
9.C
10.D
11.B
12.D
13.C
14.C
15.B
16.(1)锥形瓶
(2)
(3)b
(4) 温室 增大
(5) 化学 13.75
17. 6:5 b a>b>c b>a=c b>a>c
18. 蒸发池 饱和 过滤 玻璃棒 搅拌,使液体均匀受热,防止飞溅 细口瓶 氯化钠溶液 10% =
同课章节目录
