2024年中考化学总复习 特色专题专训 题型三 工艺流程图题 学案 (含解析)
文档属性
| 名称 | 2024年中考化学总复习 特色专题专训 题型三 工艺流程图题 学案 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 278.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 11:11:11 | ||
图片预览

文档简介
题型三 工艺流程图题
【题型分析】
工艺流程图题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。工艺流程图题的结构分题头、题干和题尾三部分:题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括附产品);题干部分主要用框图形式将原料到产品的主要生产工艺流程表示出来;题尾主要是根据生产过程中涉及的化学知识设置成系列问题,构成一道完整的化学试题。
一般来说,流程题只有两个目的:一是从混合物中分离、提纯某一物质;另一目的就是利用某些物质制备另一物质。这样可以将流程题分为两个类型:
一、除杂、分离、提纯类工艺流程图题
本质就是对混合物的除杂、分离、提纯。①首先,找出要得到的主要物质,混有哪些杂质;②然后,认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物;③最后,思考要用什么样的方法才能将杂质除去。这样才能理解每一步所加试剂或操作的目的。
二、物质制备类工艺流程图题
这样的题目一般:①先是确定要制备什么物质,从题干或问题中获取有用信息,了解产品的性质(具有某些特殊性质的产物,要采取必要的措施来避免在生产过程中产生其他杂质,例如,产品受热易分解,可能要低温烘干、减压烘干、减压蒸发等);②分析流程中的每一步骤,从几个方面了解流程:反应物是什么 化学方程式是什么 该反应造成了什么后果 对制造产品有什么作用 ③从问题中获取信息,帮助解题。标准化问题要标准化回答。
物质制备类型的化学工艺流程图题往往也伴随着除杂、分离、提纯的实验操作。
【举例精讲】
类型一 分离回收金属类
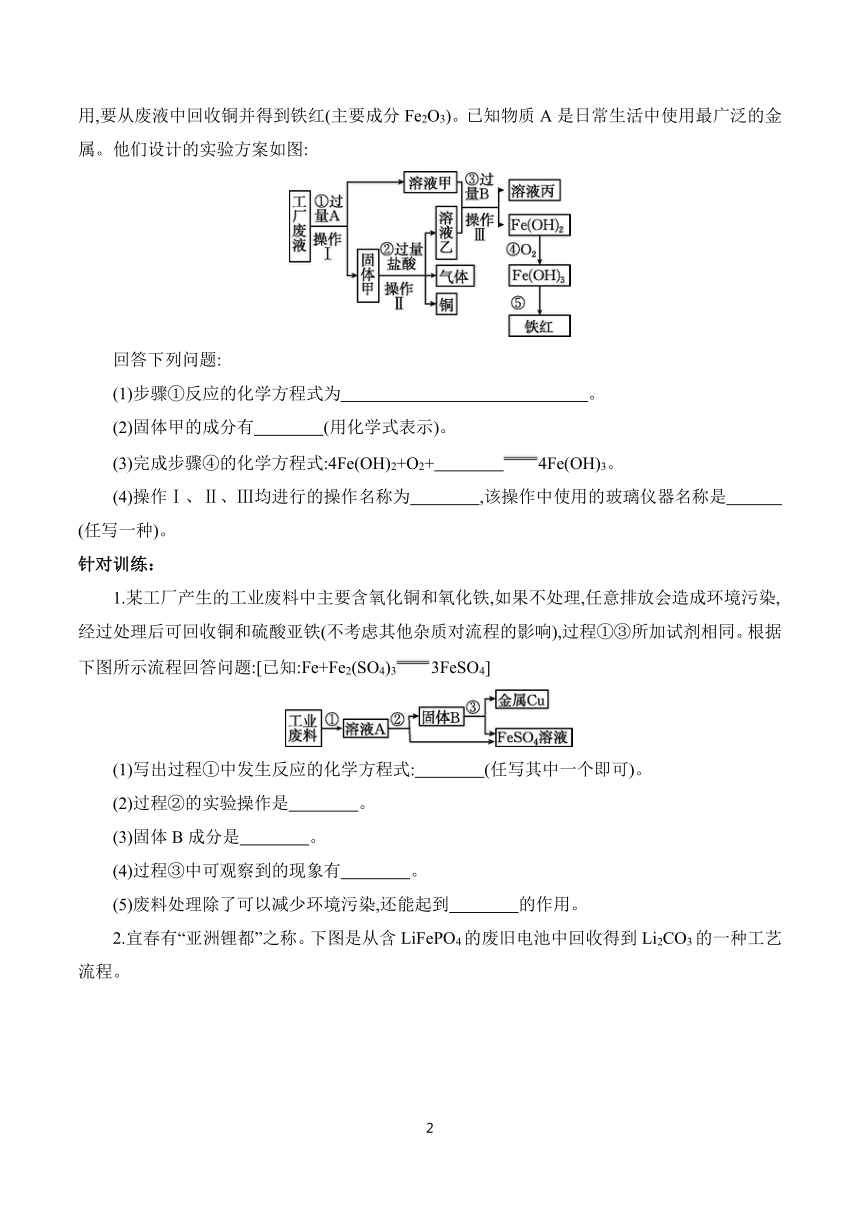
例题1 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某化学兴趣小组想废物再利
用,要从废液中回收铜并得到铁红(主要成分Fe2O3)。已知物质A是日常生活中使用最广泛的金属。他们设计的实验方案如图:
回答下列问题:
(1)步骤①反应的化学方程式为 。
(2)固体甲的成分有 (用化学式表示)。
(3)完成步骤④的化学方程式:4Fe(OH)2+O2+ 4Fe(OH)3。
(4)操作Ⅰ、Ⅱ、Ⅲ均进行的操作名称为 ,该操作中使用的玻璃仪器名称是 (任写一种)。
针对训练:
1.某工厂产生的工业废料中主要含氧化铜和氧化铁,如果不处理,任意排放会造成环境污染,经过处理后可回收铜和硫酸亚铁(不考虑其他杂质对流程的影响),过程①③所加试剂相同。根据下图所示流程回答问题:[已知:Fe+Fe2(SO4)33FeSO4]
(1)写出过程①中发生反应的化学方程式: (任写其中一个即可)。
(2)过程②的实验操作是 。
(3)固体B成分是 。
(4)过程③中可观察到的现象有 。
(5)废料处理除了可以减少环境污染,还能起到 的作用。
2.宜春有“亚洲锂都”之称。下图是从含LiFePO4的废旧电池中回收得到Li2CO3的一种工艺流程。
(1)操作1:粉碎废电极片的目的是 。
(2)操作2:反应过程中温度不宜高于40 ℃,原因是 。
(3)操作3:其原理类似于实验室中的 (填操作名称)。
(4)操作4:发生反应的化学方程式为 。
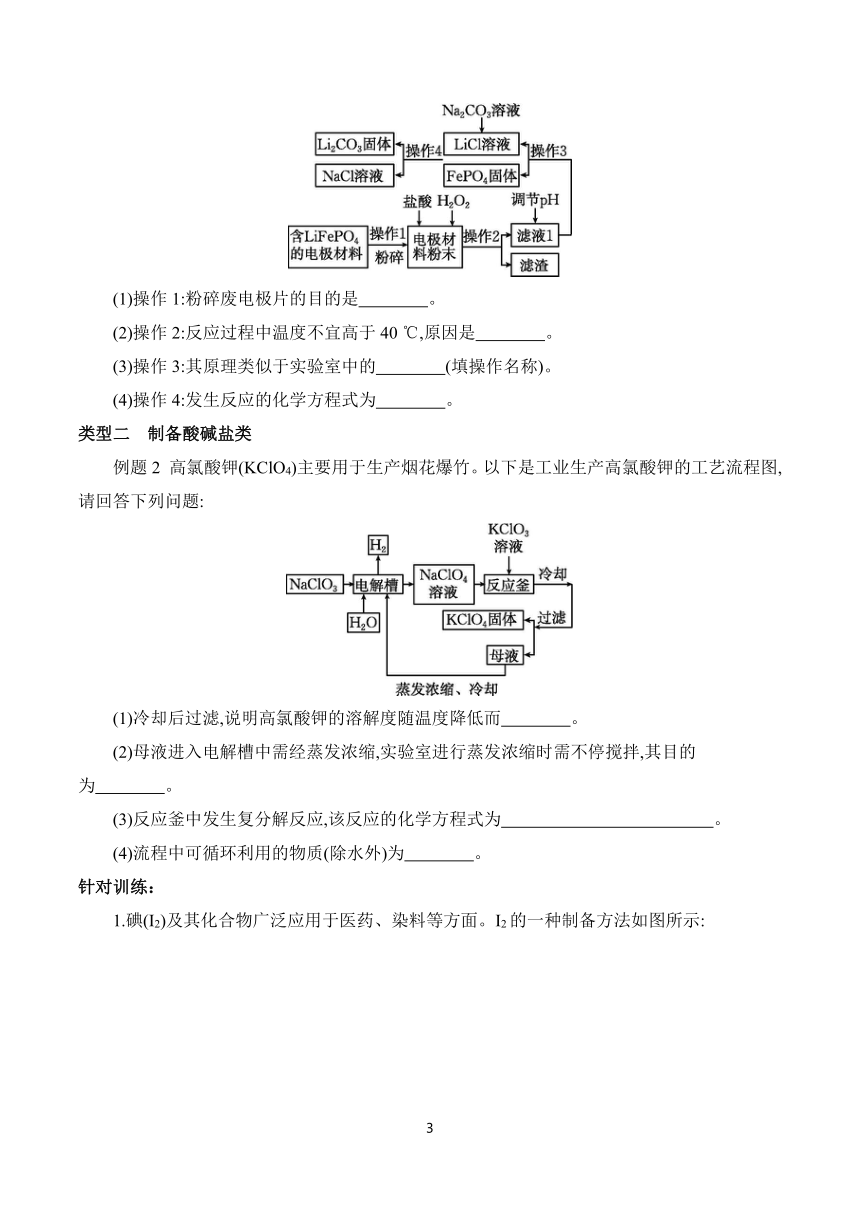
类型二 制备酸碱盐类
例题2 高氯酸钾(KClO4)主要用于生产烟花爆竹。以下是工业生产高氯酸钾的工艺流程图,请回答下列问题:
(1)冷却后过滤,说明高氯酸钾的溶解度随温度降低而 。
(2)母液进入电解槽中需经蒸发浓缩,实验室进行蒸发浓缩时需不停搅拌,其目的为 。
(3)反应釜中发生复分解反应,该反应的化学方程式为 。
(4)流程中可循环利用的物质(除水外)为 。
针对训练:
1.碘(I2)及其化合物广泛应用于医药、染料等方面。I2的一种制备方法如图所示:
说明:图中的“置换”指发生置换反应。
回答下列问题。
(1)“过滤”操作中用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称)。
(2)在此制备流程中循环使用的物质是 (填化学式)。
(3)溶液B中主要溶质可能是 (填化学式)。
(4)“置换①”中反应的化学方程式为 。
2.某化工厂以生产钛白粉的主要副产物(含硫酸亚铁)为原料,制取含高纯度氧化铁的氧化铁红,其工业流程如下:
(1)操作1能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而 。
(2)实验室中完成操作2时,玻璃棒的作用是 。
(3)操作3中,硫酸亚铁在空气中煅烧得到氧化铁和三氧化硫的化学方程式为 。
(4)操作4涉及的反应的基本反应类型为 。
【参考答案】
类型一
例题1 (1)CuCl2+FeFeCl2+Cu
(2)Fe、Cu (3)2H2O
(4)过滤 烧杯、漏斗、玻璃棒
【解析】为不引入新的金属离子,向废水中加入过量的铁,把铜还原出来,过滤得到铜、铁的混合物,再向固体中加入过量的盐酸,可以把铁除去,这时的固体中只含有铜;溶液甲的溶质是氯化亚铁和氯化钠,溶液乙的溶质是氯化亚铁和HCl,溶液甲和溶液乙混合后加入过量的B,B是氢氧化钠,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀;用氧气将氢氧化亚铁氧化为氢氧化铁后,加热氢氧化铁,氢氧化铁受热分解为氧化铁和水。(1)步骤①的反应是铁和氯化铜反应生成氯化亚铁和铜,化学方程式为CuCl2+FeFeCl2+Cu。(2)固体甲的成分有Fe、Cu。(3)由质量守恒定律可知,化学反应前后原子的种类、数目不变,则步骤④的化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3。(4)操作Ⅰ、Ⅱ、Ⅲ均进行的操作名称为过滤;该操作中使用的玻璃仪器名称是烧杯、漏斗、玻璃棒。
针对训练
1.(1)3H2SO4+Fe2O3Fe2(SO4)3+3H2O(或CuO+H2SO4CuSO4+H2O)
(2)过滤 (3)Fe、Cu (4)固体部分溶解,有气泡产生,溶液变为浅绿色 (5)废物再利用
【解析】(1)工业废料中主要含氧化铜和氧化铁,由于过程①③所加试剂相同,经过处理后可回收硫酸亚铁,则加入的是稀硫酸,过程①中氧化铁和硫酸反应生成硫酸铁和水,氧化铜与硫酸反应生成硫酸铜与水,化学方程式为3H2SO4+Fe2O3Fe2(SO4)3+3H2O、CuO+H2SO4CuSO4+H2O。(2)步骤②可以将固液分离,故该操作是过滤。(3)经分析可知,步骤②中加入的是铁粉,目的是置换硫酸铜中的铜,在固体B中加入硫酸后可得到硫酸亚铁溶液,说明在步骤②中加入了过量的铁,则固体B的组成是铁和铜。(4)过程③中在铁和铜的混合物B中加入硫酸后,铁和硫酸反应生成硫酸亚铁和氢气,故现象为固体部分溶解,溶液变为浅绿色。(5)废料处理除了可以减少环境污染,还能起到废物再利用的作用。
2.(1)增大反应物之间的接触面积,使反应更充分 (2)避免过氧化氢受热分解 (3)过滤 (4)Na2CO3+2LiClLi2CO3↓+2NaCl
【解析】(1)粉碎废电极片,可以增大反应物之间的接触面积,使反应更充分。(2)由于加入了过氧化氢,过氧化氢常温下能分解出水和氧气,加热后反应速度加快,故反应过程中温度不宜高于40℃,原因是避免过氧化氢受热分解。(3)操作3是将固液分离,类似于过滤操作。(4)操作4是碳酸钠和氯化锂反应生成碳酸锂和氯化钠,化学方程式为Na2CO3+2LiClLi2CO3↓+2NaCl。
类型二
例题2 (1)减小 (2)防止母液受热不均匀而迸溅
(3)KClO3+NaClO4KClO4↓+NaClO3 (4)NaClO3
【解析】(1)冷却后过滤,说明降温有晶体析出,即高氯酸钾的溶解度随温度降低而减小。(2)母液进入电解槽中需经蒸发浓缩,实验室进行蒸发浓缩时需不停搅拌,其目的为防止母液受热不均匀而迸溅。(3)考查陌生化学方程式的书写:①用箭头判断反应物和生成物,箭头由物质指向方框的是反应物,箭头离开方框指向的物质是生成物;②根据元素守恒与反应规律,判断没有给出的其他反应物或生成物;③若用已知物书写的化学方程式未配平,可根据质量守恒定律(主要是原子守恒)进行配平,必要时可考虑添加氧气或水,比如反应强调在空气中进行,要考虑空气中氧气是否参与反应,在溶液中进行要考虑水是否参与反应。该题目中反应釜中发生复分解反应,是KClO3和NaClO4生成KClO4和NaClO3,由于图中显示KClO4为固体,所以该反应的化学方程式为 KClO3+NaClO4KClO4↓+NaClO3。(4)箭头回转指向前面方框的是可循环利用的物质,流程中可循环利用的物质(除水外)为 NaClO3。
针对训练
1.(1)漏斗 (2)AgNO3 (3)FeCl3(或FeCl2) (4)2AgI+FeFeI2+2Ag
【解析】(1)“过滤”操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗。(2)在流程图中,既是反应物又是生成物的物质能循环使用,故可循环使用的物质是AgNO3。(3)置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物。因此,置换②是氯气和碘化亚铁反应生成碘和氯化亚铁或生成碘和氯化铁,故溶液B中的溶质可以为FeCl3或FeCl2。(4)置换①是AgI和Fe反应生成FeI2和Ag,该反应的化学方程式为2AgI+FeFeI2+2Ag。
2.(1)增大 (2)引流 (3)4FeSO4+O22Fe2O3+4SO3 (4)化合反应
【解析】(1)操作1通过冷却结晶能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而增大。(2)操作2实现了固液分离,名称是过滤,过滤时,玻璃棒的作用是引流。(3)硫酸亚铁在空气中煅烧得到氧化铁和三氧化硫,根据质量守恒定律,化学反应前后原子的种类和数目不变,则该反应的化学方程式为4FeSO4+O22Fe2O3+4SO3。(4)操作4涉及的化学反应为三氧化硫和水反应生成硫酸,该反应符合“多变一”的特点,属于化合反应。
2
【题型分析】
工艺流程图题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。工艺流程图题的结构分题头、题干和题尾三部分:题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括附产品);题干部分主要用框图形式将原料到产品的主要生产工艺流程表示出来;题尾主要是根据生产过程中涉及的化学知识设置成系列问题,构成一道完整的化学试题。
一般来说,流程题只有两个目的:一是从混合物中分离、提纯某一物质;另一目的就是利用某些物质制备另一物质。这样可以将流程题分为两个类型:
一、除杂、分离、提纯类工艺流程图题
本质就是对混合物的除杂、分离、提纯。①首先,找出要得到的主要物质,混有哪些杂质;②然后,认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物;③最后,思考要用什么样的方法才能将杂质除去。这样才能理解每一步所加试剂或操作的目的。
二、物质制备类工艺流程图题
这样的题目一般:①先是确定要制备什么物质,从题干或问题中获取有用信息,了解产品的性质(具有某些特殊性质的产物,要采取必要的措施来避免在生产过程中产生其他杂质,例如,产品受热易分解,可能要低温烘干、减压烘干、减压蒸发等);②分析流程中的每一步骤,从几个方面了解流程:反应物是什么 化学方程式是什么 该反应造成了什么后果 对制造产品有什么作用 ③从问题中获取信息,帮助解题。标准化问题要标准化回答。
物质制备类型的化学工艺流程图题往往也伴随着除杂、分离、提纯的实验操作。
【举例精讲】
类型一 分离回收金属类
例题1 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某化学兴趣小组想废物再利
用,要从废液中回收铜并得到铁红(主要成分Fe2O3)。已知物质A是日常生活中使用最广泛的金属。他们设计的实验方案如图:
回答下列问题:
(1)步骤①反应的化学方程式为 。
(2)固体甲的成分有 (用化学式表示)。
(3)完成步骤④的化学方程式:4Fe(OH)2+O2+ 4Fe(OH)3。
(4)操作Ⅰ、Ⅱ、Ⅲ均进行的操作名称为 ,该操作中使用的玻璃仪器名称是 (任写一种)。
针对训练:
1.某工厂产生的工业废料中主要含氧化铜和氧化铁,如果不处理,任意排放会造成环境污染,经过处理后可回收铜和硫酸亚铁(不考虑其他杂质对流程的影响),过程①③所加试剂相同。根据下图所示流程回答问题:[已知:Fe+Fe2(SO4)33FeSO4]
(1)写出过程①中发生反应的化学方程式: (任写其中一个即可)。
(2)过程②的实验操作是 。
(3)固体B成分是 。
(4)过程③中可观察到的现象有 。
(5)废料处理除了可以减少环境污染,还能起到 的作用。
2.宜春有“亚洲锂都”之称。下图是从含LiFePO4的废旧电池中回收得到Li2CO3的一种工艺流程。
(1)操作1:粉碎废电极片的目的是 。
(2)操作2:反应过程中温度不宜高于40 ℃,原因是 。
(3)操作3:其原理类似于实验室中的 (填操作名称)。
(4)操作4:发生反应的化学方程式为 。
类型二 制备酸碱盐类
例题2 高氯酸钾(KClO4)主要用于生产烟花爆竹。以下是工业生产高氯酸钾的工艺流程图,请回答下列问题:
(1)冷却后过滤,说明高氯酸钾的溶解度随温度降低而 。
(2)母液进入电解槽中需经蒸发浓缩,实验室进行蒸发浓缩时需不停搅拌,其目的为 。
(3)反应釜中发生复分解反应,该反应的化学方程式为 。
(4)流程中可循环利用的物质(除水外)为 。
针对训练:
1.碘(I2)及其化合物广泛应用于医药、染料等方面。I2的一种制备方法如图所示:
说明:图中的“置换”指发生置换反应。
回答下列问题。
(1)“过滤”操作中用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称)。
(2)在此制备流程中循环使用的物质是 (填化学式)。
(3)溶液B中主要溶质可能是 (填化学式)。
(4)“置换①”中反应的化学方程式为 。
2.某化工厂以生产钛白粉的主要副产物(含硫酸亚铁)为原料,制取含高纯度氧化铁的氧化铁红,其工业流程如下:
(1)操作1能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而 。
(2)实验室中完成操作2时,玻璃棒的作用是 。
(3)操作3中,硫酸亚铁在空气中煅烧得到氧化铁和三氧化硫的化学方程式为 。
(4)操作4涉及的反应的基本反应类型为 。
【参考答案】
类型一
例题1 (1)CuCl2+FeFeCl2+Cu
(2)Fe、Cu (3)2H2O
(4)过滤 烧杯、漏斗、玻璃棒
【解析】为不引入新的金属离子,向废水中加入过量的铁,把铜还原出来,过滤得到铜、铁的混合物,再向固体中加入过量的盐酸,可以把铁除去,这时的固体中只含有铜;溶液甲的溶质是氯化亚铁和氯化钠,溶液乙的溶质是氯化亚铁和HCl,溶液甲和溶液乙混合后加入过量的B,B是氢氧化钠,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀;用氧气将氢氧化亚铁氧化为氢氧化铁后,加热氢氧化铁,氢氧化铁受热分解为氧化铁和水。(1)步骤①的反应是铁和氯化铜反应生成氯化亚铁和铜,化学方程式为CuCl2+FeFeCl2+Cu。(2)固体甲的成分有Fe、Cu。(3)由质量守恒定律可知,化学反应前后原子的种类、数目不变,则步骤④的化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3。(4)操作Ⅰ、Ⅱ、Ⅲ均进行的操作名称为过滤;该操作中使用的玻璃仪器名称是烧杯、漏斗、玻璃棒。
针对训练
1.(1)3H2SO4+Fe2O3Fe2(SO4)3+3H2O(或CuO+H2SO4CuSO4+H2O)
(2)过滤 (3)Fe、Cu (4)固体部分溶解,有气泡产生,溶液变为浅绿色 (5)废物再利用
【解析】(1)工业废料中主要含氧化铜和氧化铁,由于过程①③所加试剂相同,经过处理后可回收硫酸亚铁,则加入的是稀硫酸,过程①中氧化铁和硫酸反应生成硫酸铁和水,氧化铜与硫酸反应生成硫酸铜与水,化学方程式为3H2SO4+Fe2O3Fe2(SO4)3+3H2O、CuO+H2SO4CuSO4+H2O。(2)步骤②可以将固液分离,故该操作是过滤。(3)经分析可知,步骤②中加入的是铁粉,目的是置换硫酸铜中的铜,在固体B中加入硫酸后可得到硫酸亚铁溶液,说明在步骤②中加入了过量的铁,则固体B的组成是铁和铜。(4)过程③中在铁和铜的混合物B中加入硫酸后,铁和硫酸反应生成硫酸亚铁和氢气,故现象为固体部分溶解,溶液变为浅绿色。(5)废料处理除了可以减少环境污染,还能起到废物再利用的作用。
2.(1)增大反应物之间的接触面积,使反应更充分 (2)避免过氧化氢受热分解 (3)过滤 (4)Na2CO3+2LiClLi2CO3↓+2NaCl
【解析】(1)粉碎废电极片,可以增大反应物之间的接触面积,使反应更充分。(2)由于加入了过氧化氢,过氧化氢常温下能分解出水和氧气,加热后反应速度加快,故反应过程中温度不宜高于40℃,原因是避免过氧化氢受热分解。(3)操作3是将固液分离,类似于过滤操作。(4)操作4是碳酸钠和氯化锂反应生成碳酸锂和氯化钠,化学方程式为Na2CO3+2LiClLi2CO3↓+2NaCl。
类型二
例题2 (1)减小 (2)防止母液受热不均匀而迸溅
(3)KClO3+NaClO4KClO4↓+NaClO3 (4)NaClO3
【解析】(1)冷却后过滤,说明降温有晶体析出,即高氯酸钾的溶解度随温度降低而减小。(2)母液进入电解槽中需经蒸发浓缩,实验室进行蒸发浓缩时需不停搅拌,其目的为防止母液受热不均匀而迸溅。(3)考查陌生化学方程式的书写:①用箭头判断反应物和生成物,箭头由物质指向方框的是反应物,箭头离开方框指向的物质是生成物;②根据元素守恒与反应规律,判断没有给出的其他反应物或生成物;③若用已知物书写的化学方程式未配平,可根据质量守恒定律(主要是原子守恒)进行配平,必要时可考虑添加氧气或水,比如反应强调在空气中进行,要考虑空气中氧气是否参与反应,在溶液中进行要考虑水是否参与反应。该题目中反应釜中发生复分解反应,是KClO3和NaClO4生成KClO4和NaClO3,由于图中显示KClO4为固体,所以该反应的化学方程式为 KClO3+NaClO4KClO4↓+NaClO3。(4)箭头回转指向前面方框的是可循环利用的物质,流程中可循环利用的物质(除水外)为 NaClO3。
针对训练
1.(1)漏斗 (2)AgNO3 (3)FeCl3(或FeCl2) (4)2AgI+FeFeI2+2Ag
【解析】(1)“过滤”操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗。(2)在流程图中,既是反应物又是生成物的物质能循环使用,故可循环使用的物质是AgNO3。(3)置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物。因此,置换②是氯气和碘化亚铁反应生成碘和氯化亚铁或生成碘和氯化铁,故溶液B中的溶质可以为FeCl3或FeCl2。(4)置换①是AgI和Fe反应生成FeI2和Ag,该反应的化学方程式为2AgI+FeFeI2+2Ag。
2.(1)增大 (2)引流 (3)4FeSO4+O22Fe2O3+4SO3 (4)化合反应
【解析】(1)操作1通过冷却结晶能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而增大。(2)操作2实现了固液分离,名称是过滤,过滤时,玻璃棒的作用是引流。(3)硫酸亚铁在空气中煅烧得到氧化铁和三氧化硫,根据质量守恒定律,化学反应前后原子的种类和数目不变,则该反应的化学方程式为4FeSO4+O22Fe2O3+4SO3。(4)操作4涉及的化学反应为三氧化硫和水反应生成硫酸,该反应符合“多变一”的特点,属于化合反应。
2
同课章节目录
