化学人教版(2019)必修第二册5.2.3硝酸(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.3硝酸(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 16:17:29 | ||
图片预览




文档简介
(共17张PPT)
(5.2.3)
硝 酸
必修二
第五章 化工生产中的重要非金属元素
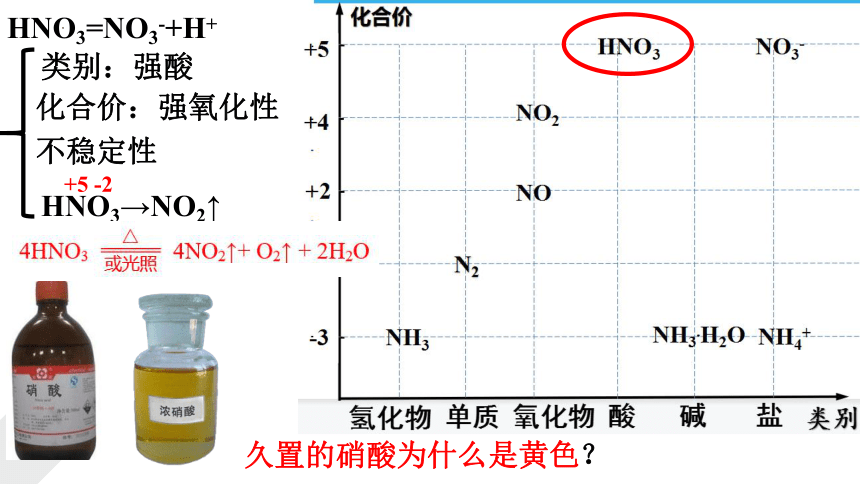
HNO3=NO3-+H+
类别:强酸
化合价:强氧化性
不稳定性
HNO3→NO2↑
+5 -2
久置的硝酸为什么是黄色?
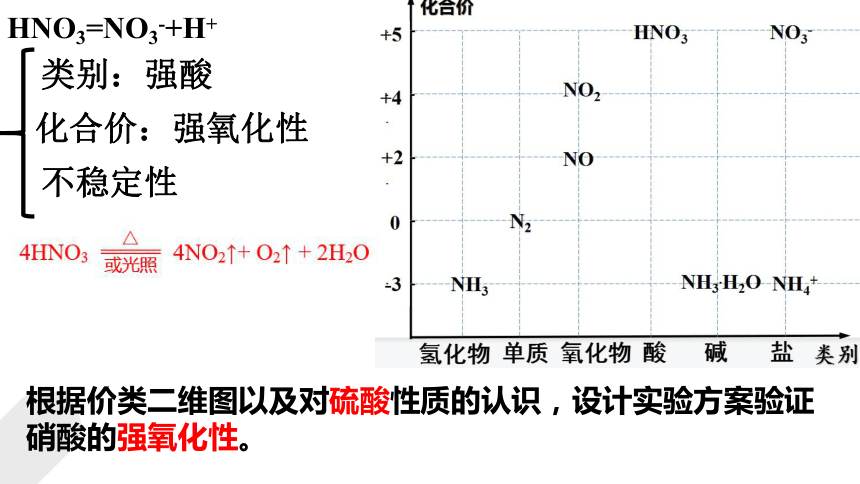
HNO3=NO3-+H+
类别:强酸
化合价:强氧化性
不稳定性
根据价类二维图以及对硫酸性质的认识,设计实验方案验证硝酸的强氧化性。
?还原剂
方案1:不活泼金属铜分别与稀硝酸和浓硝酸反应
什么条件、什么装置、产物验证
硝酸的强氧化性
硝酸的强氧化性
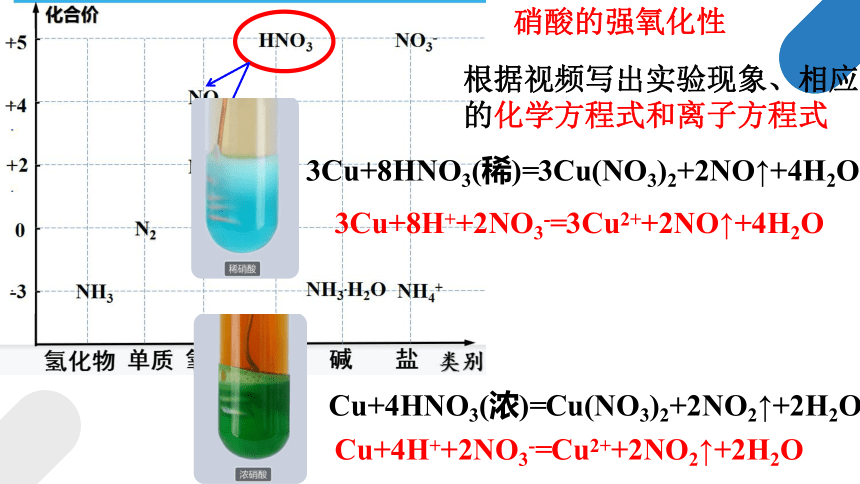
根据视频描述实验现象、相应的化学方程式和离子方程式
固体:
液体:
气体:
固体:
液体:
气体:
铜片缓慢溶解
溶液变蓝
无色气体,上升过程逐渐变为红棕色
铜片快速溶解
溶液变绿
产生大量红棕色气体
为什么溶液
颜色不一样?
硝酸的强氧化性
根据视频写出实验现象、相应的化学方程式和离子方程式
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
硝酸的强氧化性
思考1
1.铜与浓、稀硝酸反应中硝酸表现强氧化性,你觉得浓、稀硝酸氧化性谁强
+5
+2
+5
+4
2.有同学认为:铜与浓硝酸反应生成NO2得1个电子,铜与稀硝酸反应生成NO得3个电子,所以稀硝酸的氧化性强,对吗?
氧化性,还原性强弱与得失电子的数目无关,只与得失电子能力有关
(1)常温下, Fe、Al与浓H2SO4或浓HNO3反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。
(2)常温下可用铁制品或铝制品盛放浓硝酸,但要注意密封,以防硝酸挥发变稀后与铁、铝反应。
硝酸的强氧化性
方案1:将不活泼金属铜换成铝铁等活泼金属分别与稀硝酸和浓硝酸反应会怎样?
硝酸与金属的反应
硝酸的强氧化性
1.硝酸的浓度
2.金属的还原能力
3.反应条件/反应物的用量
情况多样
思考:铁和稀硝酸反应生成NO,结合铁及其化合物的性质,写出下列反应的方程式
Fe(少量) Fe(过量)
2Fe3++Fe=3Fe2+
Fe(少量)+4HNO3(稀) =Fe(NO3)3+NO↑+2H2O
3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
方案2:王水的性质
硝酸的强氧化性
浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
资料卡片——王水
方案3:碳与浓硝酸反应
硝酸的强氧化性
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
在加热时,浓硫酸也能与木炭发生反应,生成二氧化碳、二氧化硫与水
硝酸的强氧化性
某实验过程如图所示:则图③的试管中的现象是( )
HNO3=NO3-+H+
+5
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
NO3-+H+
NO3-的氧化性受溶液pH影响
NO3-(H+)
硝酸的性质与用途
硝酸的制备
①
②
③
1.硝石法
NaNO3+H2SO4(浓)=NaHSO4+HNO3
Δ
2.电弧法
N2 NO NO2 HNO3
O2
放电
O2
H2O
③
3.氨催化氧化法
N2 NH3 NO NO2 HNO3
H2
高温高压
催化剂
O2
H2O
催化剂
O2
产生氮的氧化物
硝酸的制备
酸雨的形成
正常雨水由于溶解了二氧化碳,呈酸性,其pH约为5.6,而酸雨的pH小于5.6。
硫酸型酸雨:
硝酸型酸雨:
3NO2+H2O=2HNO3+NO
(5.2.3)
硝 酸
必修二
第五章 化工生产中的重要非金属元素
HNO3=NO3-+H+
类别:强酸
化合价:强氧化性
不稳定性
HNO3→NO2↑
+5 -2
久置的硝酸为什么是黄色?
HNO3=NO3-+H+
类别:强酸
化合价:强氧化性
不稳定性
根据价类二维图以及对硫酸性质的认识,设计实验方案验证硝酸的强氧化性。
?还原剂
方案1:不活泼金属铜分别与稀硝酸和浓硝酸反应
什么条件、什么装置、产物验证
硝酸的强氧化性
硝酸的强氧化性
根据视频描述实验现象、相应的化学方程式和离子方程式
固体:
液体:
气体:
固体:
液体:
气体:
铜片缓慢溶解
溶液变蓝
无色气体,上升过程逐渐变为红棕色
铜片快速溶解
溶液变绿
产生大量红棕色气体
为什么溶液
颜色不一样?
硝酸的强氧化性
根据视频写出实验现象、相应的化学方程式和离子方程式
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
硝酸的强氧化性
思考1
1.铜与浓、稀硝酸反应中硝酸表现强氧化性,你觉得浓、稀硝酸氧化性谁强
+5
+2
+5
+4
2.有同学认为:铜与浓硝酸反应生成NO2得1个电子,铜与稀硝酸反应生成NO得3个电子,所以稀硝酸的氧化性强,对吗?
氧化性,还原性强弱与得失电子的数目无关,只与得失电子能力有关
(1)常温下, Fe、Al与浓H2SO4或浓HNO3反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。
(2)常温下可用铁制品或铝制品盛放浓硝酸,但要注意密封,以防硝酸挥发变稀后与铁、铝反应。
硝酸的强氧化性
方案1:将不活泼金属铜换成铝铁等活泼金属分别与稀硝酸和浓硝酸反应会怎样?
硝酸与金属的反应
硝酸的强氧化性
1.硝酸的浓度
2.金属的还原能力
3.反应条件/反应物的用量
情况多样
思考:铁和稀硝酸反应生成NO,结合铁及其化合物的性质,写出下列反应的方程式
Fe(少量) Fe(过量)
2Fe3++Fe=3Fe2+
Fe(少量)+4HNO3(稀) =Fe(NO3)3+NO↑+2H2O
3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
方案2:王水的性质
硝酸的强氧化性
浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
资料卡片——王水
方案3:碳与浓硝酸反应
硝酸的强氧化性
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
在加热时,浓硫酸也能与木炭发生反应,生成二氧化碳、二氧化硫与水
硝酸的强氧化性
某实验过程如图所示:则图③的试管中的现象是( )
HNO3=NO3-+H+
+5
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
NO3-+H+
NO3-的氧化性受溶液pH影响
NO3-(H+)
硝酸的性质与用途
硝酸的制备
①
②
③
1.硝石法
NaNO3+H2SO4(浓)=NaHSO4+HNO3
Δ
2.电弧法
N2 NO NO2 HNO3
O2
放电
O2
H2O
③
3.氨催化氧化法
N2 NH3 NO NO2 HNO3
H2
高温高压
催化剂
O2
H2O
催化剂
O2
产生氮的氧化物
硝酸的制备
酸雨的形成
正常雨水由于溶解了二氧化碳,呈酸性,其pH约为5.6,而酸雨的pH小于5.6。
硫酸型酸雨:
硝酸型酸雨:
3NO2+H2O=2HNO3+NO
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
