2024年中考科学 核心考点复习 专题 11 酸碱盐(含答案)
文档属性
| 名称 | 2024年中考科学 核心考点复习 专题 11 酸碱盐(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 672.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-03-14 23:08:35 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
新中考 核心考点复习 11 酸碱盐
模块一 酸碱盐的性质
1. 酸的性质
(1)常见的酸
酸 盐酸 硫酸
颜色与状态 无色液体 浓硫酸是无色、黏稠、油状液体
特性 浓盐酸具有较强的挥发性 浓硫酸溶于水时会放出大量热
用途 金属除锈,制造药物,人体胃液中的盐酸有助于消化 金属除锈,生产化肥、农药、火药、燃料及冶炼金属、精炼石油等,实验室中浓硫酸作干燥剂
(2)酸的化学性质
化学性质 反应通式/现象(常见为盐酸和稀硫酸)
与酸碱指示剂反应 使紫色石蕊试液变红,无色酚酞试液不变色
与活泼金属反应 酸+活泼金属=盐+氢气
与金属氧化物反应 酸+金属氧化物=盐+水
与碱反应 酸+碱=盐+水
与盐反应 酸+盐=新酸+新盐
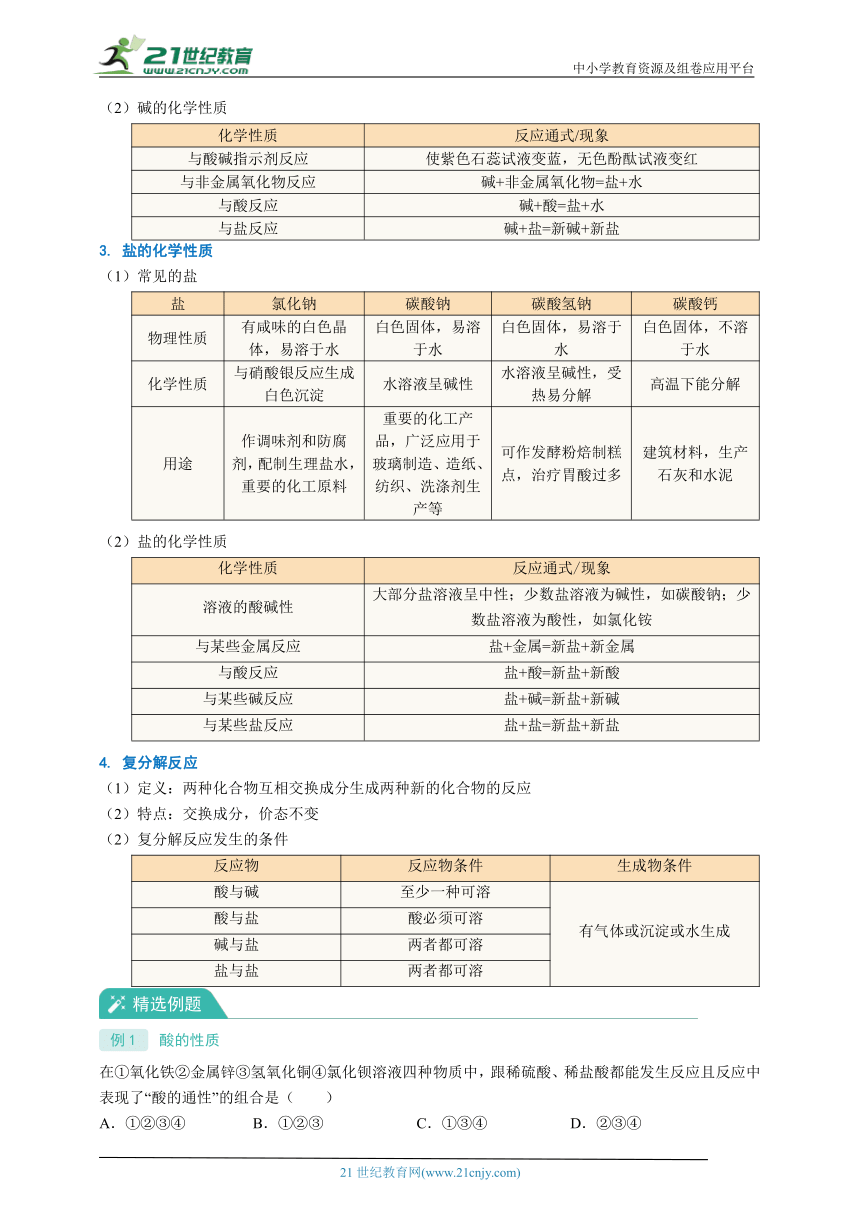
2. 碱的性质
(1)常见的碱
碱 氢氧化钠 氢氧化钙
俗名 烧碱、火碱、苛性钠 熟石灰、消石灰
状态 白色固体
特性 易溶于水,并放出大量热,易吸收水分而潮解,具有强腐蚀性 微溶于水,溶解度随温度升高而降低,腐蚀性较强
用途 用于制皂、造纸、精炼石油、纺织和印染等,实验室中固体氢氧化钠可作干燥剂 用于建筑行业,农业上可用于改良酸性土壤、配制农药波尔多液,制取漂白粉等
(2)碱的化学性质
化学性质 反应通式/现象
与酸碱指示剂反应 使紫色石蕊试液变蓝,无色酚酞试液变红
与非金属氧化物反应 碱+非金属氧化物=盐+水
与酸反应 碱+酸=盐+水
与盐反应 碱+盐=新碱+新盐
3. 盐的化学性质
(1)常见的盐
盐 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
物理性质 有咸味的白色晶体,易溶于水 白色固体,易溶于水 白色固体,易溶于水 白色固体,不溶于水
化学性质 与硝酸银反应生成白色沉淀 水溶液呈碱性 水溶液呈碱性,受热易分解 高温下能分解
用途 作调味剂和防腐剂,配制生理盐水,重要的化工原料 重要的化工产品,广泛应用于玻璃制造、造纸、纺织、洗涤剂生产等 可作发酵粉焙制糕点,治疗胃酸过多 建筑材料,生产石灰和水泥
(2)盐的化学性质
化学性质 反应通式/现象
溶液的酸碱性 大部分盐溶液呈中性;少数盐溶液为碱性,如碳酸钠;少数盐溶液为酸性,如氯化铵
与某些金属反应 盐+金属=新盐+新金属
与酸反应 盐+酸=新盐+新酸
与某些碱反应 盐+碱=新盐+新碱
与某些盐反应 盐+盐=新盐+新盐
4. 复分解反应
(1)定义:两种化合物互相交换成分生成两种新的化合物的反应
(2)特点:交换成分,价态不变
(2)复分解反应发生的条件
反应物 反应物条件 生成物条件
酸与碱 至少一种可溶 有气体或沉淀或水生成
酸与盐 酸必须可溶
碱与盐 两者都可溶
盐与盐 两者都可溶
在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
如图甲、乙、丙是三种不同类别的物质,且均能与X发生化学反应。若X为稀盐酸,则甲、乙、丙三种物质不可能为( )
A.Fe2O3、Ca(OH)2、CaCO3 B.Mg、Na2CO3、CuO
C.Fe、NaNO3、Ba(OH)2 D.Zn、CaO、AgNO3
下列物质能够反应,且没有明显现象的是( )
A.Na2CO3溶液加入澄清石灰水中 B.Fe2O3加入NaOH溶液中
C.稀盐酸滴入Ba(OH)2溶液中 D.CO2通入澄清石灰水中
如图物质经一步反应转化的两种途径,相关说法正确的是( )
A.②可能有沉淀生成 B.X只能是硫酸
C.氧化物为SO2 D.①②属于复分解反应
在氯化钡溶液中加入某种试剂,得到无色溶液和白色沉淀,下列说法正确的是( )
A.加入的试剂一定是硝酸银溶液
B.加入的试剂可能是二氧化碳
C.无色溶液可能呈酸性
D.白色沉淀一定不溶于稀硝酸
向ag K2CO3溶液中滴入bg Ba(OH)2溶液至恰好完全反应,如图表示该反应前后溶液中存在的主要离子,下列说法不正确的是( )
A.表示K+
B.反应后溶液的质量小于(a+b)g
C.将Ba(OH)2换成BaCl2也能观察到相同的现象
D.恰好完全反应时,滴入无色酚酞,溶液不变色
模块二 酸碱盐的相关实验
1. 酸碱中和反应的探究
(1)实验原理:中和反应过程中往往没有明显现象,无法确定是否发生反应或者反应是
否完全,因此需要借助酸碱指示剂来判断
(2)实验步骤:在盛有氢氧化钠的试管中加入几滴酚酞试液,再逐滴滴加稀盐酸,边滴
边振荡
(3)实验现象:滴加稀盐酸至一定量时,溶液由红色变为无色
(4)实验分析和结论:氢氧化钠溶液能使无色酚酞试液变红色,稀盐酸和氯化钠不能使
无色酚酞试液变红,滴加稀盐酸过程中溶液颜色变浅,最后变成无色,说明氢氧化
钠与稀盐酸发生了反应
2. 常见碱的变质探究
(1)氢氧化钙的变质探究
① 是否变质的实验探究:取样,加入过量稀盐酸,有气泡产生,说明氢氧化钙已变质
② 变质程度的探究(已知变质):取少量样品,加水溶解后过滤,向所得滤液中滴加
酚酞试液,若滤液变红,说明氢氧化钙部分变质,若滤液不变色,则氢氧化钙已全
部变质
(2)氢氧化钠变质探究
① 是否变质的实验探究
具体操作、现象与结论
气化法 取样溶于水,加入过量稀盐酸,若有气泡产生,证明NaOH已经变质
沉淀法 取样溶于水,加入BaCl2(或CaCl2)溶液,若有白色沉淀生成,证明NaOH已经变质
②变质程度的探究
实验 目的 具体操作、现象与结论
除去Na2CO3 取样溶于水,加入过量的BaCl2(或CaCl2)溶液,产生白色沉淀,充分反应后过滤
检验NaOH 向滤液中滴加酚酞试液,若溶液变红,说明部分变质,若溶液不变红,说明是全部变质
4. 纯碱样品中碳酸钠质量分数的测定
(1)生成气体
① 实验原理:H2SO4+Na2CO3= Na2SO4+H2O+CO2↑
② 实验方法:向质量为m的纯碱样品中加入足量的稀硫酸,准确测量生成的二氧化碳
气体的质量为m1
③ 数据处理:纯碱样品中碳酸钠的质量分数为
(2)生成沉淀
① 实验原理:BaCl2+Na2CO3=BaCO3↓+2NaCl
② 实验方法:先将质量为m的纯碱样品溶于水配成溶液,向溶液中加入过量的氯化钡
溶液,经过滤、洗涤、干燥可得BaCO3沉淀的质量为n
③ 数据处理:纯碱样品中碳酸钠的质量分数为
室温时,在氢氧化钠溶液与盐酸反应中,测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是( )
A.所得溶液的pH随加入溶液体积的变化是不均匀的
B.该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中
C.当滴入溶液体积为5mL时,所得溶液中含有两种溶质
D.当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色
某科学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
【实验探究】
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变
红,然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
① 实验结论 。
② 从微观的角度分析,该反应的实质是 。
(2)方案Ⅱ:
实验步骤 实验现象 结论
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若有气泡产生 稀盐酸过量
若没有明显现象 NaOH溶液与稀盐酸恰好完全反应
【实验反思】
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完
全反应” (填序号)。
A.铜片 B.pH试纸 C.氧化铜 D.紫色石蕊试液
实验室中同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是( )
A.甲溶液可以选择稀盐酸或CaC12溶液
B.若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C.D物质可能是气体,也可能是沉淀
D.溶液B中的溶质一定只含有NaOH和甲
实验室有一瓶久置的氢氧化钠固体,某同学想了解是否变质和变质程度,设计了实验,过程如下,有关实验说法不正确的是( )
A.实验证明该氢氧化钠已变质
B.有10.6克的氢氧化钠发生了变质
C.能进一步推算出氢氧化钠变质的程度
D.可用硝酸钡溶液代替氯化钡溶液完成实验
某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠,用如图装置对产品进行碳酸钠的含量分析。(已知:HCl+NaHCO3→NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)有关实验操作说法正确的是( )
A.锥形瓶中原有的空气对实验结果无影响
B.对取用样品的量的多少无一定要求
C.实验中若改用水,对测定无影响
D.实验中加入盐酸液体的体积,对测定无影响
某纯碱样品中混有少量的氯化钠,为了测定该样品中碳酸钠的质量分数,小明同学准确称取12.0g样品,做了如下实验:
请回答下列问题:
(1)操作X用到的玻璃仪器除烧杯、玻璃棒外,还必需有 。
(2)写出滤液C中的溶质的化学式 。
(3)若将滤渣B洗涤烘干后,称量其质量为10.0g,则该纯碱样品中的Na2CO3的质量分
数为 。
模块三 酸碱盐综合
1. 溶液中的离子与物质共存
(1)有气体产生:如与OH-,H+与、等不能大量共存
(2)有水生成:OH-与H+不能大量共存
(3)有沉淀生成
① Cl-与Ag+不能大量共存
② 与Ba2+、Ca2+、Ag+等不能大量共存
③ 与Mg2+、Ba2+、Ca2+、Ag+、Cu2+、Zn2+等不能大量共存
④ OH-与Mg2+、Cu2+、Al3+、Ag+、Zn2+、Fe2+、Fe3+等不能大量共存
2. 复分解反应后溶液中溶质成分的探究
(1)对反应后所得溶液溶质成分的猜想
① 写出相应的化学反应方程式
② 反应后的溶液中一定有可溶性的生成物,反应后的溶液中可能有可溶性反应物中的
一种
③ 如果将几个反应的废液同时倒入废液缸,要考虑溶质是否能够在溶液中共存
(2)判断反应后溶液中溶质成分的方法
① 确定反应物是否有剩余,一定要关注实际操作时所加入的试剂量,即注意少量、适
量、过量、一定量的不同
② 选择合适的试剂向反应后的溶液中滴加,通过特征反应来判断溶液中的溶质组成
小明向盛有盐酸和氯化镁溶液的烧杯中加入一定量的氢氧化钠溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液 a 于试管中,用下表中的试剂进行实验,相应的结果错误的是( )
选项 试剂 现象和结论
A 氧化铁粉末 溶液变为黄色,则溶液一定含有MgCl2
B 铁粉 无明显现象,则溶液一定有两种溶质
C NaOH溶液 无明显现象,则溶液a可能有NaOH
D 氯化铁溶液 有红褐色沉淀,则溶液一定有两种溶质
某科学兴趣小组设计了一组实验,已知甲中盛有一定量的碳酸钠溶液,实验流程如图所示:下列说法正确的个数是( )
①乙中溶液为红色;
②丙中溶液的溶质组成有2种可能情况;
③丙中加入过量稀盐酸后,观察到的现象为有气泡产生,溶液由红色变为无色,白色沉淀消失;
④丁中溶液的溶质除酚酞外,只有氯化钠、氯化氢
A.1 B.2 C.3 D.4
某科学实验小组在验证酸碱盐的化学性质时做如图所示的实验:
(1)实验一中能够观察到的明显现象是 。
(2)将上述实验后三支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色
固体A和无色溶液B,向溶液B中滴加少量Ba(OH)2溶液,无现象。综上分析,固
体A的成分是 ;溶液B中除酚酞外,一定还含有的溶质是 。
例1.B
解:氧化铁与稀盐酸、稀硫酸均能反应,生成盐和水;金属锌与稀盐酸、稀硫酸均能发生置换反应,生成盐和氢气;氢氧化铜与稀盐酸、稀硫酸均能发生中和反应,生成盐和水;氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,与稀盐酸不反应。故表现了“酸的通性”的组合是①②③。
故选:B。
练1.1.C
解:A、氧化铁属于金属氧化物,能与稀盐酸反应生成氯化铁和水;氢氧化钙与稀盐酸反应生成氯化钙和水;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;氢氧化钙与碳酸钙分别属于碱和盐,符合要求,故选项错误。
B、镁属于金属,能与稀盐酸反应生成氯化镁和氢气;碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳;氧化铜与稀盐酸反应生成氯化铜和水;碳酸钠与氧化铜分别属于盐和金属氧化物,符合要求,故选项错误。
C、铁属于金属,能与稀盐酸反应生成氯化亚铁和氢气;硝酸钠与稀盐酸交换成分,没有沉淀、气体或水生成,不能发生反应,不符合要求,故选项正确。
D、锌属于金属,能与稀盐酸反应生成氯化锌和氢气;氧化钙与稀盐酸反应生成氯化钙、水;硝酸银与稀盐酸反应生成氯化银沉淀和硝酸;三种物质分别属于金属单质、金属氧化物和盐,符合要求,故选项错误。
故选:C。
例2.C
解:A、Na2CO3溶液加入澄清石灰水中会生成白色沉淀,故此项错误;
B、Fe2O3加入NaOH溶液中,二者不发生反应,此项错误;
C、稀HCl滴入Ba(OH)2溶液中,发生中和反应,但没有沉淀和气体产生,没有明显现象,故此项正确。
D、CO2通入澄清石灰水中,溶液会变浑浊,此项错误。
故选:C。
练2.1.A
解:A、氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,②可能有沉淀生成,故选项说法正确。
B、氢氧化钠与三氧化硫反应生成硫酸钠和水,X不一定只能是硫酸,故选项说法错误。
C、二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,氧化物应为三氧化硫,故选项说法错误。
D、非金属氧化物与碱的反应,不属于复分解反应,故选项说法错误。
故选:A。
例3.C
解:A、加入的试剂不一定是硝酸银溶液,也可能是硫酸盐溶液等,故选项错误。
B、加入的试剂不可能是二氧化碳,二氧化碳不能与氯化钡溶液反应,故选项错误。
C、该溶液可能是溶液,可能是硫酸,无色溶液可能呈酸性,故选项正确。
D、白色沉淀不一定不溶于稀硝酸,也可能是碳酸钡沉淀,故选项错误。
故选:C。
练3.1.D
解:A、已知是向 向ag K2CO3溶液中滴入bgBa(OH)2溶液至恰好完全反应,故下方烧杯中盛装的物质应为K2CO3,根据K+和CO32﹣的个数比为2:1,可知O表示K+,正确;
B、由于K2CO3+Ba(OH)2=2KOH+BaCO3↓中有沉淀生成,则溶液的质量小于(a+b)g,正确;
C、由于BaCl2+K2CO3=BaCO3↓+2KCl,也有沉淀生成,正确;
D、根据化学反应方程式,结束时溶液中含有KOH,呈碱性,故滴入无色酚酞,溶液呈红色,错误。
故选:D。
例4.B
解:A、由测得溶液的pH随滴入溶液体积变化情况图,所得溶液的pH随加入溶液体积的变化是不均匀的,故选项说法正确。
B、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误。
C、当滴入溶液体积为5mL时,溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故选项说法正确。
D、当滴入溶液体积为20mL时,溶液的pH大于7,显碱性,所得溶液能使酚酞试液变红色,故选项说法正确。
故选:B。
练4.1.
(1)①NaOH 溶液与稀盐酸恰好完全反应
②H+和OH﹣反应生成H2O分子
(3)稀盐酸量不足的情况下,也无明显现象
(4)BD
解:(1)①酚酞遇碱性溶液可以变红,而遇到酸性或是中性溶液时则不会变色,所以当溶液变成无色时,证明NaOH溶液与稀硫酸恰好完全反应;
②从微观的角度分析,中和反应实质是氢离子和氢氧根离子生成水;
(2)镁和盐酸反应会生成氯化镁和氢气;
(3)向NaOH溶液中滴入一定量的稀盐酸,振荡后加入镁条,若没有明显现象,可能是NaOH溶液与稀盐酸恰好完全反应,或者稀盐酸的量不足,氢氧化钠有剩余;
(4)铜与稀盐酸不反应,若盐酸过量,也没有明显现象;用pH 试纸测定溶液的酸碱度,若=7,则恰好反应,若<7,酸有剩余;盐酸和氧化铜反应,若加入氧化铜,氧化铜逐渐减少,溶液逐渐变为蓝色,说明盐酸过量,若加入氧化铜无现象,可能是盐酸与氢氧化钠恰好反应,也有可能是氢氧化钠过量;如果滴入石蕊试液,石蕊试液变红,说明盐酸过量,如果石蕊试液不变红,说明盐酸恰好完全反应;故选BD;
答案为:
(1)①NaOH 溶液与稀盐酸恰好完全反应;
②H+和OH﹣反应生成H2O分子(离子方程式也可以);
(3)稀盐酸量不足的情况下,也无明显现象;
(4)B、D。
例5.B
【解答】解:A、甲溶液不能选择稀盐酸,因为氢氧化钠、碳酸钠均能与稀盐酸反应生成氯化钠溶液,溶液B为氯化钠溶液和盐酸的混合溶液,滴加酚酞溶液不变色,无法确定溶液中是否含有氢氧化钠,故选项说法错误。
B、甲溶液可以选用氯化钙溶液,若Ⅱ、Ⅲ均有明显现象(现象分别是产生白色沉淀、酚酞溶液变红色),分别说明含有碳酸钠、氢氧化钠,则说明样品部分变质,故选项说法正确。
C、由A选项的分析,D物质是沉淀,故选项说法错误。
D、溶液B中的溶质中一定含有碳酸钠与氯化钙反应生成的氯化钠,故选项说法错误。
故选:B。
练5.1.B
解:A、加入氯化钡产生沉淀,是因为碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,说明氢氧化钠已经变质,该选项说法正确;
B、设变质的氢氧化钠质量为x,
由 2NaOH+CO2═Na2CO3+H2O,BaCl2+Na2CO3═BaCO3↓+2NaCl可知,2NaOH~BaCO3↓,
2NaOH~BaCO3↓,
80 197
x 19.7g
=,
x=8g,
该选项说法不正确;
C、根据提供的数据可以计算变质的氢氧化钠质量、反应生成的碳酸钠质量、没有反应的氢氧化钠质量,因此能进一步推算出氢氧化钠变质的程度。该选项说法正确;
D、硝酸钡和碳酸钠反应生成碳酸钡沉淀和硝酸钠,因此可以用硝酸钡溶液代替氯化钡溶液完成实验,该选项说法正确。
故选:B。
例6.A
解:A、空气中含有的二氧化碳量很少,不会对结果产生大的影响。故A正确;
B、取用样品的量产生的二氧化碳的体积不能超过量筒的体积,因为样品量太多会使液体外溢或气体外逸导致测量不准;太少会导致气体量太少,产生的气压不够,造成较大误差。故B错误;
C、由于二氧化碳能溶于水,对测定有影响。故C错误;
D、实验中加入盐酸液体的体积过多,瓶内压强增大,排除的气体较多,对测定有影响。故D错误。
故选:A。
练6.1.
(1)漏斗 (2)NaCl、NaOH、Ca(OH)2
(3)88.3%
解:(1)操作X用到的玻璃仪器除烧杯、玻璃棒外,还必需有漏斗,故填:漏斗;
(2)根据图框,可知碳酸钠和氢氧化钙反应能生成碳酸钙沉淀和氢氧化钠,故滤液C中的溶质氯化钠、氢氧化钠和氢氧化钙;
(3)解:设纯碱样品中碳酸钠的质量为x,
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
106 100
x 10.0g
解得x=10.6g,
纯碱样品中的Na2CO3的质量分数为:×100%=88.3%,
答:纯碱样品中的Na2CO3的质量分数为88.3%
故答案为:
(1)漏斗;(2)NaCl、NaOH、Ca(OH)2;(3)88.3%
例7.B
解:A、加入氧化铁,溶液变为黄色,是因为氧化铁和盐酸反应生成氯化铁溶液(黄色)和水,则溶液一定含有盐酸,含有盐酸时同时一定含有氯化镁,该选项说法正确;
B、加入铁,无明显现象,说明溶液中不含有盐酸,溶液中可能含有一种物质,例如氢氧化钠和盐酸、氯化镁恰好完全反应时,溶液中含有一种物质氯化钠,该选项说法不正确;
C、如果氢氧化钠溶液过量时,加入氢氧化钠溶液无明显现象,该选项说法正确;
D、加入氯化铁溶液,有红褐色沉淀,则溶液一定有两种溶质,即含有氯化钠和氢氧化钠,该选项说法正确。
故选:B。
练7.1.B
解:①碳酸钠溶液显碱性,能使酚酞溶液变红色,故乙中溶液为红色,故说法正确。
②碳酸钠能与石灰水反应生成碳酸钙沉淀和氢氧化钠,丙中溶液的溶质组成有氢氧化钠、氢氧化钠和碳酸钠、氢氧化钠和氢氧化钙3种可能情况,故说法错误。
③两中加入过量稀盐酸后,碳酸钙沉淀能与稀盐酸反应生成二氧化碳气体,观察到的现象为有气泡产生,白色沉淀消失;稀盐酸过量,最终溶液显酸性,溶液由红色变为无色,故说法正确。
④丁中溶液的溶质除酚酞外,还有氯化钠、氯化氢、氯化钙,故说法错误。
故说法正确的个数是2个。
故选:B。
练7.2.
(1)溶液由无色变成红色,再由红色变成无色
(2)BaSO4;NaCl、HCl和MgCl2
解:(1)由于碱性溶液能使无色酚酞试液变红色,中性或酸性溶液不能无色酚酞试液变红色,所以实验一中能够观察到的明显现象是:溶液由无色变成红色,再由红色变成无色;
(2)将上述实验后三支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体A和无色溶液B,溶液B中没有氢氧根离子;向溶液B中滴加少量Ba(OH)2溶液,无现象,说明溶液中无硫酸根离子,但有氢离子,所以固体A中没有氢氧化镁,只有硫酸钡;溶液中一定有的溶质是:NaCl、HCl和MgCl2。
故答案为:
(1)溶液由无色变成红色,再由红色变成无色;
(2)BaSO4;NaCl、HCl和MgCl2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
新中考 核心考点复习 11 酸碱盐
模块一 酸碱盐的性质
1. 酸的性质
(1)常见的酸
酸 盐酸 硫酸
颜色与状态 无色液体 浓硫酸是无色、黏稠、油状液体
特性 浓盐酸具有较强的挥发性 浓硫酸溶于水时会放出大量热
用途 金属除锈,制造药物,人体胃液中的盐酸有助于消化 金属除锈,生产化肥、农药、火药、燃料及冶炼金属、精炼石油等,实验室中浓硫酸作干燥剂
(2)酸的化学性质
化学性质 反应通式/现象(常见为盐酸和稀硫酸)
与酸碱指示剂反应 使紫色石蕊试液变红,无色酚酞试液不变色
与活泼金属反应 酸+活泼金属=盐+氢气
与金属氧化物反应 酸+金属氧化物=盐+水
与碱反应 酸+碱=盐+水
与盐反应 酸+盐=新酸+新盐
2. 碱的性质
(1)常见的碱
碱 氢氧化钠 氢氧化钙
俗名 烧碱、火碱、苛性钠 熟石灰、消石灰
状态 白色固体
特性 易溶于水,并放出大量热,易吸收水分而潮解,具有强腐蚀性 微溶于水,溶解度随温度升高而降低,腐蚀性较强
用途 用于制皂、造纸、精炼石油、纺织和印染等,实验室中固体氢氧化钠可作干燥剂 用于建筑行业,农业上可用于改良酸性土壤、配制农药波尔多液,制取漂白粉等
(2)碱的化学性质
化学性质 反应通式/现象
与酸碱指示剂反应 使紫色石蕊试液变蓝,无色酚酞试液变红
与非金属氧化物反应 碱+非金属氧化物=盐+水
与酸反应 碱+酸=盐+水
与盐反应 碱+盐=新碱+新盐
3. 盐的化学性质
(1)常见的盐
盐 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
物理性质 有咸味的白色晶体,易溶于水 白色固体,易溶于水 白色固体,易溶于水 白色固体,不溶于水
化学性质 与硝酸银反应生成白色沉淀 水溶液呈碱性 水溶液呈碱性,受热易分解 高温下能分解
用途 作调味剂和防腐剂,配制生理盐水,重要的化工原料 重要的化工产品,广泛应用于玻璃制造、造纸、纺织、洗涤剂生产等 可作发酵粉焙制糕点,治疗胃酸过多 建筑材料,生产石灰和水泥
(2)盐的化学性质
化学性质 反应通式/现象
溶液的酸碱性 大部分盐溶液呈中性;少数盐溶液为碱性,如碳酸钠;少数盐溶液为酸性,如氯化铵
与某些金属反应 盐+金属=新盐+新金属
与酸反应 盐+酸=新盐+新酸
与某些碱反应 盐+碱=新盐+新碱
与某些盐反应 盐+盐=新盐+新盐
4. 复分解反应
(1)定义:两种化合物互相交换成分生成两种新的化合物的反应
(2)特点:交换成分,价态不变
(2)复分解反应发生的条件
反应物 反应物条件 生成物条件
酸与碱 至少一种可溶 有气体或沉淀或水生成
酸与盐 酸必须可溶
碱与盐 两者都可溶
盐与盐 两者都可溶
在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
如图甲、乙、丙是三种不同类别的物质,且均能与X发生化学反应。若X为稀盐酸,则甲、乙、丙三种物质不可能为( )
A.Fe2O3、Ca(OH)2、CaCO3 B.Mg、Na2CO3、CuO
C.Fe、NaNO3、Ba(OH)2 D.Zn、CaO、AgNO3
下列物质能够反应,且没有明显现象的是( )
A.Na2CO3溶液加入澄清石灰水中 B.Fe2O3加入NaOH溶液中
C.稀盐酸滴入Ba(OH)2溶液中 D.CO2通入澄清石灰水中
如图物质经一步反应转化的两种途径,相关说法正确的是( )
A.②可能有沉淀生成 B.X只能是硫酸
C.氧化物为SO2 D.①②属于复分解反应
在氯化钡溶液中加入某种试剂,得到无色溶液和白色沉淀,下列说法正确的是( )
A.加入的试剂一定是硝酸银溶液
B.加入的试剂可能是二氧化碳
C.无色溶液可能呈酸性
D.白色沉淀一定不溶于稀硝酸
向ag K2CO3溶液中滴入bg Ba(OH)2溶液至恰好完全反应,如图表示该反应前后溶液中存在的主要离子,下列说法不正确的是( )
A.表示K+
B.反应后溶液的质量小于(a+b)g
C.将Ba(OH)2换成BaCl2也能观察到相同的现象
D.恰好完全反应时,滴入无色酚酞,溶液不变色
模块二 酸碱盐的相关实验
1. 酸碱中和反应的探究
(1)实验原理:中和反应过程中往往没有明显现象,无法确定是否发生反应或者反应是
否完全,因此需要借助酸碱指示剂来判断
(2)实验步骤:在盛有氢氧化钠的试管中加入几滴酚酞试液,再逐滴滴加稀盐酸,边滴
边振荡
(3)实验现象:滴加稀盐酸至一定量时,溶液由红色变为无色
(4)实验分析和结论:氢氧化钠溶液能使无色酚酞试液变红色,稀盐酸和氯化钠不能使
无色酚酞试液变红,滴加稀盐酸过程中溶液颜色变浅,最后变成无色,说明氢氧化
钠与稀盐酸发生了反应
2. 常见碱的变质探究
(1)氢氧化钙的变质探究
① 是否变质的实验探究:取样,加入过量稀盐酸,有气泡产生,说明氢氧化钙已变质
② 变质程度的探究(已知变质):取少量样品,加水溶解后过滤,向所得滤液中滴加
酚酞试液,若滤液变红,说明氢氧化钙部分变质,若滤液不变色,则氢氧化钙已全
部变质
(2)氢氧化钠变质探究
① 是否变质的实验探究
具体操作、现象与结论
气化法 取样溶于水,加入过量稀盐酸,若有气泡产生,证明NaOH已经变质
沉淀法 取样溶于水,加入BaCl2(或CaCl2)溶液,若有白色沉淀生成,证明NaOH已经变质
②变质程度的探究
实验 目的 具体操作、现象与结论
除去Na2CO3 取样溶于水,加入过量的BaCl2(或CaCl2)溶液,产生白色沉淀,充分反应后过滤
检验NaOH 向滤液中滴加酚酞试液,若溶液变红,说明部分变质,若溶液不变红,说明是全部变质
4. 纯碱样品中碳酸钠质量分数的测定
(1)生成气体
① 实验原理:H2SO4+Na2CO3= Na2SO4+H2O+CO2↑
② 实验方法:向质量为m的纯碱样品中加入足量的稀硫酸,准确测量生成的二氧化碳
气体的质量为m1
③ 数据处理:纯碱样品中碳酸钠的质量分数为
(2)生成沉淀
① 实验原理:BaCl2+Na2CO3=BaCO3↓+2NaCl
② 实验方法:先将质量为m的纯碱样品溶于水配成溶液,向溶液中加入过量的氯化钡
溶液,经过滤、洗涤、干燥可得BaCO3沉淀的质量为n
③ 数据处理:纯碱样品中碳酸钠的质量分数为
室温时,在氢氧化钠溶液与盐酸反应中,测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是( )
A.所得溶液的pH随加入溶液体积的变化是不均匀的
B.该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中
C.当滴入溶液体积为5mL时,所得溶液中含有两种溶质
D.当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色
某科学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
【实验探究】
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变
红,然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
① 实验结论 。
② 从微观的角度分析,该反应的实质是 。
(2)方案Ⅱ:
实验步骤 实验现象 结论
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 若有气泡产生 稀盐酸过量
若没有明显现象 NaOH溶液与稀盐酸恰好完全反应
【实验反思】
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完
全反应” (填序号)。
A.铜片 B.pH试纸 C.氧化铜 D.紫色石蕊试液
实验室中同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是( )
A.甲溶液可以选择稀盐酸或CaC12溶液
B.若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C.D物质可能是气体,也可能是沉淀
D.溶液B中的溶质一定只含有NaOH和甲
实验室有一瓶久置的氢氧化钠固体,某同学想了解是否变质和变质程度,设计了实验,过程如下,有关实验说法不正确的是( )
A.实验证明该氢氧化钠已变质
B.有10.6克的氢氧化钠发生了变质
C.能进一步推算出氢氧化钠变质的程度
D.可用硝酸钡溶液代替氯化钡溶液完成实验
某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠,用如图装置对产品进行碳酸钠的含量分析。(已知:HCl+NaHCO3→NaCl+CO2↑+H2O;CO2在饱和NaHCO3溶液中溶解度很小)有关实验操作说法正确的是( )
A.锥形瓶中原有的空气对实验结果无影响
B.对取用样品的量的多少无一定要求
C.实验中若改用水,对测定无影响
D.实验中加入盐酸液体的体积,对测定无影响
某纯碱样品中混有少量的氯化钠,为了测定该样品中碳酸钠的质量分数,小明同学准确称取12.0g样品,做了如下实验:
请回答下列问题:
(1)操作X用到的玻璃仪器除烧杯、玻璃棒外,还必需有 。
(2)写出滤液C中的溶质的化学式 。
(3)若将滤渣B洗涤烘干后,称量其质量为10.0g,则该纯碱样品中的Na2CO3的质量分
数为 。
模块三 酸碱盐综合
1. 溶液中的离子与物质共存
(1)有气体产生:如与OH-,H+与、等不能大量共存
(2)有水生成:OH-与H+不能大量共存
(3)有沉淀生成
① Cl-与Ag+不能大量共存
② 与Ba2+、Ca2+、Ag+等不能大量共存
③ 与Mg2+、Ba2+、Ca2+、Ag+、Cu2+、Zn2+等不能大量共存
④ OH-与Mg2+、Cu2+、Al3+、Ag+、Zn2+、Fe2+、Fe3+等不能大量共存
2. 复分解反应后溶液中溶质成分的探究
(1)对反应后所得溶液溶质成分的猜想
① 写出相应的化学反应方程式
② 反应后的溶液中一定有可溶性的生成物,反应后的溶液中可能有可溶性反应物中的
一种
③ 如果将几个反应的废液同时倒入废液缸,要考虑溶质是否能够在溶液中共存
(2)判断反应后溶液中溶质成分的方法
① 确定反应物是否有剩余,一定要关注实际操作时所加入的试剂量,即注意少量、适
量、过量、一定量的不同
② 选择合适的试剂向反应后的溶液中滴加,通过特征反应来判断溶液中的溶质组成
小明向盛有盐酸和氯化镁溶液的烧杯中加入一定量的氢氧化钠溶液,为判断反应后溶液的成分,他分别取少量反应后的溶液 a 于试管中,用下表中的试剂进行实验,相应的结果错误的是( )
选项 试剂 现象和结论
A 氧化铁粉末 溶液变为黄色,则溶液一定含有MgCl2
B 铁粉 无明显现象,则溶液一定有两种溶质
C NaOH溶液 无明显现象,则溶液a可能有NaOH
D 氯化铁溶液 有红褐色沉淀,则溶液一定有两种溶质
某科学兴趣小组设计了一组实验,已知甲中盛有一定量的碳酸钠溶液,实验流程如图所示:下列说法正确的个数是( )
①乙中溶液为红色;
②丙中溶液的溶质组成有2种可能情况;
③丙中加入过量稀盐酸后,观察到的现象为有气泡产生,溶液由红色变为无色,白色沉淀消失;
④丁中溶液的溶质除酚酞外,只有氯化钠、氯化氢
A.1 B.2 C.3 D.4
某科学实验小组在验证酸碱盐的化学性质时做如图所示的实验:
(1)实验一中能够观察到的明显现象是 。
(2)将上述实验后三支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色
固体A和无色溶液B,向溶液B中滴加少量Ba(OH)2溶液,无现象。综上分析,固
体A的成分是 ;溶液B中除酚酞外,一定还含有的溶质是 。
例1.B
解:氧化铁与稀盐酸、稀硫酸均能反应,生成盐和水;金属锌与稀盐酸、稀硫酸均能发生置换反应,生成盐和氢气;氢氧化铜与稀盐酸、稀硫酸均能发生中和反应,生成盐和水;氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,与稀盐酸不反应。故表现了“酸的通性”的组合是①②③。
故选:B。
练1.1.C
解:A、氧化铁属于金属氧化物,能与稀盐酸反应生成氯化铁和水;氢氧化钙与稀盐酸反应生成氯化钙和水;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;氢氧化钙与碳酸钙分别属于碱和盐,符合要求,故选项错误。
B、镁属于金属,能与稀盐酸反应生成氯化镁和氢气;碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳;氧化铜与稀盐酸反应生成氯化铜和水;碳酸钠与氧化铜分别属于盐和金属氧化物,符合要求,故选项错误。
C、铁属于金属,能与稀盐酸反应生成氯化亚铁和氢气;硝酸钠与稀盐酸交换成分,没有沉淀、气体或水生成,不能发生反应,不符合要求,故选项正确。
D、锌属于金属,能与稀盐酸反应生成氯化锌和氢气;氧化钙与稀盐酸反应生成氯化钙、水;硝酸银与稀盐酸反应生成氯化银沉淀和硝酸;三种物质分别属于金属单质、金属氧化物和盐,符合要求,故选项错误。
故选:C。
例2.C
解:A、Na2CO3溶液加入澄清石灰水中会生成白色沉淀,故此项错误;
B、Fe2O3加入NaOH溶液中,二者不发生反应,此项错误;
C、稀HCl滴入Ba(OH)2溶液中,发生中和反应,但没有沉淀和气体产生,没有明显现象,故此项正确。
D、CO2通入澄清石灰水中,溶液会变浑浊,此项错误。
故选:C。
练2.1.A
解:A、氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,②可能有沉淀生成,故选项说法正确。
B、氢氧化钠与三氧化硫反应生成硫酸钠和水,X不一定只能是硫酸,故选项说法错误。
C、二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,氧化物应为三氧化硫,故选项说法错误。
D、非金属氧化物与碱的反应,不属于复分解反应,故选项说法错误。
故选:A。
例3.C
解:A、加入的试剂不一定是硝酸银溶液,也可能是硫酸盐溶液等,故选项错误。
B、加入的试剂不可能是二氧化碳,二氧化碳不能与氯化钡溶液反应,故选项错误。
C、该溶液可能是溶液,可能是硫酸,无色溶液可能呈酸性,故选项正确。
D、白色沉淀不一定不溶于稀硝酸,也可能是碳酸钡沉淀,故选项错误。
故选:C。
练3.1.D
解:A、已知是向 向ag K2CO3溶液中滴入bgBa(OH)2溶液至恰好完全反应,故下方烧杯中盛装的物质应为K2CO3,根据K+和CO32﹣的个数比为2:1,可知O表示K+,正确;
B、由于K2CO3+Ba(OH)2=2KOH+BaCO3↓中有沉淀生成,则溶液的质量小于(a+b)g,正确;
C、由于BaCl2+K2CO3=BaCO3↓+2KCl,也有沉淀生成,正确;
D、根据化学反应方程式,结束时溶液中含有KOH,呈碱性,故滴入无色酚酞,溶液呈红色,错误。
故选:D。
例4.B
解:A、由测得溶液的pH随滴入溶液体积变化情况图,所得溶液的pH随加入溶液体积的变化是不均匀的,故选项说法正确。
B、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误。
C、当滴入溶液体积为5mL时,溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故选项说法正确。
D、当滴入溶液体积为20mL时,溶液的pH大于7,显碱性,所得溶液能使酚酞试液变红色,故选项说法正确。
故选:B。
练4.1.
(1)①NaOH 溶液与稀盐酸恰好完全反应
②H+和OH﹣反应生成H2O分子
(3)稀盐酸量不足的情况下,也无明显现象
(4)BD
解:(1)①酚酞遇碱性溶液可以变红,而遇到酸性或是中性溶液时则不会变色,所以当溶液变成无色时,证明NaOH溶液与稀硫酸恰好完全反应;
②从微观的角度分析,中和反应实质是氢离子和氢氧根离子生成水;
(2)镁和盐酸反应会生成氯化镁和氢气;
(3)向NaOH溶液中滴入一定量的稀盐酸,振荡后加入镁条,若没有明显现象,可能是NaOH溶液与稀盐酸恰好完全反应,或者稀盐酸的量不足,氢氧化钠有剩余;
(4)铜与稀盐酸不反应,若盐酸过量,也没有明显现象;用pH 试纸测定溶液的酸碱度,若=7,则恰好反应,若<7,酸有剩余;盐酸和氧化铜反应,若加入氧化铜,氧化铜逐渐减少,溶液逐渐变为蓝色,说明盐酸过量,若加入氧化铜无现象,可能是盐酸与氢氧化钠恰好反应,也有可能是氢氧化钠过量;如果滴入石蕊试液,石蕊试液变红,说明盐酸过量,如果石蕊试液不变红,说明盐酸恰好完全反应;故选BD;
答案为:
(1)①NaOH 溶液与稀盐酸恰好完全反应;
②H+和OH﹣反应生成H2O分子(离子方程式也可以);
(3)稀盐酸量不足的情况下,也无明显现象;
(4)B、D。
例5.B
【解答】解:A、甲溶液不能选择稀盐酸,因为氢氧化钠、碳酸钠均能与稀盐酸反应生成氯化钠溶液,溶液B为氯化钠溶液和盐酸的混合溶液,滴加酚酞溶液不变色,无法确定溶液中是否含有氢氧化钠,故选项说法错误。
B、甲溶液可以选用氯化钙溶液,若Ⅱ、Ⅲ均有明显现象(现象分别是产生白色沉淀、酚酞溶液变红色),分别说明含有碳酸钠、氢氧化钠,则说明样品部分变质,故选项说法正确。
C、由A选项的分析,D物质是沉淀,故选项说法错误。
D、溶液B中的溶质中一定含有碳酸钠与氯化钙反应生成的氯化钠,故选项说法错误。
故选:B。
练5.1.B
解:A、加入氯化钡产生沉淀,是因为碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,说明氢氧化钠已经变质,该选项说法正确;
B、设变质的氢氧化钠质量为x,
由 2NaOH+CO2═Na2CO3+H2O,BaCl2+Na2CO3═BaCO3↓+2NaCl可知,2NaOH~BaCO3↓,
2NaOH~BaCO3↓,
80 197
x 19.7g
=,
x=8g,
该选项说法不正确;
C、根据提供的数据可以计算变质的氢氧化钠质量、反应生成的碳酸钠质量、没有反应的氢氧化钠质量,因此能进一步推算出氢氧化钠变质的程度。该选项说法正确;
D、硝酸钡和碳酸钠反应生成碳酸钡沉淀和硝酸钠,因此可以用硝酸钡溶液代替氯化钡溶液完成实验,该选项说法正确。
故选:B。
例6.A
解:A、空气中含有的二氧化碳量很少,不会对结果产生大的影响。故A正确;
B、取用样品的量产生的二氧化碳的体积不能超过量筒的体积,因为样品量太多会使液体外溢或气体外逸导致测量不准;太少会导致气体量太少,产生的气压不够,造成较大误差。故B错误;
C、由于二氧化碳能溶于水,对测定有影响。故C错误;
D、实验中加入盐酸液体的体积过多,瓶内压强增大,排除的气体较多,对测定有影响。故D错误。
故选:A。
练6.1.
(1)漏斗 (2)NaCl、NaOH、Ca(OH)2
(3)88.3%
解:(1)操作X用到的玻璃仪器除烧杯、玻璃棒外,还必需有漏斗,故填:漏斗;
(2)根据图框,可知碳酸钠和氢氧化钙反应能生成碳酸钙沉淀和氢氧化钠,故滤液C中的溶质氯化钠、氢氧化钠和氢氧化钙;
(3)解:设纯碱样品中碳酸钠的质量为x,
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
106 100
x 10.0g
解得x=10.6g,
纯碱样品中的Na2CO3的质量分数为:×100%=88.3%,
答:纯碱样品中的Na2CO3的质量分数为88.3%
故答案为:
(1)漏斗;(2)NaCl、NaOH、Ca(OH)2;(3)88.3%
例7.B
解:A、加入氧化铁,溶液变为黄色,是因为氧化铁和盐酸反应生成氯化铁溶液(黄色)和水,则溶液一定含有盐酸,含有盐酸时同时一定含有氯化镁,该选项说法正确;
B、加入铁,无明显现象,说明溶液中不含有盐酸,溶液中可能含有一种物质,例如氢氧化钠和盐酸、氯化镁恰好完全反应时,溶液中含有一种物质氯化钠,该选项说法不正确;
C、如果氢氧化钠溶液过量时,加入氢氧化钠溶液无明显现象,该选项说法正确;
D、加入氯化铁溶液,有红褐色沉淀,则溶液一定有两种溶质,即含有氯化钠和氢氧化钠,该选项说法正确。
故选:B。
练7.1.B
解:①碳酸钠溶液显碱性,能使酚酞溶液变红色,故乙中溶液为红色,故说法正确。
②碳酸钠能与石灰水反应生成碳酸钙沉淀和氢氧化钠,丙中溶液的溶质组成有氢氧化钠、氢氧化钠和碳酸钠、氢氧化钠和氢氧化钙3种可能情况,故说法错误。
③两中加入过量稀盐酸后,碳酸钙沉淀能与稀盐酸反应生成二氧化碳气体,观察到的现象为有气泡产生,白色沉淀消失;稀盐酸过量,最终溶液显酸性,溶液由红色变为无色,故说法正确。
④丁中溶液的溶质除酚酞外,还有氯化钠、氯化氢、氯化钙,故说法错误。
故说法正确的个数是2个。
故选:B。
练7.2.
(1)溶液由无色变成红色,再由红色变成无色
(2)BaSO4;NaCl、HCl和MgCl2
解:(1)由于碱性溶液能使无色酚酞试液变红色,中性或酸性溶液不能无色酚酞试液变红色,所以实验一中能够观察到的明显现象是:溶液由无色变成红色,再由红色变成无色;
(2)将上述实验后三支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体A和无色溶液B,溶液B中没有氢氧根离子;向溶液B中滴加少量Ba(OH)2溶液,无现象,说明溶液中无硫酸根离子,但有氢离子,所以固体A中没有氢氧化镁,只有硫酸钡;溶液中一定有的溶质是:NaCl、HCl和MgCl2。
故答案为:
(1)溶液由无色变成红色,再由红色变成无色;
(2)BaSO4;NaCl、HCl和MgCl2。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
