化学人教版(2019)必修第二册6.2.2化学反应的限度(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.2化学反应的限度(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 21:43:53 | ||
图片预览








文档简介
(共31张PPT)
第六章 化学反应与能量
第二节 化学反应的速率与限度
6.2.2 化学反应的限度
学习目标
1、能判断一个反应是否为可逆反应,了解可逆反应的特点。
2、理解化学平衡状态的特征及标志,知道改变条件化学平衡会发生改变。
3、了解控制反应条件在生产、生活和科学研究中的作用。
思考:在化学反应中,反应物是按照化学方程式中的系数比进行反应的,在实际生产中,反应物能否按相应的计量关系完全转化为生成物呢?
① 2H2 + O2 = 2H2O
已知:2mol 1mol
② 2SO2 + O2 2SO3
已知:2mol 1mol
2mol
<2mol
可逆反应中反应物不能全部转化为生成物,存在化学反应限度。
一定条件
课堂导入
1、可逆反应:
在同一条件下既能向正反应方向进行,同时又能向逆反应方向进行的反应称为可逆反应。
同一条件下
表示方法:书写可逆反应的化学方程式时不用“===”而用“ ”。
一、化学反应限度
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2 ↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C 的粒子有 。
1、以下几个反应是否是可逆反应?为什么?
1. 反应刚开始时, v正 、v逆 为何值?
2. 随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?
3. v正 递减、v逆 递增将导致二者之间出现什么的结果?
4. 在v正 = v逆 后,v正会继续减小吗?
5. v逆 会继续增大吗?反应物和生成物的浓度呢?
在一固定容积的密闭容器里,加 2 mol SO2和 1 mol O2 (合适催化剂),能发生什么反应?是否能生成2 mol SO3?
2SO2+O2 2SO3
催化剂
△
2.化学平衡状态的建立
一、化学反应限度
(1)开始
反应速率
v(正)
v(逆)
t1
时间(t)
0
c(SO2) 、c(O2)最大,
c(SO3)=0
2SO2 + O2 2SO3
v(正)最大,v(逆)=0
反应速率
v(正)
v(逆)
t1
时间(t)
0
v(正)
v(逆)
反应速率
t1
时间(t)
0
(3)平衡
(2)变化
v(正)减小,v(逆)增大
v(逆)≠0,v(正)>v(逆)
v(正)=v(逆) ≠0
c(SO2) 、c(O2 )减小,
c(SO3)增大
2SO2 + O2 2SO3
c(SO2) 、c(O2 )不变,
c(SO3)不变
2SO2+O2 2SO3
催化剂
△
反应物浓度最大,生成物浓度为0
反应物浓度不变,生成物浓度不变
反应物浓度减小,生成物浓度增大
正反应速率
逆反应速率
v正= v正(化学平衡状态)
时间
反应速率
3.化学平衡状态
(1)化学平衡状态的概念
在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。
t1
(1) 0-t1 : v(正)____v(逆)
(2) t1以后:v(正)____v(逆)
>
=
一、化学反应限度
动:动态平衡
等:v(正)= v(逆) ≠0
定:平衡时,各组分的浓度保持不变。
变:条件改变,原平衡破坏,建立新平衡。
逆:研究对象是可逆反应
(2)化学平衡状态的特征
(研究对象)
(外部特征)
(本质原因)
3.化学平衡状态
判断可逆反应是否达到平衡的直接标志。
一、化学反应限度
1、对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
C
2、在一定温度下,可逆反应A(g)+3B (g) 2C(g) 达到平衡状态的标志是( )
A
A. C的生成速率和C的分解速率相等.
B. 单位时间内生成1molA同时生成了3molB.
C. A、B、C浓度一样
D. A、B、C的分子个数之比为1:3:2
(1)等速标志:
v(正) = v(逆) ≠ 0(化学平衡的本质)
方法1:一正一逆,符合比例
以N2+3H2 2NH3为例
v正(H2) v正(NH3)
3 2
=
v正(N2)
1
=
任意时刻成立
v逆(H2) v逆(NH3)
3 2
=
v逆(N2)
1
=
任意时刻成立
=
=
=
平衡时刻成立
同种物质: v正 = v逆 消耗速率 = 生成速率
不同物质:一正一逆,速率之比 = 计量数之比
4、化学平衡状态的判断
一、化学反应限度
(2)浓度不变标志:
①反应体系中各物质的浓度不随时间的改变而改变。
②各组成成分的质量、质量分数、物质的量、物质的量分数、气体的体积及体积分数、物质的量浓度、分子数、反应物的转化率、产物的产率保持不变时为平衡状态。
(注意不是相等,也不是成一定的比例)
③反应体系中的总物质的量、总体积、总压强、平均摩尔质量、混合气体的密度、颜色等保持不变时,要根据具体情况判断是否为平衡状态。
温度:绝热的恒容反应体系中温度保持不变,说明已达平衡
颜色:针对有颜色变化的反应,若颜色保持不变,可认为已达平衡
方法2:变量不变,平衡出现
4、化学平衡状态的判断
一、化学反应限度
直 接 标 志
速率
v(正)=v(逆)
浓度不再改变
4、化学平衡状态的判断
方法1:一正一逆,符合比例
方法2:变量不变,平衡出现
一、化学反应限度
1、以3H2+N2 2NH3为列分析,判断下列情形是否达到平衡状态
(1) 若有1molN2消耗,则有1molN2生成。
(2) 若有1molN2消耗,则有3molH2生成。
(3) 若有1molN2消耗,则有2molNH3生成。
(4) 若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5) 若有1molN≡N键断裂,则有6molN﹣H键生成。
(6) 若反应体系中N2、H2、NH3的百分含量不变。
(7) 反应体系中平均相对分子质量一定。
(8) 若体系的体积一定,气体的密度一定。
(9) 若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
在一恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g),下列说法能够证明上述反应已达平衡状态的是:
①各物质的物质的量浓度不再改变
②SO2 、O2、SO3的浓度之比为2:1:2
③ SO2的转化率不再改变
④ SO3的体积分数不再改变
⑤混合物的总质量不再改变
⑥混合气体的密度不再改变
⑦混合物的颜色不再改变
⑧混合物的平均摩尔质量不再改变
⑨绝热容器中反应体系的温度不再改变
⑩恒温容器中混合气体的压强一定
①③④⑧⑨⑩
公式:
公式:
其他特别的反应类型:
A(g)+B(s) C(g)
其他有颜色变化的反应:
I2(g)+H2(g) 2HI(g)
(紫色)
公式:
公式:PV=nRT
间 接 标志
压强不变
若m+n≠p+q
平衡
若m+n=p+q
不一定
平均相对分子质量不变
若m+n≠p+q
若m+n=p+q
平衡
不一定
密度不变
若m+n≠p+q
若m+n=p+q
不一定
不一定
颜色不变
平衡
4、化学平衡状态的判断
以mA(g)+nB(g) pC(g)+qD(g) 为例
一、化学反应限度
归纳总结
化学平衡状态的判断依据
1.化学平衡状态:
是可逆反应在一定条件下所能达到或完成的最大程度,即该反应进行的限度。
2.对化学反应限度的理解:
N2(g) + 3H2 (g) = 2NH3(g)
起:
变:
平:
1 3 0
0.8
0.2
0.6
2.4
0.4
0.4
一、化学反应的限度
①同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的限度。
②化学反应的限度决定了反应物在一定条件下的最大转化率。
科学史话
1.控制反应条件的目的:
促进有利的化学反应(提高反应速率,提高反应物的转化率即原料的利用率)
抑制有害的化学反应(降低反应速率,控制副反应的发生,减少甚至消除有害物质的产生)
阅读课本P47-48,了解化学反应条件的控制的目的和方法
2.方法:
3.工业合成氨条件的控制:
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
通过改变条件改变反应的速率和可逆反应进行的程度
二、化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
催化剂
高温、高压
N2 + 3H2 2NH3
合成氨的生产压强越大,氨的产率越高;在温度较低时,氨的产率较高,但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高。工业上通常选择在400~500℃下进行,而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
压强:10~30MPa
温度:400~500℃
催化剂:铁触媒
催化剂也在400~500℃时催化效率高
二、化学反应条件的控制
思考与讨论:为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
①燃料与空气接触;
②温度达到燃料的着火点。
(2)燃料充分燃烧的条件
①要有足够的空气或氧气(助燃剂);
②燃料与空气或氧气要有足够大的接触面积。
(3)燃料充分燃烧的意义
①使有限的能量发挥最大的作用,节约能源;
②降低污染程度。
二、化学反应条件的控制
二、化学反应条件的控制
1.以下关于合成氨工业中条件控制的叙述正确的是 ( )
A. 选择在400~500℃下进行生产的目的是为了减小反应速率
B. 高压下反应速率太慢,所以未选择很高的压强
C. 关于生产条件的控制,只需要考虑反应的限度
D. 加入催化剂的目的是为了加快反应速率
2.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果改变条件提高化学反应的限度,下列说法错误的是( )
A. 能够节约原料和能源 B. 能够提高产品的产量
C. 能够提高经济效益 D. 能够提高化学反应速率
D
D
课堂小结
一定条件下的密闭容器中,发生可逆反应:N2(g)+3H2(g) 2NH3(g)。下列哪些情况能说明正反应速率和逆反应速率相等,反应达到了平衡状态。
①生成2 mol NH3的同时消耗1 mol N2
②v(N2)∶v(H2)∶v(NH3)=1∶3∶2
③2v正(H2)=3v正(NH3)
④1个N≡N断裂的同时,有6个N—H断裂
⑤H2的百分含量保持不变
⑥NH3的体积分数保持不变
⑦压强保持不变
√
√
√
×
×
×
√
1、可逆反应2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
H2(g)+I2(g) 2HI(g)
2.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
C
3.在体积不变的密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内生成2a mol NH3,同时消耗a mol N2
4.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是( )
A.能够节约原料和能源 B.能够提高产品的产量
C.能够提高经济效益 D.能够提高化学反应速率
D
5.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
6.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
第六章 化学反应与能量
第二节 化学反应的速率与限度
6.2.2 化学反应的限度
学习目标
1、能判断一个反应是否为可逆反应,了解可逆反应的特点。
2、理解化学平衡状态的特征及标志,知道改变条件化学平衡会发生改变。
3、了解控制反应条件在生产、生活和科学研究中的作用。
思考:在化学反应中,反应物是按照化学方程式中的系数比进行反应的,在实际生产中,反应物能否按相应的计量关系完全转化为生成物呢?
① 2H2 + O2 = 2H2O
已知:2mol 1mol
② 2SO2 + O2 2SO3
已知:2mol 1mol
2mol
<2mol
可逆反应中反应物不能全部转化为生成物,存在化学反应限度。
一定条件
课堂导入
1、可逆反应:
在同一条件下既能向正反应方向进行,同时又能向逆反应方向进行的反应称为可逆反应。
同一条件下
表示方法:书写可逆反应的化学方程式时不用“===”而用“ ”。
一、化学反应限度
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2
放电
充电
2H2O
H2↑+O2 ↑
电解
点燃
√
×
√
×
14CO2、14C、14CO
2、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C 的粒子有 。
1、以下几个反应是否是可逆反应?为什么?
1. 反应刚开始时, v正 、v逆 为何值?
2. 随着反应的进行,反应物和生成物的浓度如何改变?速率如何变化?
3. v正 递减、v逆 递增将导致二者之间出现什么的结果?
4. 在v正 = v逆 后,v正会继续减小吗?
5. v逆 会继续增大吗?反应物和生成物的浓度呢?
在一固定容积的密闭容器里,加 2 mol SO2和 1 mol O2 (合适催化剂),能发生什么反应?是否能生成2 mol SO3?
2SO2+O2 2SO3
催化剂
△
2.化学平衡状态的建立
一、化学反应限度
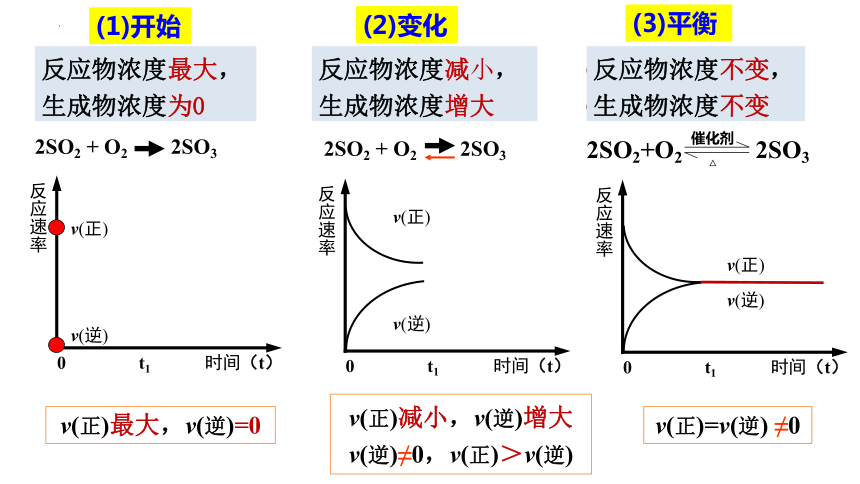
(1)开始
反应速率
v(正)
v(逆)
t1
时间(t)
0
c(SO2) 、c(O2)最大,
c(SO3)=0
2SO2 + O2 2SO3
v(正)最大,v(逆)=0
反应速率
v(正)
v(逆)
t1
时间(t)
0
v(正)
v(逆)
反应速率
t1
时间(t)
0
(3)平衡
(2)变化
v(正)减小,v(逆)增大
v(逆)≠0,v(正)>v(逆)
v(正)=v(逆) ≠0
c(SO2) 、c(O2 )减小,
c(SO3)增大
2SO2 + O2 2SO3
c(SO2) 、c(O2 )不变,
c(SO3)不变
2SO2+O2 2SO3
催化剂
△
反应物浓度最大,生成物浓度为0
反应物浓度不变,生成物浓度不变
反应物浓度减小,生成物浓度增大
正反应速率
逆反应速率
v正= v正(化学平衡状态)
时间
反应速率
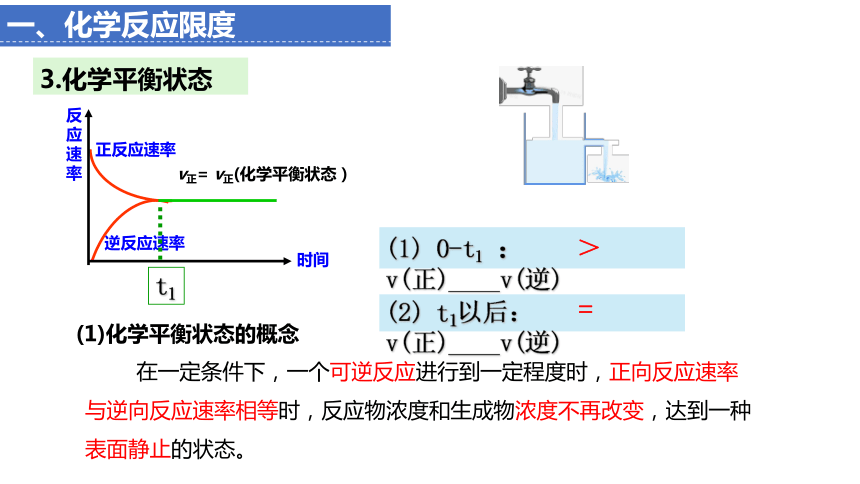
3.化学平衡状态
(1)化学平衡状态的概念
在一定条件下,一个可逆反应进行到一定程度时,正向反应速率与逆向反应速率相等时,反应物浓度和生成物浓度不再改变,达到一种表面静止的状态。
t1
(1) 0-t1 : v(正)____v(逆)
(2) t1以后:v(正)____v(逆)
>
=
一、化学反应限度
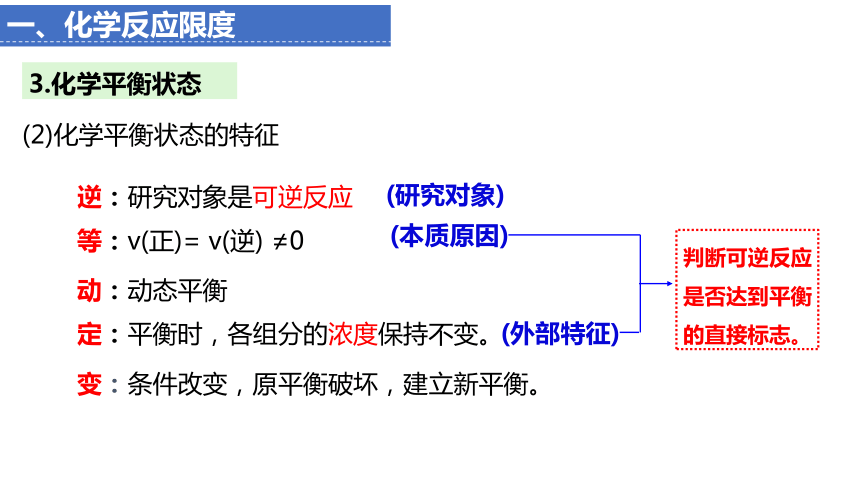
动:动态平衡
等:v(正)= v(逆) ≠0
定:平衡时,各组分的浓度保持不变。
变:条件改变,原平衡破坏,建立新平衡。
逆:研究对象是可逆反应
(2)化学平衡状态的特征
(研究对象)
(外部特征)
(本质原因)
3.化学平衡状态
判断可逆反应是否达到平衡的直接标志。
一、化学反应限度
1、对于可逆反应M+N Q 达到平衡时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. 反应物和生成物的浓度都保持不变
D. 反应已经停止
C
2、在一定温度下,可逆反应A(g)+3B (g) 2C(g) 达到平衡状态的标志是( )
A
A. C的生成速率和C的分解速率相等.
B. 单位时间内生成1molA同时生成了3molB.
C. A、B、C浓度一样
D. A、B、C的分子个数之比为1:3:2
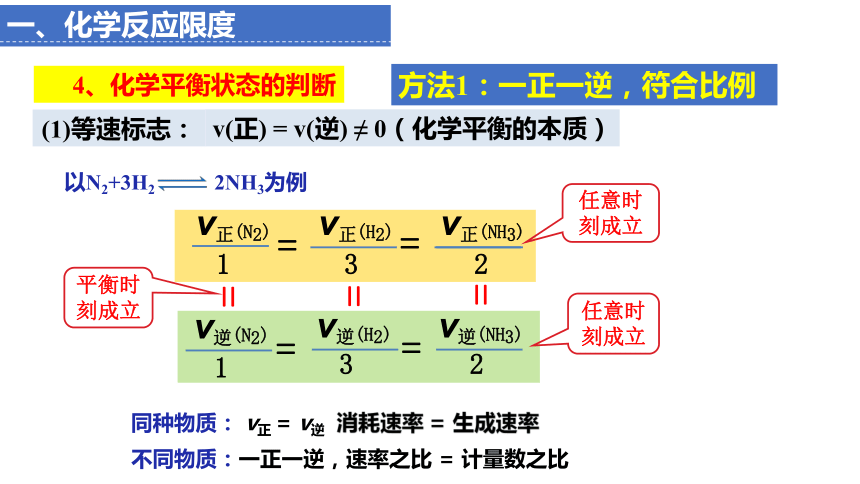
(1)等速标志:
v(正) = v(逆) ≠ 0(化学平衡的本质)
方法1:一正一逆,符合比例
以N2+3H2 2NH3为例
v正(H2) v正(NH3)
3 2
=
v正(N2)
1
=
任意时刻成立
v逆(H2) v逆(NH3)
3 2
=
v逆(N2)
1
=
任意时刻成立
=
=
=
平衡时刻成立
同种物质: v正 = v逆 消耗速率 = 生成速率
不同物质:一正一逆,速率之比 = 计量数之比
4、化学平衡状态的判断
一、化学反应限度
(2)浓度不变标志:
①反应体系中各物质的浓度不随时间的改变而改变。
②各组成成分的质量、质量分数、物质的量、物质的量分数、气体的体积及体积分数、物质的量浓度、分子数、反应物的转化率、产物的产率保持不变时为平衡状态。
(注意不是相等,也不是成一定的比例)
③反应体系中的总物质的量、总体积、总压强、平均摩尔质量、混合气体的密度、颜色等保持不变时,要根据具体情况判断是否为平衡状态。
温度:绝热的恒容反应体系中温度保持不变,说明已达平衡
颜色:针对有颜色变化的反应,若颜色保持不变,可认为已达平衡
方法2:变量不变,平衡出现
4、化学平衡状态的判断
一、化学反应限度
直 接 标 志
速率
v(正)=v(逆)
浓度不再改变
4、化学平衡状态的判断
方法1:一正一逆,符合比例
方法2:变量不变,平衡出现
一、化学反应限度
1、以3H2+N2 2NH3为列分析,判断下列情形是否达到平衡状态
(1) 若有1molN2消耗,则有1molN2生成。
(2) 若有1molN2消耗,则有3molH2生成。
(3) 若有1molN2消耗,则有2molNH3生成。
(4) 若有1molN≡N键断裂,则有6molN﹣H键断裂。
(5) 若有1molN≡N键断裂,则有6molN﹣H键生成。
(6) 若反应体系中N2、H2、NH3的百分含量不变。
(7) 反应体系中平均相对分子质量一定。
(8) 若体系的体积一定,气体的密度一定。
(9) 若体系的体积一定,气体的压强一定。
是
否
是
是
是
是
否
是
否
在一恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g),下列说法能够证明上述反应已达平衡状态的是:
①各物质的物质的量浓度不再改变
②SO2 、O2、SO3的浓度之比为2:1:2
③ SO2的转化率不再改变
④ SO3的体积分数不再改变
⑤混合物的总质量不再改变
⑥混合气体的密度不再改变
⑦混合物的颜色不再改变
⑧混合物的平均摩尔质量不再改变
⑨绝热容器中反应体系的温度不再改变
⑩恒温容器中混合气体的压强一定
①③④⑧⑨⑩
公式:
公式:
其他特别的反应类型:
A(g)+B(s) C(g)
其他有颜色变化的反应:
I2(g)+H2(g) 2HI(g)
(紫色)
公式:
公式:PV=nRT
间 接 标志
压强不变
若m+n≠p+q
平衡
若m+n=p+q
不一定
平均相对分子质量不变
若m+n≠p+q
若m+n=p+q
平衡
不一定
密度不变
若m+n≠p+q
若m+n=p+q
不一定
不一定
颜色不变
平衡
4、化学平衡状态的判断
以mA(g)+nB(g) pC(g)+qD(g) 为例
一、化学反应限度
归纳总结
化学平衡状态的判断依据
1.化学平衡状态:
是可逆反应在一定条件下所能达到或完成的最大程度,即该反应进行的限度。
2.对化学反应限度的理解:
N2(g) + 3H2 (g) = 2NH3(g)
起:
变:
平:
1 3 0
0.8
0.2
0.6
2.4
0.4
0.4
一、化学反应的限度
①同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的限度。
②化学反应的限度决定了反应物在一定条件下的最大转化率。
科学史话
1.控制反应条件的目的:
促进有利的化学反应(提高反应速率,提高反应物的转化率即原料的利用率)
抑制有害的化学反应(降低反应速率,控制副反应的发生,减少甚至消除有害物质的产生)
阅读课本P47-48,了解化学反应条件的控制的目的和方法
2.方法:
3.工业合成氨条件的控制:
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
通过改变条件改变反应的速率和可逆反应进行的程度
二、化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
催化剂
高温、高压
N2 + 3H2 2NH3
合成氨的生产压强越大,氨的产率越高;在温度较低时,氨的产率较高,但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高。工业上通常选择在400~500℃下进行,而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
压强:10~30MPa
温度:400~500℃
催化剂:铁触媒
催化剂也在400~500℃时催化效率高
二、化学反应条件的控制
思考与讨论:为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
①燃料与空气接触;
②温度达到燃料的着火点。
(2)燃料充分燃烧的条件
①要有足够的空气或氧气(助燃剂);
②燃料与空气或氧气要有足够大的接触面积。
(3)燃料充分燃烧的意义
①使有限的能量发挥最大的作用,节约能源;
②降低污染程度。
二、化学反应条件的控制
二、化学反应条件的控制
1.以下关于合成氨工业中条件控制的叙述正确的是 ( )
A. 选择在400~500℃下进行生产的目的是为了减小反应速率
B. 高压下反应速率太慢,所以未选择很高的压强
C. 关于生产条件的控制,只需要考虑反应的限度
D. 加入催化剂的目的是为了加快反应速率
2.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果改变条件提高化学反应的限度,下列说法错误的是( )
A. 能够节约原料和能源 B. 能够提高产品的产量
C. 能够提高经济效益 D. 能够提高化学反应速率
D
D
课堂小结
一定条件下的密闭容器中,发生可逆反应:N2(g)+3H2(g) 2NH3(g)。下列哪些情况能说明正反应速率和逆反应速率相等,反应达到了平衡状态。
①生成2 mol NH3的同时消耗1 mol N2
②v(N2)∶v(H2)∶v(NH3)=1∶3∶2
③2v正(H2)=3v正(NH3)
④1个N≡N断裂的同时,有6个N—H断裂
⑤H2的百分含量保持不变
⑥NH3的体积分数保持不变
⑦压强保持不变
√
√
√
×
×
×
√
1、可逆反应2NO2(红棕色) 2NO(无色)+O2(无色)在密闭容器中反应,达到化学平衡状态的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C.c(NO2):c(NO):c(CO2)= 2: 2: 1
D.混合气体的颜色不再改变
F.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
H.混合气体个组分的 体积分数不再改变
ADEH
H2(g)+I2(g) 2HI(g)
2.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
C
3.在体积不变的密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内生成2a mol NH3,同时消耗a mol N2
4.化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法中错误的是( )
A.能够节约原料和能源 B.能够提高产品的产量
C.能够提高经济效益 D.能够提高化学反应速率
D
5.下列措施可以提高燃料燃烧效率的是_________(填序号)。
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
③④⑤⑥
6.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒
(2)步骤②中“加压”可以加快反应速率
(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大
(4)步骤③,选择高效催化剂是合成氨反应的重要条件
(5)目前,步骤③一般选择控制反应温度为700 ℃左右
(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
