化学人教版(2019)必修第二册6.2.1化学反应的速率(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.1化学反应的速率(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-14 21:44:34 | ||
图片预览








文档简介
(共27张PPT)
在化学反应的研究和实际应用
关注点1:选择合适的化学反应以实现所期待的物质转化或能量转化
关注点2:化学反应进行的快慢和程度,以提高生产效率
第六章 化学反应与能量
第二节 化学反应的速率与限度
6.2.1 化学反应的速率
学习目标
1.理解化学反应速率的概念和表示方法,能从定量的角度描述化学反应快慢,进行简单计算。
2.通过探究影响化学反应速率的因素,初步设计实验,学会变量控制的科学方法,增强证据推理的意识,提高科学探究能力 。
3.尝试用化学原理解释生活生产中有关化学反应快慢的现象。
课堂导入
爆炸
生锈
溶洞
化学反应也有快有慢!如何界定化学反应的快慢?
想一想
物理上:
速度:单位时间内物体运动的位移
单位时间
某个变化量
化学反应速率:单位时间内 ?的改变
质量?物质的量?体积?物质的量浓度?
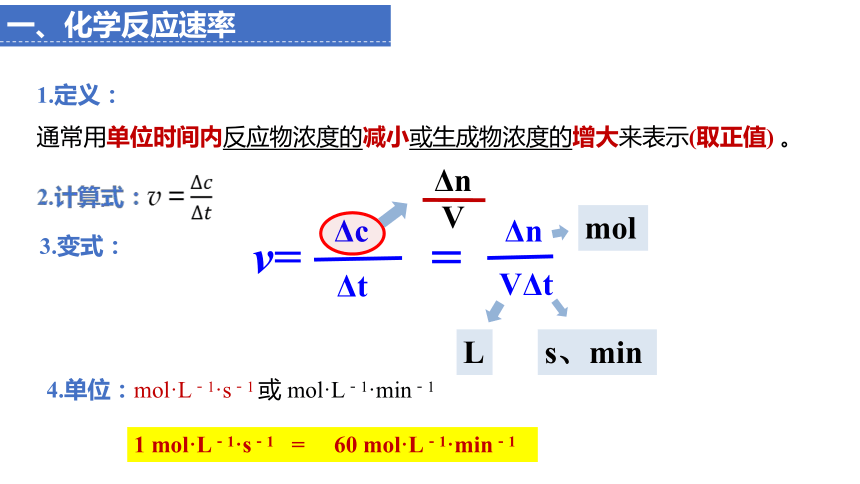
一、化学反应速率
1.定义:
通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值) 。
4.单位:mol·L-1·s-1 或 mol·L-1·min-1
2.计算式:v=
v=
Δc
Δt
Δn
V
=
Δn
VΔt
mol
L
s、min
3.变式:
1 mol·L-1·s-1 = 60 mol·L-1·min-1
随堂检测
[例1] 在2L含有0.8mol的HCl溶液中放入56g铁粉,发生反应Fe(s)+2HCl (aq) ===FeCl2 (aq)+H2 (g),2min后HCl物质的量为0.2mol,在这2min内用盐酸表示的该反应速率为_______________,用氯化亚铁表示的反应速率为_______________
Fe(s)+2HCl (aq) ===FeCl2 (aq)+H2 (g)
起始
0.8mol
0mol
0mol
转化
2min末
0.6mol
0.2mol
0.3mol
0.3mol
0.3mol
0.3mol
0mol
0mol
0mol
v(HCl) =
Δc (HCl)
Δt
V·△t
=
△n(HCl)
0.15mol/(L·min)
0.075mol/(L·min)
v(B) =
Δc (B)
Δt
容器的体积
V·△t
=
△n(B)
指明具体物质
2 2
=
0.6
0.15mol/(L·min)
=
思考讨论:
Fe(s) + 2HCl (aq) ===FeCl2 (aq)+H2 (g)
起始
0.8mol
0mol
0mol
转化
2min末
0.6mol
0.2mol
0.3mol
0.3mol
0.3mol
0.3mol
0mol
0mol
0mol
Δc (Fe)
=
0
v(B) =
Δc (B)
Δt
V·△t
=
△n(B)
思考讨论:
思考1:
同一反应中,速率之比等于化学方程式中的系数之比。
aA+bB = cC+dD,V(A)︰V(B)︰V(C)︰V(D)=a︰b︰c︰d
思考2:
固体或纯液体其浓度可视为常数,不用固体或纯液体表示化学反应速率。
下列反应,其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏
■ 炼钢 ■ 合成氨
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
二、影响化学反应速率的因素
(1)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(2)铁在空气中和在纯氧中反应的剧烈程度明显不同。
(3)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
(4)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品研细并混匀,或者将固体试剂溶于水配成溶液后再进行实验。
(5)钠与冷水反应剧烈,铁与冷水不反应
注:参加反应的物质自身的性质是决定化学反应速率的主要原因。
二、影响化学反应速率的因素
下列案例中,分别利用或体现了哪些影响反应速率的因素?
影响化学反应速率的因素
【问题】我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影响化学反应的速率?
【假设】
影响化学反应速率的因素可能有反应温度、反应物浓度等。
【实验用品】
5%H2O2溶液、1mol/LFeCl3溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、冷水、热水、试管、试管夹、烧杯。
实验探究
方法导引
变量控制
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。
实验设计
实验方案设计
【实验用品】5%H2O2溶液、1mol/LFeCl3溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、冷水、热水、试管、试管夹、烧杯。
其它因素···
二、影响化学反应速率的因素
升高温度, v 加快 ;
降低温度, v 减慢
增大浓度, v 加快 ;
减小浓度, v 减慢
固体和纯液体无影响
催化剂,加快v
增大比表面积, v 加快
如:块状 → 粉末状
二、影响化学反应速率的因素
有气体参加的反应,改变压强时,只有导致参加反应的气体浓度改变,反应速率才会改变
压强对反应速率的影响
——有气体参与的反应
增大压强(减小容器的体积),
减小压强(减小容器的体积),
改变
浓度
C↑ , v 加快
C , v 减小
二、影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
二、影响化学反应速率的因素
课堂小结
一、化学反应速率
课堂小结
二、影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
课堂练习
1.在某一化学反应中,反应物A的浓度在10 s内从0.8 mol·L-1变为0.2 mol·L-1,则在这10 s内A的化学反应速率为( )
A.0.02 mol·L-1 B.0.02 mol·L-1·s-1
C.0.06 mol·L-1·s-1 D.0.06 mol·L-1·min-1
解析 10 s内A的化学反应速率为(0.8 mol·L-1-0.2 mol·L-1)÷10 s=
0.06 mol·L-1·s-1。
C
课堂练习
则该反应速率的快慢顺序为:_____________________
2.反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)>(4)>(2)>(3)
化学反应速率大小的比较
归一法
A + 3B = 2C + 2D
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)V(A)=0.3mol/(L·s )
(2) V(A)=0.2mol/(L·s)
(3) V(A)=0.003mol/(L·s)
(4) V(A)=0.225mol/(L·s)
统一单位
同一物质
(1)>(4)>(2)>(3)
比值法
A + 3B = 2C + 2D
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1) =0.3mol/(L·s )
(2) =0.2mol/(L·s)
(3) =0.2mol/(L·min)
(4) =0.225mol/(L·s)
(1)>(4)>(2)>(3)
化学反应速率大小的比较
课堂练习
3.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率最快的是( )
A.v(A)=0.15 mol/(L·s) B.v(B)=0.6 mol/(L·s)
C.v(C)=2.4 mol/(L·min) D.v(D)=0.45 mol/(L·s)
D
课堂练习
4. 在密闭容器里,通入x mol H2 (g)和y mol O2(g),改变下列条件,反应速率将如何改变?
(1)升高温度:________(填“增大”、“减小”、“不变”);
(2)加入催化剂:______________;
(3)充入更多的H2:________;
(4)扩大容器的容积:_______;
(5)容器容积不变,通入氖气:___________。
减小
增大
增大
增大
不变
在化学反应的研究和实际应用
关注点1:选择合适的化学反应以实现所期待的物质转化或能量转化
关注点2:化学反应进行的快慢和程度,以提高生产效率
第六章 化学反应与能量
第二节 化学反应的速率与限度
6.2.1 化学反应的速率
学习目标
1.理解化学反应速率的概念和表示方法,能从定量的角度描述化学反应快慢,进行简单计算。
2.通过探究影响化学反应速率的因素,初步设计实验,学会变量控制的科学方法,增强证据推理的意识,提高科学探究能力 。
3.尝试用化学原理解释生活生产中有关化学反应快慢的现象。
课堂导入
爆炸
生锈
溶洞
化学反应也有快有慢!如何界定化学反应的快慢?
想一想
物理上:
速度:单位时间内物体运动的位移
单位时间
某个变化量
化学反应速率:单位时间内 ?的改变
质量?物质的量?体积?物质的量浓度?
一、化学反应速率
1.定义:
通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示(取正值) 。
4.单位:mol·L-1·s-1 或 mol·L-1·min-1
2.计算式:v=
v=
Δc
Δt
Δn
V
=
Δn
VΔt
mol
L
s、min
3.变式:
1 mol·L-1·s-1 = 60 mol·L-1·min-1
随堂检测
[例1] 在2L含有0.8mol的HCl溶液中放入56g铁粉,发生反应Fe(s)+2HCl (aq) ===FeCl2 (aq)+H2 (g),2min后HCl物质的量为0.2mol,在这2min内用盐酸表示的该反应速率为_______________,用氯化亚铁表示的反应速率为_______________
Fe(s)+2HCl (aq) ===FeCl2 (aq)+H2 (g)
起始
0.8mol
0mol
0mol
转化
2min末
0.6mol
0.2mol
0.3mol
0.3mol
0.3mol
0.3mol
0mol
0mol
0mol
v(HCl) =
Δc (HCl)
Δt
V·△t
=
△n(HCl)
0.15mol/(L·min)
0.075mol/(L·min)
v(B) =
Δc (B)
Δt
容器的体积
V·△t
=
△n(B)
指明具体物质
2 2
=
0.6
0.15mol/(L·min)
=
思考讨论:
Fe(s) + 2HCl (aq) ===FeCl2 (aq)+H2 (g)
起始
0.8mol
0mol
0mol
转化
2min末
0.6mol
0.2mol
0.3mol
0.3mol
0.3mol
0.3mol
0mol
0mol
0mol
Δc (Fe)
=
0
v(B) =
Δc (B)
Δt
V·△t
=
△n(B)
思考讨论:
思考1:
同一反应中,速率之比等于化学方程式中的系数之比。
aA+bB = cC+dD,V(A)︰V(B)︰V(C)︰V(D)=a︰b︰c︰d
思考2:
固体或纯液体其浓度可视为常数,不用固体或纯液体表示化学反应速率。
下列反应,其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏
■ 炼钢 ■ 合成氨
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
二、影响化学反应速率的因素
(1)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(2)铁在空气中和在纯氧中反应的剧烈程度明显不同。
(3)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
(4)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品研细并混匀,或者将固体试剂溶于水配成溶液后再进行实验。
(5)钠与冷水反应剧烈,铁与冷水不反应
注:参加反应的物质自身的性质是决定化学反应速率的主要原因。
二、影响化学反应速率的因素
下列案例中,分别利用或体现了哪些影响反应速率的因素?
影响化学反应速率的因素
【问题】我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影响化学反应的速率?
【假设】
影响化学反应速率的因素可能有反应温度、反应物浓度等。
【实验用品】
5%H2O2溶液、1mol/LFeCl3溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、冷水、热水、试管、试管夹、烧杯。
实验探究
方法导引
变量控制
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。
实验设计
实验方案设计
【实验用品】5%H2O2溶液、1mol/LFeCl3溶液、0.1mol/L盐酸、1mol/L盐酸、大理石碎块、冷水、热水、试管、试管夹、烧杯。
其它因素···
二、影响化学反应速率的因素
升高温度, v 加快 ;
降低温度, v 减慢
增大浓度, v 加快 ;
减小浓度, v 减慢
固体和纯液体无影响
催化剂,加快v
增大比表面积, v 加快
如:块状 → 粉末状
二、影响化学反应速率的因素
有气体参加的反应,改变压强时,只有导致参加反应的气体浓度改变,反应速率才会改变
压强对反应速率的影响
——有气体参与的反应
增大压强(减小容器的体积),
减小压强(减小容器的体积),
改变
浓度
C↑ , v 加快
C , v 减小
二、影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
二、影响化学反应速率的因素
课堂小结
一、化学反应速率
课堂小结
二、影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
课堂练习
1.在某一化学反应中,反应物A的浓度在10 s内从0.8 mol·L-1变为0.2 mol·L-1,则在这10 s内A的化学反应速率为( )
A.0.02 mol·L-1 B.0.02 mol·L-1·s-1
C.0.06 mol·L-1·s-1 D.0.06 mol·L-1·min-1
解析 10 s内A的化学反应速率为(0.8 mol·L-1-0.2 mol·L-1)÷10 s=
0.06 mol·L-1·s-1。
C
课堂练习
则该反应速率的快慢顺序为:_____________________
2.反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)>(4)>(2)>(3)
化学反应速率大小的比较
归一法
A + 3B = 2C + 2D
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1)V(A)=0.3mol/(L·s )
(2) V(A)=0.2mol/(L·s)
(3) V(A)=0.003mol/(L·s)
(4) V(A)=0.225mol/(L·s)
统一单位
同一物质
(1)>(4)>(2)>(3)
比值法
A + 3B = 2C + 2D
(1)V(A)=0.3mol/(L·s )
(2) V(B)=0.6mol/(L·s)
(3) V(C)=0.4mol/(L·min)
(4) V(D)=0.45mol/(L·s)
(1) =0.3mol/(L·s )
(2) =0.2mol/(L·s)
(3) =0.2mol/(L·min)
(4) =0.225mol/(L·s)
(1)>(4)>(2)>(3)
化学反应速率大小的比较
课堂练习
3.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率最快的是( )
A.v(A)=0.15 mol/(L·s) B.v(B)=0.6 mol/(L·s)
C.v(C)=2.4 mol/(L·min) D.v(D)=0.45 mol/(L·s)
D
课堂练习
4. 在密闭容器里,通入x mol H2 (g)和y mol O2(g),改变下列条件,反应速率将如何改变?
(1)升高温度:________(填“增大”、“减小”、“不变”);
(2)加入催化剂:______________;
(3)充入更多的H2:________;
(4)扩大容器的容积:_______;
(5)容器容积不变,通入氖气:___________。
减小
增大
增大
增大
不变
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
