化学人教版(2019)必修第一册1.3.1氧化还原反应(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 09:07:36 | ||
图片预览





文档简介
(共19张PPT)
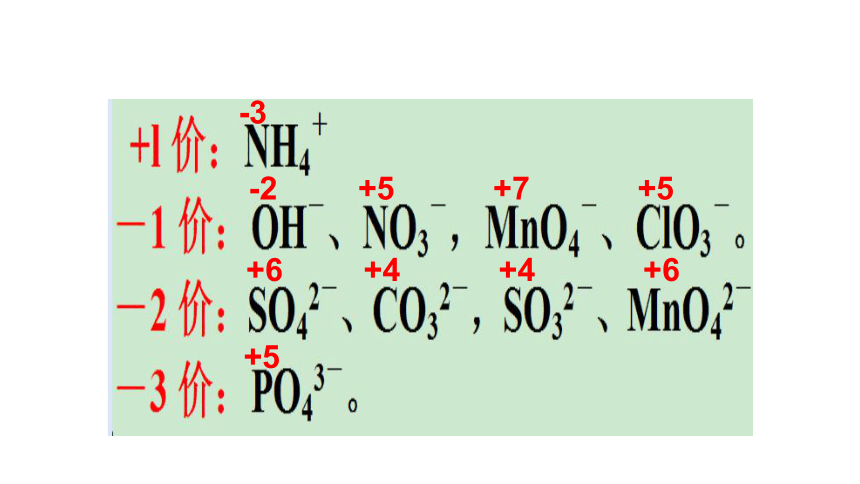
化合价口诀
-3
原子团化合价
-2 +5 +7 +5
+6 +4 +4 +6
+5
氧化还原反应
第1课时
学习目标
1、能够从化合价变化角度认识氧化还原反应。
2、能够从电子转移的角度认识氧化还原反应,并会分析判断。
3、掌握氧化还原反应的表示方法——双线桥。
切开的苹果其表面的颜色会逐渐变深
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
为什么?
切开的苹果中的某些化学物质与空气中的氧气接触,该化学物质被氧化,颜色发生了变化
红酒与氧气充分接触,使某些化学物质被氧化,从而使口感更柔和
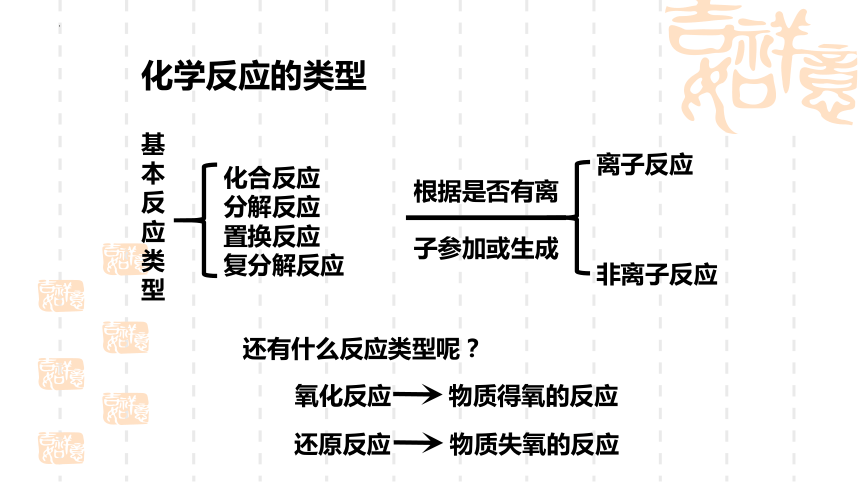
化学反应的类型
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
还有什么反应类型呢?
氧化反应
还原反应
物质得氧的反应
物质失氧的反应
创原家独
自学指导
仅从得失氧角度判断氧化还原反应准确吗?
元素化合价升降与什么有关?
氧化还原反应的外在标志?
氧化还原反应的实质?
+1 -1
失电子 化合价升高 被氧化
得电子 化合价降低 被还原
升失氧
降得还
+1 -1
偏离 偏向
共用电子对:
被氧化 发生氧化反应
化合价升高
得氧
被还原 发生还原反应
失氧
失电子或
共用电子对偏离
化合价降低
得电子或
共用电子对偏向
实质:电子转移(得失或偏移)
外在标志
CuO + H2 === Cu + H2O
+2 0 0 +1
升失氧
降得还
2、氧化还原反应的表示方法
——双线桥
⑴标化合价
⑵由反应物指向生成物,箭头、箭尾对准同一元素
⑶线上标明“失(得)ne-×a,化合价
升高(降低),被氧化(还原)”
得失电子数目×原子个数
3NO2+H2O===2HNO3+NO
(1)氧化还原反应中得电子的物质发生还原反应( )
(2)氧化还原反应中所有元素的化合价都一定发生变化( )
(3)一个反应中可以只有元素化合价升高,而无元素化合价降低( )
判断正误
√
×
×
(4)氧化还原反应中有一种元素被氧化,必然有另一种元素被还原( )
(5)元素由化合物变成单质一定是发生了还原反应( )
×
×
本课结束
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
SiO2+3C===SiC+2CO↑
2KMnO4===K2MnO4+MnO2+O2↑
3NO2+H2O===2HNO3+NO
化合价口诀
-3
原子团化合价
-2 +5 +7 +5
+6 +4 +4 +6
+5
氧化还原反应
第1课时
学习目标
1、能够从化合价变化角度认识氧化还原反应。
2、能够从电子转移的角度认识氧化还原反应,并会分析判断。
3、掌握氧化还原反应的表示方法——双线桥。
切开的苹果其表面的颜色会逐渐变深
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
为什么?
切开的苹果中的某些化学物质与空气中的氧气接触,该化学物质被氧化,颜色发生了变化
红酒与氧气充分接触,使某些化学物质被氧化,从而使口感更柔和
化学反应的类型
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
还有什么反应类型呢?
氧化反应
还原反应
物质得氧的反应
物质失氧的反应
创原家独
自学指导
仅从得失氧角度判断氧化还原反应准确吗?
元素化合价升降与什么有关?
氧化还原反应的外在标志?
氧化还原反应的实质?
+1 -1
失电子 化合价升高 被氧化
得电子 化合价降低 被还原
升失氧
降得还
+1 -1
偏离 偏向
共用电子对:
被氧化 发生氧化反应
化合价升高
得氧
被还原 发生还原反应
失氧
失电子或
共用电子对偏离
化合价降低
得电子或
共用电子对偏向
实质:电子转移(得失或偏移)
外在标志
CuO + H2 === Cu + H2O
+2 0 0 +1
升失氧
降得还
2、氧化还原反应的表示方法
——双线桥
⑴标化合价
⑵由反应物指向生成物,箭头、箭尾对准同一元素
⑶线上标明“失(得)ne-×a,化合价
升高(降低),被氧化(还原)”
得失电子数目×原子个数
3NO2+H2O===2HNO3+NO
(1)氧化还原反应中得电子的物质发生还原反应( )
(2)氧化还原反应中所有元素的化合价都一定发生变化( )
(3)一个反应中可以只有元素化合价升高,而无元素化合价降低( )
判断正误
√
×
×
(4)氧化还原反应中有一种元素被氧化,必然有另一种元素被还原( )
(5)元素由化合物变成单质一定是发生了还原反应( )
×
×
本课结束
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
SiO2+3C===SiC+2CO↑
2KMnO4===K2MnO4+MnO2+O2↑
3NO2+H2O===2HNO3+NO
