8.1溶液的酸碱性同步练习科粤版化学九年级下册(含答案)
文档属性
| 名称 | 8.1溶液的酸碱性同步练习科粤版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 737.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 12:37:05 | ||
图片预览



文档简介
8.1溶液的酸碱性 同步练习
一、多选题
1.小雅学习了 pH 相关知识后,对生活中的水果及饮料的 pH 产生了好奇,并查阅到部分水果及饮料的 pH 如下:
食物 柠檬 橘子汁 西瓜汁 苏打水
pH 2.9 3.8 6.4 8.6
下列说法正确的是
A.胃酸过多的人不宜多吃柠檬 B.西瓜汁显碱性
C.橘子汁比柠檬的酸性强 D.苏打水显碱性
2.某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是
酸雨pH 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大 B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小 D.酸雨的酸性越强,小麦的减产越大
3.化学是一门以实验为基础的科学,而规范的操作方法是实验安全和成功的保障。下列实验操作正确的是
A. 加热液体 B. 甲烷验纯
C. 取用液体 D. 测定溶液pH
4.溶液的pH大小与一定量溶液中所含的H+和OH-的数量有关。下列说法正确的是
A.H+浓度越大,pH越大 B.OH-浓度越大,pH越大
C.pH越小,H+浓度越小 D.OH-的质量分数越大,pH越大
5.下列叙述错误的是
A.正常雨水的pH约为5.6
B.空气中氧气的质量分数为21%
C.食品袋中常用铁粉作抗氧化剂,以延长食品的保质期
D.用二氧化碳灭火器灭火时,降低了可燃物的着火点且隔绝空气
二、选择题
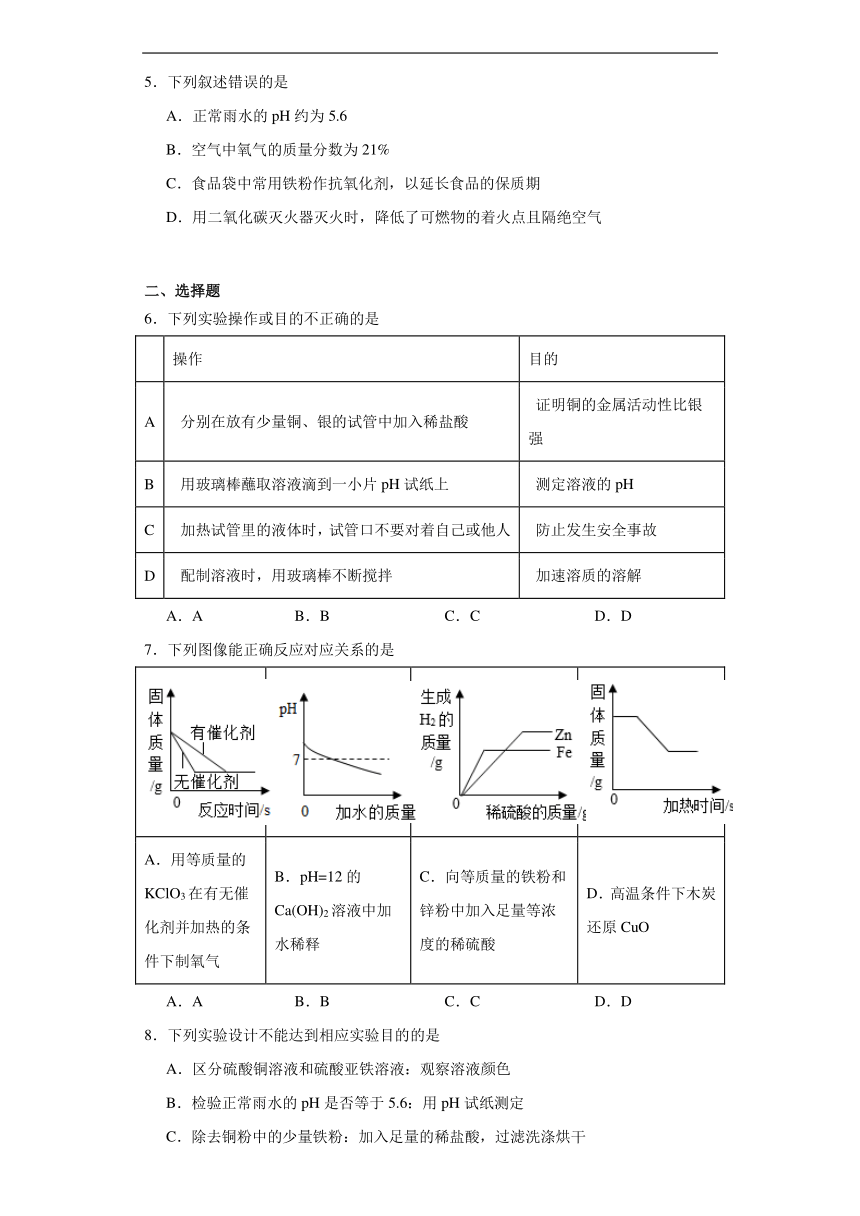
6.下列实验操作或目的不正确的是
操作 目的
A 分别在放有少量铜、银的试管中加入稀盐酸 证明铜的金属活动性比银强
B 用玻璃棒蘸取溶液滴到一小片pH试纸上 测定溶液的pH
C 加热试管里的液体时,试管口不要对着自己或他人 防止发生安全事故
D 配制溶液时,用玻璃棒不断搅拌 加速溶质的溶解
A.A B.B C.C D.D
7.下列图像能正确反应对应关系的是
A.用等质量的KClO3在有无催化剂并加热的条件下制氧气 B.pH=12的Ca(OH)2溶液中加水稀释 C.向等质量的铁粉和锌粉中加入足量等浓度的稀硫酸 D.高温条件下木炭还原CuO
A.A B.B C.C D.D
8.下列实验设计不能达到相应实验目的的是
A.区分硫酸铜溶液和硫酸亚铁溶液:观察溶液颜色
B.检验正常雨水的pH是否等于5.6:用pH试纸测定
C.除去铜粉中的少量铁粉:加入足量的稀盐酸,过滤洗涤烘干
D.除去CO2中混有的少量氯化氢气体和水蒸气:依次通入装有足量饱和NaHCO3溶液和浓硫酸的洗气瓶
9.下列实验操作正确的是
A.取固体药品 B.倾倒液体
C. 测溶液pH D. 读液体体积
10.如图是由传感器采集实验相关信息描绘出的曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标y表示烧杯中的某个量。下列对物质X与纵坐标Y的分析正确的是
选项 物质X 纵坐标Y
A 水 溶液的质量
B 水 溶液的pH
C 氢氧化钠溶液 溶液的质量
D 氢氧化钠溶液 溶液中钙元素的质量
A.A B.B C.C D.D
11.只用一种试剂,就能把稀盐酸、氢氧化钠溶液、澄清石灰水一次性鉴别出来的是
A.Na2CO3溶液 B.氯化钠溶液 C.紫色石蕊试液 D.CO2
12.推理是学习化学的一种重要方法,不合理的推理会得出错误的结论。下列推理正确的是
A.室温下的溶液显酸性,则雨水是酸雨
B.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
C.催化剂在反应前后质量不变,则反应前后质量不变的物质一定是催化剂
D.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的化合物
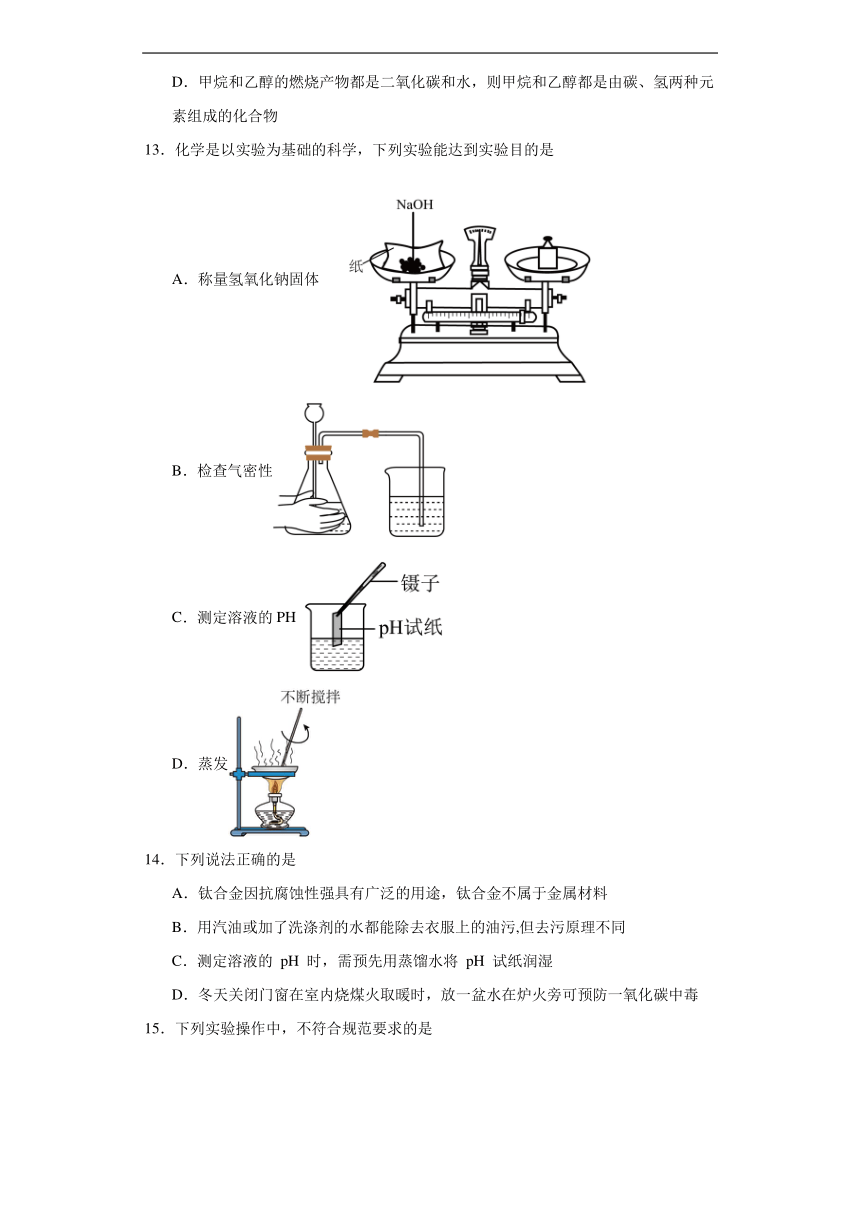
13.化学是以实验为基础的科学,下列实验能达到实验目的是
A.称量氢氧化钠固体
B.检查气密性
C.测定溶液的PH
D.蒸发
14.下列说法正确的是
A.钛合金因抗腐蚀性强具有广泛的用途,钛合金不属于金属材料
B.用汽油或加了洗涤剂的水都能除去衣服上的油污,但去污原理不同
C.测定溶液的 pH 时,需预先用蒸馏水将 pH 试纸润湿
D.冬天关闭门窗在室内烧煤火取暖时,放一盆水在炉火旁可预防一氧化碳中毒
15.下列实验操作中,不符合规范要求的是
A.称量固体氢氧化钠 B.测定溶液的pH
C.过滤 D.放置洗净的滴管
三、综合应用题
16.能源利用和环境保护是人类共同关注的问题。
(1)家用燃料的发展历程如下图所示,括号内的物质是该燃料的主要成分。
下列说法不正确的是 (填字母)。
A.煤、石油、天然气都是化石燃料
B.液化石油气是石油化工的一种产品
C.可燃冰将成为未来新能源,其中主要含有丙烷水合物
D.等质量的甲烷和丙烷完全燃烧,生成的二氧化碳质量相等
(2)煤燃烧时排放出SO2等污染物,可能导致降雨的酸性增强,我们把 pH 5.6(填“>”、“<”或“=”)的降雨称为酸雨。将煤燃烧后的烟气通入吸收塔,用石灰水吸收其中的SO2,石灰水需要“喷淋”的目的是 (填“增大”或“减小”)与烟气的接触面积,充分吸收SO2。
(3)在汽车尾气系统中安装催化转化器,可将有毒的CO、NO转化为无毒的CO2、N2 ,该反应中化合价发生变化的元素是 (填元素符号)。
(4)2016年年初,诺贝尔化学奖获得者乔治·欧拉教授率领团队,首次采用基于金属钌的催化剂,将从空气中捕获的二氧化碳直接转化为甲醇燃料,转化率高达79%。二氧化碳转化为甲醇的化学方程式可表示为;
(5)乙醇是实验室常用的燃料。如果92g乙醇完全燃烧,至少需要氧气的质量是多少?(写出计算过程)
17.水是我们生活中最普遍、最常见的物质之一、
(1)“节约用水,从我做起”。请写出一种生活中节约用水的做法 。
(2)如图是电解水实验的改进装置,接通直流电源一段时间后,可观察到 (填“左”或“右”)端气球膨胀的速率更快,该实验说明水是由 组成的。
(3)饮用酸性或碱性较强的水不利于人体健康,可用 测定水的酸碱度。经常饮用软水的人偶尔饮用硬水,会造成肠胃紊乱,是因为软水中含有 (填“较多”或“较少”)的可溶性钙、镁化合物。
(4)为探究硝酸钾的溶解性,某探究小组进行了下面实验(图),结合硝酸钾溶解度曲线(图2),回答下列问题:
①图1中一定属于饱和溶液的是溶液 (填字母序号)。
A.甲 B.乙 C.丙 D.丁
②30℃时,将30g的KNO3加入到50g水中,所形成的溶液的质量为 g。
③溶液乙、丙、丁中溶质质量分数由大到小的顺序是 。
18.某冶炼厂用含氯化铜和盐酸的废液生产干燥的氢氧化铜,工程师设计了如下图流程,并用实验探究最佳工艺。试回答相关问题。
(1)不同种助剂对产品洗涤(达到相同效果)的实验结果见表。
助剂种类 过滤时间/min 滤渣状态 洗涤用水量/g
A 13 密实 639.8
B 12 密实 589.3
C 13 蓬松 326.5
D 13 较蓬松 350.0
根据表格可知,遵循绿色化学中的“减量”原则,助剂应该选用 (填助剂种类)。选择该助剂还有什么优点?
(2)调节pH对Cu2+回收率及产品纯度的影响见图1所示。
所以该工艺中需要调节pH至 为最佳。当pH逐步提高到14过滤,观察到沉淀量 同时溶液呈深蓝色的现象,说明Cu2+回收率明显下降。
(3)工艺中“搅拌1.5h”的目的是 。
(4)对实验产品进行热重分析,测得加热温度与样品质量的关系如图2所示:取干燥的产品98 g,当温度高于80℃时开始出现黑色固体氧化铜,同时生成另一种氧化物。持续升温到185℃时完全变黑且质量恒定,请计算x的值(写出计算过程)。
参考答案:
1.AD
2.BD
3.BD
4.BD
5.BD
6.A
7.D
8.B
9.B
10.B
11.A
12.B
13.D
14.B
15.A
16.(1)CD
(2) < 增大
(3)C、N
(4)H2O
(5)解:设至少需要氧气的质量为x,
答:至少需要氧气的质量是192g。
17.(1)洗菜水浇花(合理即可)
(2) 右 氢元素和氧元素#H和O
(3) pH试纸#pH计 较少
(4) BD 71.8 丙>乙=丁
18.(1) C 便于对滤渣进行洗涤,除去残留的杂质
(2) 13 减少
(3)增加反应物的接触面积,使反应更快更充分
(4)解:根据题意可知,185℃时完全变黑且质量恒定,则剩余固体全部为氧化铜。化学反应前后元素的种类不变,则氧化铜中铜元素的质量与氢氧化铜中铜元素的质量相同。
98g氢氧化铜中铜元素的质量为
含有64g铜的氧化铜的质量为
所以图中x的值为80。
答:x的值为80。
一、多选题
1.小雅学习了 pH 相关知识后,对生活中的水果及饮料的 pH 产生了好奇,并查阅到部分水果及饮料的 pH 如下:
食物 柠檬 橘子汁 西瓜汁 苏打水
pH 2.9 3.8 6.4 8.6
下列说法正确的是
A.胃酸过多的人不宜多吃柠檬 B.西瓜汁显碱性
C.橘子汁比柠檬的酸性强 D.苏打水显碱性
2.某地农业科技工作者在进行“酸雨对农业产量影响及对策的研究”中,得出酸雨的pH大小与小麦减产幅度关系的一组数据如下表所示。根据数据判断,下列说法正确的是
酸雨pH 3.58 4.59 4.86
小麦减产(%) 10 5 3
A.酸雨的pH越大,小麦减产幅度越大 B.酸雨的pH越小,小麦减产幅度越大
C.酸雨的酸性越强,小麦的减产越小 D.酸雨的酸性越强,小麦的减产越大
3.化学是一门以实验为基础的科学,而规范的操作方法是实验安全和成功的保障。下列实验操作正确的是
A. 加热液体 B. 甲烷验纯
C. 取用液体 D. 测定溶液pH
4.溶液的pH大小与一定量溶液中所含的H+和OH-的数量有关。下列说法正确的是
A.H+浓度越大,pH越大 B.OH-浓度越大,pH越大
C.pH越小,H+浓度越小 D.OH-的质量分数越大,pH越大
5.下列叙述错误的是
A.正常雨水的pH约为5.6
B.空气中氧气的质量分数为21%
C.食品袋中常用铁粉作抗氧化剂,以延长食品的保质期
D.用二氧化碳灭火器灭火时,降低了可燃物的着火点且隔绝空气
二、选择题
6.下列实验操作或目的不正确的是
操作 目的
A 分别在放有少量铜、银的试管中加入稀盐酸 证明铜的金属活动性比银强
B 用玻璃棒蘸取溶液滴到一小片pH试纸上 测定溶液的pH
C 加热试管里的液体时,试管口不要对着自己或他人 防止发生安全事故
D 配制溶液时,用玻璃棒不断搅拌 加速溶质的溶解
A.A B.B C.C D.D
7.下列图像能正确反应对应关系的是
A.用等质量的KClO3在有无催化剂并加热的条件下制氧气 B.pH=12的Ca(OH)2溶液中加水稀释 C.向等质量的铁粉和锌粉中加入足量等浓度的稀硫酸 D.高温条件下木炭还原CuO
A.A B.B C.C D.D
8.下列实验设计不能达到相应实验目的的是
A.区分硫酸铜溶液和硫酸亚铁溶液:观察溶液颜色
B.检验正常雨水的pH是否等于5.6:用pH试纸测定
C.除去铜粉中的少量铁粉:加入足量的稀盐酸,过滤洗涤烘干
D.除去CO2中混有的少量氯化氢气体和水蒸气:依次通入装有足量饱和NaHCO3溶液和浓硫酸的洗气瓶
9.下列实验操作正确的是
A.取固体药品 B.倾倒液体
C. 测溶液pH D. 读液体体积
10.如图是由传感器采集实验相关信息描绘出的曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标y表示烧杯中的某个量。下列对物质X与纵坐标Y的分析正确的是
选项 物质X 纵坐标Y
A 水 溶液的质量
B 水 溶液的pH
C 氢氧化钠溶液 溶液的质量
D 氢氧化钠溶液 溶液中钙元素的质量
A.A B.B C.C D.D
11.只用一种试剂,就能把稀盐酸、氢氧化钠溶液、澄清石灰水一次性鉴别出来的是
A.Na2CO3溶液 B.氯化钠溶液 C.紫色石蕊试液 D.CO2
12.推理是学习化学的一种重要方法,不合理的推理会得出错误的结论。下列推理正确的是
A.室温下的溶液显酸性,则雨水是酸雨
B.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
C.催化剂在反应前后质量不变,则反应前后质量不变的物质一定是催化剂
D.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的化合物
13.化学是以实验为基础的科学,下列实验能达到实验目的是
A.称量氢氧化钠固体
B.检查气密性
C.测定溶液的PH
D.蒸发
14.下列说法正确的是
A.钛合金因抗腐蚀性强具有广泛的用途,钛合金不属于金属材料
B.用汽油或加了洗涤剂的水都能除去衣服上的油污,但去污原理不同
C.测定溶液的 pH 时,需预先用蒸馏水将 pH 试纸润湿
D.冬天关闭门窗在室内烧煤火取暖时,放一盆水在炉火旁可预防一氧化碳中毒
15.下列实验操作中,不符合规范要求的是
A.称量固体氢氧化钠 B.测定溶液的pH
C.过滤 D.放置洗净的滴管
三、综合应用题
16.能源利用和环境保护是人类共同关注的问题。
(1)家用燃料的发展历程如下图所示,括号内的物质是该燃料的主要成分。
下列说法不正确的是 (填字母)。
A.煤、石油、天然气都是化石燃料
B.液化石油气是石油化工的一种产品
C.可燃冰将成为未来新能源,其中主要含有丙烷水合物
D.等质量的甲烷和丙烷完全燃烧,生成的二氧化碳质量相等
(2)煤燃烧时排放出SO2等污染物,可能导致降雨的酸性增强,我们把 pH 5.6(填“>”、“<”或“=”)的降雨称为酸雨。将煤燃烧后的烟气通入吸收塔,用石灰水吸收其中的SO2,石灰水需要“喷淋”的目的是 (填“增大”或“减小”)与烟气的接触面积,充分吸收SO2。
(3)在汽车尾气系统中安装催化转化器,可将有毒的CO、NO转化为无毒的CO2、N2 ,该反应中化合价发生变化的元素是 (填元素符号)。
(4)2016年年初,诺贝尔化学奖获得者乔治·欧拉教授率领团队,首次采用基于金属钌的催化剂,将从空气中捕获的二氧化碳直接转化为甲醇燃料,转化率高达79%。二氧化碳转化为甲醇的化学方程式可表示为;
(5)乙醇是实验室常用的燃料。如果92g乙醇完全燃烧,至少需要氧气的质量是多少?(写出计算过程)
17.水是我们生活中最普遍、最常见的物质之一、
(1)“节约用水,从我做起”。请写出一种生活中节约用水的做法 。
(2)如图是电解水实验的改进装置,接通直流电源一段时间后,可观察到 (填“左”或“右”)端气球膨胀的速率更快,该实验说明水是由 组成的。
(3)饮用酸性或碱性较强的水不利于人体健康,可用 测定水的酸碱度。经常饮用软水的人偶尔饮用硬水,会造成肠胃紊乱,是因为软水中含有 (填“较多”或“较少”)的可溶性钙、镁化合物。
(4)为探究硝酸钾的溶解性,某探究小组进行了下面实验(图),结合硝酸钾溶解度曲线(图2),回答下列问题:
①图1中一定属于饱和溶液的是溶液 (填字母序号)。
A.甲 B.乙 C.丙 D.丁
②30℃时,将30g的KNO3加入到50g水中,所形成的溶液的质量为 g。
③溶液乙、丙、丁中溶质质量分数由大到小的顺序是 。
18.某冶炼厂用含氯化铜和盐酸的废液生产干燥的氢氧化铜,工程师设计了如下图流程,并用实验探究最佳工艺。试回答相关问题。
(1)不同种助剂对产品洗涤(达到相同效果)的实验结果见表。
助剂种类 过滤时间/min 滤渣状态 洗涤用水量/g
A 13 密实 639.8
B 12 密实 589.3
C 13 蓬松 326.5
D 13 较蓬松 350.0
根据表格可知,遵循绿色化学中的“减量”原则,助剂应该选用 (填助剂种类)。选择该助剂还有什么优点?
(2)调节pH对Cu2+回收率及产品纯度的影响见图1所示。
所以该工艺中需要调节pH至 为最佳。当pH逐步提高到14过滤,观察到沉淀量 同时溶液呈深蓝色的现象,说明Cu2+回收率明显下降。
(3)工艺中“搅拌1.5h”的目的是 。
(4)对实验产品进行热重分析,测得加热温度与样品质量的关系如图2所示:取干燥的产品98 g,当温度高于80℃时开始出现黑色固体氧化铜,同时生成另一种氧化物。持续升温到185℃时完全变黑且质量恒定,请计算x的值(写出计算过程)。
参考答案:
1.AD
2.BD
3.BD
4.BD
5.BD
6.A
7.D
8.B
9.B
10.B
11.A
12.B
13.D
14.B
15.A
16.(1)CD
(2) < 增大
(3)C、N
(4)H2O
(5)解:设至少需要氧气的质量为x,
答:至少需要氧气的质量是192g。
17.(1)洗菜水浇花(合理即可)
(2) 右 氢元素和氧元素#H和O
(3) pH试纸#pH计 较少
(4) BD 71.8 丙>乙=丁
18.(1) C 便于对滤渣进行洗涤,除去残留的杂质
(2) 13 减少
(3)增加反应物的接触面积,使反应更快更充分
(4)解:根据题意可知,185℃时完全变黑且质量恒定,则剩余固体全部为氧化铜。化学反应前后元素的种类不变,则氧化铜中铜元素的质量与氢氧化铜中铜元素的质量相同。
98g氢氧化铜中铜元素的质量为
含有64g铜的氧化铜的质量为
所以图中x的值为80。
答:x的值为80。
