化学人教版(2019)必修第一册4.1.3碱金属元素(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.3碱金属元素(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 17:28:04 | ||
图片预览





文档简介
(共31张PPT)
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第三课时
原子结构与元素的性质——碱金属元素
1、知道碱金属元素的结构和特点。
2、能说出碱金属元素性质的递变规律。
3、能用原子结构理论初步加以解释;培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
学习目标
七主七副一八一零族
三短四长七周期
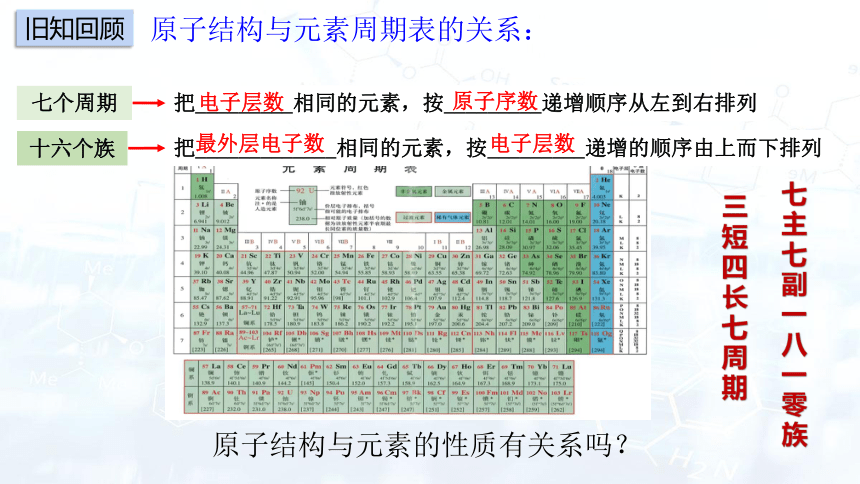
原子结构与元素周期表的关系:
七个周期
十六个族
把_________相同的元素,按_________递增顺序从左到右排列
把_____________相同的元素,按_________递增的顺序由上而下排列
电子层数
原子序数
最外层电子数
电子层数
原子结构与元素的性质有关系吗?
旧知回顾
元素
稀有气体元素
金属
元素
一般最外层电子数<4
非金属元素
最外层电子数=8(He=2)
一般最外层电子数>4
易失电子
不易得失
易得电子
化学性质活泼
化学性质稳定
化学性质活泼
结论:最外层电子数决定元素的化学性质
金属性
非金属性
元素化学性质与原子最外层电子数的关系
教师导学
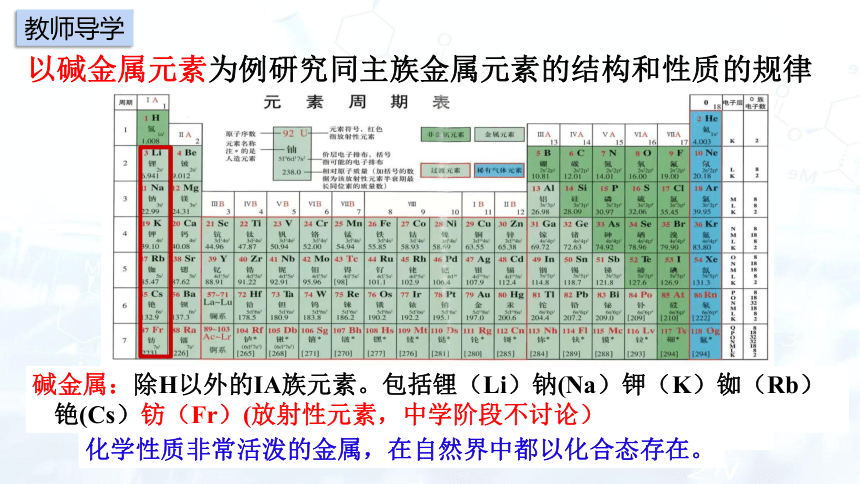
以碱金属元素为例研究同主族金属元素的结构和性质的规律
碱金属:除H以外的IA族元素。包括锂(Li)钠(Na)钾(K)铷(Rb)铯(Cs)钫(Fr)(放射性元素,中学阶段不讨论)
化学性质非常活泼的金属,在自然界中都以化合态存在。
教师导学
一、碱金属元素:
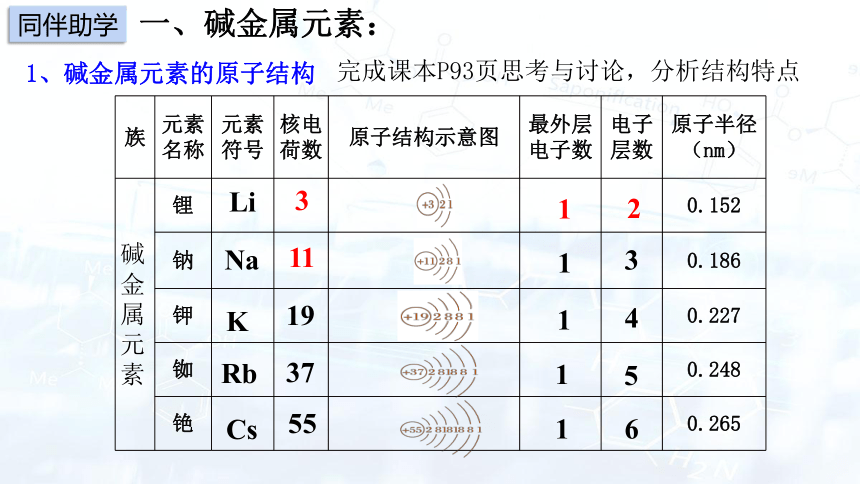
1、碱金属元素的原子结构
完成课本P93页思考与讨论,分析结构特点
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径(nm)
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
同伴助学
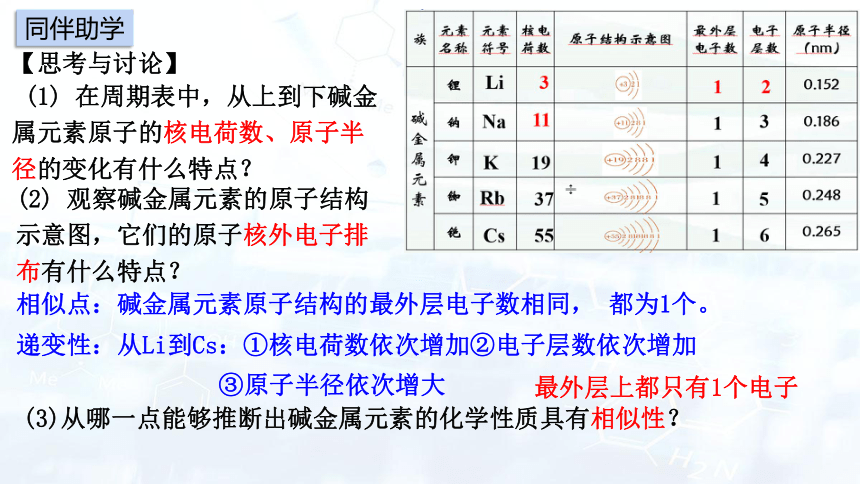
【思考与讨论】
(1) 在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2) 观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?
相似点:碱金属元素原子结构的最外层电子数相同, 都为1个。
递变性:从Li到Cs:①核电荷数依次增加②电子层数依次增加
③原子半径依次增大
(3)从哪一点能够推断出碱金属元素的化学性质具有相似性?
最外层上都只有1个电子
同伴助学
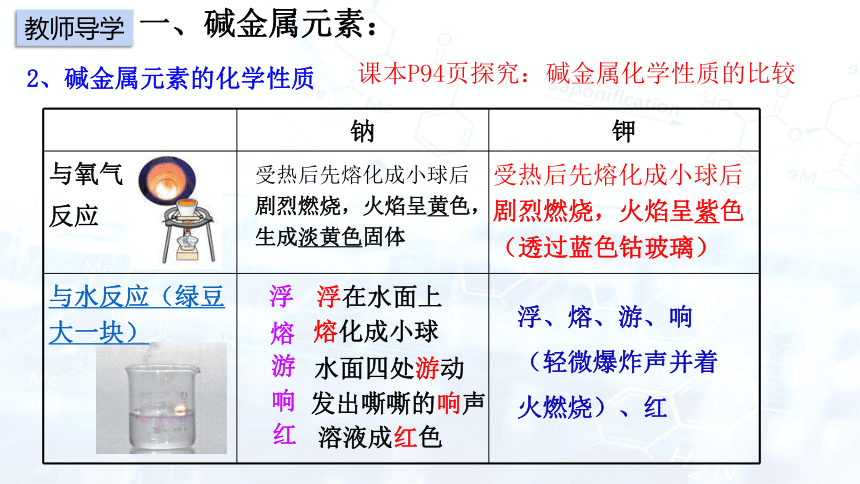
2、碱金属元素的化学性质
课本P94页探究:碱金属化学性质的比较
钠 钾
与氧气 反应
与水反应(绿豆大一块)
浮
红
熔
游
响
浮在水面上
熔化成小球
水面四处游动
发出嘶嘶的响声
溶液成红色
受热后先熔化成小球后剧烈燃烧,火焰呈黄色,生成淡黄色固体
受热后先熔化成小球后剧烈燃烧,火焰呈紫色(透过蓝色钴玻璃)
浮、熔、游、响(轻微爆炸声并着火燃烧)、红
教师导学
一、碱金属元素:
(1)钠、钾有哪些相似的化学性质?
(2)比较钠钾与水反应的难易程度。
都与氧气、水反应
钾的反应更剧烈
锂与水呢?
锂与水反应很缓慢
(3)碱金属与水反应的难易程度与其原子结构有什么关系?
由锂到铯,碱金属元素的原子电子层增加,原子半径增大,所以原子失电子能力增加,金属单质的活动性增强,其与水反应应该变得越来越容易
铯与氧气、水的反应
一、碱金属元素:
教师导学
(4)由此,你能推断出碱金属的化学性质的相似性和递变规律吗?
由锂到铯,原子电子层逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,金属性(还原性)逐渐增强。
碱金属单质的相似性
都容易失去1个电子,都表现出还原性,都能与氧气、水反应
碱金属单质的递变性:
与O2、H2O的反应的反应越来越剧烈,由锂到铯,还原性逐渐增强。
教师导学
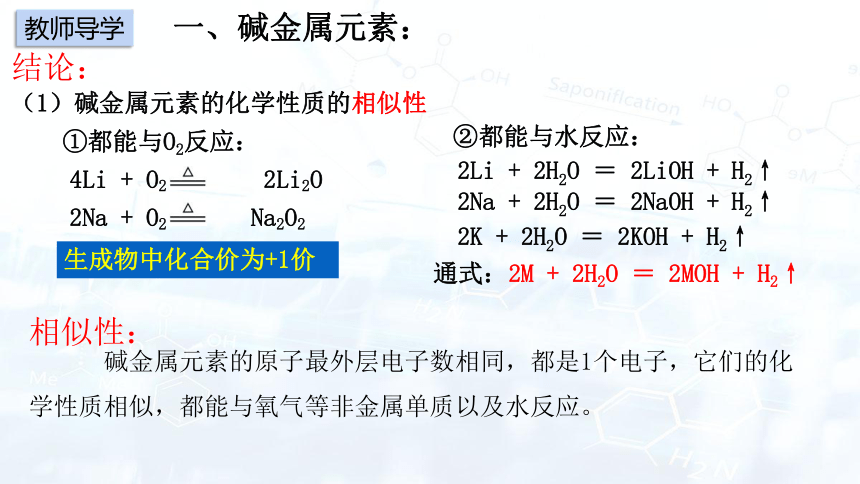
一、碱金属元素:
①都能与O2反应:
②都能与水反应:
2Li + 2H2O = 2LiOH + H2↑
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
通式:2M + 2H2O = 2MOH + H2↑
生成物中化合价为+1价
碱金属元素的原子最外层电子数相同,都是1个电子,它们的化学性质相似,都能与氧气等非金属单质以及水反应。
结论:
(1)碱金属元素的化学性质的相似性
4Li + O2 2Li2O
2Na + O2 Na2O2
相似性:
一、碱金属元素:
教师导学
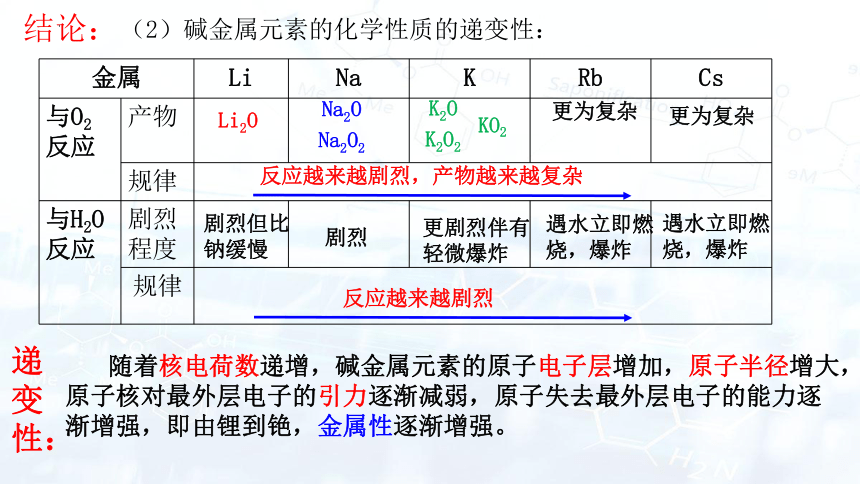
金属 Li Na K Rb Cs
与O2反应 产物
规律 与H2O反应 剧烈程度
规律 更为复杂
Li2O
更为复杂
Na2O
Na2O2
K2O
K2O2
KO2
反应越来越剧烈,产物越来越复杂
反应越来越剧烈
剧烈但比钠缓慢
剧烈
更剧烈伴有轻微爆炸
遇水立即燃烧,爆炸
遇水立即燃烧,爆炸
(2)碱金属元素的化学性质的递变性:
随着核电荷数递增,碱金属元素的原子电子层增加,原子半径增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,即由锂到铯,金属性逐渐增强。
递变性:
结论:
金属性强弱的比较方法:
⒈元素的单质与水(或酸)反应置换出氢的剧烈程度。
⒉元素最高价氧化物对应的水化物的碱性强弱。
⒊单质的还原性强弱。
⒋金属阳离子的氧化性强弱判断。
LiOH从Li到Cs与水反应原来越剧烈
元素的金属性:
元素气态原子在反应中失去电子的性质
教师导学
1、下列关于碱金属原子结构和性质叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失去
B.都是强还原剂
C.都能在O2里燃烧生成过氧化物
D.都能与水反应生成碱
C
训练验学
2、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是( )
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成Fr2O
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
训练验学
Li
Rb
Na
3、碱金属单质的物理性质
它们都比较柔软,有延展性;密度都比较小,熔点也都比较低,导热性和导电性也都很好,如液态钠可用作核反应。
相似性:
一、碱金属元素:
教师导学
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
表4-2 碱金属单质的主要物理性质
反常
沸点降低
熔点降低
密度增大
递变性:
Li→Cs,单质熔点和沸点逐渐降低;密度逐渐增大(ρK<ρNa )
注意:锂是最轻的金属,保存在石蜡里;其他保存在煤油中。
一、碱金属元素:
教师导学
锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。
铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
4、碱金属元素的用途:
液态钠可作为核反应堆的传热介质。
一、碱金属元素:
教师导学
3、下列叙述正确的是( )
A.碱金属单质性质相似,均为银白色(铯除外)的柔软金属,密度都比较小
B.碱金属单质在空气中燃烧生成的都是过氧化物
C.碱金属单质的熔、沸点随原子序数的增加而升高
D.Li、Na、K都可以保存在煤油中
A
训练验学
(1)碱金属元素单质性质的相似性
物理性质:硬度、密度小,熔点、沸点低,导电导热性,延展性
化学性质:最外层都为1,易失电子(均为+1价),表现出金属性(还原性)
与O2反应:
R+O2
=
△
RxOy
与Cl2反应:
2R+Cl2
=
△
2RCl
与H2O反应:
2R+2H2O=2ROH+H2↑
主要掌握
Li、Na、K
小结:碱金属元素的性质
教师导学
(2)碱金属元素性质的递变性
教师导学
(3)碱金属元素的特殊性:
①锂——最轻的金属。密度比煤油小、保存时用石蜡封,锂和氧气反应只有一种产物氧化锂。
②钠密度比钾大。钾金属性比钠强,但是不能从氯化钠的水溶液中置换出钠,发生的是钾和水的反应。但是可以用利用沸点高低液态钠置换钾
Na(熔融)+KCl=K↑+NaCl
③铷和铯密度比水大,与水反应沉在水下。
教师导学
4、下列说法正确的是( )
①从锂到铯,碱金属元素单质的密度依次增大
② Li、Na、K在空气中燃烧均生成过氧化物
③碱金属元素原子随核电荷数增加,其单质与水反应越来越剧烈
④碱金属元素单质都应该保存在煤油中
⑤ K比Na活泼,故K可以从钠盐溶液中置换出Na
⑥碱金属元素在自然界中能以游离态存在
③
训练验学
5、下列关于碱金属的叙述正确的是( )
A.钾与氧气或水反应比钠的反应剧烈,铷、铯的反应更剧烈
B.碱金属的密度随着原子序数的递增逐渐减小
C.碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的
递增依次减弱
D.碱金属元素的阳离子的氧化性随着原子序数的递增依次增强
A
训练验学
碱金属
元素
碱金属元素的原子结构
碱金属单质的物理性质
碱金属单质
的化学性质
单质与氧气、水的反应
卤素最高价氧化物对应的水化物的碱性
熟记碱金属的特殊性
同主族元素的原子结构与金属性的关系
课堂小结
1、钾的金属活动性比钠强,根本原因是( )
A、钾的密度比钠的小
B、钾原子的电子层比钠原子多一层
C、钾与水反应比钠与水反应更剧烈
D、加热时,钾比钠更易气化
B
课堂达标
2、下列有关碱金属单质的性质的说法错误的是( )
A.锂和水反应不如钠与水反应剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.熔、沸点:Li>Na>K
D.碱性:LiOHB
3.如图表示第ⅠA族金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质不符合图示关系的是 ( )
A.金属性
B.与水反应的剧烈程度
C.阳离子的氧化性
D.原子半径
C
4.关于铯及其化合物的以下各种说法中不正确的是( )
A.氢氧化铯是一种强碱,比KOH的碱性强
B.铯与水或酸溶液反应剧烈,都生成氢气
C.Cs的还原性比Na强,故Na+的氧化性强于Cs+
D.Al的金属性大于Cs的金属性
D
5. 以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH;②单质熔点最高的是铯;③单质都是热的良导体;④单质的密度依次增大,且都比水小;⑤单质的还原性依次增强;⑥对应阳离子的氧化性依次增强。
A. ①③ B. ②⑤ C. ②④⑥ D. ①③⑤
C
6、已知铷(Rb)是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
(1)铷位于第____周期,其原子半径比钠元素的原子半径____(填大或小)。
五
大
(2)铷单质性质活泼,写出它与氯气反应的化学方程式:________________。铷单质易与水反应,反应的离子方程式为____________________________,铷与水反应比钠与水反应______(填“剧烈”或“缓慢”)。遇水后沉在水_____(填“底”或“上”),铷的密度比水的密度_____(填“大”或“小”)。
2Rb+2H2O=2Rb++2OH+H2↑
剧烈
底
大
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与CO2反应的化学方程式:______________________________。
2Rb2O2+2CO2===2Rb2CO3+O2
2Rb+Cl2 2RbCl2
第一节 原子结构与元素周期表
第四章 物质结构 元素周期律
第三课时
原子结构与元素的性质——碱金属元素
1、知道碱金属元素的结构和特点。
2、能说出碱金属元素性质的递变规律。
3、能用原子结构理论初步加以解释;培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
学习目标
七主七副一八一零族
三短四长七周期
原子结构与元素周期表的关系:
七个周期
十六个族
把_________相同的元素,按_________递增顺序从左到右排列
把_____________相同的元素,按_________递增的顺序由上而下排列
电子层数
原子序数
最外层电子数
电子层数
原子结构与元素的性质有关系吗?
旧知回顾
元素
稀有气体元素
金属
元素
一般最外层电子数<4
非金属元素
最外层电子数=8(He=2)
一般最外层电子数>4
易失电子
不易得失
易得电子
化学性质活泼
化学性质稳定
化学性质活泼
结论:最外层电子数决定元素的化学性质
金属性
非金属性
元素化学性质与原子最外层电子数的关系
教师导学
以碱金属元素为例研究同主族金属元素的结构和性质的规律
碱金属:除H以外的IA族元素。包括锂(Li)钠(Na)钾(K)铷(Rb)铯(Cs)钫(Fr)(放射性元素,中学阶段不讨论)
化学性质非常活泼的金属,在自然界中都以化合态存在。
教师导学
一、碱金属元素:
1、碱金属元素的原子结构
完成课本P93页思考与讨论,分析结构特点
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径(nm)
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
同伴助学
【思考与讨论】
(1) 在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2) 观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?
相似点:碱金属元素原子结构的最外层电子数相同, 都为1个。
递变性:从Li到Cs:①核电荷数依次增加②电子层数依次增加
③原子半径依次增大
(3)从哪一点能够推断出碱金属元素的化学性质具有相似性?
最外层上都只有1个电子
同伴助学
2、碱金属元素的化学性质
课本P94页探究:碱金属化学性质的比较
钠 钾
与氧气 反应
与水反应(绿豆大一块)
浮
红
熔
游
响
浮在水面上
熔化成小球
水面四处游动
发出嘶嘶的响声
溶液成红色
受热后先熔化成小球后剧烈燃烧,火焰呈黄色,生成淡黄色固体
受热后先熔化成小球后剧烈燃烧,火焰呈紫色(透过蓝色钴玻璃)
浮、熔、游、响(轻微爆炸声并着火燃烧)、红
教师导学
一、碱金属元素:
(1)钠、钾有哪些相似的化学性质?
(2)比较钠钾与水反应的难易程度。
都与氧气、水反应
钾的反应更剧烈
锂与水呢?
锂与水反应很缓慢
(3)碱金属与水反应的难易程度与其原子结构有什么关系?
由锂到铯,碱金属元素的原子电子层增加,原子半径增大,所以原子失电子能力增加,金属单质的活动性增强,其与水反应应该变得越来越容易
铯与氧气、水的反应
一、碱金属元素:
教师导学
(4)由此,你能推断出碱金属的化学性质的相似性和递变规律吗?
由锂到铯,原子电子层逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,金属性(还原性)逐渐增强。
碱金属单质的相似性
都容易失去1个电子,都表现出还原性,都能与氧气、水反应
碱金属单质的递变性:
与O2、H2O的反应的反应越来越剧烈,由锂到铯,还原性逐渐增强。
教师导学
一、碱金属元素:
①都能与O2反应:
②都能与水反应:
2Li + 2H2O = 2LiOH + H2↑
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
通式:2M + 2H2O = 2MOH + H2↑
生成物中化合价为+1价
碱金属元素的原子最外层电子数相同,都是1个电子,它们的化学性质相似,都能与氧气等非金属单质以及水反应。
结论:
(1)碱金属元素的化学性质的相似性
4Li + O2 2Li2O
2Na + O2 Na2O2
相似性:
一、碱金属元素:
教师导学
金属 Li Na K Rb Cs
与O2反应 产物
规律 与H2O反应 剧烈程度
规律 更为复杂
Li2O
更为复杂
Na2O
Na2O2
K2O
K2O2
KO2
反应越来越剧烈,产物越来越复杂
反应越来越剧烈
剧烈但比钠缓慢
剧烈
更剧烈伴有轻微爆炸
遇水立即燃烧,爆炸
遇水立即燃烧,爆炸
(2)碱金属元素的化学性质的递变性:
随着核电荷数递增,碱金属元素的原子电子层增加,原子半径增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,即由锂到铯,金属性逐渐增强。
递变性:
结论:
金属性强弱的比较方法:
⒈元素的单质与水(或酸)反应置换出氢的剧烈程度。
⒉元素最高价氧化物对应的水化物的碱性强弱。
⒊单质的还原性强弱。
⒋金属阳离子的氧化性强弱判断。
LiOH
元素的金属性:
元素气态原子在反应中失去电子的性质
教师导学
1、下列关于碱金属原子结构和性质叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失去
B.都是强还原剂
C.都能在O2里燃烧生成过氧化物
D.都能与水反应生成碱
C
训练验学
2、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是( )
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成Fr2O
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
训练验学
Li
Rb
Na
3、碱金属单质的物理性质
它们都比较柔软,有延展性;密度都比较小,熔点也都比较低,导热性和导电性也都很好,如液态钠可用作核反应。
相似性:
一、碱金属元素:
教师导学
碱金属单质 颜色和状态 密度 (g.cm3) 熔点 (℃) 沸点(℃)
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金属光泽,柔软 1.879 28.40 678.4
表4-2 碱金属单质的主要物理性质
反常
沸点降低
熔点降低
密度增大
递变性:
Li→Cs,单质熔点和沸点逐渐降低;密度逐渐增大(ρK<ρNa )
注意:锂是最轻的金属,保存在石蜡里;其他保存在煤油中。
一、碱金属元素:
教师导学
锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。
铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
4、碱金属元素的用途:
液态钠可作为核反应堆的传热介质。
一、碱金属元素:
教师导学
3、下列叙述正确的是( )
A.碱金属单质性质相似,均为银白色(铯除外)的柔软金属,密度都比较小
B.碱金属单质在空气中燃烧生成的都是过氧化物
C.碱金属单质的熔、沸点随原子序数的增加而升高
D.Li、Na、K都可以保存在煤油中
A
训练验学
(1)碱金属元素单质性质的相似性
物理性质:硬度、密度小,熔点、沸点低,导电导热性,延展性
化学性质:最外层都为1,易失电子(均为+1价),表现出金属性(还原性)
与O2反应:
R+O2
=
△
RxOy
与Cl2反应:
2R+Cl2
=
△
2RCl
与H2O反应:
2R+2H2O=2ROH+H2↑
主要掌握
Li、Na、K
小结:碱金属元素的性质
教师导学
(2)碱金属元素性质的递变性
教师导学
(3)碱金属元素的特殊性:
①锂——最轻的金属。密度比煤油小、保存时用石蜡封,锂和氧气反应只有一种产物氧化锂。
②钠密度比钾大。钾金属性比钠强,但是不能从氯化钠的水溶液中置换出钠,发生的是钾和水的反应。但是可以用利用沸点高低液态钠置换钾
Na(熔融)+KCl=K↑+NaCl
③铷和铯密度比水大,与水反应沉在水下。
教师导学
4、下列说法正确的是( )
①从锂到铯,碱金属元素单质的密度依次增大
② Li、Na、K在空气中燃烧均生成过氧化物
③碱金属元素原子随核电荷数增加,其单质与水反应越来越剧烈
④碱金属元素单质都应该保存在煤油中
⑤ K比Na活泼,故K可以从钠盐溶液中置换出Na
⑥碱金属元素在自然界中能以游离态存在
③
训练验学
5、下列关于碱金属的叙述正确的是( )
A.钾与氧气或水反应比钠的反应剧烈,铷、铯的反应更剧烈
B.碱金属的密度随着原子序数的递增逐渐减小
C.碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的
递增依次减弱
D.碱金属元素的阳离子的氧化性随着原子序数的递增依次增强
A
训练验学
碱金属
元素
碱金属元素的原子结构
碱金属单质的物理性质
碱金属单质
的化学性质
单质与氧气、水的反应
卤素最高价氧化物对应的水化物的碱性
熟记碱金属的特殊性
同主族元素的原子结构与金属性的关系
课堂小结
1、钾的金属活动性比钠强,根本原因是( )
A、钾的密度比钠的小
B、钾原子的电子层比钠原子多一层
C、钾与水反应比钠与水反应更剧烈
D、加热时,钾比钠更易气化
B
课堂达标
2、下列有关碱金属单质的性质的说法错误的是( )
A.锂和水反应不如钠与水反应剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.熔、沸点:Li>Na>K
D.碱性:LiOH
3.如图表示第ⅠA族金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质不符合图示关系的是 ( )
A.金属性
B.与水反应的剧烈程度
C.阳离子的氧化性
D.原子半径
C
4.关于铯及其化合物的以下各种说法中不正确的是( )
A.氢氧化铯是一种强碱,比KOH的碱性强
B.铯与水或酸溶液反应剧烈,都生成氢气
C.Cs的还原性比Na强,故Na+的氧化性强于Cs+
D.Al的金属性大于Cs的金属性
D
5. 以下关于锂、钠、钾、铷、铯的叙述不正确的是( )
①氢氧化物中碱性最强的是CsOH;②单质熔点最高的是铯;③单质都是热的良导体;④单质的密度依次增大,且都比水小;⑤单质的还原性依次增强;⑥对应阳离子的氧化性依次增强。
A. ①③ B. ②⑤ C. ②④⑥ D. ①③⑤
C
6、已知铷(Rb)是37号元素,其相对原子质量是85.5,与钠同主族,回答下列问题:
(1)铷位于第____周期,其原子半径比钠元素的原子半径____(填大或小)。
五
大
(2)铷单质性质活泼,写出它与氯气反应的化学方程式:________________。铷单质易与水反应,反应的离子方程式为____________________________,铷与水反应比钠与水反应______(填“剧烈”或“缓慢”)。遇水后沉在水_____(填“底”或“上”),铷的密度比水的密度_____(填“大”或“小”)。
2Rb+2H2O=2Rb++2OH+H2↑
剧烈
底
大
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与CO2反应的化学方程式:______________________________。
2Rb2O2+2CO2===2Rb2CO3+O2
2Rb+Cl2 2RbCl2
