化学人教版(2019)必修第二册6.1.1化学反应与热能(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.1化学反应与热能(共42张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 33.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 17:30:30 | ||
图片预览







文档简介
(共42张PPT)
第一课时
(化学反应与热能)
化学反应与能量变化
学习目标:
1.通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随着能量变化的观念。
2.能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的原因。
学习重难点:
化学反应中能量变化的原因
个人预学
1.放热反应、吸热反应的概念
2.常见的吸热、放热反应有哪些?
3.化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
微观怎么解释,宏观怎么判断?
情景引入
情景导入
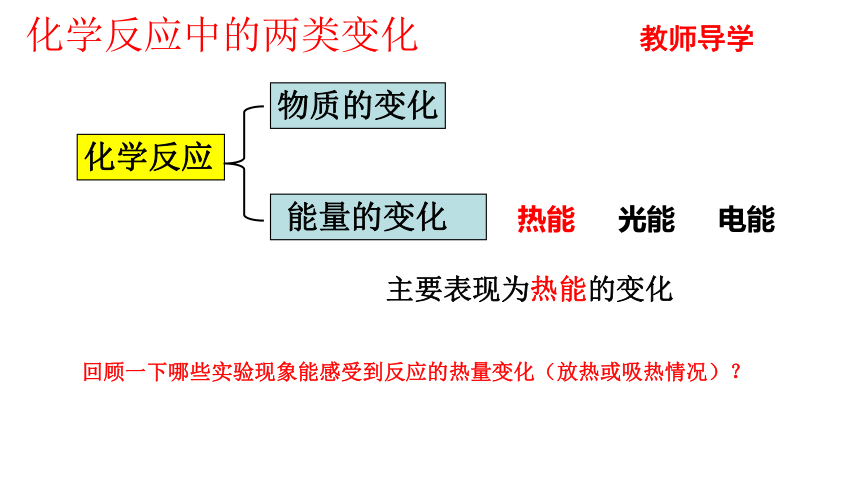
化学反应
物质的变化
能量的变化
化学反应中的两类变化
热能 光能 电能
回顾一下哪些实验现象能感受到反应的热量变化(放热或吸热情况)?
主要表现为热能的变化
教师导学
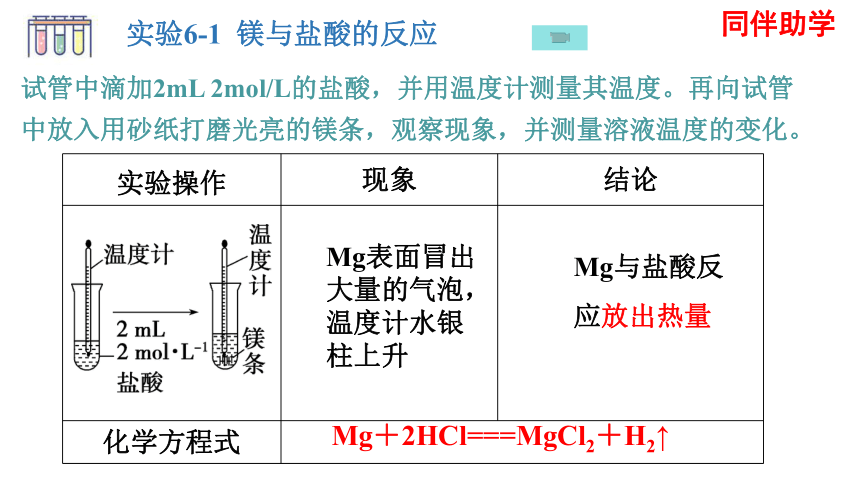
实验操作 现象 结论
化学方程式 Mg表面冒出大量的气泡,温度计水银柱上升
Mg与盐酸反
应放出热量
实验6-1 镁与盐酸的反应
试管中滴加2mL 2mol/L的盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
Mg+2HCl===MgCl2+H2↑
同伴助学
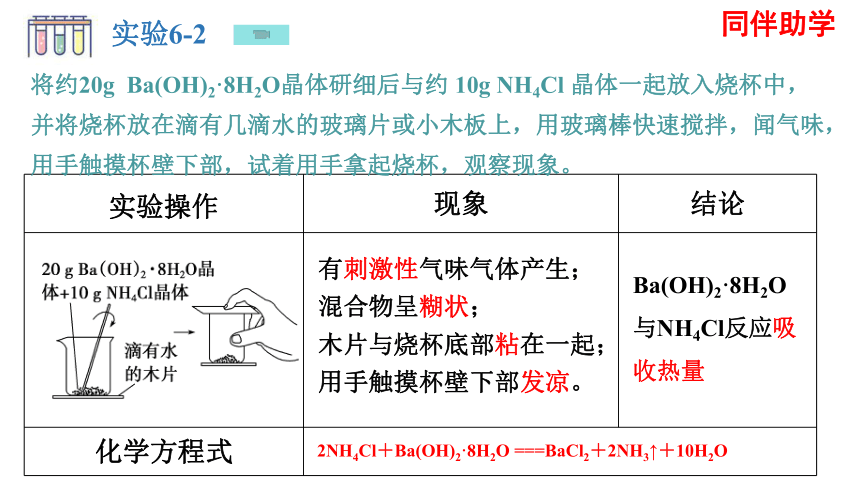
实验操作 现象 结论
化学方程式 有刺激性气味气体产生;混合物呈糊状; 木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
2NH4Cl+Ba(OH)2·8H2O ===BaCl2+2NH3↑+10H2O
实验6-2
将约20g Ba(OH)2·8H2O晶体研细后与约 10g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片或小木板上,用玻璃棒快速搅拌,闻气味,用手触摸杯壁下部,试着用手拿起烧杯,观察现象。
同伴助学
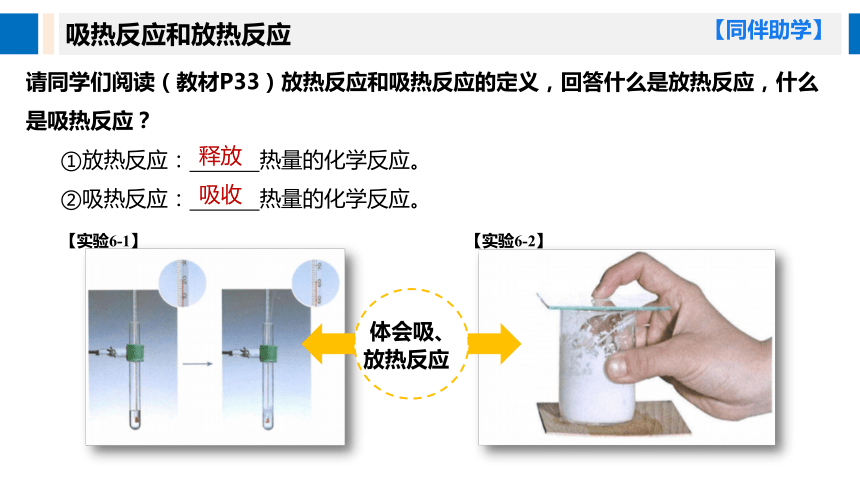
吸热反应和放热反应
请同学们阅读(教材P33)放热反应和吸热反应的定义,回答什么是放热反应,什么是吸热反应?
①放热反应: 热量的化学反应。
②吸热反应: 热量的化学反应。
释放
吸收
体会吸、
放热反应
【实验6-1】
【实验6-2】
【同伴助学】
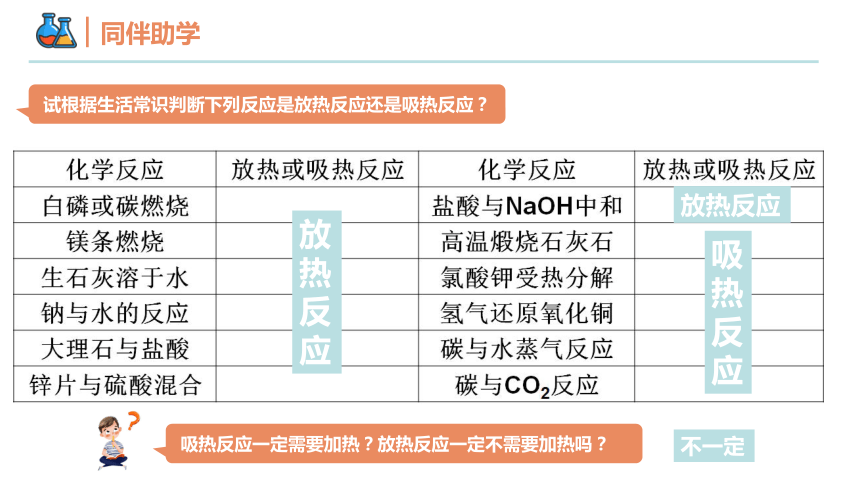
同伴助学
试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
不一定
吸热反应一定需要加热?放热反应一定不需要加热吗?
内容内容内容
一、放热反应与吸热反应
把 热量的化学反应称为放热反应。
常见的放热反应:
可燃物的燃烧
活泼金属和酸或水的反应
酸碱中和反应
大多数化合反应(如生石灰和水反应)
铝热反应
物质的缓慢氧化
2Al+Fe2O3===== 2Fe+Al2O3
高温
教师导学
把 热量的化学反应称为放热反应。
释放
内容内容内容
一、放热反应与吸热反应
把 热量的化学反应称为吸热反应
C+H2O===CO+H2
高温
常见的吸热反应
盐酸与碳酸氢钠的反应
C+CO2===2CO
高温
Ba(OH)2 . 8H2O+2NH4Cl===BaCl2+10H2O+2NH3↑
大多数的分解反应
教师导学
C+CuO===2CO+Cu
高温
把 热量的化学反应称为吸热反应
吸收
一、吸热反应与放热反应
特别提醒:
吸热反应和放热反应均是化学反应。
同伴助学
(1)NaOH固体溶于水、浓H2SO4溶于水,属于放热反应吗?
(2)NH4NO3固体溶于水,升华、蒸发属于吸热反应?
1.举例说明:放出(吸收)热量的变化一定是放热(吸热)反应吗?
同伴助学
不一定。吸、放热反应都属于化学反应,像浓H2SO4、NaOH固体等溶于水放热,NH4NO3、KNO3、NH4Cl等固体溶于水吸热,冰融化成水吸热,以上变化过程均为物理变化,不是放(吸)热反应。
2.放热反应不用加热、吸热反应一定需要加热才能发生吗?
不一定,吸、放热反应与反应是否需要加热等条件没有直接联系,如NH4Cl晶体与Ba(OH)2·8H2O晶体常温下的反应为吸热反应,而H2和O2反应需要点燃的条件反应。
1.下列各组变化中,前者是放热反应,后者是吸热反应的是( )
A.生石灰溶于水;锌粒和稀硫酸反应
B.干冰升华;金属或金属氧化物熔化
C.氨水与醋酸反应;木炭和水蒸气反应生成CO和H2
D.工业煅烧石灰石;化石燃料燃烧
C
训练验学
2.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③工业合成氨是可逆反应,正反应是放热反应则逆反应是吸热反应;④镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
A.只有③ B.只有①② C.①②③④ D.②③④
A
【能力提升】
1.放热反应不一定容易发生如工业合成氨,吸热反应也不一定必须加热,如Ba(OH)2 8H2O 和 NH4Cl ;
2.在可逆反应中,如果正反应为吸热,则逆反应为放热。
训练验学
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
同伴助学
教师导学
化学反应过程中为什么会有能量的变化?
微观角度——分子和原子的角度
2H2 + O2 2H2O
化学变化的实质
在化学变化中,分子破裂成原子,原子又重新组合成新的分子
教师导学
化学反应过程中为什么会有能量的变化?
微观角度——化学键
H2 + Cl2 2HCl
化学变化的实质
化学反应是一个旧的化学键发生断裂,新的化学键发生形成的过程
教师导学
反应物
旧化学键断裂
新化学键形成
生成物
吸收能量E1
放出能量E2
若E1>E2,吸热反应
若E1教师导学
断开 1 mol H—H 键需要吸收 436 kJ 的能量
例如: H2 + Cl2 = 2HCl 该反应是放热反应还是吸热反应?
断开 1 mol Cl—Cl 键需要吸收 243 kJ 的能量
形成 1 mol H—Cl 键需要放出 431 kJ 的能量
E吸收 = 436 + 243 = 679 kJ
E放出 = 431 × 2 = 862 kJ
E吸< E放
放热反应
结论:化学键的断裂和形成是化学反应中能量变化的主要原因。
教师导学
用图形表征化学反应中能量变化
反应进程
能量
H—H
O—O
H H
O O
H—O—H
放热反应
断键吸收
成键释放
反应进程
能量
吸热反应
断键吸收
成键释放
H—O—H
H H
O O
H—H
O—O
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。
放热反应
吸热反应
取决于反应物总能量 与 生成物总能量的相对大小。
(二)从宏观角度分析能量变化的原因(宏观判断)
这个学生画出
能量越低越稳定
同伴助学
小结:化学反应中能量变化的原因
角度一:比较旧化学键断裂吸收能量与新化学键生成放出的能量(微观)
角度二:比较反应物与生成物的总能能量(宏观)
E
E断
生成物
反应过程
反应物
E成
放热反应
E反> E生
E断< E成
E
E断
生成物
反应过程
反应物
E成
吸热反应
E反< E生
E断> E成
教师导学
1.化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示,请回答下列问题:
(1)图中A、C分别表示______________________
_________、____________________,反应____
(填“吸收”或“释放”)能量。
A、C分别表示1 mol N2(g)和3 mol H2(g)(反应物)的总能量、2 mol NH3(g)(生成物)的总能量,由于反应物总能量高于生成物总能量,因此反应放出能量。
1 mol N2(g)和3 mol H2(g)
的总能量
2 mol NH3(g)的总能量
释放
训练验学
(2)反应过程中断裂的化学键为______________
___________,_____(填“吸收”或“释放”)的能量为___;形成的化学键为____________,_____(填“吸收”或“释放”)的能量为___。
1 mol N≡N和
吸收
E1
6 mol N—H
释放
E3
3 mol H—H
(3)E2=______或_______(用A、C或E1、E3表示)。
A—C E3-E1
D
训练验学
3.(2022·江苏淮安高一期中)下列反应或过程中能量的变化符合图像的是
A.H+H―→ H—H
B.2NH4Cl+Ba(OH)2·8H2O===BaCl2+2NH3↑+10H2O
C.Mg+2HCl===MgCl2+H2↑
D.H2SO4+2KOH===K2SO4+2H2O
√
训练验学
1.人类对能源的利用三阶段
早期:
以树枝杂草为主要能源
三、人类对能源的利用
教师导学
现代:
煤、石油和天然气
教师导学
多能源结构时期:
太阳能,氢能,核能,风能等
2.面临问题:
影响环境
储量有限,短期内不可再生
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
酸雨
温室效应
提高燃料的燃烧效率
比如:
提高能源的利用率
比如:
开发使用清洁能源
比如:
3.解决方法
能源
一级能源
二级能源
可再生能源
非可再生能源
(可再生能源)
(一级能源加工转换)
(水能,风能,太阳能,)
(煤炭,石油,天然气,核能)
教师导学
蒸汽
电能
水能
风能
石油
天然气
原煤
指出下列哪些是二次能源?
同伴助学
揭秘时刻
2Al+6H2O+2OH-===2[Al(OH)4]-+3H2↑
反应放热
氧化还原反应
CaO+H2O===Ca(OH)2
化合反应
反应放热
01
02
此外,发热包中也常见铝粉,铝通过和碱溶液发生氧化还原反应释放热量,以此实现持续发热。
自热包有不同配方,但大体上包括四类成分。最主要的是生石灰,学名氧化钙,它和水接触之后可以产生熟石灰,学名氢氧化钙。在这个过程中会释放大量热量,是发热包主要的热量来源。
【课堂小结】
1.(2022·广东阳江月考)将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知 ( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
【答案】B
训练验学
2.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,
下列结论正确的是( )
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1molC(金刚石)比1molC(石墨)的总能量高
D
【方法点拨】稳定性物质的判断方法:
①物质能量越低越稳定;
②破坏化学键需要的能量越大越稳定;
③放热反应放出热量越大,生成物稳定。
训练验学
3.已知一定条件下断裂或形成某些化学键的能量数据如下表:
断裂1 mol H2分子中的化学键 吸收能量436 kJ
断裂1 mol Cl2分子中的化学键 吸收能量243 kJ
形成1 mol HCl分子中的化学键 释放能量431 kJ
对于反应:H2(g)+Cl2(g)===2HCl(g),下列说法正确的是 ( )
A.该反应是吸热反应
B.生成1 mol HCl时反应放热431 kJ
C.氢气分子中的化学键比氯气分子中的化学键更牢固
D.相同条件下,氢气分子具有的能量高于氯气分子具有的能量
【答案】C
训练验学
4.下列说法正确的是 ( )
A.干冰升华需吸收大量的热,这个变化是吸热反应
B.已知反应:X+Y===M+N为放热反应,则X的能量一定高于M的能量
C.分解反应一定是吸热反应
D.用氢氧焰可以加热软化玻璃,生产各种玻璃器皿,
主要是利用了氢气和氧气化合时放出的热量
【答案】D
训练验学
5.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键吸收的能量为Q1 kJ,破坏1 mol氯气中的化学键吸收的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式正确的是 ( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
【答案】D
【解析】H2+Cl2===2HCl是放热反应,断裂旧化学键吸收的能量小于形成新化学键放出的能量,所以2Q3>Q1+Q2。
训练验学
第一课时
(化学反应与热能)
化学反应与能量变化
学习目标:
1.通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随着能量变化的观念。
2.能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的原因。
学习重难点:
化学反应中能量变化的原因
个人预学
1.放热反应、吸热反应的概念
2.常见的吸热、放热反应有哪些?
3.化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
微观怎么解释,宏观怎么判断?
情景引入
情景导入
化学反应
物质的变化
能量的变化
化学反应中的两类变化
热能 光能 电能
回顾一下哪些实验现象能感受到反应的热量变化(放热或吸热情况)?
主要表现为热能的变化
教师导学
实验操作 现象 结论
化学方程式 Mg表面冒出大量的气泡,温度计水银柱上升
Mg与盐酸反
应放出热量
实验6-1 镁与盐酸的反应
试管中滴加2mL 2mol/L的盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
Mg+2HCl===MgCl2+H2↑
同伴助学
实验操作 现象 结论
化学方程式 有刺激性气味气体产生;混合物呈糊状; 木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
2NH4Cl+Ba(OH)2·8H2O ===BaCl2+2NH3↑+10H2O
实验6-2
将约20g Ba(OH)2·8H2O晶体研细后与约 10g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片或小木板上,用玻璃棒快速搅拌,闻气味,用手触摸杯壁下部,试着用手拿起烧杯,观察现象。
同伴助学
吸热反应和放热反应
请同学们阅读(教材P33)放热反应和吸热反应的定义,回答什么是放热反应,什么是吸热反应?
①放热反应: 热量的化学反应。
②吸热反应: 热量的化学反应。
释放
吸收
体会吸、
放热反应
【实验6-1】
【实验6-2】
【同伴助学】
同伴助学
试根据生活常识判断下列反应是放热反应还是吸热反应?
放热反应
放热反应
吸热反应
不一定
吸热反应一定需要加热?放热反应一定不需要加热吗?
内容内容内容
一、放热反应与吸热反应
把 热量的化学反应称为放热反应。
常见的放热反应:
可燃物的燃烧
活泼金属和酸或水的反应
酸碱中和反应
大多数化合反应(如生石灰和水反应)
铝热反应
物质的缓慢氧化
2Al+Fe2O3===== 2Fe+Al2O3
高温
教师导学
把 热量的化学反应称为放热反应。
释放
内容内容内容
一、放热反应与吸热反应
把 热量的化学反应称为吸热反应
C+H2O===CO+H2
高温
常见的吸热反应
盐酸与碳酸氢钠的反应
C+CO2===2CO
高温
Ba(OH)2 . 8H2O+2NH4Cl===BaCl2+10H2O+2NH3↑
大多数的分解反应
教师导学
C+CuO===2CO+Cu
高温
把 热量的化学反应称为吸热反应
吸收
一、吸热反应与放热反应
特别提醒:
吸热反应和放热反应均是化学反应。
同伴助学
(1)NaOH固体溶于水、浓H2SO4溶于水,属于放热反应吗?
(2)NH4NO3固体溶于水,升华、蒸发属于吸热反应?
1.举例说明:放出(吸收)热量的变化一定是放热(吸热)反应吗?
同伴助学
不一定。吸、放热反应都属于化学反应,像浓H2SO4、NaOH固体等溶于水放热,NH4NO3、KNO3、NH4Cl等固体溶于水吸热,冰融化成水吸热,以上变化过程均为物理变化,不是放(吸)热反应。
2.放热反应不用加热、吸热反应一定需要加热才能发生吗?
不一定,吸、放热反应与反应是否需要加热等条件没有直接联系,如NH4Cl晶体与Ba(OH)2·8H2O晶体常温下的反应为吸热反应,而H2和O2反应需要点燃的条件反应。
1.下列各组变化中,前者是放热反应,后者是吸热反应的是( )
A.生石灰溶于水;锌粒和稀硫酸反应
B.干冰升华;金属或金属氧化物熔化
C.氨水与醋酸反应;木炭和水蒸气反应生成CO和H2
D.工业煅烧石灰石;化石燃料燃烧
C
训练验学
2.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③工业合成氨是可逆反应,正反应是放热反应则逆反应是吸热反应;④镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能
A.只有③ B.只有①② C.①②③④ D.②③④
A
【能力提升】
1.放热反应不一定容易发生如工业合成氨,吸热反应也不一定必须加热,如Ba(OH)2 8H2O 和 NH4Cl ;
2.在可逆反应中,如果正反应为吸热,则逆反应为放热。
训练验学
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
同伴助学
教师导学
化学反应过程中为什么会有能量的变化?
微观角度——分子和原子的角度
2H2 + O2 2H2O
化学变化的实质
在化学变化中,分子破裂成原子,原子又重新组合成新的分子
教师导学
化学反应过程中为什么会有能量的变化?
微观角度——化学键
H2 + Cl2 2HCl
化学变化的实质
化学反应是一个旧的化学键发生断裂,新的化学键发生形成的过程
教师导学
反应物
旧化学键断裂
新化学键形成
生成物
吸收能量E1
放出能量E2
若E1>E2,吸热反应
若E1
断开 1 mol H—H 键需要吸收 436 kJ 的能量
例如: H2 + Cl2 = 2HCl 该反应是放热反应还是吸热反应?
断开 1 mol Cl—Cl 键需要吸收 243 kJ 的能量
形成 1 mol H—Cl 键需要放出 431 kJ 的能量
E吸收 = 436 + 243 = 679 kJ
E放出 = 431 × 2 = 862 kJ
E吸< E放
放热反应
结论:化学键的断裂和形成是化学反应中能量变化的主要原因。
教师导学
用图形表征化学反应中能量变化
反应进程
能量
H—H
O—O
H H
O O
H—O—H
放热反应
断键吸收
成键释放
反应进程
能量
吸热反应
断键吸收
成键释放
H—O—H
H H
O O
H—H
O—O
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。
放热反应
吸热反应
取决于反应物总能量 与 生成物总能量的相对大小。
(二)从宏观角度分析能量变化的原因(宏观判断)
这个学生画出
能量越低越稳定
同伴助学
小结:化学反应中能量变化的原因
角度一:比较旧化学键断裂吸收能量与新化学键生成放出的能量(微观)
角度二:比较反应物与生成物的总能能量(宏观)
E
E断
生成物
反应过程
反应物
E成
放热反应
E反> E生
E断< E成
E
E断
生成物
反应过程
反应物
E成
吸热反应
E反< E生
E断> E成
教师导学
1.化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示,请回答下列问题:
(1)图中A、C分别表示______________________
_________、____________________,反应____
(填“吸收”或“释放”)能量。
A、C分别表示1 mol N2(g)和3 mol H2(g)(反应物)的总能量、2 mol NH3(g)(生成物)的总能量,由于反应物总能量高于生成物总能量,因此反应放出能量。
1 mol N2(g)和3 mol H2(g)
的总能量
2 mol NH3(g)的总能量
释放
训练验学
(2)反应过程中断裂的化学键为______________
___________,_____(填“吸收”或“释放”)的能量为___;形成的化学键为____________,_____(填“吸收”或“释放”)的能量为___。
1 mol N≡N和
吸收
E1
6 mol N—H
释放
E3
3 mol H—H
(3)E2=______或_______(用A、C或E1、E3表示)。
A—C E3-E1
D
训练验学
3.(2022·江苏淮安高一期中)下列反应或过程中能量的变化符合图像的是
A.H+H―→ H—H
B.2NH4Cl+Ba(OH)2·8H2O===BaCl2+2NH3↑+10H2O
C.Mg+2HCl===MgCl2+H2↑
D.H2SO4+2KOH===K2SO4+2H2O
√
训练验学
1.人类对能源的利用三阶段
早期:
以树枝杂草为主要能源
三、人类对能源的利用
教师导学
现代:
煤、石油和天然气
教师导学
多能源结构时期:
太阳能,氢能,核能,风能等
2.面临问题:
影响环境
储量有限,短期内不可再生
煤、石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
酸雨
温室效应
提高燃料的燃烧效率
比如:
提高能源的利用率
比如:
开发使用清洁能源
比如:
3.解决方法
能源
一级能源
二级能源
可再生能源
非可再生能源
(可再生能源)
(一级能源加工转换)
(水能,风能,太阳能,)
(煤炭,石油,天然气,核能)
教师导学
蒸汽
电能
水能
风能
石油
天然气
原煤
指出下列哪些是二次能源?
同伴助学
揭秘时刻
2Al+6H2O+2OH-===2[Al(OH)4]-+3H2↑
反应放热
氧化还原反应
CaO+H2O===Ca(OH)2
化合反应
反应放热
01
02
此外,发热包中也常见铝粉,铝通过和碱溶液发生氧化还原反应释放热量,以此实现持续发热。
自热包有不同配方,但大体上包括四类成分。最主要的是生石灰,学名氧化钙,它和水接触之后可以产生熟石灰,学名氢氧化钙。在这个过程中会释放大量热量,是发热包主要的热量来源。
【课堂小结】
1.(2022·广东阳江月考)将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知 ( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
【答案】B
训练验学
2.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,
下列结论正确的是( )
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1molC(金刚石)比1molC(石墨)的总能量高
D
【方法点拨】稳定性物质的判断方法:
①物质能量越低越稳定;
②破坏化学键需要的能量越大越稳定;
③放热反应放出热量越大,生成物稳定。
训练验学
3.已知一定条件下断裂或形成某些化学键的能量数据如下表:
断裂1 mol H2分子中的化学键 吸收能量436 kJ
断裂1 mol Cl2分子中的化学键 吸收能量243 kJ
形成1 mol HCl分子中的化学键 释放能量431 kJ
对于反应:H2(g)+Cl2(g)===2HCl(g),下列说法正确的是 ( )
A.该反应是吸热反应
B.生成1 mol HCl时反应放热431 kJ
C.氢气分子中的化学键比氯气分子中的化学键更牢固
D.相同条件下,氢气分子具有的能量高于氯气分子具有的能量
【答案】C
训练验学
4.下列说法正确的是 ( )
A.干冰升华需吸收大量的热,这个变化是吸热反应
B.已知反应:X+Y===M+N为放热反应,则X的能量一定高于M的能量
C.分解反应一定是吸热反应
D.用氢氧焰可以加热软化玻璃,生产各种玻璃器皿,
主要是利用了氢气和氧气化合时放出的热量
【答案】D
训练验学
5.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键吸收的能量为Q1 kJ,破坏1 mol氯气中的化学键吸收的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式正确的是 ( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
【答案】D
【解析】H2+Cl2===2HCl是放热反应,断裂旧化学键吸收的能量小于形成新化学键放出的能量,所以2Q3>Q1+Q2。
训练验学
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
