2023—2024学年科粤版(2012)化学九年级下册第八章 常见的酸、碱、盐 基础训练题(含答案)
文档属性
| 名称 | 2023—2024学年科粤版(2012)化学九年级下册第八章 常见的酸、碱、盐 基础训练题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 546.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-15 19:56:47 | ||
图片预览




文档简介
2023—2024学年科粤版(2012)化学九年级下册第八章 常见的酸、碱、盐 基础训练题附答案
一、选择题。
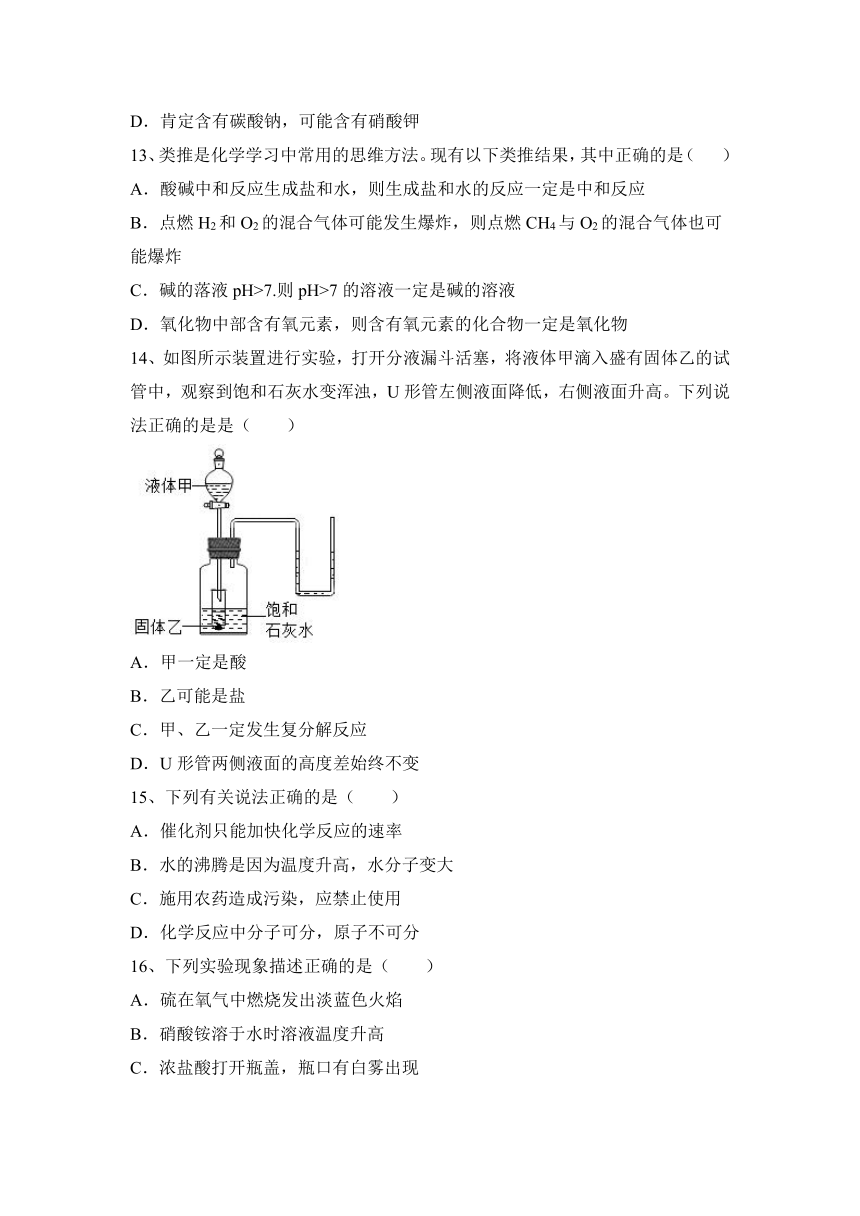
1、下列实验方法或操作能达到实验目的,且结果正确的是( )
选项 实验目的 实验方法或操作
测定某溶液的pH值 取溶液滴到PH试纸上,测得pH=3.5
除去氧化铜中混有的少量木炭粉 隔绝空气加热混合物
鉴别氮气、二氧化碳 用燃着的木条观察火焰是否熄灭
鉴别硫酸铜和氯化钠固体 取样,加水溶解,观察颜色
A.A B.B C.C D.D
2、金属氧化物陶瓷的可用作着色剂,有时需测定金属氧化物中的金属含量。现将Fe2O3、CuO、Al2O3的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是( )
A.20% B.70% C.73.5% D.80%
3、某同学演示酸碱中和并利用反应后的溶液制得Na2SO4固体.下列操作错误的是( )
A.溶解 B.稀释
C.中和 D.蒸发
4、为除去下列物质中的杂质(括号内为杂质),选用试剂和操作方法都正确的是( )
序号 物质 操作方法
A Fe(Fe2O3) 加入过量稀盐酸,过滤
B CO2气体(O2) 将混合气体通过灼热的碳粉
C CaCO3固体(CaCl2) 加水溶解,过滤,洗涤,干燥
D NaCl溶液(MgCl2) 加入过量的NaOH溶液,过滤
A.A B.B C.C D.D
5、化学肥料碳酸氢铵在加热时尤其容易发生反应,为保存该化肥,通常应采取的措施是( )
A.储存仓库要注意通风 B.仓库要尽量密封,保持低温
C.要经常翻动包装袋,防止结块 D.如果受潮要放在太阳下晒干
6、如表实验操作中不能达到实验目的的是( )
选项 实验目的 实验操作
A 比较人体吸入的空气和呼出气体中氧气的含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别氢氧化钠和氯化钠固体 分别放入盛水的烧杯中,用手触摸烧杯外壁
C 探究铁和铜的活动性 铁和铜分别放入硫酸锌溶液中
D 鉴别NH4Cl固体和KCl固体 分别加入熟石灰研磨,闻气味
A.A B.B C.C D.D
7、水是人类宝贵的自然资源,下列有关水的说法正确的是( )
A.煮沸可以使硬水软化 B.正常雨水一般显中性
C.溶液中只有水可作溶剂 D.硬水属于混合物,软水属于纯净物
8、下列有关“验证氢氧化钠与稀硫酸反应”的实验操作,符合规范要求的是( )
A.倾倒NaOH溶液 B.稀释浓硫酸
C.滴加稀硫酸 D.测溶液pH
9、逻辑推理是一种重要的化学思维方法.以下推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.碳酸盐能与酸反应产生气体,则能与酸反应产生气体的物质一定是碳酸盐
C.H2O和H2O2的分子构成不同,则化学性质不同
D.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
10、下列事实和解释相符的是( )
A.干冰用作制冷剂——干冰是冰
B.纯碱溶液使酚酞试液变红——纯碱是碱
C.用炭黑墨汁书写的字经久不变色——常温下,碳的化学性质稳定
D.制糖工业用活性炭脱色制白糖——活性炭和有色物质反应
11、下列有关化学肥料性质和用途的说法中错误的是( )
A.氮肥通常情况下是白色的晶体
B.铵态氮肥与草木灰一起使用可以增强肥力
C.可以用氢氧化钙或与氢氧化钠溶液共热的方法鉴别铵态氮肥
D.化肥对农业增产有重要作用
12、某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是( )
A.肯定含有硝酸钾,可能含有硝酸钡
B.肯定含有碳酸钠,可能含有硝酸钡
C.不含硫酸铜和硝酸钡,只含碳酸钠
D.肯定含有碳酸钠,可能含有硝酸钾
13、类推是化学学习中常用的思维方法。现有以下类推结果,其中正确的是( )
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸
C.碱的落液pH>7.则pH>7的溶液一定是碱的溶液
D.氧化物中部含有氧元素,则含有氧元素的化合物一定是氧化物
14、如图所示装置进行实验,打开分液漏斗活塞,将液体甲滴入盛有固体乙的试管中,观察到饱和石灰水变浑浊,U形管左侧液面降低,右侧液面升高。下列说法正确的是是( )
A.甲一定是酸
B.乙可能是盐
C.甲、乙一定发生复分解反应
D.U形管两侧液面的高度差始终不变
15、下列有关说法正确的是( )
A.催化剂只能加快化学反应的速率
B.水的沸腾是因为温度升高,水分子变大
C.施用农药造成污染,应禁止使用
D.化学反应中分子可分,原子不可分
16、下列实验现象描述正确的是( )
A.硫在氧气中燃烧发出淡蓝色火焰
B.硝酸铵溶于水时溶液温度升高
C.浓盐酸打开瓶盖,瓶口有白雾出现
D.氯化铵加熟石灰研磨有氨气产生
二、填空题。
17、铅蓄电池在生产、生活中使用广泛,其构造如图所示,回答下列问题。
(1)铅蓄电池充电时是将电能转化为 ______ (填序号)。
A 机械能 B 热能 C 化学能
(2)铅蓄电池放电过程中,反应的化学方程式为:
,据此可知,铅蓄电池在放电时,溶液的pH不断 ______ (选填“增大”“减小”或“不变”)。
18、某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为 ,待铁锈消失后又看到 现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为 溶液。
19、用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示:
(1)该实验是将___________(填“稀硫酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)完全中和一定量的某硫酸溶液需要100g8%的NaOH溶液,若改用100g8%的KOH溶液,则反应后的溶液的pH___________7(填“>”、“<”或“=”)
20、复分解反应是我们学过的基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①碳酸钾溶液与石灰水反应:_____ ;
②碳酸钾和稀盐酸混合:_____ ;
③氢氧化钡与稀硝酸混合:_____ 。
(2)你想到上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述①中,实际参加反应的离子是CO32﹣和Ca2+,而K+和OH﹣则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_____ ,上述反应③中实际参加反应的离子是_____ 。
21、果果在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,经查阅记录本发现可能是氢氧化钠、硫酸铜、食盐、碳酸钙中的一种。果果为了检验该白色固体成分,取少量白色固体样品放入水中,搅拌,观察实验现象。请根据现象填写相关物质的化学式:
(1)若溶于水形成蓝色溶液,则该白色固体是 ;
(2)若不溶于水,则该白色固体则是 ;
(3)若溶于水溶液温度无明显变化,则该白色固体是 ;
(4)若溶于水溶液温度升高,则该白色固体是 ;
三、综合应用题。
22、根据下列仪器装置,回答有关问题。
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是 (用化学式表示);收集氧气可以选用的装置是 填装置序号)。实验结束熄灭酒精灯的操作为 。
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为 。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为 →H→ →干燥、纯净CO2 (在括号内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3=Na2CO3+H2O;Ca(HCO3)2溶于水。
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④ 。
【实验】请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 现象 分析
取少量反应后的溶液,加入足量的CaCl2溶液 。 发生反应的方程式: 。
。 产生白色沉淀 结论:猜想③正确
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是 。
四、实验题。
23、为研究CO2与NaOH溶液发生的反应,学习小组的同学进行了下列实验探究。
【查阅资料】本实验条件下,Na2CO3溶液和 NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)实验一:小林取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪;小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 。实验中,小林采用两只矿泉水瓶做对比实验的目的是 。
(2)实验二:小亮取少许实验一所得溶液X于烧杯中,向其中加入BaCl2溶液观察到 ,说明CO2和NaOH溶液发生了反应。
(3)实验三:学习小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液pH和温度的变化,结果如图1、图2所示。
图1中,AB段发生反应的化学方程式为 。
图2中,DE段温度变化的原因是 。
【拓展应用】在实验室中,氢氧化钠固体应 保存。
五、计算类题。
24、某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少______?(写出计算过程)
(3)y=____。
(4)b点对应的溶液的溶质是(填化学式)_________。
2023—2024学年科粤版(2012)化学九年级下册第八章 常见的酸、碱、盐 基础训练题附答案
一、选择题。
1、下列实验方法或操作能达到实验目的,且结果正确的是( )
选项 实验目的 实验方法或操作
测定某溶液的pH值 取溶液滴到PH试纸上,测得pH=3.5
除去氧化铜中混有的少量木炭粉 隔绝空气加热混合物
鉴别氮气、二氧化碳 用燃着的木条观察火焰是否熄灭
鉴别硫酸铜和氯化钠固体 取样,加水溶解,观察颜色
A.A B.B C.C D.D
【答案】D
2、金属氧化物陶瓷的可用作着色剂,有时需测定金属氧化物中的金属含量。现将Fe2O3、CuO、Al2O3的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是( )
A.20% B.70% C.73.5% D.80%
【答案】B
3、某同学演示酸碱中和并利用反应后的溶液制得Na2SO4固体.下列操作错误的是( )
A.溶解 B.稀释
C.中和 D.蒸发
【答案】A
4、为除去下列物质中的杂质(括号内为杂质),选用试剂和操作方法都正确的是( )
序号 物质 操作方法
A Fe(Fe2O3) 加入过量稀盐酸,过滤
B CO2气体(O2) 将混合气体通过灼热的碳粉
C CaCO3固体(CaCl2) 加水溶解,过滤,洗涤,干燥
D NaCl溶液(MgCl2) 加入过量的NaOH溶液,过滤
A.A B.B C.C D.D
【答案】C
5、化学肥料碳酸氢铵在加热时尤其容易发生反应,为保存该化肥,通常应采取的措施是( )
A.储存仓库要注意通风 B.仓库要尽量密封,保持低温
C.要经常翻动包装袋,防止结块 D.如果受潮要放在太阳下晒干
【答案】B
6、如表实验操作中不能达到实验目的的是( )
选项 实验目的 实验操作
A 比较人体吸入的空气和呼出气体中氧气的含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别氢氧化钠和氯化钠固体 分别放入盛水的烧杯中,用手触摸烧杯外壁
C 探究铁和铜的活动性 铁和铜分别放入硫酸锌溶液中
D 鉴别NH4Cl固体和KCl固体 分别加入熟石灰研磨,闻气味
A.A B.B C.C D.D
【答案】C
7、水是人类宝贵的自然资源,下列有关水的说法正确的是( )
A.煮沸可以使硬水软化 B.正常雨水一般显中性
C.溶液中只有水可作溶剂 D.硬水属于混合物,软水属于纯净物
【答案】A
8、下列有关“验证氢氧化钠与稀硫酸反应”的实验操作,符合规范要求的是( )
A.倾倒NaOH溶液 B.稀释浓硫酸
C.滴加稀硫酸 D.测溶液pH
【答案】C
9、逻辑推理是一种重要的化学思维方法.以下推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.碳酸盐能与酸反应产生气体,则能与酸反应产生气体的物质一定是碳酸盐
C.H2O和H2O2的分子构成不同,则化学性质不同
D.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
【答案】C
10、下列事实和解释相符的是( )
A.干冰用作制冷剂——干冰是冰
B.纯碱溶液使酚酞试液变红——纯碱是碱
C.用炭黑墨汁书写的字经久不变色——常温下,碳的化学性质稳定
D.制糖工业用活性炭脱色制白糖——活性炭和有色物质反应
【答案】C
11、下列有关化学肥料性质和用途的说法中错误的是( )
A.氮肥通常情况下是白色的晶体
B.铵态氮肥与草木灰一起使用可以增强肥力
C.可以用氢氧化钙或与氢氧化钠溶液共热的方法鉴别铵态氮肥
D.化肥对农业增产有重要作用
【答案】B
12、某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是( )
A.肯定含有硝酸钾,可能含有硝酸钡
B.肯定含有碳酸钠,可能含有硝酸钡
C.不含硫酸铜和硝酸钡,只含碳酸钠
D.肯定含有碳酸钠,可能含有硝酸钾
【答案】D
13、类推是化学学习中常用的思维方法。现有以下类推结果,其中正确的是( )
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸
C.碱的落液pH>7.则pH>7的溶液一定是碱的溶液
D.氧化物中部含有氧元素,则含有氧元素的化合物一定是氧化物
【答案】B
14、如图所示装置进行实验,打开分液漏斗活塞,将液体甲滴入盛有固体乙的试管中,观察到饱和石灰水变浑浊,U形管左侧液面降低,右侧液面升高。下列说法正确的是是( )
A.甲一定是酸
B.乙可能是盐
C.甲、乙一定发生复分解反应
D.U形管两侧液面的高度差始终不变
【答案】B
15、下列有关说法正确的是( )
A.催化剂只能加快化学反应的速率
B.水的沸腾是因为温度升高,水分子变大
C.施用农药造成污染,应禁止使用
D.化学反应中分子可分,原子不可分
【答案】D
16、下列实验现象描述正确的是( )
A.硫在氧气中燃烧发出淡蓝色火焰
B.硝酸铵溶于水时溶液温度升高
C.浓盐酸打开瓶盖,瓶口有白雾出现
D.氯化铵加熟石灰研磨有氨气产生
【答案】C
二、填空题。
17、铅蓄电池在生产、生活中使用广泛,其构造如图所示,回答下列问题。
(1)铅蓄电池充电时是将电能转化为 ______ (填序号)。
A 机械能 B 热能 C 化学能
(2)铅蓄电池放电过程中,反应的化学方程式为:
,据此可知,铅蓄电池在放电时,溶液的pH不断 ______ (选填“增大”“减小”或“不变”)。
【答案】C 增大
18、某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为 ,待铁锈消失后又看到 现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为 溶液。
【答案】;有气泡产生;氯化亚铁
19、用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示:
(1)该实验是将___________(填“稀硫酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)完全中和一定量的某硫酸溶液需要100g8%的NaOH溶液,若改用100g8%的KOH溶液,则反应后的溶液的pH___________7(填“>”、“<”或“=”)
【答案】氢氧化钠溶液 <
20、复分解反应是我们学过的基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①碳酸钾溶液与石灰水反应:_____ ;
②碳酸钾和稀盐酸混合:_____ ;
③氢氧化钡与稀硝酸混合:_____ 。
(2)你想到上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述①中,实际参加反应的离子是CO32﹣和Ca2+,而K+和OH﹣则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_____ ,上述反应③中实际参加反应的离子是_____ 。
【答案】(1)K2CO3+Ca(OH)2═CaCO3↓+2KOH
K2CO3+2HCl═2KCl+CO2↑+H2O
Ba(OH)2+2HNO3═Ba(NO3)2+2H2O
(2)CO32﹣、H+ OH﹣、H+
21、果果在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,经查阅记录本发现可能是氢氧化钠、硫酸铜、食盐、碳酸钙中的一种。果果为了检验该白色固体成分,取少量白色固体样品放入水中,搅拌,观察实验现象。请根据现象填写相关物质的化学式:
(1)若溶于水形成蓝色溶液,则该白色固体是 ;
(2)若不溶于水,则该白色固体则是 ;
(3)若溶于水溶液温度无明显变化,则该白色固体是 ;
(4)若溶于水溶液温度升高,则该白色固体是 ;
【答案】CuSO4 CaCO3 NaCl NaOH
三、综合应用题。
22、根据下列仪器装置,回答有关问题。
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是 (用化学式表示);收集氧气可以选用的装置是 填装置序号)。实验结束熄灭酒精灯的操作为 。
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为 。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为 →H→ →干燥、纯净CO2 (在括号内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3=Na2CO3+H2O;Ca(HCO3)2溶于水。
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④ 。
【实验】请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 现象 分析
取少量反应后的溶液,加入足量的CaCl2溶液 。 发生反应的方程式: 。
。 产生白色沉淀 结论:猜想③正确
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是 。
【答案】(1)KClO3、MnO2 C 用灯帽盖灭
(2) B E
(3)NaOH、Na2CO3 产生白色沉淀
过滤,向滤液中加入少量的氢氧化钠溶液 通入二氧化碳的量的多少
四、实验题。
23、为研究CO2与NaOH溶液发生的反应,学习小组的同学进行了下列实验探究。
【查阅资料】本实验条件下,Na2CO3溶液和 NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)实验一:小林取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪;小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 。实验中,小林采用两只矿泉水瓶做对比实验的目的是 。
(2)实验二:小亮取少许实验一所得溶液X于烧杯中,向其中加入BaCl2溶液观察到 ,说明CO2和NaOH溶液发生了反应。
(3)实验三:学习小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液pH和温度的变化,结果如图1、图2所示。
图1中,AB段发生反应的化学方程式为 。
图2中,DE段温度变化的原因是 。
【拓展应用】在实验室中,氢氧化钠固体应 保存。
【答案】(1)瓶子变瘪比装水的更瘪(合理即可)
排除水的干扰,证明二氧化碳和氢氧化钠溶液发生了反应(合理即可)
(2)有白色沉淀产生 (3)
二氧化碳和氢氧化钠溶液反应放热 密封
五、计算类题。
24、某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少______?(写出计算过程)
(3)y=____。
(4)b点对应的溶液的溶质是(填化学式)_________。
【答案】(1)5 (2)11.1%。 (3)2.2 (4)NaCl
【详解】(1)根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与氯化钙反应,生成沉淀5.0g。
(2)设:生成沉淀5.0g所需CaCl2的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl 111 100 x 5g
x=5.55g,
50g溶液中CaCl2的质量分数=×100%=11.1%;
(3)根据题意可知,与盐酸反应的碳酸钠的质量为53g×10%=5.3g;
设:5.3gNa2CO3与盐酸反应生成的二氧化碳的质量为y,
Na2CO3+2HCl===2NaCl+CO2↑+H2O106 445.3g y
y=2.2g;
(4)b点表示碳酸钠与氯化钙、盐酸恰好完全反应,对应的溶液的溶质是氯化钠,化学式为NaCl。
一、选择题。
1、下列实验方法或操作能达到实验目的,且结果正确的是( )
选项 实验目的 实验方法或操作
测定某溶液的pH值 取溶液滴到PH试纸上,测得pH=3.5
除去氧化铜中混有的少量木炭粉 隔绝空气加热混合物
鉴别氮气、二氧化碳 用燃着的木条观察火焰是否熄灭
鉴别硫酸铜和氯化钠固体 取样,加水溶解,观察颜色
A.A B.B C.C D.D
2、金属氧化物陶瓷的可用作着色剂,有时需测定金属氧化物中的金属含量。现将Fe2O3、CuO、Al2O3的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是( )
A.20% B.70% C.73.5% D.80%
3、某同学演示酸碱中和并利用反应后的溶液制得Na2SO4固体.下列操作错误的是( )
A.溶解 B.稀释
C.中和 D.蒸发
4、为除去下列物质中的杂质(括号内为杂质),选用试剂和操作方法都正确的是( )
序号 物质 操作方法
A Fe(Fe2O3) 加入过量稀盐酸,过滤
B CO2气体(O2) 将混合气体通过灼热的碳粉
C CaCO3固体(CaCl2) 加水溶解,过滤,洗涤,干燥
D NaCl溶液(MgCl2) 加入过量的NaOH溶液,过滤
A.A B.B C.C D.D
5、化学肥料碳酸氢铵在加热时尤其容易发生反应,为保存该化肥,通常应采取的措施是( )
A.储存仓库要注意通风 B.仓库要尽量密封,保持低温
C.要经常翻动包装袋,防止结块 D.如果受潮要放在太阳下晒干
6、如表实验操作中不能达到实验目的的是( )
选项 实验目的 实验操作
A 比较人体吸入的空气和呼出气体中氧气的含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别氢氧化钠和氯化钠固体 分别放入盛水的烧杯中,用手触摸烧杯外壁
C 探究铁和铜的活动性 铁和铜分别放入硫酸锌溶液中
D 鉴别NH4Cl固体和KCl固体 分别加入熟石灰研磨,闻气味
A.A B.B C.C D.D
7、水是人类宝贵的自然资源,下列有关水的说法正确的是( )
A.煮沸可以使硬水软化 B.正常雨水一般显中性
C.溶液中只有水可作溶剂 D.硬水属于混合物,软水属于纯净物
8、下列有关“验证氢氧化钠与稀硫酸反应”的实验操作,符合规范要求的是( )
A.倾倒NaOH溶液 B.稀释浓硫酸
C.滴加稀硫酸 D.测溶液pH
9、逻辑推理是一种重要的化学思维方法.以下推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.碳酸盐能与酸反应产生气体,则能与酸反应产生气体的物质一定是碳酸盐
C.H2O和H2O2的分子构成不同,则化学性质不同
D.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
10、下列事实和解释相符的是( )
A.干冰用作制冷剂——干冰是冰
B.纯碱溶液使酚酞试液变红——纯碱是碱
C.用炭黑墨汁书写的字经久不变色——常温下,碳的化学性质稳定
D.制糖工业用活性炭脱色制白糖——活性炭和有色物质反应
11、下列有关化学肥料性质和用途的说法中错误的是( )
A.氮肥通常情况下是白色的晶体
B.铵态氮肥与草木灰一起使用可以增强肥力
C.可以用氢氧化钙或与氢氧化钠溶液共热的方法鉴别铵态氮肥
D.化肥对农业增产有重要作用
12、某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是( )
A.肯定含有硝酸钾,可能含有硝酸钡
B.肯定含有碳酸钠,可能含有硝酸钡
C.不含硫酸铜和硝酸钡,只含碳酸钠
D.肯定含有碳酸钠,可能含有硝酸钾
13、类推是化学学习中常用的思维方法。现有以下类推结果,其中正确的是( )
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸
C.碱的落液pH>7.则pH>7的溶液一定是碱的溶液
D.氧化物中部含有氧元素,则含有氧元素的化合物一定是氧化物
14、如图所示装置进行实验,打开分液漏斗活塞,将液体甲滴入盛有固体乙的试管中,观察到饱和石灰水变浑浊,U形管左侧液面降低,右侧液面升高。下列说法正确的是是( )
A.甲一定是酸
B.乙可能是盐
C.甲、乙一定发生复分解反应
D.U形管两侧液面的高度差始终不变
15、下列有关说法正确的是( )
A.催化剂只能加快化学反应的速率
B.水的沸腾是因为温度升高,水分子变大
C.施用农药造成污染,应禁止使用
D.化学反应中分子可分,原子不可分
16、下列实验现象描述正确的是( )
A.硫在氧气中燃烧发出淡蓝色火焰
B.硝酸铵溶于水时溶液温度升高
C.浓盐酸打开瓶盖,瓶口有白雾出现
D.氯化铵加熟石灰研磨有氨气产生
二、填空题。
17、铅蓄电池在生产、生活中使用广泛,其构造如图所示,回答下列问题。
(1)铅蓄电池充电时是将电能转化为 ______ (填序号)。
A 机械能 B 热能 C 化学能
(2)铅蓄电池放电过程中,反应的化学方程式为:
,据此可知,铅蓄电池在放电时,溶液的pH不断 ______ (选填“增大”“减小”或“不变”)。
18、某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为 ,待铁锈消失后又看到 现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为 溶液。
19、用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示:
(1)该实验是将___________(填“稀硫酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)完全中和一定量的某硫酸溶液需要100g8%的NaOH溶液,若改用100g8%的KOH溶液,则反应后的溶液的pH___________7(填“>”、“<”或“=”)
20、复分解反应是我们学过的基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①碳酸钾溶液与石灰水反应:_____ ;
②碳酸钾和稀盐酸混合:_____ ;
③氢氧化钡与稀硝酸混合:_____ 。
(2)你想到上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述①中,实际参加反应的离子是CO32﹣和Ca2+,而K+和OH﹣则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_____ ,上述反应③中实际参加反应的离子是_____ 。
21、果果在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,经查阅记录本发现可能是氢氧化钠、硫酸铜、食盐、碳酸钙中的一种。果果为了检验该白色固体成分,取少量白色固体样品放入水中,搅拌,观察实验现象。请根据现象填写相关物质的化学式:
(1)若溶于水形成蓝色溶液,则该白色固体是 ;
(2)若不溶于水,则该白色固体则是 ;
(3)若溶于水溶液温度无明显变化,则该白色固体是 ;
(4)若溶于水溶液温度升高,则该白色固体是 ;
三、综合应用题。
22、根据下列仪器装置,回答有关问题。
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是 (用化学式表示);收集氧气可以选用的装置是 填装置序号)。实验结束熄灭酒精灯的操作为 。
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为 。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为 →H→ →干燥、纯净CO2 (在括号内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3=Na2CO3+H2O;Ca(HCO3)2溶于水。
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④ 。
【实验】请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 现象 分析
取少量反应后的溶液,加入足量的CaCl2溶液 。 发生反应的方程式: 。
。 产生白色沉淀 结论:猜想③正确
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是 。
四、实验题。
23、为研究CO2与NaOH溶液发生的反应,学习小组的同学进行了下列实验探究。
【查阅资料】本实验条件下,Na2CO3溶液和 NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)实验一:小林取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪;小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 。实验中,小林采用两只矿泉水瓶做对比实验的目的是 。
(2)实验二:小亮取少许实验一所得溶液X于烧杯中,向其中加入BaCl2溶液观察到 ,说明CO2和NaOH溶液发生了反应。
(3)实验三:学习小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液pH和温度的变化,结果如图1、图2所示。
图1中,AB段发生反应的化学方程式为 。
图2中,DE段温度变化的原因是 。
【拓展应用】在实验室中,氢氧化钠固体应 保存。
五、计算类题。
24、某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少______?(写出计算过程)
(3)y=____。
(4)b点对应的溶液的溶质是(填化学式)_________。
2023—2024学年科粤版(2012)化学九年级下册第八章 常见的酸、碱、盐 基础训练题附答案
一、选择题。
1、下列实验方法或操作能达到实验目的,且结果正确的是( )
选项 实验目的 实验方法或操作
测定某溶液的pH值 取溶液滴到PH试纸上,测得pH=3.5
除去氧化铜中混有的少量木炭粉 隔绝空气加热混合物
鉴别氮气、二氧化碳 用燃着的木条观察火焰是否熄灭
鉴别硫酸铜和氯化钠固体 取样,加水溶解,观察颜色
A.A B.B C.C D.D
【答案】D
2、金属氧化物陶瓷的可用作着色剂,有时需测定金属氧化物中的金属含量。现将Fe2O3、CuO、Al2O3的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是( )
A.20% B.70% C.73.5% D.80%
【答案】B
3、某同学演示酸碱中和并利用反应后的溶液制得Na2SO4固体.下列操作错误的是( )
A.溶解 B.稀释
C.中和 D.蒸发
【答案】A
4、为除去下列物质中的杂质(括号内为杂质),选用试剂和操作方法都正确的是( )
序号 物质 操作方法
A Fe(Fe2O3) 加入过量稀盐酸,过滤
B CO2气体(O2) 将混合气体通过灼热的碳粉
C CaCO3固体(CaCl2) 加水溶解,过滤,洗涤,干燥
D NaCl溶液(MgCl2) 加入过量的NaOH溶液,过滤
A.A B.B C.C D.D
【答案】C
5、化学肥料碳酸氢铵在加热时尤其容易发生反应,为保存该化肥,通常应采取的措施是( )
A.储存仓库要注意通风 B.仓库要尽量密封,保持低温
C.要经常翻动包装袋,防止结块 D.如果受潮要放在太阳下晒干
【答案】B
6、如表实验操作中不能达到实验目的的是( )
选项 实验目的 实验操作
A 比较人体吸入的空气和呼出气体中氧气的含量 将燃着的木条分别插入空气样品和呼出气体样品中
B 鉴别氢氧化钠和氯化钠固体 分别放入盛水的烧杯中,用手触摸烧杯外壁
C 探究铁和铜的活动性 铁和铜分别放入硫酸锌溶液中
D 鉴别NH4Cl固体和KCl固体 分别加入熟石灰研磨,闻气味
A.A B.B C.C D.D
【答案】C
7、水是人类宝贵的自然资源,下列有关水的说法正确的是( )
A.煮沸可以使硬水软化 B.正常雨水一般显中性
C.溶液中只有水可作溶剂 D.硬水属于混合物,软水属于纯净物
【答案】A
8、下列有关“验证氢氧化钠与稀硫酸反应”的实验操作,符合规范要求的是( )
A.倾倒NaOH溶液 B.稀释浓硫酸
C.滴加稀硫酸 D.测溶液pH
【答案】C
9、逻辑推理是一种重要的化学思维方法.以下推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.碳酸盐能与酸反应产生气体,则能与酸反应产生气体的物质一定是碳酸盐
C.H2O和H2O2的分子构成不同,则化学性质不同
D.中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
【答案】C
10、下列事实和解释相符的是( )
A.干冰用作制冷剂——干冰是冰
B.纯碱溶液使酚酞试液变红——纯碱是碱
C.用炭黑墨汁书写的字经久不变色——常温下,碳的化学性质稳定
D.制糖工业用活性炭脱色制白糖——活性炭和有色物质反应
【答案】C
11、下列有关化学肥料性质和用途的说法中错误的是( )
A.氮肥通常情况下是白色的晶体
B.铵态氮肥与草木灰一起使用可以增强肥力
C.可以用氢氧化钙或与氢氧化钠溶液共热的方法鉴别铵态氮肥
D.化肥对农业增产有重要作用
【答案】B
12、某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是( )
A.肯定含有硝酸钾,可能含有硝酸钡
B.肯定含有碳酸钠,可能含有硝酸钡
C.不含硫酸铜和硝酸钡,只含碳酸钠
D.肯定含有碳酸钠,可能含有硝酸钾
【答案】D
13、类推是化学学习中常用的思维方法。现有以下类推结果,其中正确的是( )
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸
C.碱的落液pH>7.则pH>7的溶液一定是碱的溶液
D.氧化物中部含有氧元素,则含有氧元素的化合物一定是氧化物
【答案】B
14、如图所示装置进行实验,打开分液漏斗活塞,将液体甲滴入盛有固体乙的试管中,观察到饱和石灰水变浑浊,U形管左侧液面降低,右侧液面升高。下列说法正确的是是( )
A.甲一定是酸
B.乙可能是盐
C.甲、乙一定发生复分解反应
D.U形管两侧液面的高度差始终不变
【答案】B
15、下列有关说法正确的是( )
A.催化剂只能加快化学反应的速率
B.水的沸腾是因为温度升高,水分子变大
C.施用农药造成污染,应禁止使用
D.化学反应中分子可分,原子不可分
【答案】D
16、下列实验现象描述正确的是( )
A.硫在氧气中燃烧发出淡蓝色火焰
B.硝酸铵溶于水时溶液温度升高
C.浓盐酸打开瓶盖,瓶口有白雾出现
D.氯化铵加熟石灰研磨有氨气产生
【答案】C
二、填空题。
17、铅蓄电池在生产、生活中使用广泛,其构造如图所示,回答下列问题。
(1)铅蓄电池充电时是将电能转化为 ______ (填序号)。
A 机械能 B 热能 C 化学能
(2)铅蓄电池放电过程中,反应的化学方程式为:
,据此可知,铅蓄电池在放电时,溶液的pH不断 ______ (选填“增大”“减小”或“不变”)。
【答案】C 增大
18、某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为 ,待铁锈消失后又看到 现象。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为 溶液。
【答案】;有气泡产生;氯化亚铁
19、用稀硫酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的pH变化如图所示:
(1)该实验是将___________(填“稀硫酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)完全中和一定量的某硫酸溶液需要100g8%的NaOH溶液,若改用100g8%的KOH溶液,则反应后的溶液的pH___________7(填“>”、“<”或“=”)
【答案】氢氧化钠溶液 <
20、复分解反应是我们学过的基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①碳酸钾溶液与石灰水反应:_____ ;
②碳酸钾和稀盐酸混合:_____ ;
③氢氧化钡与稀硝酸混合:_____ 。
(2)你想到上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述①中,实际参加反应的离子是CO32﹣和Ca2+,而K+和OH﹣则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_____ ,上述反应③中实际参加反应的离子是_____ 。
【答案】(1)K2CO3+Ca(OH)2═CaCO3↓+2KOH
K2CO3+2HCl═2KCl+CO2↑+H2O
Ba(OH)2+2HNO3═Ba(NO3)2+2H2O
(2)CO32﹣、H+ OH﹣、H+
21、果果在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,经查阅记录本发现可能是氢氧化钠、硫酸铜、食盐、碳酸钙中的一种。果果为了检验该白色固体成分,取少量白色固体样品放入水中,搅拌,观察实验现象。请根据现象填写相关物质的化学式:
(1)若溶于水形成蓝色溶液,则该白色固体是 ;
(2)若不溶于水,则该白色固体则是 ;
(3)若溶于水溶液温度无明显变化,则该白色固体是 ;
(4)若溶于水溶液温度升高,则该白色固体是 ;
【答案】CuSO4 CaCO3 NaCl NaOH
三、综合应用题。
22、根据下列仪器装置,回答有关问题。
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是 (用化学式表示);收集氧气可以选用的装置是 填装置序号)。实验结束熄灭酒精灯的操作为 。
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为 。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为 →H→ →干燥、纯净CO2 (在括号内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3=Na2CO3+H2O;Ca(HCO3)2溶于水。
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④ 。
【实验】请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 现象 分析
取少量反应后的溶液,加入足量的CaCl2溶液 。 发生反应的方程式: 。
。 产生白色沉淀 结论:猜想③正确
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是 。
【答案】(1)KClO3、MnO2 C 用灯帽盖灭
(2) B E
(3)NaOH、Na2CO3 产生白色沉淀
过滤,向滤液中加入少量的氢氧化钠溶液 通入二氧化碳的量的多少
四、实验题。
23、为研究CO2与NaOH溶液发生的反应,学习小组的同学进行了下列实验探究。
【查阅资料】本实验条件下,Na2CO3溶液和 NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)实验一:小林取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪;小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 。实验中,小林采用两只矿泉水瓶做对比实验的目的是 。
(2)实验二:小亮取少许实验一所得溶液X于烧杯中,向其中加入BaCl2溶液观察到 ,说明CO2和NaOH溶液发生了反应。
(3)实验三:学习小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液pH和温度的变化,结果如图1、图2所示。
图1中,AB段发生反应的化学方程式为 。
图2中,DE段温度变化的原因是 。
【拓展应用】在实验室中,氢氧化钠固体应 保存。
【答案】(1)瓶子变瘪比装水的更瘪(合理即可)
排除水的干扰,证明二氧化碳和氢氧化钠溶液发生了反应(合理即可)
(2)有白色沉淀产生 (3)
二氧化碳和氢氧化钠溶液反应放热 密封
五、计算类题。
24、某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少______?(写出计算过程)
(3)y=____。
(4)b点对应的溶液的溶质是(填化学式)_________。
【答案】(1)5 (2)11.1%。 (3)2.2 (4)NaCl
【详解】(1)根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与氯化钙反应,生成沉淀5.0g。
(2)设:生成沉淀5.0g所需CaCl2的质量为x。
Na2CO3+CaCl2===CaCO3↓+2NaCl 111 100 x 5g
x=5.55g,
50g溶液中CaCl2的质量分数=×100%=11.1%;
(3)根据题意可知,与盐酸反应的碳酸钠的质量为53g×10%=5.3g;
设:5.3gNa2CO3与盐酸反应生成的二氧化碳的质量为y,
Na2CO3+2HCl===2NaCl+CO2↑+H2O106 445.3g y
y=2.2g;
(4)b点表示碳酸钠与氯化钙、盐酸恰好完全反应,对应的溶液的溶质是氯化钠,化学式为NaCl。
