2023-2024学年高中化学选择性必修2第一章原子结构与性质检测卷(含答案)
文档属性
| 名称 | 2023-2024学年高中化学选择性必修2第一章原子结构与性质检测卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 674.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-17 19:38:31 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2023-2024学年高中化学选择性必修2第一章原子结构与性质检测卷
一、选择题
1.化学处处呈现美。下列说法不正确的是( )
A.金刚石中的碳原子采取杂化轨道形成空间网状结构
B.溶液与溶液反应生成蓝色沉淀
C.缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性
D.绚烂烟花的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的
2.下列基态原子的核外电子在原子轨道上的能量大小关系错误的是( )
A. B. C. D.
3.肼()是一种强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属单质,因此可用于镜面镀银,原理为。下列说法正确的是( )
A.Ag为d区元素
B.肼分子中心原子的VSEPR模型为四面体形
C.肼分子结构对称,为非极性分子
D.肼与氨气的组成元素相同,性质也完全相同
4.现有三种元素的基态原子的电子排布式如下:①;②;③。则下列说法中错误的是( )
A.①③为金属元素 B.原子半径:③>①>②
C.最高正化合价:①-②=③ D.第一电离能:②>①>③
5.电催化还原的某种催化剂的结构如图,下列说法错误的是( )
A.Re的配位数为6
B.结构中N的杂化方式均相同
C.Rc提供空轨道
D.CO中C的电负性小,易于提供配位电子对
6.三聚的结构如图所示,下列关于三聚的推测合理的是( )
A.S原子的杂化方式与分子中原子的杂化方式相同
B.S原子与O原子间的键长均相同
C.自发转变为三聚的过程放热
D.在水中的溶解度较小
7.砷化镓是一种重要的半导体材料,熔点1238℃。它在600℃以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.基态As原子的价电子排布式为
D.晶胞中Ga与周围等距且最近的As形成的空间正四面体
8.X、Y、Z、W、R是周期表中的短周期主族元素,原子序数依次增大。X在所有元素中原子半径最小,Y、W基态原子核外均有2个未成对电子,R具有11种不同运动状态的电子。下列说法不正确的是( )。
A.原子半径:
B.元素第一电离能:Y<W<Z
C.Y、Z最高价氧化物对应水化物的酸性:Y>Z
D.中含有极性共价键和非极性共价键
9.电子跃迁伴随着能量的释放或吸收。下列与电子跃迁无关的是( )
A.成都大运会燃放的焰火 B.铜丝可以导电
C.装饰建筑夜景的LED灯光 D.从太阳光谱中发现氦
10.短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为
C.r与m可形成离子化合物,其阳离子电子式为
D.一定条件下,m能与Z的单质反应生成p
二、非选择题
11.用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
(ⅰ)
(ⅱ)
(ⅲ)
(1)根据盖斯定律,反应 。
(2)基态碘原子价层电子的轨道表示式为 。
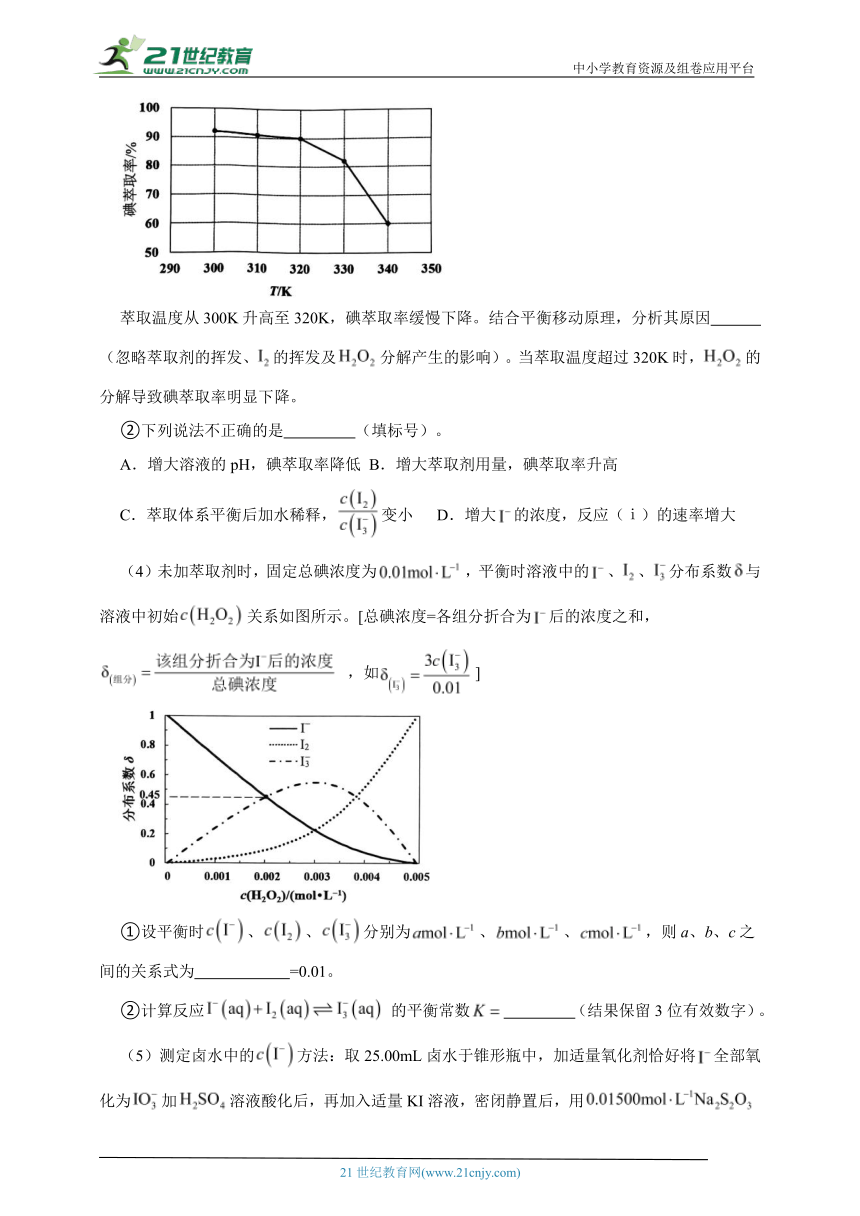
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率]曲线如图所示:
萃取温度从300K升高至320K,碘萃取率缓慢下降。结合平衡移动原理,分析其原因 (忽略萃取剂的挥发、的挥发及分解产生的影响)。当萃取温度超过320K时,的分解导致碘萃取率明显下降。
②下列说法不正确的是 (填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,变小 D.增大的浓度,反应(ⅰ)的速率增大
(4)未加萃取剂时,固定总碘浓度为,平衡时溶液中的、、分布系数与溶液中初始关系如图所示。[总碘浓度=各组分折合为后的浓度之和,,如]
①设平衡时、、分别为、、,则a、b、c之间的关系式为 =0.01。
②计算反应的平衡常数 (结果保留3位有效数字)。
(5)测定卤水中的方法:取25.00mL卤水于锥形瓶中,加适量氧化剂恰好将全部氧化为加溶液酸化后,再加入适量KI溶液,密闭静置后,用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗,则卤水中 。(已知:)
12.硫酸锌是制造锌钡白和锌盐的主要原料,口服硫酸锌可纠正锌缺乏,恢复酶系统的功能。用锌白矿(主要成分为ZnO,还含有、、等杂质)制备的流程如图:
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol L时视为沉淀完全):
金属离子 开始沉淀的pH 沉淀完全的pH
1.1 3.1
7.6 9.6
6.4 8.0
(1)基态锌离子的价层电子轨道表示式为 。
(2)“酸浸”前通常需要将锌白矿粉碎,其目的是 。
(3)滤渣1的主要成分为 (填化学式)。
(4)加入“氧化”时发生反应的离子方程式为 。
(5)加入试剂X调节溶液的pH在,使铁元素转化为沉淀而除去,试剂X可以选用下列中的 (填标号)。
A.ZnO B. C.
根据题中数据计算常温下的溶度积 .
(6)pH过大时,锌元素会以形式存在,则中存在的作用力为____(填标号)。
A.离子键 B.共价键 C.σ键 D.π键
13.C、Si、Ge、Sn是同族元素,该族元素的单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)C、Si、Ge、Sn的第一电离能从大到小的顺序是 (用元素符号表示);在基态Ge原子中,电子占据的最高能层的符号为 ,该能层中有 种不同运动状态的电子。
(2)有晶体和非晶体两种,可通过 方法鉴别二者。
(3)C、Si、Ge、Sn均能与卤素化合,已知常温下为无色液体,遇水有白雾出现,发烟,则属于 (填“共价”“分子”或“离子”)晶体;遇水有白雾出现的化学方程式为 .
(4)是一种优秀的透明导电材料,其晶胞结构如图所示。晶胞参数分别为a pm、a pm、c pm,晶胞中立方体的边长为a pm,阿伏加德罗常数的值为。
①白球表示的是 (填元素符号)。
②晶体的密度为 g cm。
14.某农药由原子序数依次增大的V、W、X、Y、Z五种前四周期元素组成。请根据下列相关信息,回答问题。
元素 相关信息
V 核外电子数与周期序数相等
W 成对电子数与未成对电子数之比为3∶1
X 在火山口附近可发现其淡黄色固体单质
Y 有四个电子层,且最外层电子数与最内层电子数相等
Z 基态Z元素原子的价层电子排布式为
(1)Y元素在周期表中的位置为第 周期第 族;基态Z元素原子的最外层电子所占据的原子轨道的电子云轮廓图为 形。
(2)V、W、X三种元素的电负性由大到小的顺序是 (用元素符号表示);W、X的最简单氢化物的熔、沸点由大到小的顺序是 (用化学式表示),原因为 。
(3)Y、Z两种元素的最高价氧化物对应的水化物的酸性或碱性最强的是 (填化学式)。
(4)W、X可组成空间结构为平面三角形的分子,该分子的化学式为 。分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则该平面三角形分子中的大π键应表示为 .
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】C
5.【答案】B
6.【答案】C
7.【答案】D
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】(1)
(2)
(3)反应(ⅱ)、(ⅲ)均为放热反应,升温导致平衡逆向移动,碘萃取率下降;C
(4);667
(5)
12.【答案】(1)
(2)增大接触面积,使反应快速而充分
(3)
(4)
(5)AB;
(6)B;C
13.【答案】(1);N;4
(2)X射线衍射
(3)分子;
(4)Sn;
14.【答案】(1)四;ⅡA;球
(2);;可形成分子间氢键,而不能
(3)
(4);
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2023-2024学年高中化学选择性必修2第一章原子结构与性质检测卷
一、选择题
1.化学处处呈现美。下列说法不正确的是( )
A.金刚石中的碳原子采取杂化轨道形成空间网状结构
B.溶液与溶液反应生成蓝色沉淀
C.缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性
D.绚烂烟花的产生是电子由基态跃迁到激发态时,能量以光的形式释放引起的
2.下列基态原子的核外电子在原子轨道上的能量大小关系错误的是( )
A. B. C. D.
3.肼()是一种强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属单质,因此可用于镜面镀银,原理为。下列说法正确的是( )
A.Ag为d区元素
B.肼分子中心原子的VSEPR模型为四面体形
C.肼分子结构对称,为非极性分子
D.肼与氨气的组成元素相同,性质也完全相同
4.现有三种元素的基态原子的电子排布式如下:①;②;③。则下列说法中错误的是( )
A.①③为金属元素 B.原子半径:③>①>②
C.最高正化合价:①-②=③ D.第一电离能:②>①>③
5.电催化还原的某种催化剂的结构如图,下列说法错误的是( )
A.Re的配位数为6
B.结构中N的杂化方式均相同
C.Rc提供空轨道
D.CO中C的电负性小,易于提供配位电子对
6.三聚的结构如图所示,下列关于三聚的推测合理的是( )
A.S原子的杂化方式与分子中原子的杂化方式相同
B.S原子与O原子间的键长均相同
C.自发转变为三聚的过程放热
D.在水中的溶解度较小
7.砷化镓是一种重要的半导体材料,熔点1238℃。它在600℃以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是( )
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.基态As原子的价电子排布式为
D.晶胞中Ga与周围等距且最近的As形成的空间正四面体
8.X、Y、Z、W、R是周期表中的短周期主族元素,原子序数依次增大。X在所有元素中原子半径最小,Y、W基态原子核外均有2个未成对电子,R具有11种不同运动状态的电子。下列说法不正确的是( )。
A.原子半径:
B.元素第一电离能:Y<W<Z
C.Y、Z最高价氧化物对应水化物的酸性:Y>Z
D.中含有极性共价键和非极性共价键
9.电子跃迁伴随着能量的释放或吸收。下列与电子跃迁无关的是( )
A.成都大运会燃放的焰火 B.铜丝可以导电
C.装饰建筑夜景的LED灯光 D.从太阳光谱中发现氦
10.短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为
C.r与m可形成离子化合物,其阳离子电子式为
D.一定条件下,m能与Z的单质反应生成p
二、非选择题
11.用“氧化-萃取法”可从卤水中提取碘,其方法为向酸化的卤水中加入溶液,再加入萃取剂(R)进行萃取。该过程涉及以下反应:
(ⅰ)
(ⅱ)
(ⅲ)
(1)根据盖斯定律,反应 。
(2)基态碘原子价层电子的轨道表示式为 。
(3)①反应条件会影响碘的萃取率。其他条件不变时,不同温度下达平衡时碘萃取率]曲线如图所示:
萃取温度从300K升高至320K,碘萃取率缓慢下降。结合平衡移动原理,分析其原因 (忽略萃取剂的挥发、的挥发及分解产生的影响)。当萃取温度超过320K时,的分解导致碘萃取率明显下降。
②下列说法不正确的是 (填标号)。
A.增大溶液的pH,碘萃取率降低 B.增大萃取剂用量,碘萃取率升高
C.萃取体系平衡后加水稀释,变小 D.增大的浓度,反应(ⅰ)的速率增大
(4)未加萃取剂时,固定总碘浓度为,平衡时溶液中的、、分布系数与溶液中初始关系如图所示。[总碘浓度=各组分折合为后的浓度之和,,如]
①设平衡时、、分别为、、,则a、b、c之间的关系式为 =0.01。
②计算反应的平衡常数 (结果保留3位有效数字)。
(5)测定卤水中的方法:取25.00mL卤水于锥形瓶中,加适量氧化剂恰好将全部氧化为加溶液酸化后,再加入适量KI溶液,密闭静置后,用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点;平行测定3次,平均消耗,则卤水中 。(已知:)
12.硫酸锌是制造锌钡白和锌盐的主要原料,口服硫酸锌可纠正锌缺乏,恢复酶系统的功能。用锌白矿(主要成分为ZnO,还含有、、等杂质)制备的流程如图:
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol L时视为沉淀完全):
金属离子 开始沉淀的pH 沉淀完全的pH
1.1 3.1
7.6 9.6
6.4 8.0
(1)基态锌离子的价层电子轨道表示式为 。
(2)“酸浸”前通常需要将锌白矿粉碎,其目的是 。
(3)滤渣1的主要成分为 (填化学式)。
(4)加入“氧化”时发生反应的离子方程式为 。
(5)加入试剂X调节溶液的pH在,使铁元素转化为沉淀而除去,试剂X可以选用下列中的 (填标号)。
A.ZnO B. C.
根据题中数据计算常温下的溶度积 .
(6)pH过大时,锌元素会以形式存在,则中存在的作用力为____(填标号)。
A.离子键 B.共价键 C.σ键 D.π键
13.C、Si、Ge、Sn是同族元素,该族元素的单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)C、Si、Ge、Sn的第一电离能从大到小的顺序是 (用元素符号表示);在基态Ge原子中,电子占据的最高能层的符号为 ,该能层中有 种不同运动状态的电子。
(2)有晶体和非晶体两种,可通过 方法鉴别二者。
(3)C、Si、Ge、Sn均能与卤素化合,已知常温下为无色液体,遇水有白雾出现,发烟,则属于 (填“共价”“分子”或“离子”)晶体;遇水有白雾出现的化学方程式为 .
(4)是一种优秀的透明导电材料,其晶胞结构如图所示。晶胞参数分别为a pm、a pm、c pm,晶胞中立方体的边长为a pm,阿伏加德罗常数的值为。
①白球表示的是 (填元素符号)。
②晶体的密度为 g cm。
14.某农药由原子序数依次增大的V、W、X、Y、Z五种前四周期元素组成。请根据下列相关信息,回答问题。
元素 相关信息
V 核外电子数与周期序数相等
W 成对电子数与未成对电子数之比为3∶1
X 在火山口附近可发现其淡黄色固体单质
Y 有四个电子层,且最外层电子数与最内层电子数相等
Z 基态Z元素原子的价层电子排布式为
(1)Y元素在周期表中的位置为第 周期第 族;基态Z元素原子的最外层电子所占据的原子轨道的电子云轮廓图为 形。
(2)V、W、X三种元素的电负性由大到小的顺序是 (用元素符号表示);W、X的最简单氢化物的熔、沸点由大到小的顺序是 (用化学式表示),原因为 。
(3)Y、Z两种元素的最高价氧化物对应的水化物的酸性或碱性最强的是 (填化学式)。
(4)W、X可组成空间结构为平面三角形的分子,该分子的化学式为 。分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为),则该平面三角形分子中的大π键应表示为 .
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】B
4.【答案】C
5.【答案】B
6.【答案】C
7.【答案】D
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】(1)
(2)
(3)反应(ⅱ)、(ⅲ)均为放热反应,升温导致平衡逆向移动,碘萃取率下降;C
(4);667
(5)
12.【答案】(1)
(2)增大接触面积,使反应快速而充分
(3)
(4)
(5)AB;
(6)B;C
13.【答案】(1);N;4
(2)X射线衍射
(3)分子;
(4)Sn;
14.【答案】(1)四;ⅡA;球
(2);;可形成分子间氢键,而不能
(3)
(4);
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
