二轮专题物质制备型实验设计题的专题突破(共27张PPT)
文档属性
| 名称 | 二轮专题物质制备型实验设计题的专题突破(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教A版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-17 09:28:06 | ||
图片预览






文档简介
(共27张PPT)
实验专题
物质制备型实验设计题的专题突破
水平四:能提出有实际价值的实验探究课题,设计有关物质转化、分离提比、性质应用等综合性实验方案;能适用变量控制的方法探究并选择合适的反应条件,独立成与同学合作。安全、顺利、高效地完成实验,综合运用多种方式描述实验证据,依据证据分析推理形成结论,评估结论的合理性;能从资源利用、安全、绿色环保等多视角对实验方案、实验过程进行评价,提出改造建议和进一步探究的设想,并与同学交流讨论。
【课程标准】
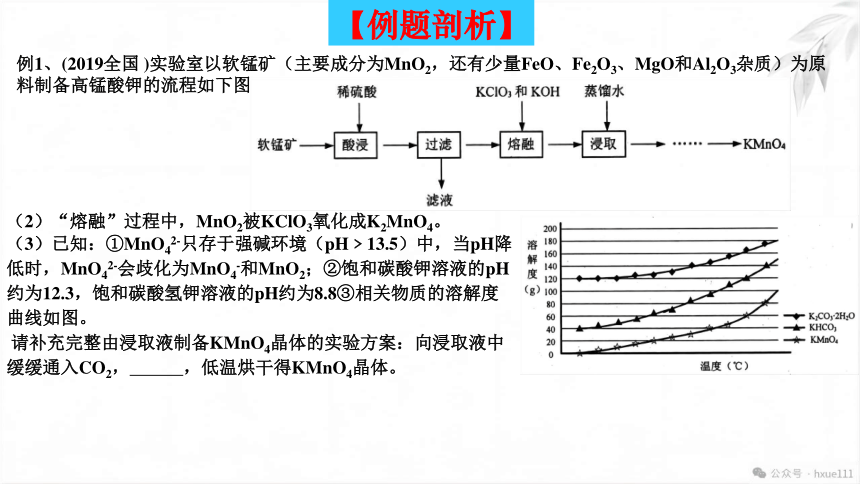
例1、(2019全国 )实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
【例题剖析】
(2)“熔融”过程中,MnO2被KClO3氧化成K2MnO4。
(3)已知:①MnO42-只存于强碱环境(pH﹥13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8③相关物质的溶解度曲线如图。
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2, ,低温烘干得KMnO4晶体。
【审题方法】
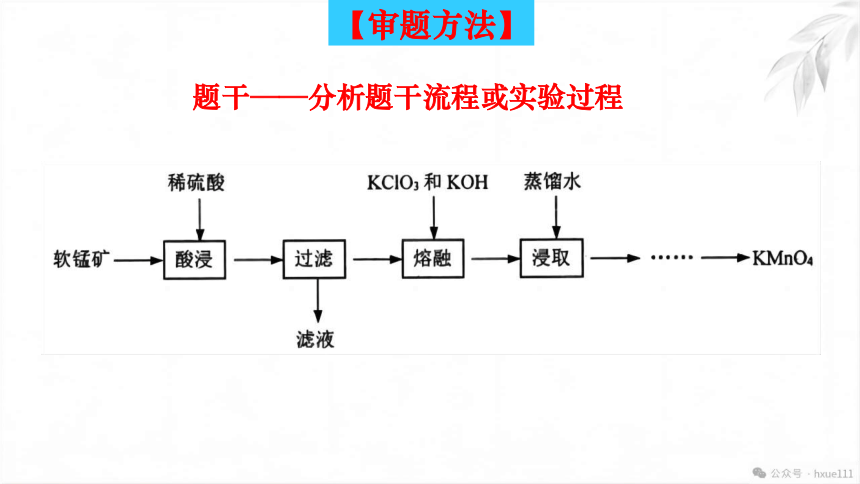
题头——挖掘题头信息
实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
题干——分析题干流程或实验过程
【审题方法】
【审题方法】
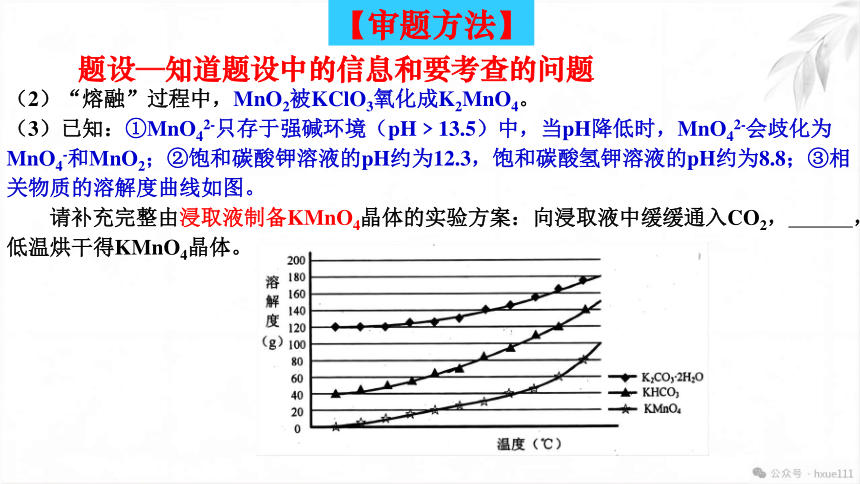
题设—知道题设中的信息和要考查的问题
(2)“熔融”过程中,MnO2被KClO3氧化成K2MnO4。
(3)已知:①MnO42-只存于强碱环境(pH﹥13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如图。
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2, ,低温烘干得KMnO4晶体。
问题(3)是涉及实验最终产品的提纯问题,正确的答题必须利用好题给信息①、②、③。
首先缓缓通入CO2 ,目的是调节溶液pH约为12.3,MnO42-歧化为MnO4-和MnO2,
然后过滤除去MnO2,根据相关物质的溶解度曲线图,利用碳酸钾和KMnO4的溶液度相差比较大的信息,将滤液蒸发浓缩,冷却结晶,分离出KMnO4 ,而碳酸钾仍留在溶液中,过滤,洗涤,低温烘干得KMnO4晶体。
【答题分析】
至pH≈12.3( 或调节pH 约为12.3 ) (1分),
过滤 (1分),
将滤液蒸发浓缩,冷却结晶(1分),
过滤 (1分),
洗涤 (1分)。
【规范答题】
【错误展示】
【基础梳理】
图 实验方案设计题的类型
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
1、产品分离与提纯的设计思路
起始物质:混合物或溶液
产品
控制
条件
物质的转化
选择试剂
分离
提纯
根据条件信息确定
起始物质的组成
纯净物
常见的方法:结晶、过滤、蒸发、萃取、分液、蒸馏、洗涤、干燥等。
根据信息选择合适的试剂
温度、pH等
实验方案设计的原则:
【解题策略】
常见分离与提纯方法—结晶与过滤
如:若溶液中KClO3的含量为100g L-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
蒸发浓缩 冷却结晶 过滤
实验方案设计的原则:
【解题策略】
如:碳酸锰在一定条件下可得硫酸锰溶液,根据如右曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为 。
蒸发浓缩 趁热过滤
常见分离与提纯方法—结晶与过滤
例2、实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=2Mg2+(aq)+CO2(g)+H2O(l) ΔH= -50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH= -225.4 kJ·mol-1
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知:该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0 时Al(OH)3沉淀完全]
【题型展示】
一、产品分离与提纯型实验设计题
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
1、产品分离与提纯的设计思路
起始物质:混合物或溶液
产品
控制
条件
物质的转化
选择试剂
分离
提纯
根据条件信息确定
起始物质的组成
纯净物
常见的方法:过滤、结晶、蒸发、萃取、分液、蒸馏、洗涤、干燥等。
根据信息选择合适的试剂
温度、pH等
【题型展示】
边搅拌边向溶液中滴加氨水,至 8.5>pH≥5.0,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
一、产品分离与提纯型实验设计题
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
2、产品的检验与性质探究的设计思路
已知条件
确定实验步骤和操作方法
要验证
的性质
推测物质具
有的性质
实验中的试剂及反应条件的选择
已有知识或题给信息
结论
氧化还原滴定法
实验方案设计的原则:
【解题策略】
氧化还原反应滴定法:
以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。
如:以高锰酸钾为标准溶液,在酸性溶液中滴定KI溶液 ,请判断滴定终点 。
当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅红色,且半分钟内不褪色。
例3、亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2=2NaNO2。
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【测定NaNO2纯度】
(5)本小题可供选择的试剂有:
A. 稀硫酸 B. c1 mol·L-1 KI溶液 C. 淀粉溶液
D. c2 mol·L-1 Na2S2O3溶液 E. c3 mol·L-1酸性KMnO4溶液
②利用NaNO2的氧化性来测定其纯度的步骤:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解, (请补充完整实验步骤)。
【题型展示】
二、产品的检验与性质探究型实验设计题
【解题策略】
实验方案设计的思路:
2、产品的检验与性质探究的设计思路
已知条件
确定实验步骤和操作方法
要验证
的性质
推测物质具
有的性质
实验中的试剂及反应条件的选择
已有知识或题给信息
结论
氧化还原滴定法
【题型展示】
②加入过量的c1 mol·L-1KI溶液,淀粉溶液,然后滴加稀硫酸酸化,用c2 mol·L-1Na2S2O3溶液滴定至溶液由蓝色恰好变为无色且半分钟内不变色,读数,重复以上操作2~3 次。
二、产品的检验与性质探究型实验设计题
【提炼升华】
1、科学性:实验原理、操作程序及操作方法必须正确。
2、安全性:药品的使用及操作要注意安全。
3、简约性:步骤少、用药量小及时间短。
4、绿色化:注意环境保护。
实验方案设计的原则
实验方案设计的原则:
【提炼升华】
实验方案设计思维的模型化
实验方案设计思维的模型化
减压,不高于60℃(55℃)蒸发结晶,趁热过滤,用38~60℃热水洗涤 低于60℃干燥
【答案】
从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,若溶液变蓝,则I-、IO3-都存在,若不变蓝,再滴加FeCl3 溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3 溶液,若溶液变蓝,说明废水中含有IO3-,若溶液不变蓝,说明废水中不含有IO3-
实验专题
物质制备型实验设计题的专题突破
水平四:能提出有实际价值的实验探究课题,设计有关物质转化、分离提比、性质应用等综合性实验方案;能适用变量控制的方法探究并选择合适的反应条件,独立成与同学合作。安全、顺利、高效地完成实验,综合运用多种方式描述实验证据,依据证据分析推理形成结论,评估结论的合理性;能从资源利用、安全、绿色环保等多视角对实验方案、实验过程进行评价,提出改造建议和进一步探究的设想,并与同学交流讨论。
【课程标准】
例1、(2019全国 )实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
【例题剖析】
(2)“熔融”过程中,MnO2被KClO3氧化成K2MnO4。
(3)已知:①MnO42-只存于强碱环境(pH﹥13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8③相关物质的溶解度曲线如图。
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2, ,低温烘干得KMnO4晶体。
【审题方法】
题头——挖掘题头信息
实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:
题干——分析题干流程或实验过程
【审题方法】
【审题方法】
题设—知道题设中的信息和要考查的问题
(2)“熔融”过程中,MnO2被KClO3氧化成K2MnO4。
(3)已知:①MnO42-只存于强碱环境(pH﹥13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如图。
请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2, ,低温烘干得KMnO4晶体。
问题(3)是涉及实验最终产品的提纯问题,正确的答题必须利用好题给信息①、②、③。
首先缓缓通入CO2 ,目的是调节溶液pH约为12.3,MnO42-歧化为MnO4-和MnO2,
然后过滤除去MnO2,根据相关物质的溶解度曲线图,利用碳酸钾和KMnO4的溶液度相差比较大的信息,将滤液蒸发浓缩,冷却结晶,分离出KMnO4 ,而碳酸钾仍留在溶液中,过滤,洗涤,低温烘干得KMnO4晶体。
【答题分析】
至pH≈12.3( 或调节pH 约为12.3 ) (1分),
过滤 (1分),
将滤液蒸发浓缩,冷却结晶(1分),
过滤 (1分),
洗涤 (1分)。
【规范答题】
【错误展示】
【基础梳理】
图 实验方案设计题的类型
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
1、产品分离与提纯的设计思路
起始物质:混合物或溶液
产品
控制
条件
物质的转化
选择试剂
分离
提纯
根据条件信息确定
起始物质的组成
纯净物
常见的方法:结晶、过滤、蒸发、萃取、分液、蒸馏、洗涤、干燥等。
根据信息选择合适的试剂
温度、pH等
实验方案设计的原则:
【解题策略】
常见分离与提纯方法—结晶与过滤
如:若溶液中KClO3的含量为100g L-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
蒸发浓缩 冷却结晶 过滤
实验方案设计的原则:
【解题策略】
如:碳酸锰在一定条件下可得硫酸锰溶液,根据如右曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为 。
蒸发浓缩 趁热过滤
常见分离与提纯方法—结晶与过滤
例2、实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=2Mg2+(aq)+CO2(g)+H2O(l) ΔH= -50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH= -225.4 kJ·mol-1
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知:该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0 时Al(OH)3沉淀完全]
【题型展示】
一、产品分离与提纯型实验设计题
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
1、产品分离与提纯的设计思路
起始物质:混合物或溶液
产品
控制
条件
物质的转化
选择试剂
分离
提纯
根据条件信息确定
起始物质的组成
纯净物
常见的方法:过滤、结晶、蒸发、萃取、分液、蒸馏、洗涤、干燥等。
根据信息选择合适的试剂
温度、pH等
【题型展示】
边搅拌边向溶液中滴加氨水,至 8.5>pH≥5.0,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
一、产品分离与提纯型实验设计题
实验方案设计的原则:
【解题策略】
实验方案设计的思路:
2、产品的检验与性质探究的设计思路
已知条件
确定实验步骤和操作方法
要验证
的性质
推测物质具
有的性质
实验中的试剂及反应条件的选择
已有知识或题给信息
结论
氧化还原滴定法
实验方案设计的原则:
【解题策略】
氧化还原反应滴定法:
以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。
如:以高锰酸钾为标准溶液,在酸性溶液中滴定KI溶液 ,请判断滴定终点 。
当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅红色,且半分钟内不褪色。
例3、亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2=2NaNO2。
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【测定NaNO2纯度】
(5)本小题可供选择的试剂有:
A. 稀硫酸 B. c1 mol·L-1 KI溶液 C. 淀粉溶液
D. c2 mol·L-1 Na2S2O3溶液 E. c3 mol·L-1酸性KMnO4溶液
②利用NaNO2的氧化性来测定其纯度的步骤:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解, (请补充完整实验步骤)。
【题型展示】
二、产品的检验与性质探究型实验设计题
【解题策略】
实验方案设计的思路:
2、产品的检验与性质探究的设计思路
已知条件
确定实验步骤和操作方法
要验证
的性质
推测物质具
有的性质
实验中的试剂及反应条件的选择
已有知识或题给信息
结论
氧化还原滴定法
【题型展示】
②加入过量的c1 mol·L-1KI溶液,淀粉溶液,然后滴加稀硫酸酸化,用c2 mol·L-1Na2S2O3溶液滴定至溶液由蓝色恰好变为无色且半分钟内不变色,读数,重复以上操作2~3 次。
二、产品的检验与性质探究型实验设计题
【提炼升华】
1、科学性:实验原理、操作程序及操作方法必须正确。
2、安全性:药品的使用及操作要注意安全。
3、简约性:步骤少、用药量小及时间短。
4、绿色化:注意环境保护。
实验方案设计的原则
实验方案设计的原则:
【提炼升华】
实验方案设计思维的模型化
实验方案设计思维的模型化
减压,不高于60℃(55℃)蒸发结晶,趁热过滤,用38~60℃热水洗涤 低于60℃干燥
【答案】
从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,若溶液变蓝,则I-、IO3-都存在,若不变蓝,再滴加FeCl3 溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3 溶液,若溶液变蓝,说明废水中含有IO3-,若溶液不变蓝,说明废水中不含有IO3-
同课章节目录
