化学人教版(2019)选择性必修2 1.1.2原子轨道 基态原子核外电子排布(共51张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.2原子轨道 基态原子核外电子排布(共51张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 00:00:00 | ||
图片预览








文档简介
(共51张PPT)
原子结构
第一章·第一节
第二课时
原子轨道
基态原子核外电子排布
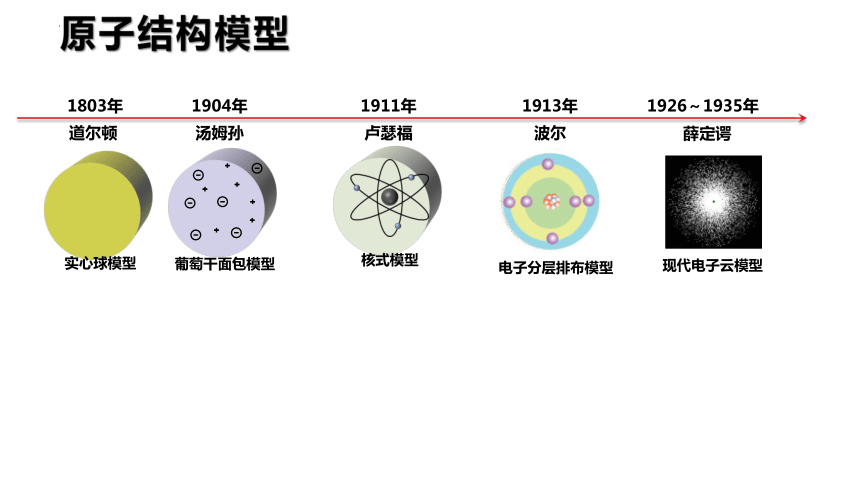
1803年
道尔顿
实心球模型
1904年
汤姆孙
葡萄干面包模型
1911年
卢瑟福
核式模型
1913年
波尔
电子分层排布模型
1926~1935年
薛定谔
现代电子云模型
原子结构模型
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
PART 01
电子云
原子轨道
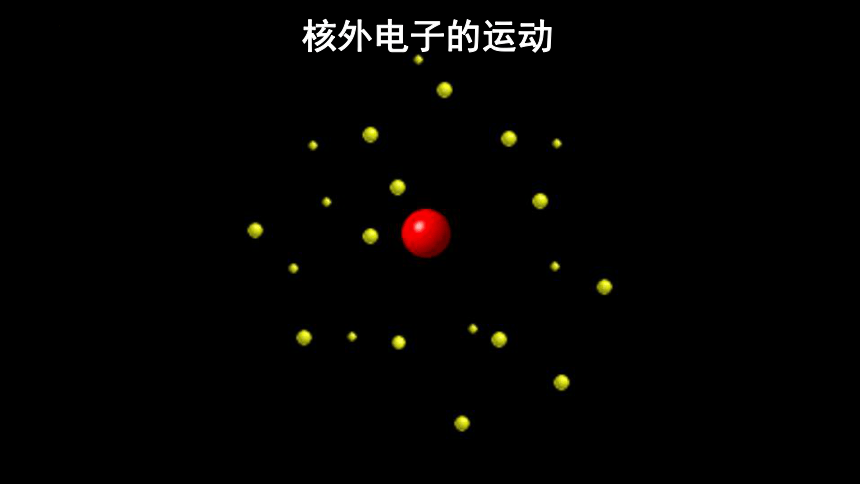
核外电子的运动
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
德国物理学家、量子力学的创立者海森堡
1927年发表著名的海森堡测不准原理
1932年获诺贝尔物理学奖
无法同时精确测量某个电子在某一时刻的位置和速率。
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
薛定谔方程
1926~1935年
现代电子云模型
1926年,玻尔建立的线性轨道模型被量子力学推翻。
资料在线
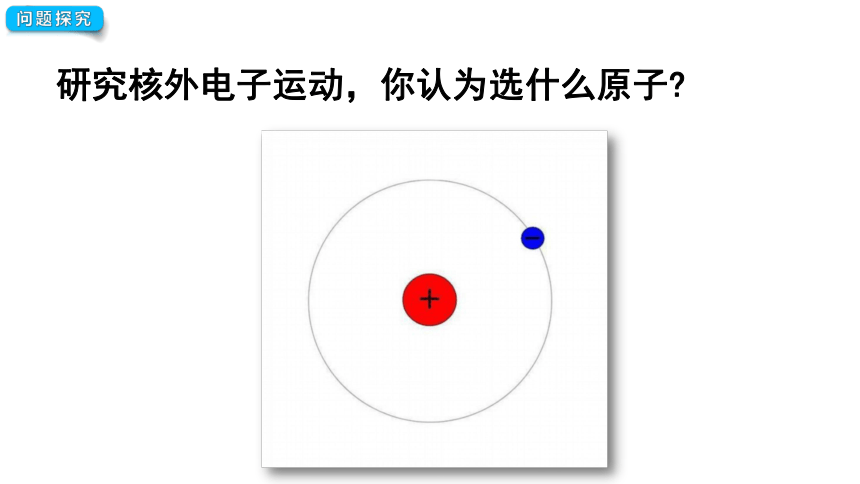
问题探究
研究核外电子运动,你认为选什么原子
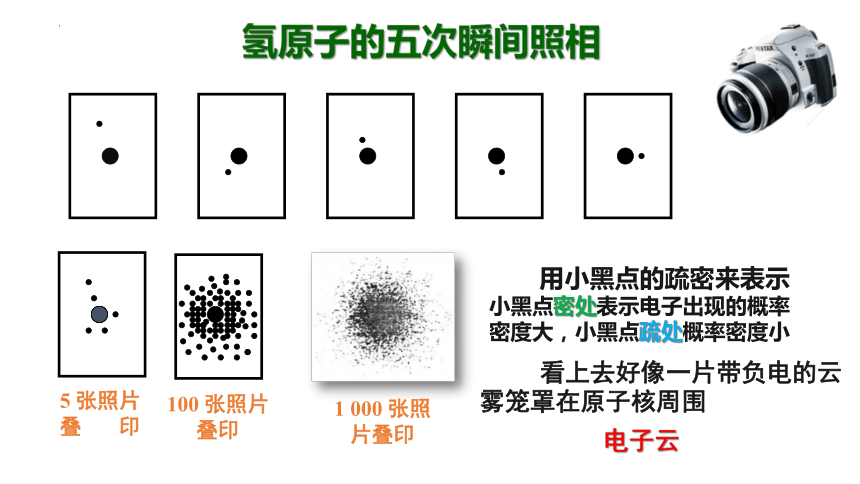
氢原子的五次瞬间照相
5 张照片 叠 印
100 张照片叠印
1 000 张照片叠印
用小黑点的疏密来表示
小黑点密处表示电子出现的概率密度大,小黑点疏处概率密度小
看上去好像一片带负电的云雾笼罩在原子核周围
电子云
概率密度 ρ =
电子在某处出现的概率
该处的体积
一定空间运动状态的电子在核外空间各处都可能出现,但出现的 不同
概率
氢原子1s电子的
概率密度分布图
电子云
小点越密,表明概率密度越大。
由于核外电子的 看起来像一片云雾,因而被形象地称作电子云。
概率密度分布
为了表示电子云轮廓的形状,对核外电子的 有一个形象化的简便描述。把电子在原子核外空间出现概率P= 的空间圈出来,即电子云轮廓图。
电子云轮廓图:
电子云图难绘制
电子云轮廓图
空间运动状态
90%
你能发现什么规律?
同一原子的s电子的电子云轮廓图
形 状
s电子的原子轨道呈 形,能层序数越大,原子轨道的半径越
球形
大
形 状
除s电子云外,其他电子云轮廓图都不是球形的。例如,p电子云轮廓图是呈 状的。
哑铃
哑铃形或纺锤形
形 状
p 电子云
纺锤形
哑铃状
有3种伸展方向
d 电子云
有5种伸展方向
花瓣形
有7种伸展方法
f 电子云
这很难评啊……
原子轨道
(1)定义:量子力学把电子在原子核外的 称为一个原子轨道。(2)各能级所含有原子轨道数目
一个空间运动状态
能级符号 ns np nd nf
轨道数目 1 3 5 7
原子轨道与能层序数的关系
②s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
①不同能层的同种能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
同一原子的s电子的电子云轮廓图
【即学即练1】
1.以下关于原子核外电子的叙述正确的是A.在同一原子轨道上的不同电子的电子云是相同的
B.电子云的小黑点表示电子曾在该处出现过一次C.所有原子的电子云都是球形的
D.原子核外电子的运动无法作规律性描述
√
2.下列有关电子云和原子轨道的说法正确的是A.s、p、d能级所含原子轨道数分别为1,3,5B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p能级的原子轨道呈哑铃形,随着能层的增加,p能级原子轨道数也增多D.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
√
3.下列说法正确的是A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B.s能级的电子云呈球形,处在该轨道上的电子只能在球壳内运动C.p电子云轮廓图呈哑铃形,在空间有两个伸展方向D.2s轨道与1s轨道都是球形,但2s轨道的球形半径更大
√
PART 02
泡利原理
洪特规则
能量最低原理
1924年斯通纳(E. Stoner)采用了元素特征X射线量子数的标记方法,对玻尔的壳层填充电子的方式重新排列。
在斯通纳工作基础上,1925年泡利(W. Pauli)发现了泡利不相容原理,在斯通纳三个量子数基础上引入了表述电子固有属性的第四个量子数,而且预言了第四量子数只有两个值。
泡利的预测
01
02
03
1918年中学毕业后就成为慕尼黑大学的研究生。 1921年以一篇关于氢分子模型的论文获得博士学位。1922年在格丁根大学任M.玻恩的助教,结识了来该校讲学的N.玻尔。
学习
1923~1928年,在汉堡大学任讲师;1928年到瑞士苏黎世的联邦工业大学任理论物理学教授。1935年为躲避法西斯迫害而到美国,1940年受聘为普林斯顿高级研究院的理论物理学访问教授。
工作
由于发现“不相容原理”(后称泡利不相容原理),获得1945年诺贝尔物理学奖,时年25岁。
成就
化学趣史
1900-1958
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
第一则笑话是,因为有泡利效应,大名鼎鼎的实验物理学家施特恩一看到泡利要来,就会关上实验室的大门。即便有问题要讨论,他们也是隔着实验室的门进行。
另一则笑话是,欧洲某著名的实验物理学家正在做实验,突然实验数据毫无理由地出现异常,对此查不出任何原因。后来才发现,原来是那天泡利坐火车从镇上经过。
泡利发现了著名的“不相容原理”。有人说,生活中的泡利也是与他人“不相容的”。坊间甚至还流传着一个所谓的“泡利效应”(这可不是什么正规的物理效应)
化学趣史
那就是:“只要泡利一进实验室,实验室的仪器设备一定非出毛病不可。”
有两则关于“泡利效应”的笑话不妨在这里简单叙述一下。
电子自旋
1925年,两个物理研究生,竟然搞出了电子自旋的概念,认为契合了天才泡利的预测,于是就整出了1页的论文。没想到的是,这个理论竟然违背了爱因斯坦相对论,其速度居然达到了光速10倍,偏偏还是对的!
他们分别叫,乌仑贝克和古德斯密特。
拍摄时间约为 1928 年
1925年,两名荷兰学生乌仑贝克和古德斯密特提出了电子自旋假设。
物理史上最嚣张的论文——1页
乌伦贝克
古德斯米特
电子自旋与泡利原理
(1)自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性,电子自旋在空间有 和 两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。
顺时针
逆时针
(2)泡利原理(泡利不相容原理):
在一个原子轨道里,最多只能容纳 个电子,它们的自旋 。
电子自旋与泡利原理
2
相反
1925 年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(泡利不相容原理)。
H
1s1
交流 研讨
1s
电子排布式
轨道表示式
原子轨道
自旋状态的电子
He
1s2
1s
1s
1s
电子排布的轨道表示式
在轨道表示式中,用方框(也可用圆圈)表示 ,能量相同的原子轨道(简并轨道)的方框相连,箭头表示一种自旋状态的电子,“↑↓”称 ,“↑”或“↓”称 (或称 )。
原子轨道
电子对
单电子
未成对电子
①用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)要相连。
深化理解
2s
1s
2p
简并轨道
不同能级中的□或○要相互分开,同一能级中的□或○要相互连接。
1s
2p
②整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
1s 2s2p 3s3p3d 4s4p
深化理解
1s
2s
2p
3s
3p
3d
4s
4p
③通常在方框下方或者上方标记能级符号,有时画出的能级上下错落,以表达能量高低不同。。
④箭头表示一种自旋状态的电子,一个箭头表示一个电子,“↓↑”称电子对,“↓”或“↑”表示单电子。
1s 2s 2p
B
电子对
单电子
未成对电子
表示方法:以铝原子为例,轨道表示式中各符号、数字的意义为
Li
1s
↑↓
↑
2s
Be
1s
↑↓
↑↓
2s
B
1s
↑
↑↓
↑↓
2s
2p
请写出Li、Be、B的轨道表示式。
1s22s22p63s1
Na
简化电子排布式
原子结构示意图
电子排布式
价电子排布式
轨道排布式
[Ne]3s1
3s1
1s 2s 2p 3s
原子核外电子排布的多种表达方式
请写出基态碳原子可能的轨道表示式。
② C
1s
↑↑
↑↓
↑↓
2s
2p
① C
1s
↑↓
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
【思考与讨论】
这是为啥?
洪特规则
基态原子中,填入简并轨道的电子总是先单独分占,且自旋 。洪特规则不仅适用于基态原子,也适用于基态离子。
平行
2p
C
↑
1s
↑
↑↓
↑↓
2s
自旋平行:_________________________________
箭头同向的单电子称为自旋平行
洪特规则特例*
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑↓
Cr
↑
↑
↑
↑
3d 4s
↑
Cr
↑
↑
↑
↑
↑
只有一组全满的简并轨道
有两组半满的简并轨道
半充满状态
√
洪特规则特例*
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑↓
↑
↑↓
↑↓
↑↓
↑↓
Cu
3d 4s
↑↓
↑↓
↑
↑↓
↑↓
↑↓
Cu
全充满状态
√
请写出以下元素原子的轨道表示式。
1s
↑
↑↓
↑↓
↑
↑
2s
2p
N
1s
↑↓
↑↓
↑↓
↑
↑
2s
2p
O
1s
↑↓
↑↓
↑↓
↑↓
↑
2s
2p
F
能量最低原理
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。能级的能量高低顺序如构造原理所示。
能量越低越稳定,这是自然界的一个普遍规律。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
当相邻能级能量差别不大时,有1~2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如:所有副族元素的基态原子。
总之,基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
【即学即练2】
√
√
√
4.下列说法错误的是A.ns电子的能量不一定高于(n-1)p电子的能量B.基态C原子的电子排布式1s22s22p2C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
√
√
加油干!!!
原子结构
第一章·第一节
第二课时
原子轨道
基态原子核外电子排布
1803年
道尔顿
实心球模型
1904年
汤姆孙
葡萄干面包模型
1911年
卢瑟福
核式模型
1913年
波尔
电子分层排布模型
1926~1935年
薛定谔
现代电子云模型
原子结构模型
宏观物体的运动轨迹
电子的运动轨迹是什么样子?
PART 01
电子云
原子轨道
核外电子的运动
宏观物体 电子
质量 很大
速度 较慢
空间 大
轨迹 可描述 (画图或函数描述)
核外电子运动有何特点
问题探究
很小
很快(接近光速)
极小
不可确定
德国物理学家、量子力学的创立者海森堡
1927年发表著名的海森堡测不准原理
1932年获诺贝尔物理学奖
无法同时精确测量某个电子在某一时刻的位置和速率。
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
薛定谔方程
1926~1935年
现代电子云模型
1926年,玻尔建立的线性轨道模型被量子力学推翻。
资料在线
问题探究
研究核外电子运动,你认为选什么原子
氢原子的五次瞬间照相
5 张照片 叠 印
100 张照片叠印
1 000 张照片叠印
用小黑点的疏密来表示
小黑点密处表示电子出现的概率密度大,小黑点疏处概率密度小
看上去好像一片带负电的云雾笼罩在原子核周围
电子云
概率密度 ρ =
电子在某处出现的概率
该处的体积
一定空间运动状态的电子在核外空间各处都可能出现,但出现的 不同
概率
氢原子1s电子的
概率密度分布图
电子云
小点越密,表明概率密度越大。
由于核外电子的 看起来像一片云雾,因而被形象地称作电子云。
概率密度分布
为了表示电子云轮廓的形状,对核外电子的 有一个形象化的简便描述。把电子在原子核外空间出现概率P= 的空间圈出来,即电子云轮廓图。
电子云轮廓图:
电子云图难绘制
电子云轮廓图
空间运动状态
90%
你能发现什么规律?
同一原子的s电子的电子云轮廓图
形 状
s电子的原子轨道呈 形,能层序数越大,原子轨道的半径越
球形
大
形 状
除s电子云外,其他电子云轮廓图都不是球形的。例如,p电子云轮廓图是呈 状的。
哑铃
哑铃形或纺锤形
形 状
p 电子云
纺锤形
哑铃状
有3种伸展方向
d 电子云
有5种伸展方向
花瓣形
有7种伸展方法
f 电子云
这很难评啊……
原子轨道
(1)定义:量子力学把电子在原子核外的 称为一个原子轨道。(2)各能级所含有原子轨道数目
一个空间运动状态
能级符号 ns np nd nf
轨道数目 1 3 5 7
原子轨道与能层序数的关系
②s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
①不同能层的同种能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
同一原子的s电子的电子云轮廓图
【即学即练1】
1.以下关于原子核外电子的叙述正确的是A.在同一原子轨道上的不同电子的电子云是相同的
B.电子云的小黑点表示电子曾在该处出现过一次C.所有原子的电子云都是球形的
D.原子核外电子的运动无法作规律性描述
√
2.下列有关电子云和原子轨道的说法正确的是A.s、p、d能级所含原子轨道数分别为1,3,5B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p能级的原子轨道呈哑铃形,随着能层的增加,p能级原子轨道数也增多D.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
√
3.下列说法正确的是A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B.s能级的电子云呈球形,处在该轨道上的电子只能在球壳内运动C.p电子云轮廓图呈哑铃形,在空间有两个伸展方向D.2s轨道与1s轨道都是球形,但2s轨道的球形半径更大
√
PART 02
泡利原理
洪特规则
能量最低原理
1924年斯通纳(E. Stoner)采用了元素特征X射线量子数的标记方法,对玻尔的壳层填充电子的方式重新排列。
在斯通纳工作基础上,1925年泡利(W. Pauli)发现了泡利不相容原理,在斯通纳三个量子数基础上引入了表述电子固有属性的第四个量子数,而且预言了第四量子数只有两个值。
泡利的预测
01
02
03
1918年中学毕业后就成为慕尼黑大学的研究生。 1921年以一篇关于氢分子模型的论文获得博士学位。1922年在格丁根大学任M.玻恩的助教,结识了来该校讲学的N.玻尔。
学习
1923~1928年,在汉堡大学任讲师;1928年到瑞士苏黎世的联邦工业大学任理论物理学教授。1935年为躲避法西斯迫害而到美国,1940年受聘为普林斯顿高级研究院的理论物理学访问教授。
工作
由于发现“不相容原理”(后称泡利不相容原理),获得1945年诺贝尔物理学奖,时年25岁。
成就
化学趣史
1900-1958
1927年10月,第五届索尔维会议,泡利是年龄最小的顶级科学家
第一则笑话是,因为有泡利效应,大名鼎鼎的实验物理学家施特恩一看到泡利要来,就会关上实验室的大门。即便有问题要讨论,他们也是隔着实验室的门进行。
另一则笑话是,欧洲某著名的实验物理学家正在做实验,突然实验数据毫无理由地出现异常,对此查不出任何原因。后来才发现,原来是那天泡利坐火车从镇上经过。
泡利发现了著名的“不相容原理”。有人说,生活中的泡利也是与他人“不相容的”。坊间甚至还流传着一个所谓的“泡利效应”(这可不是什么正规的物理效应)
化学趣史
那就是:“只要泡利一进实验室,实验室的仪器设备一定非出毛病不可。”
有两则关于“泡利效应”的笑话不妨在这里简单叙述一下。
电子自旋
1925年,两个物理研究生,竟然搞出了电子自旋的概念,认为契合了天才泡利的预测,于是就整出了1页的论文。没想到的是,这个理论竟然违背了爱因斯坦相对论,其速度居然达到了光速10倍,偏偏还是对的!
他们分别叫,乌仑贝克和古德斯密特。
拍摄时间约为 1928 年
1925年,两名荷兰学生乌仑贝克和古德斯密特提出了电子自旋假设。
物理史上最嚣张的论文——1页
乌伦贝克
古德斯米特
电子自旋与泡利原理
(1)自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性,电子自旋在空间有 和 两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。
顺时针
逆时针
(2)泡利原理(泡利不相容原理):
在一个原子轨道里,最多只能容纳 个电子,它们的自旋 。
电子自旋与泡利原理
2
相反
1925 年,泡利正式提出,在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(泡利不相容原理)。
H
1s1
交流 研讨
1s
电子排布式
轨道表示式
原子轨道
自旋状态的电子
He
1s2
1s
1s
1s
电子排布的轨道表示式
在轨道表示式中,用方框(也可用圆圈)表示 ,能量相同的原子轨道(简并轨道)的方框相连,箭头表示一种自旋状态的电子,“↑↓”称 ,“↑”或“↓”称 (或称 )。
原子轨道
电子对
单电子
未成对电子
①用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)要相连。
深化理解
2s
1s
2p
简并轨道
不同能级中的□或○要相互分开,同一能级中的□或○要相互连接。
1s
2p
②整个电子排布图中各能级的排列顺序要与相应的电子排布式一致。
1s 2s2p 3s3p3d 4s4p
深化理解
1s
2s
2p
3s
3p
3d
4s
4p
③通常在方框下方或者上方标记能级符号,有时画出的能级上下错落,以表达能量高低不同。。
④箭头表示一种自旋状态的电子,一个箭头表示一个电子,“↓↑”称电子对,“↓”或“↑”表示单电子。
1s 2s 2p
B
电子对
单电子
未成对电子
表示方法:以铝原子为例,轨道表示式中各符号、数字的意义为
Li
1s
↑↓
↑
2s
Be
1s
↑↓
↑↓
2s
B
1s
↑
↑↓
↑↓
2s
2p
请写出Li、Be、B的轨道表示式。
1s22s22p63s1
Na
简化电子排布式
原子结构示意图
电子排布式
价电子排布式
轨道排布式
[Ne]3s1
3s1
1s 2s 2p 3s
原子核外电子排布的多种表达方式
请写出基态碳原子可能的轨道表示式。
② C
1s
↑↑
↑↓
↑↓
2s
2p
① C
1s
↑↓
↑↓
↑↓
2s
2p
2p
③ C
↑
1s
↑
↑↓
↑↓
2s
2p
④ C
↓
1s
↑
↑↓
↑↓
2s
√
【思考与讨论】
这是为啥?
洪特规则
基态原子中,填入简并轨道的电子总是先单独分占,且自旋 。洪特规则不仅适用于基态原子,也适用于基态离子。
平行
2p
C
↑
1s
↑
↑↓
↑↓
2s
自旋平行:_________________________________
箭头同向的单电子称为自旋平行
洪特规则特例*
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑↓
Cr
↑
↑
↑
↑
3d 4s
↑
Cr
↑
↑
↑
↑
↑
只有一组全满的简并轨道
有两组半满的简并轨道
半充满状态
√
洪特规则特例*
能量相同的简并轨道在______、_____和_______条件时,体系能量较低,原子较稳定。
全满
半满
全空
3d 4s
↑↓
↑
↑↓
↑↓
↑↓
↑↓
Cu
3d 4s
↑↓
↑↓
↑
↑↓
↑↓
↑↓
Cu
全充满状态
√
请写出以下元素原子的轨道表示式。
1s
↑
↑↓
↑↓
↑
↑
2s
2p
N
1s
↑↓
↑↓
↑↓
↑
↑
2s
2p
O
1s
↑↓
↑↓
↑↓
↑↓
↑
2s
2p
F
能量最低原理
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。能级的能量高低顺序如构造原理所示。
能量越低越稳定,这是自然界的一个普遍规律。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
当相邻能级能量差别不大时,有1~2个电子填入能量稍高的能级可能反而降低电子排斥能,进而使原子整体能量最低。例如:所有副族元素的基态原子。
总之,基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。
【即学即练2】
√
√
√
4.下列说法错误的是A.ns电子的能量不一定高于(n-1)p电子的能量B.基态C原子的电子排布式1s22s22p2C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
√
√
加油干!!!
