第1节 自然资源的开发利用 第1课时 优秀课件(共38张PPT)
文档属性
| 名称 | 第1节 自然资源的开发利用 第1课时 优秀课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:11:42 | ||
图片预览










文档简介
(共38张PPT)
第1课时 金属矿物、海水资源的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
一、导入新课
化学是人类利用自然资源和应对环境问题的重要科学依据。本节我们将以金属矿物、海水资源和化石资源的综合利用为例,认识化学的应用价值,了解与此有关的环境与发展问题。
金属矿物
海水资源
化石资源
1.金属元素在自然界中的存在形态
游离态
金、铂
化合态
2.金属冶炼的一般原理
(1)基本原理:将金属元素从其化合物中 出来。
(2)表示方法:Mn++ne-===M。
还原
二、金属矿物的开发利用
3.金属冶炼的一般方法
(1)依据:金属活泼性不同,将其由化合态还原为游离态的难易程度不同。
(2)写出用下列方法冶炼金属的化学方程式
①热分解法:加热分解HgO:2HgO 2Hg+O2↑
加热分解Ag2O:2Ag2O 4Ag+O2↑
二、金属矿物的开发利用
②热还原法:H2还原CuO:CuO+H2 Cu+H2O
高炉炼铁:Fe2O3+3CO 2Fe+3CO2
铝热反应:2Al+Fe2O3 2Fe+Al2O3
二、金属矿物的开发利用
③电解法:冶炼钠:___________________________
冶炼镁:_____________________________
冶炼铝:_____________________________
④其他方式:湿法炼铜:_________________________
Fe+CuSO4===FeSO4+Cu
二、金属矿物的开发利用
4.合理开发和利用金属矿物资源
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)加强废旧金属的回收和再利用。
(5)使用其他材料代替金属材料。
二、金属矿物的开发利用
(1)所有金属单质必须通过化学反应才能获得( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
×
√
【判断正误】
提示 活泼性非常弱的金属,如金、铂等,在自然界中以单质形式存在,可以通过物理方法获得。
提示 金属冶炼的本质就是利用还原剂,将金属从化合物中还原出来。
√
提示 越活泼的金属,其金属阳离子氧化性越弱,越难被还原,因此利用的时间就越晚。
二、金属矿物的开发利用
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
×
√
提示 Mg是活泼金属,其活泼性大于H2的活泼性,不能用热还原法制备。
提示 铝热反应本质是置换反应,是利用金属铝的还原性把活泼性弱的金属从其化合物中还原出来。
二、金属矿物的开发利用
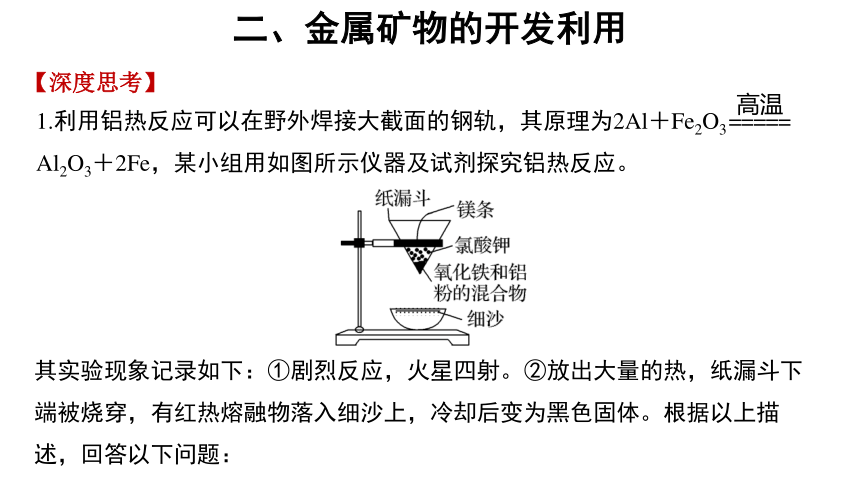
1.利用铝热反应可以在野外焊接大截面的钢轨,其原理为2Al+Fe2O3
Al2O3+2Fe,某小组用如图所示仪器及试剂探究铝热反应。
【深度思考】
其实验现象记录如下:①剧烈反应,火星四射。②放出大量的热,纸漏斗下端被烧穿,有红热熔融物落入细沙上,冷却后变为黑色固体。根据以上描述,回答以下问题:
二、金属矿物的开发利用
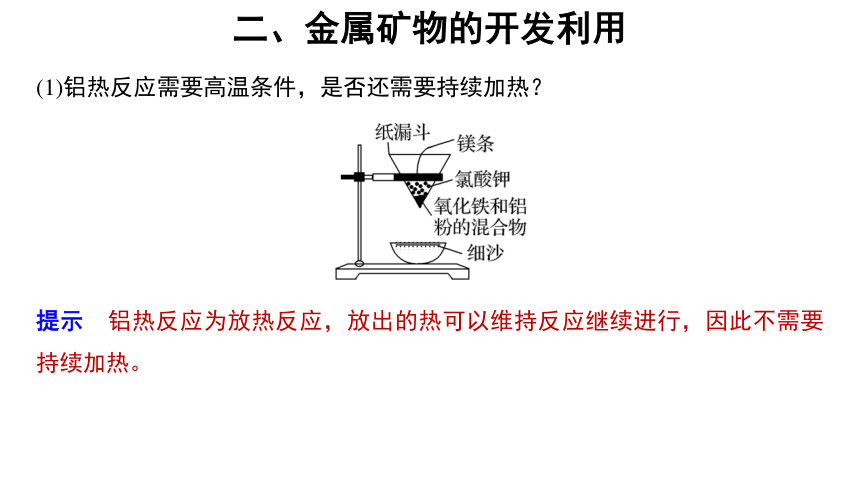
(1)铝热反应需要高温条件,是否还需要持续加热?
提示 铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
二、金属矿物的开发利用
(2)实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
提示 镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
二、金属矿物的开发利用
(3)蒸发皿中铺少量细沙的作用是什么?
提示 一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
二、金属矿物的开发利用
(4)据反应原理,Fe2O3和Al的质量比为多少最好?
提示 为保证Fe2O3和Al都反应完全,两者质量比控制在3∶1为最好。[ ∶m(Al)=160∶(2×27)≈3∶1]
二、金属矿物的开发利用
2.地球上的金属资源是有限的,合理开发利用金属资源尤为重要。下图是从铝土矿和废旧铝质饮料罐获取铝的工艺流程:
a.
二、金属矿物的开发利用
资料卡片:(1)以铝土矿为原料生产1 kg铝的资源及能耗
铝土矿:4 kg 煤:0.5 kg 燃料油:0.25 kg
纯碱:0.5 kg 石灰:0.5 kg 氟化钙:0.04 kg
焙烧碳素:0.6 kg 冰晶石:0.03 kg
电能能耗≥6.7×107 J
(2)以废旧饮料罐生产1 kg铝消耗资源及能耗废旧饮料罐1.01 kg,电能能耗≤3.35×106 J
二、金属矿物的开发利用
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
提示 用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
二、金属矿物的开发利用
1.工业上常用电解法冶炼的金属为
A.镁 B.铁
C.铜 D.银
解析 镁是活泼金属,用热还原法不能获取,只能用电解熔融的氯化镁来制取。
√
三、课堂检测
2.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是
A.金属钠的使用 B.青铜器的大量使用
C.海水提镁 D.铝热法制铬
解析 钠、镁都是活泼金属,工业制备常用电解法,铝热法制铬是在高温下用铝作还原剂,将铬从其化合物中置换出来,故A、C、D三项对应的事件都是近现代发生的,铜性质非常稳定,易从化合物中提取出来,故青铜器的使用应发生在铁器时代之前。
√
三、课堂检测
3.铝能用于冶炼熔点高的金属(如V、Cr、Mn等),用到的铝的性质是
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
√
解析 铝热法冶炼金属利用的是铝的还原性强,在反应中释放大量的热,在高温下,将活泼性相对弱的金属从其化合物中置换出来的性质。
三、课堂检测
解析 K和Mg不能用H2或CO来还原其化合物制得,因活泼金属单质会和H2O或CO2反应,A项错误;
Al应用电解法冶炼,B错误;
Hg和Ag常用热分解法冶炼,D错误。
4.下列各组金属最适合用H2或CO把它从化合物中还原出来的是
A.K、Mg B.Fe、Al
C.Fe、Cu D.Hg、Ag
√
三、课堂检测
金属冶炼方法与金属活动性关系
【归纳总结】
三、课堂检测
1.海水水资源的开发利用
(1)海洋约占地球表面积的 ,海水中水的储量约占地球总水量的 ,约1.3×1018 t。
(2)海水水资源的利用
①
71%
97%
四、海水资源的开发利用
②海水的蒸馏
a.主要仪器:A: ,B: ,C: 。
b.冷凝水的流向: 口进, 口出。
c.B中加入碎瓷片的目的是 。
冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
四、海水资源的开发利用
2.海水化学资源的开发利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
四、海水资源的开发利用
(2)海水中提取物质及综合利用
四、海水资源的开发利用
②用KBr制单质溴:_______________________
③用MgCl2制Mg:__________________________
2KBr+Cl2===2KCl+Br2
①氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
制钠和氯气:___________________________
制盐酸:H2+Cl2 2HCl
制漂白剂(84):2NaOH+Cl2===NaCl+NaClO+H2O
四、海水资源的开发利用
(1)海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
(2)海水淡化的方法中,蒸馏法成本最低( )
(3)海水中含量最多的两种元素为Na元素和Cl元素( )
(4)可以通过电解饱和食盐水的方式获取金属钠和氯气( )
提示 海水中含量最多的两种元素为O和H元素。
×
×
【判断正误】
×
×
提示 电解饱和食盐水可以获取氢氧化钠、氢气和氯气,不能生成金属钠。
四、海水资源的开发利用
(5)从溴化钾中获取单质溴发生了氧化还原反应( )
(6)除了从海水中获取淡水和化学物质外,其他就没有什么价值了( )
提示 除了从海水中获取淡水和化学物质,海水在能量方面也具有十分重要的战略意义,如潮汐能、波浪能等新型能源的开发和利用等。
√
×
四、海水资源的开发利用
溴及其化合物在工农业生产中有着广泛的应用,工业上用一种叫“吹出法”的技术从海水中提取溴,其生产流程如下:
(1)写出①、③、④过程中反应的离子方程式。
【深度思考】
提示 ①Cl2+2Br-===Br2+2Cl-
③SO2+Br2+2H2O=== +2Br-+4H+
④Cl2+2Br-===Br2+2Cl-
四、海水资源的开发利用
(2)过程②和④通入空气、水蒸气利用单质溴的什么性质?过程①获取了游离态的溴,过程③又将其转变为化合态的溴,其目的是什么?
提示 Br2易挥发,利用空气或水蒸气可以将Br2从海水中吹出;将单质溴再转化为溴离子的目的是使Br-浓缩,提高Br2的提取效率。
四、海水资源的开发利用
(3)过程⑤蒸馏过程中温度控制在80~90 ℃,温度过高或过低都不利于生产,原因是什么?
提示 温度过高,水蒸气挥发性增强,使溴的纯度降低,温度太低,溴的挥发性减小,导致溴单质不能充分挥发。
四、海水资源的开发利用
1.在海水资源的综合利用中,不需要化学变化就能够从海水中获得的物质是
A.溴、碘单质 B.钠、镁单质
C.食盐、淡水 D.烧碱、纯碱
√
解析 海水中氯、溴、碘、镁、铝都以化合态形式存在,若制取其单质,必须经过化学变化。从海水中提取食盐和海水的淡化主要是将海水进行蒸发或蒸馏,是物理变化。而由饱和食盐水制取烧碱需电解,为化学变化,故答案选C。
五、课堂检测
2.我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.海水中含有溴元素,只需经过物理变化就可以得到溴单质
D.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
√
五、课堂检测
解析 潮汐发电是将潮汐能转化为电能,故A错误;
因水的沸点较低,可用海水蒸发制海盐,其过程是物理变化过程,故B错误;
海水提溴的工艺主要步骤是在预先浓缩并酸化的海水中,通入足量氯气:2Br-+Cl2===Br2+2Cl-,需要加入氧化剂才能获得单质溴,故C错误;
从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2;之后经过过滤、干燥,镁是活泼金属,MgCl2为离子化合物,电解MgCl2即可得到金属镁,故D正确。
五、课堂检测
六、课堂小结
六、课堂小结
再 见
第1课时 金属矿物、海水资源的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
一、导入新课
化学是人类利用自然资源和应对环境问题的重要科学依据。本节我们将以金属矿物、海水资源和化石资源的综合利用为例,认识化学的应用价值,了解与此有关的环境与发展问题。
金属矿物
海水资源
化石资源
1.金属元素在自然界中的存在形态
游离态
金、铂
化合态
2.金属冶炼的一般原理
(1)基本原理:将金属元素从其化合物中 出来。
(2)表示方法:Mn++ne-===M。
还原
二、金属矿物的开发利用
3.金属冶炼的一般方法
(1)依据:金属活泼性不同,将其由化合态还原为游离态的难易程度不同。
(2)写出用下列方法冶炼金属的化学方程式
①热分解法:加热分解HgO:2HgO 2Hg+O2↑
加热分解Ag2O:2Ag2O 4Ag+O2↑
二、金属矿物的开发利用
②热还原法:H2还原CuO:CuO+H2 Cu+H2O
高炉炼铁:Fe2O3+3CO 2Fe+3CO2
铝热反应:2Al+Fe2O3 2Fe+Al2O3
二、金属矿物的开发利用
③电解法:冶炼钠:___________________________
冶炼镁:_____________________________
冶炼铝:_____________________________
④其他方式:湿法炼铜:_________________________
Fe+CuSO4===FeSO4+Cu
二、金属矿物的开发利用
4.合理开发和利用金属矿物资源
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)加强废旧金属的回收和再利用。
(5)使用其他材料代替金属材料。
二、金属矿物的开发利用
(1)所有金属单质必须通过化学反应才能获得( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
×
√
【判断正误】
提示 活泼性非常弱的金属,如金、铂等,在自然界中以单质形式存在,可以通过物理方法获得。
提示 金属冶炼的本质就是利用还原剂,将金属从化合物中还原出来。
√
提示 越活泼的金属,其金属阳离子氧化性越弱,越难被还原,因此利用的时间就越晚。
二、金属矿物的开发利用
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
×
√
提示 Mg是活泼金属,其活泼性大于H2的活泼性,不能用热还原法制备。
提示 铝热反应本质是置换反应,是利用金属铝的还原性把活泼性弱的金属从其化合物中还原出来。
二、金属矿物的开发利用
1.利用铝热反应可以在野外焊接大截面的钢轨,其原理为2Al+Fe2O3
Al2O3+2Fe,某小组用如图所示仪器及试剂探究铝热反应。
【深度思考】
其实验现象记录如下:①剧烈反应,火星四射。②放出大量的热,纸漏斗下端被烧穿,有红热熔融物落入细沙上,冷却后变为黑色固体。根据以上描述,回答以下问题:
二、金属矿物的开发利用
(1)铝热反应需要高温条件,是否还需要持续加热?
提示 铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
二、金属矿物的开发利用
(2)实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
提示 镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
二、金属矿物的开发利用
(3)蒸发皿中铺少量细沙的作用是什么?
提示 一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
二、金属矿物的开发利用
(4)据反应原理,Fe2O3和Al的质量比为多少最好?
提示 为保证Fe2O3和Al都反应完全,两者质量比控制在3∶1为最好。[ ∶m(Al)=160∶(2×27)≈3∶1]
二、金属矿物的开发利用
2.地球上的金属资源是有限的,合理开发利用金属资源尤为重要。下图是从铝土矿和废旧铝质饮料罐获取铝的工艺流程:
a.
二、金属矿物的开发利用
资料卡片:(1)以铝土矿为原料生产1 kg铝的资源及能耗
铝土矿:4 kg 煤:0.5 kg 燃料油:0.25 kg
纯碱:0.5 kg 石灰:0.5 kg 氟化钙:0.04 kg
焙烧碳素:0.6 kg 冰晶石:0.03 kg
电能能耗≥6.7×107 J
(2)以废旧饮料罐生产1 kg铝消耗资源及能耗废旧饮料罐1.01 kg,电能能耗≤3.35×106 J
二、金属矿物的开发利用
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性。
提示 用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
二、金属矿物的开发利用
1.工业上常用电解法冶炼的金属为
A.镁 B.铁
C.铜 D.银
解析 镁是活泼金属,用热还原法不能获取,只能用电解熔融的氯化镁来制取。
√
三、课堂检测
2.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是
A.金属钠的使用 B.青铜器的大量使用
C.海水提镁 D.铝热法制铬
解析 钠、镁都是活泼金属,工业制备常用电解法,铝热法制铬是在高温下用铝作还原剂,将铬从其化合物中置换出来,故A、C、D三项对应的事件都是近现代发生的,铜性质非常稳定,易从化合物中提取出来,故青铜器的使用应发生在铁器时代之前。
√
三、课堂检测
3.铝能用于冶炼熔点高的金属(如V、Cr、Mn等),用到的铝的性质是
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
√
解析 铝热法冶炼金属利用的是铝的还原性强,在反应中释放大量的热,在高温下,将活泼性相对弱的金属从其化合物中置换出来的性质。
三、课堂检测
解析 K和Mg不能用H2或CO来还原其化合物制得,因活泼金属单质会和H2O或CO2反应,A项错误;
Al应用电解法冶炼,B错误;
Hg和Ag常用热分解法冶炼,D错误。
4.下列各组金属最适合用H2或CO把它从化合物中还原出来的是
A.K、Mg B.Fe、Al
C.Fe、Cu D.Hg、Ag
√
三、课堂检测
金属冶炼方法与金属活动性关系
【归纳总结】
三、课堂检测
1.海水水资源的开发利用
(1)海洋约占地球表面积的 ,海水中水的储量约占地球总水量的 ,约1.3×1018 t。
(2)海水水资源的利用
①
71%
97%
四、海水资源的开发利用
②海水的蒸馏
a.主要仪器:A: ,B: ,C: 。
b.冷凝水的流向: 口进, 口出。
c.B中加入碎瓷片的目的是 。
冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
四、海水资源的开发利用
2.海水化学资源的开发利用
(1)海水中的化学元素
海水中元素
主要元素:______
常量元素: 、 、 、 、S、Ca、Br、C、
Sr、B、F等11种元素
微量元素:铀元素、碘元素等
O、H
Cl Na K Mg
四、海水资源的开发利用
(2)海水中提取物质及综合利用
四、海水资源的开发利用
②用KBr制单质溴:_______________________
③用MgCl2制Mg:__________________________
2KBr+Cl2===2KCl+Br2
①氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
制钠和氯气:___________________________
制盐酸:H2+Cl2 2HCl
制漂白剂(84):2NaOH+Cl2===NaCl+NaClO+H2O
四、海水资源的开发利用
(1)海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
(2)海水淡化的方法中,蒸馏法成本最低( )
(3)海水中含量最多的两种元素为Na元素和Cl元素( )
(4)可以通过电解饱和食盐水的方式获取金属钠和氯气( )
提示 海水中含量最多的两种元素为O和H元素。
×
×
【判断正误】
×
×
提示 电解饱和食盐水可以获取氢氧化钠、氢气和氯气,不能生成金属钠。
四、海水资源的开发利用
(5)从溴化钾中获取单质溴发生了氧化还原反应( )
(6)除了从海水中获取淡水和化学物质外,其他就没有什么价值了( )
提示 除了从海水中获取淡水和化学物质,海水在能量方面也具有十分重要的战略意义,如潮汐能、波浪能等新型能源的开发和利用等。
√
×
四、海水资源的开发利用
溴及其化合物在工农业生产中有着广泛的应用,工业上用一种叫“吹出法”的技术从海水中提取溴,其生产流程如下:
(1)写出①、③、④过程中反应的离子方程式。
【深度思考】
提示 ①Cl2+2Br-===Br2+2Cl-
③SO2+Br2+2H2O=== +2Br-+4H+
④Cl2+2Br-===Br2+2Cl-
四、海水资源的开发利用
(2)过程②和④通入空气、水蒸气利用单质溴的什么性质?过程①获取了游离态的溴,过程③又将其转变为化合态的溴,其目的是什么?
提示 Br2易挥发,利用空气或水蒸气可以将Br2从海水中吹出;将单质溴再转化为溴离子的目的是使Br-浓缩,提高Br2的提取效率。
四、海水资源的开发利用
(3)过程⑤蒸馏过程中温度控制在80~90 ℃,温度过高或过低都不利于生产,原因是什么?
提示 温度过高,水蒸气挥发性增强,使溴的纯度降低,温度太低,溴的挥发性减小,导致溴单质不能充分挥发。
四、海水资源的开发利用
1.在海水资源的综合利用中,不需要化学变化就能够从海水中获得的物质是
A.溴、碘单质 B.钠、镁单质
C.食盐、淡水 D.烧碱、纯碱
√
解析 海水中氯、溴、碘、镁、铝都以化合态形式存在,若制取其单质,必须经过化学变化。从海水中提取食盐和海水的淡化主要是将海水进行蒸发或蒸馏,是物理变化。而由饱和食盐水制取烧碱需电解,为化学变化,故答案选C。
五、课堂检测
2.我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.海水中含有溴元素,只需经过物理变化就可以得到溴单质
D.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
√
五、课堂检测
解析 潮汐发电是将潮汐能转化为电能,故A错误;
因水的沸点较低,可用海水蒸发制海盐,其过程是物理变化过程,故B错误;
海水提溴的工艺主要步骤是在预先浓缩并酸化的海水中,通入足量氯气:2Br-+Cl2===Br2+2Cl-,需要加入氧化剂才能获得单质溴,故C错误;
从海水中提取金属镁,最基本的方法是往海水里加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2;之后经过过滤、干燥,镁是活泼金属,MgCl2为离子化合物,电解MgCl2即可得到金属镁,故D正确。
五、课堂检测
六、课堂小结
六、课堂小结
再 见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
