第2节 氮及其化合物 第3课时 优秀课件(共36张PPT)
文档属性
| 名称 | 第2节 氮及其化合物 第3课时 优秀课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 558.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:14:32 | ||
图片预览










文档简介
(共36张PPT)
第3课时 硝酸 酸雨及防治
第五章 化工生产中的重要非金属元素 第二节 氮及其化合物
一、导入新课
为什么硝酸泄漏会有黄色的气体产生?
1.硝酸的物理性质
纯硝酸为无色、有 气味的液体,沸点低,易 ,在空气中呈“白雾”状,质量分数为95%以上的浓硝酸称为“ 硝酸”。
2.硝酸的强氧化性
(1)浓硝酸中的+5价氮元素具有很强的得电子能力。浓硝酸和稀硝酸都具有很强的氧化性,且浓度越大氧化性越强,还原剂一般被其氧化为最高价态。
刺激性
挥发
发烟
二、硝酸的性质
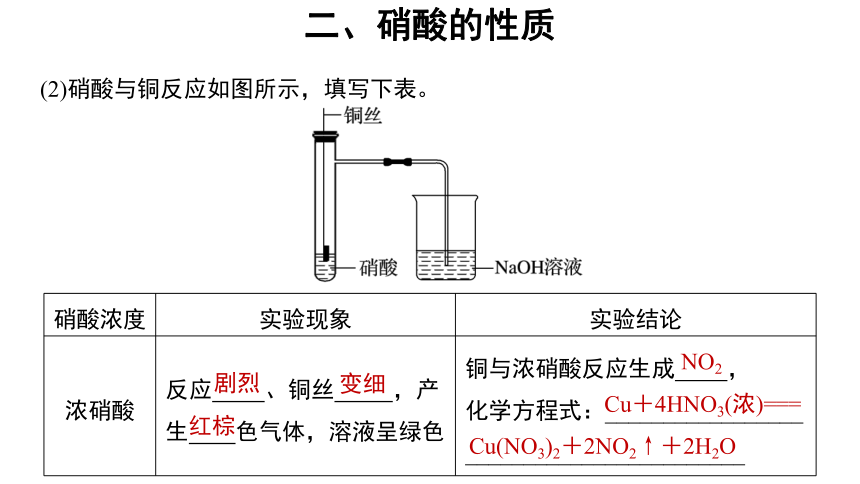
(2)硝酸与铜反应如图所示,填写下表。
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
二、硝酸的性质
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
二、硝酸的性质
根据浓硝酸和稀硝酸的强氧化性书写下列反应的化学方程式:
①铁与稀硝酸(HNO3过量):
。
②碳与浓硝酸共热生成CO2和NO2:
。
③硫与浓硝酸共热生成H2SO4和NO2:
。
Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
二、硝酸的性质
【思维拓展】
(1)硝酸与金属反应不能生成氢气。硝酸浓度不同,其还原产物不同,一般情况下,浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)硝酸能与大多数金属(金、铂等除外)反应,将金属氧化为高价态金属的硝酸盐。但在常温下,浓硝酸能使铁、铝钝化。
(3)热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(4)硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如SO2、FeO、Fe2+、Br-、I-、S2-、SO 等均能被硝酸氧化。
二、硝酸的性质
3.硝酸的不稳定性
(1)见光或受热易分解,其化学方程式为 。
(2)长期存放的浓硝酸呈黄色是因为其分解生成的 溶于硝酸中;实验室常将浓硝酸保存在 试剂瓶中,并放在 处。
4HNO3
4NO2↑+
O2↑+2H2O
NO2
棕色
阴凉
二、硝酸的性质
(1)硝酸具有腐蚀性和挥发性,使用时要注意防护和通风( )
(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(4)浓硝酸、稀硝酸都具有强氧化性,它们都能使铁、铝钝化( )
(5)王水是浓硝酸和浓盐酸体积比为1∶3的混合物,其氧化性比浓硝酸强
( )
【判断正误】
√
×
×
×
√
二、硝酸的性质
回答下列问题:
(1)如何除去浓硝酸中的“黄色”?
提示 在浓硝酸中通入足量的氧气,发生反应4NO2+O2+2H2O===4HNO3,使NO2转化为硝酸,即可除去浓硝酸中的“黄色”。
(2)足量的铜与浓硝酸反应,浓硝酸能否完全被还原?其还原产物可能是什么?
提示 浓硝酸不可能完全被还原,因生成的硝酸铜溶液中仍有NO ;在反应过程中,硝酸的浓度逐渐减小,还原产物可能是NO2和NO的混合物。
(3)将铁粉溶于稀硝酸,铁元素的存在形式可能为①________、②________、③__________________。
【深度思考】
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
二、硝酸的性质
【思维感悟】
认识无机物的主要角度
二、硝酸的性质
【相关链接】
(1)氧化性酸和酸的氧化性
①浓硫酸、硝酸等都是氧化性酸,因为其中的 易获得电子,表现出很强的氧化性;而盐酸、稀硫酸、碳酸等的酸根部分不能或不易获得电子,是非氧化性酸。
②在水溶液中任何酸都能电离出H+,H+在一定条件下可获得电子,被还原为H2,从这一点来说,酸都具有氧化性,但此时H+表现出的性质是酸性,这与氧化性酸中心元素获得电子表现出的氧化性不同。
二、硝酸的性质
(2)“三酸(浓盐酸、浓硫酸、浓硝酸)变稀”问题辨析。
①浓盐酸与足量的二氧化锰反应时,浓盐酸浓度逐渐变小,变为稀盐酸时不再与二氧化锰反应。
②浓硫酸与足量的铜反应时,浓硫酸浓度逐渐变小,变为稀硫酸时不再与铜反应。
③浓硝酸与足量的铜反应时,浓硝酸浓度逐渐变小,变为稀硝酸时,还原产物发生改变,生成NO。
二、硝酸的性质
1.酸雨的概念
正常雨水的pH约为5.6,这是因为雨水中溶解了 的缘故。pH<5.6的降水称为酸雨。
2.酸雨的形成
(1)大气中的 、 及它们反应后的生成物溶于 而形成酸雨。
二氧化碳
二氧化硫
氮氧化物
雨水
三、酸雨及防治
(2)硫酸型酸雨的形成过程
写出图中标号所示的化学方程式:
① ;
② ;
③ ;
④ 。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
三、酸雨及防治
SO2+H2O H2SO3
(3)硝酸型酸雨的形成过程
写出图中标号所示的化学方程式:
① ;
② 。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
三、酸雨及防治
3.酸雨的危害
(1)直接 农作物,破坏森林和草原,使土壤、湖泊 。
(2)加速建筑物、桥梁、工业设备、运输工具和电缆的 。
(3)导致地下水中重金属元素含量增加,污染水源,危害人体健康。
4.酸雨的防治
(1)消除 ,改变能源结构,开发利用清洁能源,如太阳能、风能、氢能等。
(2)对 的排放加以控制,如燃料脱硫处理,废气中二氧化硫回收利用、控制汽车尾气排放等。
(3)健全法律法规,严格规定污染物的排放标准,提高环境保护意识。
损伤
酸化
腐蚀
污染源
酸性物质
三、酸雨及防治
1.现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
【理解应用】
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
(1)分析数据,回答下列问题:
①雨水样品的pH变化的原因是________________________________________
(用化学方程式表示)。
2H2SO3+O2===2H2SO4
解析 酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致:SO2+H2O H2SO3,2H2SO3+O2===2H2SO4。
三、酸雨及防治
SO2+H2O H2SO3
②如果将刚取样的上述雨水和自来水相混合,pH将变___,原因是_________
_________________________________________________(用化学方程式表示)。
小
Cl2+2H2O
+SO2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl
解析 雨水和自来水混合,应考虑SO2与Cl2(或H2SO3与HClO)的反应:SO2+2H2O+Cl2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)。因此雨水与自来水混合后溶液pH将变小。
三、酸雨及防治
(2)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
解析 减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。因此①③⑤正确。
C
三、酸雨及防治
2.回答下列问题
(1)我国城市环境中常见的大气污染物主要有哪些?
提示 SO2、NO2、CO、烟尘等。
(2)根据所学知识,你知道采取什么办法能解决下列问题吗?
①治理已酸化的湖泊和土壤。
提示 对于已酸化的湖泊和土壤,可以加入生石灰进行改良。
②保护暴露在大气中的建筑。
提示 对于暴露在大气中的建筑可以通过粉刷油漆进行保护。
三、酸雨及防治
(3)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式。
提示 SO2+Ca(OH)2===CaSO3+H2O,
2CaSO3+O2+4H2O===2CaSO4·2H2O
三、酸雨及防治
【相关链接】
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
三、酸雨及防治
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
三、酸雨及防治
四、课堂小结
解析 浓硝酸在见光或受热时会发生分解反应生成氧气、二氧化氮和水,A项正确;
硝酸是氧化性酸,金属与硝酸反应不产生氢气,B项正确;
常温下铁和铝在浓硝酸中钝化,因此可用铁和铝制品盛装冷的浓硝酸,C项正确;
铜与硝酸反应生成硝酸铜、氮的氧化物和水,不属于置换反应,D项错误。
1.下列对于硝酸的认识,不正确的是
A.浓硝酸在见光或受热时会发生分解
B.金属与硝酸反应不产生氢气
C.可用铁和铝制品盛装冷的浓硝酸
D.铜与硝酸的反应属于置换反应
√
五、课堂检测
2.0.3 mol铜和含1.2 mol HNO3的浓硝酸,充分反应后,生成NO2的量为
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析 因铜与浓硝酸反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,稀硝酸与铜反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,所以放出的NO2小于0.6 mol。
√
五、课堂检测
3.氮及其化合物的变化关系如下所示。
则下列说法不正确的是
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气可在足量的氧气中通过一步反应生成NO2
√
五、课堂检测
解析 氮气和氧气在放电条件下反应生成NO,NO与O2反应生成NO2,氮气与氧气不能一步转化为NO2,D错误。
五、课堂检测
4.下列有关酸雨的说法正确的是
A.凡是呈酸性的雨水都称为酸雨
B.酸雨的形成只与SO2的排放有关
C.煤的脱硫可以在一定程度上防止酸雨的形成
D.为了不形成酸雨,应停止使用一切化石燃料
√
五、课堂检测
解析 A选项,正常雨水中由于溶解了二氧化碳,也呈酸性,pH<5.6的降水称为酸雨;
B选项,酸雨分为硝酸型酸雨和硫酸型酸雨,硝酸型酸雨的形成与氮氧化物的排放有关;
C选项,利用石灰石等物质,使燃煤中的含硫物质最终转化为硫酸钙,达到脱硫的目的,减少SO2的排放,在一定程度上可防止酸雨的形成;
D选项,化石燃料是现代社会的主要能源,不可能一点都不使用,应推广使用脱硫技术,大力开发清洁环保的新能源,减少酸雨的形成。
五、课堂检测
5.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
√
解析 煤及其他化石燃料中含S元素,它们燃烧产生的SO2的大量排放是形成酸雨的主要原因。对燃煤产生的尾气进行除硫,少用、不用原煤作燃料,开发清洁能源都可以减少SO2的排放,减少酸雨的产生。燃煤时鼓入足量空气只能提高煤的燃烧效率,不能减少SO2的排放。
五、课堂检测
6.某企业利用下列流程综合处理工厂排放的含有SO2的烟气,以减少其对环境造成的污染。下列有关说法正确的是
五、课堂检测
√
五、课堂检测
题述流程中各反应都没有元素化合价的变化,不是氧化还原反应,故C项错误;
题述流程吸收SO2,不能循环利用,故D项错误。
五、课堂检测
再 见
第3课时 硝酸 酸雨及防治
第五章 化工生产中的重要非金属元素 第二节 氮及其化合物
一、导入新课
为什么硝酸泄漏会有黄色的气体产生?
1.硝酸的物理性质
纯硝酸为无色、有 气味的液体,沸点低,易 ,在空气中呈“白雾”状,质量分数为95%以上的浓硝酸称为“ 硝酸”。
2.硝酸的强氧化性
(1)浓硝酸中的+5价氮元素具有很强的得电子能力。浓硝酸和稀硝酸都具有很强的氧化性,且浓度越大氧化性越强,还原剂一般被其氧化为最高价态。
刺激性
挥发
发烟
二、硝酸的性质
(2)硝酸与铜反应如图所示,填写下表。
硝酸浓度 实验现象 实验结论
浓硝酸 反应 、铜丝 ,产生 色气体,溶液呈绿色 铜与浓硝酸反应生成 ,
化学方程式:_________________
________________________
剧烈
变细
红棕
NO2
Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
二、硝酸的性质
稀硝酸 反应 、铜丝 ,产生 气体,溶液呈蓝色 铜与稀硝酸反应生成 ,化学方程式:________________________
________________________
缓慢
变细
无色
NO
3Cu+8HNO3(稀)===
3Cu(NO3)2+2NO↑+4H2O
二、硝酸的性质
根据浓硝酸和稀硝酸的强氧化性书写下列反应的化学方程式:
①铁与稀硝酸(HNO3过量):
。
②碳与浓硝酸共热生成CO2和NO2:
。
③硫与浓硝酸共热生成H2SO4和NO2:
。
Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O
二、硝酸的性质
【思维拓展】
(1)硝酸与金属反应不能生成氢气。硝酸浓度不同,其还原产物不同,一般情况下,浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)硝酸能与大多数金属(金、铂等除外)反应,将金属氧化为高价态金属的硝酸盐。但在常温下,浓硝酸能使铁、铝钝化。
(3)热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(4)硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如SO2、FeO、Fe2+、Br-、I-、S2-、SO 等均能被硝酸氧化。
二、硝酸的性质
3.硝酸的不稳定性
(1)见光或受热易分解,其化学方程式为 。
(2)长期存放的浓硝酸呈黄色是因为其分解生成的 溶于硝酸中;实验室常将浓硝酸保存在 试剂瓶中,并放在 处。
4HNO3
4NO2↑+
O2↑+2H2O
NO2
棕色
阴凉
二、硝酸的性质
(1)硝酸具有腐蚀性和挥发性,使用时要注意防护和通风( )
(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水( )
(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性( )
(4)浓硝酸、稀硝酸都具有强氧化性,它们都能使铁、铝钝化( )
(5)王水是浓硝酸和浓盐酸体积比为1∶3的混合物,其氧化性比浓硝酸强
( )
【判断正误】
√
×
×
×
√
二、硝酸的性质
回答下列问题:
(1)如何除去浓硝酸中的“黄色”?
提示 在浓硝酸中通入足量的氧气,发生反应4NO2+O2+2H2O===4HNO3,使NO2转化为硝酸,即可除去浓硝酸中的“黄色”。
(2)足量的铜与浓硝酸反应,浓硝酸能否完全被还原?其还原产物可能是什么?
提示 浓硝酸不可能完全被还原,因生成的硝酸铜溶液中仍有NO ;在反应过程中,硝酸的浓度逐渐减小,还原产物可能是NO2和NO的混合物。
(3)将铁粉溶于稀硝酸,铁元素的存在形式可能为①________、②________、③__________________。
【深度思考】
Fe(NO3)3
Fe(NO3)2
Fe(NO3)3和Fe(NO3)2
二、硝酸的性质
【思维感悟】
认识无机物的主要角度
二、硝酸的性质
【相关链接】
(1)氧化性酸和酸的氧化性
①浓硫酸、硝酸等都是氧化性酸,因为其中的 易获得电子,表现出很强的氧化性;而盐酸、稀硫酸、碳酸等的酸根部分不能或不易获得电子,是非氧化性酸。
②在水溶液中任何酸都能电离出H+,H+在一定条件下可获得电子,被还原为H2,从这一点来说,酸都具有氧化性,但此时H+表现出的性质是酸性,这与氧化性酸中心元素获得电子表现出的氧化性不同。
二、硝酸的性质
(2)“三酸(浓盐酸、浓硫酸、浓硝酸)变稀”问题辨析。
①浓盐酸与足量的二氧化锰反应时,浓盐酸浓度逐渐变小,变为稀盐酸时不再与二氧化锰反应。
②浓硫酸与足量的铜反应时,浓硫酸浓度逐渐变小,变为稀硫酸时不再与铜反应。
③浓硝酸与足量的铜反应时,浓硝酸浓度逐渐变小,变为稀硝酸时,还原产物发生改变,生成NO。
二、硝酸的性质
1.酸雨的概念
正常雨水的pH约为5.6,这是因为雨水中溶解了 的缘故。pH<5.6的降水称为酸雨。
2.酸雨的形成
(1)大气中的 、 及它们反应后的生成物溶于 而形成酸雨。
二氧化碳
二氧化硫
氮氧化物
雨水
三、酸雨及防治
(2)硫酸型酸雨的形成过程
写出图中标号所示的化学方程式:
① ;
② ;
③ ;
④ 。
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
三、酸雨及防治
SO2+H2O H2SO3
(3)硝酸型酸雨的形成过程
写出图中标号所示的化学方程式:
① ;
② 。
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
三、酸雨及防治
3.酸雨的危害
(1)直接 农作物,破坏森林和草原,使土壤、湖泊 。
(2)加速建筑物、桥梁、工业设备、运输工具和电缆的 。
(3)导致地下水中重金属元素含量增加,污染水源,危害人体健康。
4.酸雨的防治
(1)消除 ,改变能源结构,开发利用清洁能源,如太阳能、风能、氢能等。
(2)对 的排放加以控制,如燃料脱硫处理,废气中二氧化硫回收利用、控制汽车尾气排放等。
(3)健全法律法规,严格规定污染物的排放标准,提高环境保护意识。
损伤
酸化
腐蚀
污染源
酸性物质
三、酸雨及防治
1.现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
【理解应用】
测试时间/h 0 1 2 3 4
雨水的pH 4.73 4.63 4.56 4.55 4.55
(1)分析数据,回答下列问题:
①雨水样品的pH变化的原因是________________________________________
(用化学方程式表示)。
2H2SO3+O2===2H2SO4
解析 酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致:SO2+H2O H2SO3,2H2SO3+O2===2H2SO4。
三、酸雨及防治
SO2+H2O H2SO3
②如果将刚取样的上述雨水和自来水相混合,pH将变___,原因是_________
_________________________________________________(用化学方程式表示)。
小
Cl2+2H2O
+SO2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl
解析 雨水和自来水混合,应考虑SO2与Cl2(或H2SO3与HClO)的反应:SO2+2H2O+Cl2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)。因此雨水与自来水混合后溶液pH将变小。
三、酸雨及防治
(2)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
解析 减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。因此①③⑤正确。
C
三、酸雨及防治
2.回答下列问题
(1)我国城市环境中常见的大气污染物主要有哪些?
提示 SO2、NO2、CO、烟尘等。
(2)根据所学知识,你知道采取什么办法能解决下列问题吗?
①治理已酸化的湖泊和土壤。
提示 对于已酸化的湖泊和土壤,可以加入生石灰进行改良。
②保护暴露在大气中的建筑。
提示 对于暴露在大气中的建筑可以通过粉刷油漆进行保护。
三、酸雨及防治
(3)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式。
提示 SO2+Ca(OH)2===CaSO3+H2O,
2CaSO3+O2+4H2O===2CaSO4·2H2O
三、酸雨及防治
【相关链接】
常见的环境污染
环境污染 形成原因 主要危害
温室效应 大气中CO2含量不断增加 全球变暖,冰川融化
酸雨 SO2和氮氧化物的排放 土壤酸化,腐蚀建筑物
光化学烟雾 氮氧化物和碳氢化合物的排放 危害人体健康和植物生长
臭氧空洞 氮氧化物和氟氯代烃的排放 地球上的生物受太阳紫外线的伤害加剧
三、酸雨及防治
赤潮和水华 含磷洗衣粉的大量使用及废水的任意排放 使藻类过度繁殖,水质恶化,发生在海水中为赤潮,淡水中为水华
白色污染 聚乙烯塑料的大量使用、任意丢弃 破坏土壤结构和生态环境
三、酸雨及防治
四、课堂小结
解析 浓硝酸在见光或受热时会发生分解反应生成氧气、二氧化氮和水,A项正确;
硝酸是氧化性酸,金属与硝酸反应不产生氢气,B项正确;
常温下铁和铝在浓硝酸中钝化,因此可用铁和铝制品盛装冷的浓硝酸,C项正确;
铜与硝酸反应生成硝酸铜、氮的氧化物和水,不属于置换反应,D项错误。
1.下列对于硝酸的认识,不正确的是
A.浓硝酸在见光或受热时会发生分解
B.金属与硝酸反应不产生氢气
C.可用铁和铝制品盛装冷的浓硝酸
D.铜与硝酸的反应属于置换反应
√
五、课堂检测
2.0.3 mol铜和含1.2 mol HNO3的浓硝酸,充分反应后,生成NO2的量为
A.0.2 mol B.0.6 mol
C.小于0.6 mol D.大于0.6 mol
解析 因铜与浓硝酸反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,随着反应的进行,浓硝酸变稀,稀硝酸与铜反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,所以放出的NO2小于0.6 mol。
√
五、课堂检测
3.氮及其化合物的变化关系如下所示。
则下列说法不正确的是
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气可在足量的氧气中通过一步反应生成NO2
√
五、课堂检测
解析 氮气和氧气在放电条件下反应生成NO,NO与O2反应生成NO2,氮气与氧气不能一步转化为NO2,D错误。
五、课堂检测
4.下列有关酸雨的说法正确的是
A.凡是呈酸性的雨水都称为酸雨
B.酸雨的形成只与SO2的排放有关
C.煤的脱硫可以在一定程度上防止酸雨的形成
D.为了不形成酸雨,应停止使用一切化石燃料
√
五、课堂检测
解析 A选项,正常雨水中由于溶解了二氧化碳,也呈酸性,pH<5.6的降水称为酸雨;
B选项,酸雨分为硝酸型酸雨和硫酸型酸雨,硝酸型酸雨的形成与氮氧化物的排放有关;
C选项,利用石灰石等物质,使燃煤中的含硫物质最终转化为硫酸钙,达到脱硫的目的,减少SO2的排放,在一定程度上可防止酸雨的形成;
D选项,化石燃料是现代社会的主要能源,不可能一点都不使用,应推广使用脱硫技术,大力开发清洁环保的新能源,减少酸雨的形成。
五、课堂检测
5.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
√
解析 煤及其他化石燃料中含S元素,它们燃烧产生的SO2的大量排放是形成酸雨的主要原因。对燃煤产生的尾气进行除硫,少用、不用原煤作燃料,开发清洁能源都可以减少SO2的排放,减少酸雨的产生。燃煤时鼓入足量空气只能提高煤的燃烧效率,不能减少SO2的排放。
五、课堂检测
6.某企业利用下列流程综合处理工厂排放的含有SO2的烟气,以减少其对环境造成的污染。下列有关说法正确的是
五、课堂检测
√
五、课堂检测
题述流程中各反应都没有元素化合价的变化,不是氧化还原反应,故C项错误;
题述流程吸收SO2,不能循环利用,故D项错误。
五、课堂检测
再 见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
