第一节 化学反应与能量变化 第5课时 参考课件(共42张PPT)
文档属性
| 名称 | 第一节 化学反应与能量变化 第5课时 参考课件(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 12:22:02 | ||
图片预览







文档简介
(共42张PPT)
第一节 化学反应与能量变化(第5课时)
第六章 化学反应与能量
【复习】
【例1】下列叙述中,可以说明金属甲比乙活泼性强的是( )
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
C
一、导入新课
【例2】下列制氢气的反应速率最快的是( )
C.粗锌和 1mol/L 硫酸
A.纯锌和1mol/L 硫酸
B.纯锌和18 mol/L 硫酸
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
一、导入新课
D
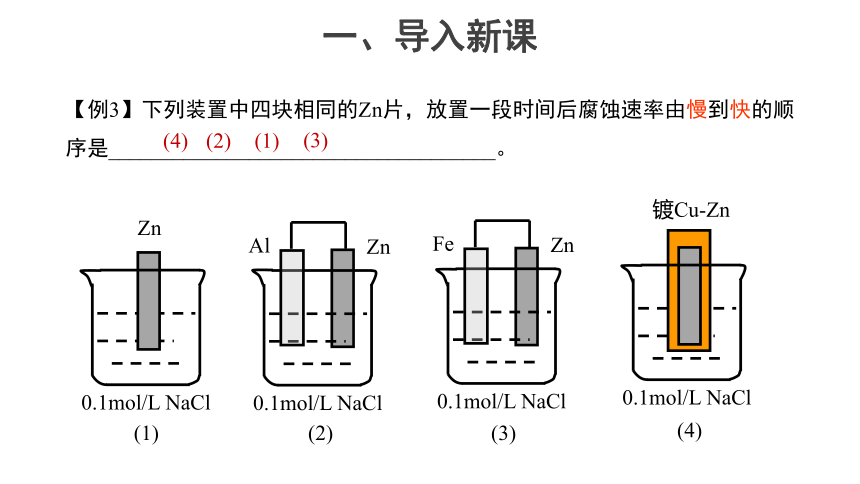
【例3】下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是____________________________________。
(4)
(2)
(1)
(3)
一、导入新课
0.1mol/L NaCl
Al
Zn
0.1mol/L NaCl
Fe
Zn
0.1mol/L NaCl
镀Cu-Zn
0.1mol/L NaCl
Zn
(1)
(2)
(3)
(4)
二、讲授新课
金属腐蚀
我国作为世界上钢铁产量最多的国家(2005年全国生产钢材37117.02万吨),每年被腐蚀的铁占到我国钢铁年产量的十分之一,因为金属腐蚀而造成的损失占到国内生产总值的2%~4%;约合人民币:3000亿元(2005年我国国内生产总值将达15万亿元)。
另据国外统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。
二、讲授新课
腐蚀不仅造成经济损失,也经常对安全构成威胁。国内外都曾发生过许多灾难性腐蚀事故,如飞机因某一零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;油管因穿孔或裂缝而漏油,引起着火爆炸;化工厂中储酸槽穿孔泄漏,造成重大环境污染;管道和设备跑、冒、滴、漏,破坏生产环境,有毒气体如Cl2、H2S、HCN等的泄漏,更会危及工作人员和附近居民的生命安全。
【问题讨论】
一、金属的腐蚀和防护
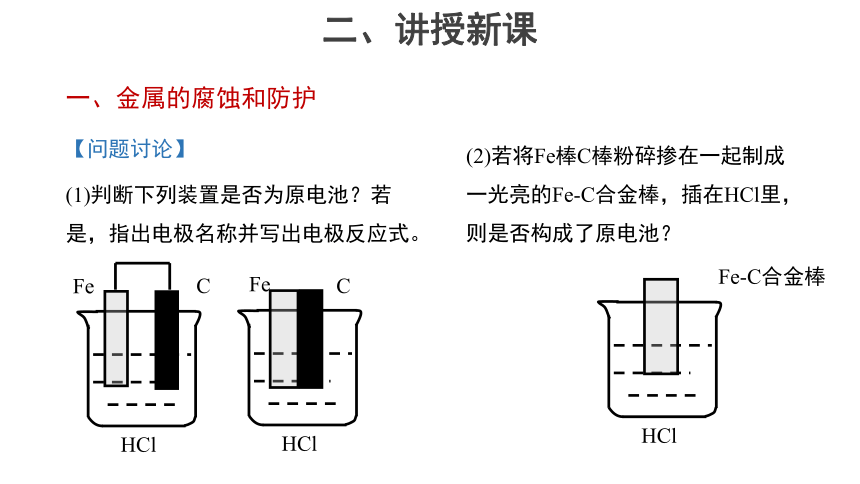
(1)判断下列装置是否为原电池?若是,指出电极名称并写出电极反应式。
二、讲授新课
(2)若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?
HCl
Fe
C
HCl
Fe
C
HCl
Fe-C合金棒
(3)钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或盐浓度较大的环境里长期放置,常易生锈变红,原因是什么?
二、讲授新课
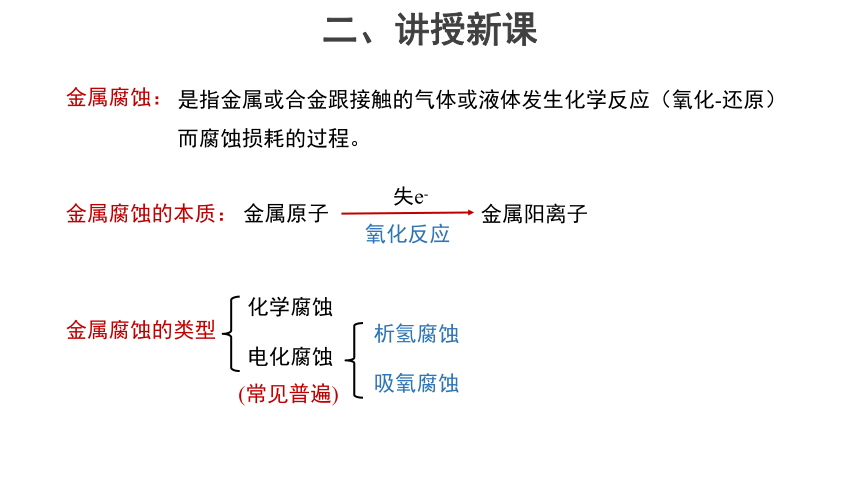
金属阳离子
失e-
氧化反应
金属腐蚀的类型
化学腐蚀
电化腐蚀
析氢腐蚀
吸氧腐蚀
(常见普遍)
金属原子
金属腐蚀的本质:
金属腐蚀:
是指金属或合金跟接触的气体或液体发生化学反应(氧化-还原)而腐蚀损耗的过程。
二、讲授新课
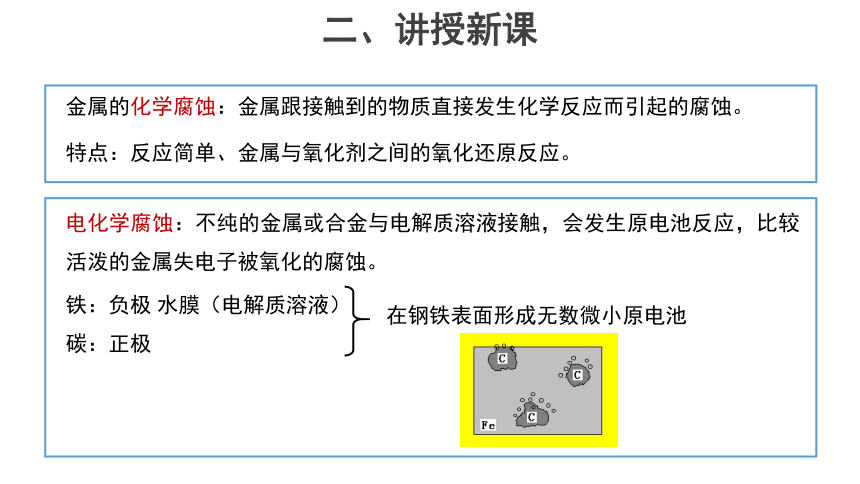
金属的化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的腐蚀。
特点:反应简单、金属与氧化剂之间的氧化还原反应。
二、讲授新课
电化学腐蚀:不纯的金属或合金与电解质溶液接触,会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀。
铁:负极 水膜(电解质溶液)
碳:正极
在钢铁表面形成无数微小原电池
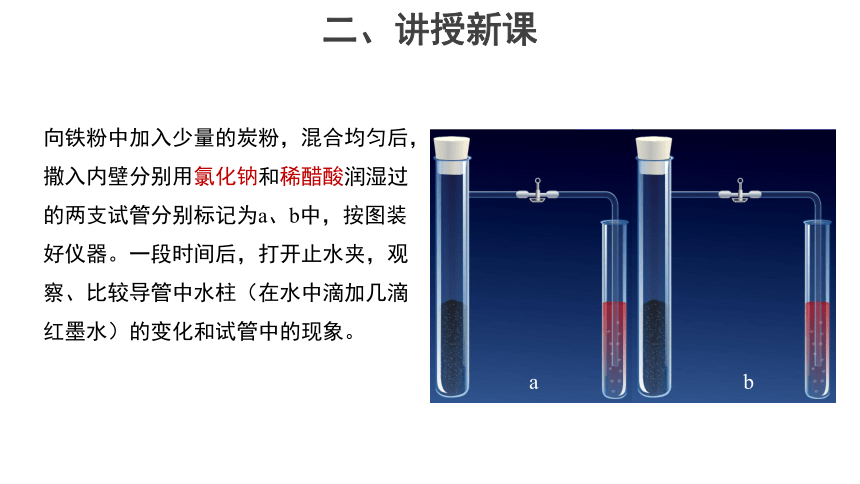
向铁粉中加入少量的炭粉,混合均匀后,撒入内壁分别用氯化钠和稀醋酸润湿过的两支试管分别标记为a、b中,按图装好仪器。一段时间后,打开止水夹,观察、比较导管中水柱(在水中滴加几滴红墨水)的变化和试管中的现象。
二、讲授新课
a
b
实验现象:
装置a中的导管中水柱上升,装置b中的导管中水柱下降。
思考:导管中的水柱变化说明什么问题?
装置a中的导管中水柱上升,说明大试管内气体压强减小, a装置中有气体参加反应。
装置b中的导管中水柱下降,说明大试管内气体生成。
思考:向铁粉中加入炭粉的作用是什么?
在a装置中铁、炭、氯化钠溶液及b装置中铁、炭、醋酸均构成原电池,能加快化学反应速率。
二、讲授新课
负极: 2Fe - 4e- = 2Fe2+
正极: O2 + 2H2O + 4e-= 4OH-
总反应: 2Fe+ O2+2H2O =2Fe(OH)2
中性或酸性很弱或碱性条件下,易发生吸氧腐蚀。
二、讲授新课
4Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O
进一步反应:
红色的铁锈
正极: 2H++ 2e- =H2 ↑
负极: Fe - 2e- = Fe2+
总反应: Fe + 2H+ =Fe2+ + H2 ↑
当钢铁处于酸性介质中时,易发生析氢腐蚀;
析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。
二、讲授新课
二、讲授新课
化学腐蚀 电化腐蚀
条件
现象
本质
联系 化学腐蚀与电化腐蚀的比较
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
两者往往同时发生,电化腐蚀更普遍
析氢腐蚀
吸氧腐蚀
二、讲授新课
析氢腐蚀和吸氧腐蚀比较
Fe2O3 · nH2O
(铁锈)
通常两种腐蚀同时存在,但以后者更普遍。
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性。
水膜呈中性碱性或酸性很弱。
电极反应
负极Fe(- )
Fe-2e=Fe2+
2Fe-4e=2Fe2+
正极C(+)
2H++2e=H2↑
O2+2H2O+4e=4OH-
总反应:
Fe+2H+=Fe2+↑
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
联系
二、讲授新课
二、讲授新课
强电解质>弱电解质>非电解质
金属腐蚀的快慢:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
同一金属在不同物质中腐蚀的快慢:
二、讲授新课
金属腐蚀快慢的判断:
(1)与构成微电池两极的材料有关。两极材料的活动性差别越大,氧化还原反应的速率越 ,活泼金属被腐蚀的速度越 。
(2) 电解原理引起的腐蚀 原电池原理引起的腐蚀 化学腐蚀 有防腐措施的腐蚀。
(3)同一种金属的腐蚀:在强电解质中 弱电解质中 非电解质中
(4)一般说来:原电池原理引起的腐蚀 化学腐蚀 有防腐措施的腐蚀。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
>
>
>
>
>
快
快
>
>
交流与讨论
铁生锈除了必须有空气及水的参与外,还受其他一些因素的影响。请解释下列有关铁生锈现象的原因。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更容易进行。
2. 1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
是由于南极的温度常年在0℃以下,说明在较高温度下,腐蚀更易进行。
二、讲授新课
3.用于连接铜板的铁螺丝容易生锈。
是由于铁与铜及空气中的水蒸汽构成了原电池,铁作原电池的负极,因此铁易被腐蚀而生锈。
4.当化工厂排出的废气为酸性气体时,工厂附近的铁制品容易生锈。
说明铁制品在酸性条件下比在中性条件下更容易被腐蚀。
二、讲授新课
交流与讨论
请大家根据铁生锈的原理,思考应采取什么措施防止铁生锈?
二、讲授新课
交流与讨论
二、钢铁腐蚀的防护:
1.改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。
2.金属表面覆盖保护层
如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化物薄膜)作保护层。
原理:
隔绝金属与外界空气、电解质溶液的接触。
衣架和电线的外面包上一层塑料层
二、讲授新课
3.电化学保护法
原理
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
二、讲授新课
牺牲阳极的阴极保护法
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
二、讲授新课
你还知道哪些防止金属腐蚀的方法?请举例说明。
用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换
制成不锈钢,在金属表面镀一层比要保护的金属耐腐蚀的金属。
用牺牲锌块的方法来保护船身,锌块必须定期更换
锌块
二、讲授新课
外加电流的阴极保护法
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
1.如图,水槽中试管内有一枚铁钉,放置数天观察:
(1) 若液面上升,则溶液呈____________性,发生_______腐蚀,电极反应式为:负极_________________;正极:____________________。
(2) 若液面下降,则溶液呈_______性,发生_______腐蚀,电极反应式为:负极:_______________正极:_______________。
中性或碱性
吸氧
Fe – 2e-=Fe2+
O2+2H2O+4e-=4OH-
酸性
析氢
Fe – 2e-=Fe2+
2H++2e-=H2↑
二、讲授新课
2.分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:________________________________________
(2)碳棒上的电极反应式为:________________________________________
(3)溶液中发生反应的化学方程式:__________________________________
___________________________________________________________________
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
O2+2H2O+4e-=4OH-
2Fe – 4e-= 2Fe2+
二、讲授新课
3.镍--镉可充电电池可发生如下反应:
Cd+2NiO(OH)+2H2O
由此可知,该电池的负极材料是( )
Cd(OH)2+2Ni(OH)2
放电
充电
A. Cd
D
B. NiO(OH)
D. Ni(OH)2
C. Cd(OH)2
二、讲授新课
1.下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀。
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
D
三、课堂练习
2.钢铁锈蚀过程中可能发生的变化是( )
① Fe由单质转化为+2价;
② Fe由+2价转化为+3价;
③ 产生氢气;④产生氧气;
⑤ 杂质C被氧化除去;
⑥ Fe(OH)3失水变成Fe2O3·3H2O。
A. ①②③⑥ B. ①③④
C. 只有①③ D. 全部
A
三、课堂练习
3.为保护地下钢管不被腐蚀,可采用的方法是( )
A.与直流电源负极相连接 B.与直流电源的正极相连接
C.与铜板相连接 D.与锌板相连接
4.下列说法正确的是( )
A.钢铁因含杂质而容易发生电化腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
AD
CD
三、课堂练习
5. 铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为( )
A. 形成原电池铝作负极
B. 形成原电池时铜作负极
C. 形成原电池时,电流由铝经导线流向铜
D. 铝质铆钉发生了化学腐蚀
6. 以下现象与电化腐蚀无关的是 ( )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜锈
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生锈
D. 银质奖牌久置后表面变暗
A
D
三、课堂练习
7.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是( )
A.Sn B.Zn C.Cu D.Ag
8. 如图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
B
C
三、课堂练习
9.下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不用特殊方法保存
D.常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应
10.下列叙述中不正确的是( )
A.金属的电化腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.原电池中电子由正极流入负极
CD
CD
三、课堂练习
11.下列叙述正确的是( )
A.原电池中阳离子向负极移动
B.原电池的负极发生氧化反应
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
D.白铁(镀锌)的表面一旦破损,铁腐蚀加快
12.自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是( )
A.铜水龙头 B.铁水龙头
C.塑料水龙头 D.陶瓷水龙头
BC
A
三、课堂练习
13.在经常受酸雨危害的地区,金属制品易受腐蚀。其中铁制品主要发生____ 腐蚀,负极反应式为_____________________;铜制品发生______腐蚀,正极反应式是_____________________。
析氢
Fe - 2e- = Fe2+
吸氧
O2+4H++4e-= 2H2O
三、课堂练习
14.烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3失水的产物。表示Fe(OH)3生成的电极反应式、离子方程式和化学方程式分别为;
(1)负极 ,
正极 ;
(2) ;
(3) 。
2Fe - 4e- = 2Fe2+
O2+2H2O+4e-=4OH-
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
14.在含有H2S气体的空气中,银器表面易变黑(生成了Ag2S),原因是银发生了______(填“析氢”或“吸氧”)腐蚀,其电极反应式为:
正极 ,
负极 ,
最终在银器表面生成Ag2S的离子方程式: 。
吸氧
O2+2H2O+4e- = 4OH-
Ag-e- = Ag+
2Ag++H2S=Ag2S+2H+
三、课堂练习
15.为了除去银器表面的Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好。过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成。请用电极反应式和离子方程式表示上述过程。
除去银器表面的Ag2S时:
(-) 2Al-6e=2Al3+
(+) 3Ag2S+6e=6Ag+3S2-溶液中发生如下反应:
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(Al3+和S2-的水解反应进行到底。)
三、课堂练习
16.市场上出售的“热敷袋”其中的成分主要是铁粉、碳粉、木屑和少量氯化钠、水等,热敷袋用塑料袋密封,使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有大量铁锈生成,回答下列各问:
(1) 热敷袋放出的热是来自 。
(2) 碳粉和氯化钠的作用分别是:
(3) 写出有关的电极反应式和化学方程式:
Fe被氧化
C 与Fe、NaCl溶液构成原电池,加速Fe的氧化;NaCl溶于水,形成电解质溶液
2Fe - 4e- = 2Fe2+
O2+2H2O+4e-=4OH-
Fe2++2OH- = Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
三、课堂练习
三、课堂练习
(a>c>d>b)
18.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。
17.把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生;则四种金属的活动性顺序由强到弱为:___________。
19.有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠人体内血液种含有一定浓度的溶解氧、H+和Zn2+进行工作。它的两极电极反应式分别为: 。
正极:Zn-2e=Zn2+ 负极:2H2O+O2+4e=4OH-
再 见
第一节 化学反应与能量变化(第5课时)
第六章 化学反应与能量
【复习】
【例1】下列叙述中,可以说明金属甲比乙活泼性强的是( )
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
C
一、导入新课
【例2】下列制氢气的反应速率最快的是( )
C.粗锌和 1mol/L 硫酸
A.纯锌和1mol/L 硫酸
B.纯锌和18 mol/L 硫酸
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
一、导入新课
D
【例3】下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是____________________________________。
(4)
(2)
(1)
(3)
一、导入新课
0.1mol/L NaCl
Al
Zn
0.1mol/L NaCl
Fe
Zn
0.1mol/L NaCl
镀Cu-Zn
0.1mol/L NaCl
Zn
(1)
(2)
(3)
(4)
二、讲授新课
金属腐蚀
我国作为世界上钢铁产量最多的国家(2005年全国生产钢材37117.02万吨),每年被腐蚀的铁占到我国钢铁年产量的十分之一,因为金属腐蚀而造成的损失占到国内生产总值的2%~4%;约合人民币:3000亿元(2005年我国国内生产总值将达15万亿元)。
另据国外统计,金属腐蚀的年损失远远超过水灾、火灾、风灾和地震(平均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。
二、讲授新课
腐蚀不仅造成经济损失,也经常对安全构成威胁。国内外都曾发生过许多灾难性腐蚀事故,如飞机因某一零部件破裂而坠毁;桥梁因钢梁产生裂缝而塌陷;油管因穿孔或裂缝而漏油,引起着火爆炸;化工厂中储酸槽穿孔泄漏,造成重大环境污染;管道和设备跑、冒、滴、漏,破坏生产环境,有毒气体如Cl2、H2S、HCN等的泄漏,更会危及工作人员和附近居民的生命安全。
【问题讨论】
一、金属的腐蚀和防护
(1)判断下列装置是否为原电池?若是,指出电极名称并写出电极反应式。
二、讲授新课
(2)若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?
HCl
Fe
C
HCl
Fe
C
HCl
Fe-C合金棒
(3)钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或盐浓度较大的环境里长期放置,常易生锈变红,原因是什么?
二、讲授新课
金属阳离子
失e-
氧化反应
金属腐蚀的类型
化学腐蚀
电化腐蚀
析氢腐蚀
吸氧腐蚀
(常见普遍)
金属原子
金属腐蚀的本质:
金属腐蚀:
是指金属或合金跟接触的气体或液体发生化学反应(氧化-还原)而腐蚀损耗的过程。
二、讲授新课
金属的化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的腐蚀。
特点:反应简单、金属与氧化剂之间的氧化还原反应。
二、讲授新课
电化学腐蚀:不纯的金属或合金与电解质溶液接触,会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀。
铁:负极 水膜(电解质溶液)
碳:正极
在钢铁表面形成无数微小原电池
向铁粉中加入少量的炭粉,混合均匀后,撒入内壁分别用氯化钠和稀醋酸润湿过的两支试管分别标记为a、b中,按图装好仪器。一段时间后,打开止水夹,观察、比较导管中水柱(在水中滴加几滴红墨水)的变化和试管中的现象。
二、讲授新课
a
b
实验现象:
装置a中的导管中水柱上升,装置b中的导管中水柱下降。
思考:导管中的水柱变化说明什么问题?
装置a中的导管中水柱上升,说明大试管内气体压强减小, a装置中有气体参加反应。
装置b中的导管中水柱下降,说明大试管内气体生成。
思考:向铁粉中加入炭粉的作用是什么?
在a装置中铁、炭、氯化钠溶液及b装置中铁、炭、醋酸均构成原电池,能加快化学反应速率。
二、讲授新课
负极: 2Fe - 4e- = 2Fe2+
正极: O2 + 2H2O + 4e-= 4OH-
总反应: 2Fe+ O2+2H2O =2Fe(OH)2
中性或酸性很弱或碱性条件下,易发生吸氧腐蚀。
二、讲授新课
4Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O
进一步反应:
红色的铁锈
正极: 2H++ 2e- =H2 ↑
负极: Fe - 2e- = Fe2+
总反应: Fe + 2H+ =Fe2+ + H2 ↑
当钢铁处于酸性介质中时,易发生析氢腐蚀;
析氢腐蚀和吸氧腐蚀都属于电化学腐蚀。
二、讲授新课
二、讲授新课
化学腐蚀 电化腐蚀
条件
现象
本质
联系 化学腐蚀与电化腐蚀的比较
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
两者往往同时发生,电化腐蚀更普遍
析氢腐蚀
吸氧腐蚀
二、讲授新课
析氢腐蚀和吸氧腐蚀比较
Fe2O3 · nH2O
(铁锈)
通常两种腐蚀同时存在,但以后者更普遍。
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性。
水膜呈中性碱性或酸性很弱。
电极反应
负极Fe(- )
Fe-2e=Fe2+
2Fe-4e=2Fe2+
正极C(+)
2H++2e=H2↑
O2+2H2O+4e=4OH-
总反应:
Fe+2H+=Fe2+↑
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
联系
二、讲授新课
二、讲授新课
强电解质>弱电解质>非电解质
金属腐蚀的快慢:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
同一金属在不同物质中腐蚀的快慢:
二、讲授新课
金属腐蚀快慢的判断:
(1)与构成微电池两极的材料有关。两极材料的活动性差别越大,氧化还原反应的速率越 ,活泼金属被腐蚀的速度越 。
(2) 电解原理引起的腐蚀 原电池原理引起的腐蚀 化学腐蚀 有防腐措施的腐蚀。
(3)同一种金属的腐蚀:在强电解质中 弱电解质中 非电解质中
(4)一般说来:原电池原理引起的腐蚀 化学腐蚀 有防腐措施的腐蚀。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
>
>
>
>
>
快
快
>
>
交流与讨论
铁生锈除了必须有空气及水的参与外,还受其他一些因素的影响。请解释下列有关铁生锈现象的原因。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更容易进行。
2. 1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
是由于南极的温度常年在0℃以下,说明在较高温度下,腐蚀更易进行。
二、讲授新课
3.用于连接铜板的铁螺丝容易生锈。
是由于铁与铜及空气中的水蒸汽构成了原电池,铁作原电池的负极,因此铁易被腐蚀而生锈。
4.当化工厂排出的废气为酸性气体时,工厂附近的铁制品容易生锈。
说明铁制品在酸性条件下比在中性条件下更容易被腐蚀。
二、讲授新课
交流与讨论
请大家根据铁生锈的原理,思考应采取什么措施防止铁生锈?
二、讲授新课
交流与讨论
二、钢铁腐蚀的防护:
1.改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。
2.金属表面覆盖保护层
如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化物薄膜)作保护层。
原理:
隔绝金属与外界空气、电解质溶液的接触。
衣架和电线的外面包上一层塑料层
二、讲授新课
3.电化学保护法
原理
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
二、讲授新课
牺牲阳极的阴极保护法
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
二、讲授新课
你还知道哪些防止金属腐蚀的方法?请举例说明。
用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换
制成不锈钢,在金属表面镀一层比要保护的金属耐腐蚀的金属。
用牺牲锌块的方法来保护船身,锌块必须定期更换
锌块
二、讲授新课
外加电流的阴极保护法
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
1.如图,水槽中试管内有一枚铁钉,放置数天观察:
(1) 若液面上升,则溶液呈____________性,发生_______腐蚀,电极反应式为:负极_________________;正极:____________________。
(2) 若液面下降,则溶液呈_______性,发生_______腐蚀,电极反应式为:负极:_______________正极:_______________。
中性或碱性
吸氧
Fe – 2e-=Fe2+
O2+2H2O+4e-=4OH-
酸性
析氢
Fe – 2e-=Fe2+
2H++2e-=H2↑
二、讲授新课
2.分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:________________________________________
(2)碳棒上的电极反应式为:________________________________________
(3)溶液中发生反应的化学方程式:__________________________________
___________________________________________________________________
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
O2+2H2O+4e-=4OH-
2Fe – 4e-= 2Fe2+
二、讲授新课
3.镍--镉可充电电池可发生如下反应:
Cd+2NiO(OH)+2H2O
由此可知,该电池的负极材料是( )
Cd(OH)2+2Ni(OH)2
放电
充电
A. Cd
D
B. NiO(OH)
D. Ni(OH)2
C. Cd(OH)2
二、讲授新课
1.下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀。
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
D
三、课堂练习
2.钢铁锈蚀过程中可能发生的变化是( )
① Fe由单质转化为+2价;
② Fe由+2价转化为+3价;
③ 产生氢气;④产生氧气;
⑤ 杂质C被氧化除去;
⑥ Fe(OH)3失水变成Fe2O3·3H2O。
A. ①②③⑥ B. ①③④
C. 只有①③ D. 全部
A
三、课堂练习
3.为保护地下钢管不被腐蚀,可采用的方法是( )
A.与直流电源负极相连接 B.与直流电源的正极相连接
C.与铜板相连接 D.与锌板相连接
4.下列说法正确的是( )
A.钢铁因含杂质而容易发生电化腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.钢铁电化腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
AD
CD
三、课堂练习
5. 铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为( )
A. 形成原电池铝作负极
B. 形成原电池时铜作负极
C. 形成原电池时,电流由铝经导线流向铜
D. 铝质铆钉发生了化学腐蚀
6. 以下现象与电化腐蚀无关的是 ( )
A. 黄铜(铜锌合金)制作的铜锣不易产生铜锈
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生锈
D. 银质奖牌久置后表面变暗
A
D
三、课堂练习
7.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是( )
A.Sn B.Zn C.Cu D.Ag
8. 如图各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
B
C
三、课堂练习
9.下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不用特殊方法保存
D.常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应
10.下列叙述中不正确的是( )
A.金属的电化腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.原电池中电子由正极流入负极
CD
CD
三、课堂练习
11.下列叙述正确的是( )
A.原电池中阳离子向负极移动
B.原电池的负极发生氧化反应
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
D.白铁(镀锌)的表面一旦破损,铁腐蚀加快
12.自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是( )
A.铜水龙头 B.铁水龙头
C.塑料水龙头 D.陶瓷水龙头
BC
A
三、课堂练习
13.在经常受酸雨危害的地区,金属制品易受腐蚀。其中铁制品主要发生____ 腐蚀,负极反应式为_____________________;铜制品发生______腐蚀,正极反应式是_____________________。
析氢
Fe - 2e- = Fe2+
吸氧
O2+4H++4e-= 2H2O
三、课堂练习
14.烧过菜的铁锅未及时洗去含有NaCl的残液,过一段时间便出现红棕色的铁锈斑点,已知该锈斑为Fe(OH)3失水的产物。表示Fe(OH)3生成的电极反应式、离子方程式和化学方程式分别为;
(1)负极 ,
正极 ;
(2) ;
(3) 。
2Fe - 4e- = 2Fe2+
O2+2H2O+4e-=4OH-
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
14.在含有H2S气体的空气中,银器表面易变黑(生成了Ag2S),原因是银发生了______(填“析氢”或“吸氧”)腐蚀,其电极反应式为:
正极 ,
负极 ,
最终在银器表面生成Ag2S的离子方程式: 。
吸氧
O2+2H2O+4e- = 4OH-
Ag-e- = Ag+
2Ag++H2S=Ag2S+2H+
三、课堂练习
15.为了除去银器表面的Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好。过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成。请用电极反应式和离子方程式表示上述过程。
除去银器表面的Ag2S时:
(-) 2Al-6e=2Al3+
(+) 3Ag2S+6e=6Ag+3S2-溶液中发生如下反应:
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(Al3+和S2-的水解反应进行到底。)
三、课堂练习
16.市场上出售的“热敷袋”其中的成分主要是铁粉、碳粉、木屑和少量氯化钠、水等,热敷袋用塑料袋密封,使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有大量铁锈生成,回答下列各问:
(1) 热敷袋放出的热是来自 。
(2) 碳粉和氯化钠的作用分别是:
(3) 写出有关的电极反应式和化学方程式:
Fe被氧化
C 与Fe、NaCl溶液构成原电池,加速Fe的氧化;NaCl溶于水,形成电解质溶液
2Fe - 4e- = 2Fe2+
O2+2H2O+4e-=4OH-
Fe2++2OH- = Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
三、课堂练习
三、课堂练习
(a>c>d>b)
18.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。
17.把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生;则四种金属的活动性顺序由强到弱为:___________。
19.有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起搏器的能源。它依靠人体内血液种含有一定浓度的溶解氧、H+和Zn2+进行工作。它的两极电极反应式分别为: 。
正极:Zn-2e=Zn2+ 负极:2H2O+O2+4e=4OH-
再 见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
