第1节 物质的分类及转化 第1课时 精品课件(共34张PPT)
文档属性
| 名称 | 第1节 物质的分类及转化 第1课时 精品课件(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:02:19 | ||
图片预览








文档简介
(共34张PPT)
第1课时 物质的分类
第一章 物质及其变化 第一节 物质的分类及转化
一、导入新课
图书馆中数不胜数的图书要分类陈列以便于人们查找,超市里数以万计的商品要分类摆放以方便人们挑选。同样,为了认识和研究的方便,对于数以千万计的物质,人们常根据物质的组成、结构、性质或用途等进行分类。
超市里分类摆放的商品
书店里分类陈列的图书
1.物质分类标准
对物质进行分类,首先要确定分类的标准,然后按标准进行分类。例如对下列化合物进行分类:①NaCl ②HCl ③CaCl2 ④CuO ⑤H2O ⑥Fe2O3
(1)依据 为标准,可分为固体: 、液体: 、
气体: 。
(2)依据物质的 为标准,可分为氯化物: 、氧化物: 。
(3)依据物质的 为标准,可分为酸: 、盐: 、氧化物: 。
通常状况下物质的存在状态
①③④⑥
⑤
②
元素组成
①②③
④⑤⑥
组成和性质
②
①③
④⑤⑥
二、物质的分类方法
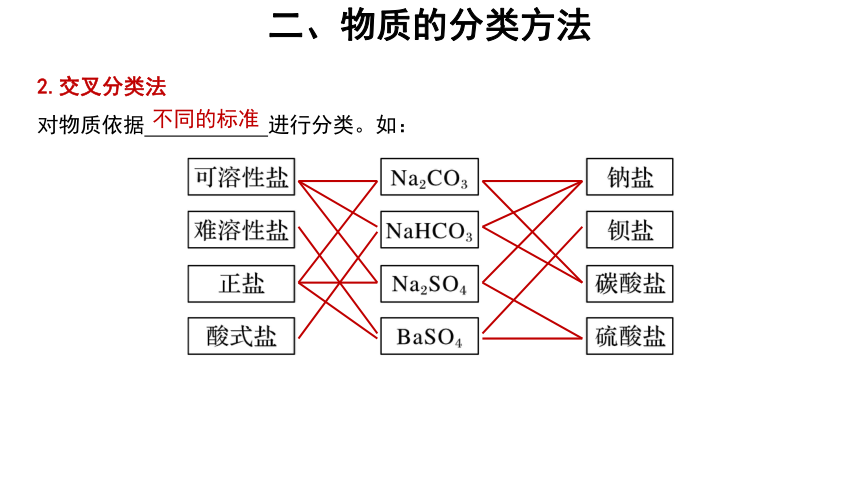
2.交叉分类法
对物质依据 进行分类。如:
不同的标准
二、物质的分类方法
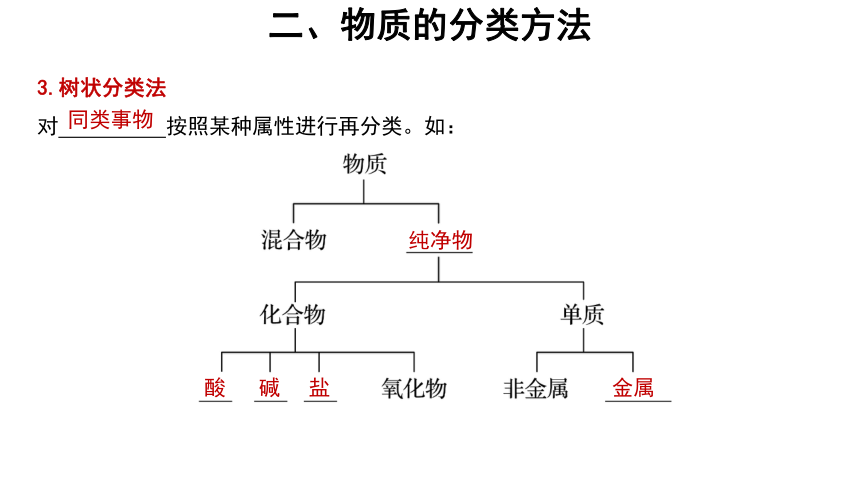
3.树状分类法
对 按照某种属性进行再分类。如:
同类事物
纯净物
酸
碱
盐
金属
二、物质的分类方法
【概念辨析】
(1)单质一定是由同一种元素组成的物质,由同一种元素组成的物质不一定是单质。
(2)化合物一定是由不同种元素组成的纯净物,但纯净物不一定是化合物。
(3)纯净物是由一种成分(分子)组成的物质,有化学式,有固定熔、沸点。
(4)混合物是由多种成分(分子)组成的物质,无化学式,无固定熔、沸点。
二、物质的分类方法
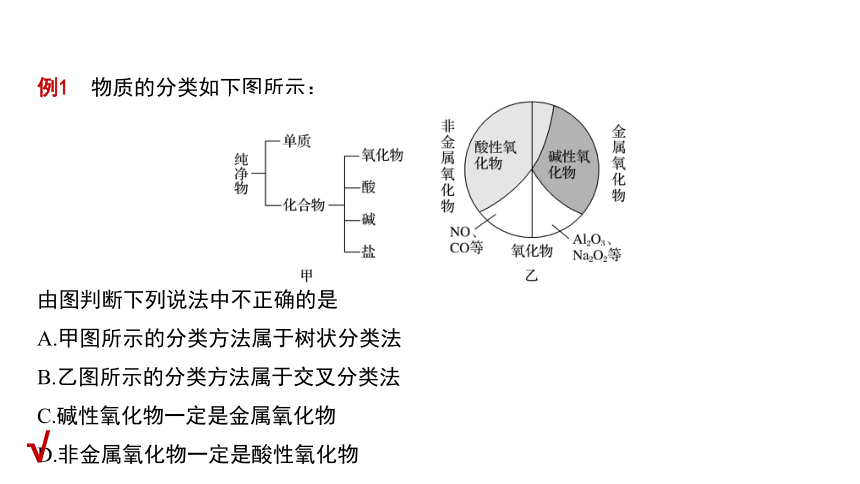
例1 物质的分类如下图所示:
由图判断下列说法中不正确的是
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一定是酸性氧化物
√
【思维启迪】
(1)氧化物的分类:
①依据性质,氧化物可分为酸性氧化物和碱性氧化物;
②依据组成,氧化物可分为金属氧化物和非金属氧化物。
(2)酸性氧化物是与碱反应生成盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物是与酸反应生成盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7。
二、物质的分类方法
1.分散系的概念与组成
(1)概念:把 分散在 中所得到的体系。
(2)组成:分散系中 称作分散质,起 作用的物质称为分散剂。
一种(或多种)物质
另一种(或多种)物质
被分散的物质
容纳分散质
三、分散系及其分类
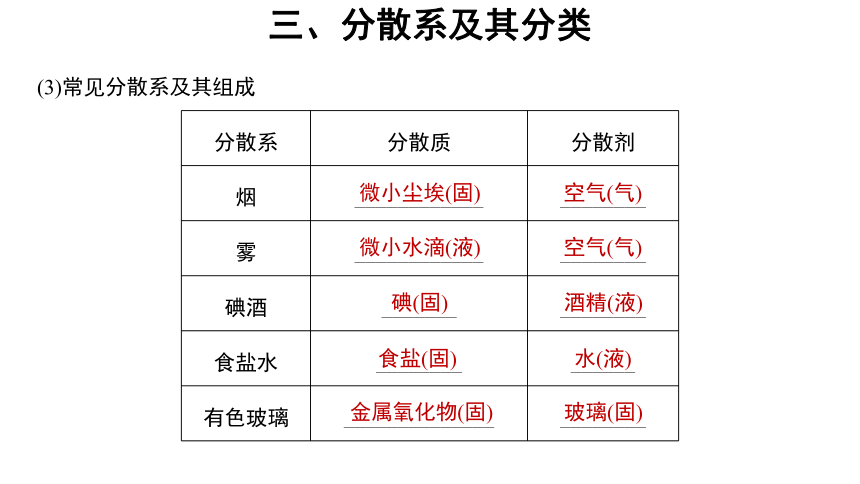
(3)常见分散系及其组成
分散系 分散质 分散剂
烟 ____________ ________
雾 ____________ ________
碘酒 _______ ________
食盐水 ________ ______
有色玻璃 ______________ ________
微小尘埃(固)
微小水滴(液)
空气(气)
空气(气)
碘(固)
酒精(液)
食盐(固)
水(液)
金属氧化物(固)
玻璃(固)
三、分散系及其分类
2.分散系的分类及其依据
(1)按分散质和分散系的状态不同,共有 种分散系。
9
三、分散系及其分类
(2)当分散剂是水或者其他液体时,根据分散质粒子直径的大小,分散系可分为三类:
①分散质粒子直径小于1 nm的分散系是 ;
②分散质粒子直径大于100 nm的分散系是 ;
③分散质粒子直径在1~100 nm之间的分散系是 。
溶液
浊液
胶体
三、分散系及其分类
【归纳总结】
(1)溶液、浊液、胶体三种分散系本质的区别是分散质粒子的大小不同。
(2)分散系都是混合物而不是纯净物。
三、分散系及其分类
例2 下列分散系中,分散质微粒直径最大的是
A.新制氢氧化铜悬浊液
B.淀粉溶液
C.溴的四氯化碳溶液
D.豆浆
解析 A为浊液,B、D为胶体,C为溶液,答案选A。
√
三、分散系及其分类
例3 根据气象台报道,近年来每到春季,沿海一些城市经常出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A.溶液 B.悬浊液
C.乳浊液 D.胶体
解析 雾是由悬浮在大气中的小液滴构成的,小液滴的直径在1~100 nm之间,所以雾属于胶体。
√
三、分散系及其分类
1.氢氧化铁胶体的制备
(1)制备实验:在小烧杯中加入25 mL ,加热至 ,向沸水中慢慢滴入5~6滴 溶液,继续煮沸至溶液呈 色,停止加热。即可得到氢氧化铁胶体。
(2)反应的化学方程式为 。
蒸馏水
沸腾
氯化铁饱和
红褐
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
四、胶体的制备与性质
例4 下列关于氢氧化铁胶体制备的说法正确的是
A.将氯化铁稀溶液慢慢滴入沸腾的自来水中,继续加热煮沸
B.将氯化铁饱和溶液慢慢滴入沸腾的蒸馏水中,并用玻璃棒搅拌
C.将氢氧化钠溶液慢慢滴入饱和的氯化铁溶液中
D.在沸腾的蒸馏水中慢慢滴入氯化铁饱和溶液,继续煮沸至溶液呈红褐色
解析 制备氢氧化铁胶体时,若选用自来水、氢氧化钠溶液,或用玻璃棒搅拌、长时间加热等,都会容易产生氢氧化铁沉淀,而不能得到氢氧化铁胶体。
√
四、胶体的制备与性质
【特别提示】
制备氢氧化铁胶体时的注意事项
(1)要选用蒸馏水、饱和氯化铁溶液;
(2)不能用玻璃棒搅拌、不能长时间加热。
四、胶体的制备与性质
2.胶体的性质
溶液
浊液
一条光亮的“通路”
散射
加热
加电解质
加入带相反电荷的胶体粒子
四、胶体的制备与性质
3.胶体粒子的带电规律
(1)胶体粒子表面积大,具有很强的吸附作用,可吸附阴离子或阳离子而带电。
(2)金属氢氧化物、金属氧化物的胶粒吸附阳离子,胶粒带正电荷。
(3)非金属氧化物、金属硫化物、硅酸、土壤的胶粒吸附阴离子,胶粒带负电荷。
(4)固体胶粒、蛋白质胶粒、淀粉胶粒等不吸附离子,不带有电荷。
四、胶体的制备与性质
4.溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
分散质粒子种类 分子、离子 较多分子集合体或大分子 大量分子集合体(固体小颗粒或小液滴)
分散质粒子直径 d<1 nm 1 nm100 nm
外部特征 均一、透明、稳定 均一、透明、较稳定 不均一、不透明、不稳定
能否透过滤纸 能 能 不能
鉴别方法 无丁达尔效应 有丁达尔效应 静置分层
实例 碘酒、蔗糖溶液、盐酸、酒精溶液 豆浆、云、雾、烟、淀粉溶液、蛋白质溶液 泥浆、油水混合物、氢氧化铁的悬浊液
四、胶体的制备与性质
例5 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是
A.其分子直径比氯离子小
B.在水中形成的分散系属于悬浊液
C.在水中形成的分散系具有丁达尔效应
D.“钴酞菁”分子不能透过滤纸
解析 分散质“钴酞菁”分子的直径(1.3×10-9 m)介于1~100 nm之间(大于氯离子的直径),为胶体粒子,其分散系为胶体,能透过滤纸,具有丁达尔效应。
√
四、胶体的制备与性质
例6 下列事实与胶体性质无关的是
A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.向饱和氯化铁溶液中加入氢氧化钠溶液,会出现红褐色沉淀
C.一束平行光线射入氢氧化铁胶体里,从侧面可以看到一条光亮的通路
D.氢氧化铁胶体中滴入稀硫酸,先看到有红褐色沉淀生成而后溶解
解析 A项是胶体的电泳;
C项是胶体的丁达尔效应;
D项是胶体的聚沉。
√
四、胶体的制备与性质
【归纳总结】
胶体性质的应用
(1)丁达尔效应常用于鉴别溶液和胶体。
(2)胶体的介稳性常用于涂料、颜料、墨水的生产等领域。
(3)电泳现象可用于静电除尘、电泳电镀、分离蛋白质与氨基酸、血清电泳用于诊断疾病等。
(4)胶体聚沉可用于明矾净水、制肥皂、制豆腐和果冻等。
四、胶体的制备与性质
五、课堂小结
1.根据某种共性,可将CO2、SO2归为一类氧化物,下列物质中与它们属于同一类的是
A.CaCO3 B.P2O5 C.CuO D.KMnO4
√
解析 CO2、SO2属于酸性氧化物,CaCO3、KMnO4属于盐,CuO属于碱性氧化物。
六、达标检测
2.判断正误(正确的打“√”,错误的打“×”)
(1)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(2)直径介于1~100 nm之间的粒子称为胶体( )
(3)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( )
(4)丁达尔效应可用来鉴定溶液与胶体( )
(5)可用过滤的方法除去氢氧化铁胶体中的氯化钠( )
(6)胶体久置会聚沉产生沉淀,属于化学变化( )
(7)胶体都带电,通电时可以作定向移动( )
×
×
×
√
×
×
×
六、达标检测
(8)用石膏或盐卤点制豆腐与胶体的性质无关( )
(9)水泥厂、冶金厂等常用高压电除去烟尘,是因为烟尘微粒带电荷( )
(10)清晨的阳光穿过茂密的树木枝叶时会观察到丁达尔效应( )
×
√
√
六、达标检测
3.下列分散系中,分散质微粒直径介于10-9~10-7 m之间的是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
√
解析 溶液中分散质微粒直径小于10-9 m,
胶体分散质微粒直径介于10-9~10-7 m之间,
悬浊液分散质微粒直径大于10-7 m,
乳浊液分散质微粒直径大于10-7 m。
六、达标检测
4.下列分散系不属于胶体的是
A.淀粉溶液 B.有色玻璃
C.烟 D.碘酒
√
解析 碘酒属于溶液,淀粉溶液属于胶体。
六、达标检测
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质粒子直径在1~100 nm之间
B.都是混合物
C.都是无色、透明的溶液
D.都呈红褐色
√
解析 氯化铁溶液与氢氧化铁胶体两种分散系,都属于混合物;
氯化铁溶液为棕黄色,其分散质粒子直径小于1 nm;
氢氧化铁胶体为红褐色,其分散质粒子直径在1~100 nm之间。
六、达标检测
请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类中的树状分类法的有关知识,在①HIO3、②NaIO3、③KOH、④I2O5、⑤NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是______(填序号)。
6.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
化合物
②⑤
六、达标检测
解析 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。
六、达标检测
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾_____溶于水(填“能”或“不能”),化学性质:碘酸钾在受热时________。
解析 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
能
易分解
六、达标检测
第1课时 物质的分类
第一章 物质及其变化 第一节 物质的分类及转化
一、导入新课
图书馆中数不胜数的图书要分类陈列以便于人们查找,超市里数以万计的商品要分类摆放以方便人们挑选。同样,为了认识和研究的方便,对于数以千万计的物质,人们常根据物质的组成、结构、性质或用途等进行分类。
超市里分类摆放的商品
书店里分类陈列的图书
1.物质分类标准
对物质进行分类,首先要确定分类的标准,然后按标准进行分类。例如对下列化合物进行分类:①NaCl ②HCl ③CaCl2 ④CuO ⑤H2O ⑥Fe2O3
(1)依据 为标准,可分为固体: 、液体: 、
气体: 。
(2)依据物质的 为标准,可分为氯化物: 、氧化物: 。
(3)依据物质的 为标准,可分为酸: 、盐: 、氧化物: 。
通常状况下物质的存在状态
①③④⑥
⑤
②
元素组成
①②③
④⑤⑥
组成和性质
②
①③
④⑤⑥
二、物质的分类方法
2.交叉分类法
对物质依据 进行分类。如:
不同的标准
二、物质的分类方法
3.树状分类法
对 按照某种属性进行再分类。如:
同类事物
纯净物
酸
碱
盐
金属
二、物质的分类方法
【概念辨析】
(1)单质一定是由同一种元素组成的物质,由同一种元素组成的物质不一定是单质。
(2)化合物一定是由不同种元素组成的纯净物,但纯净物不一定是化合物。
(3)纯净物是由一种成分(分子)组成的物质,有化学式,有固定熔、沸点。
(4)混合物是由多种成分(分子)组成的物质,无化学式,无固定熔、沸点。
二、物质的分类方法
例1 物质的分类如下图所示:
由图判断下列说法中不正确的是
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一定是酸性氧化物
√
【思维启迪】
(1)氧化物的分类:
①依据性质,氧化物可分为酸性氧化物和碱性氧化物;
②依据组成,氧化物可分为金属氧化物和非金属氧化物。
(2)酸性氧化物是与碱反应生成盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物是与酸反应生成盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7。
二、物质的分类方法
1.分散系的概念与组成
(1)概念:把 分散在 中所得到的体系。
(2)组成:分散系中 称作分散质,起 作用的物质称为分散剂。
一种(或多种)物质
另一种(或多种)物质
被分散的物质
容纳分散质
三、分散系及其分类
(3)常见分散系及其组成
分散系 分散质 分散剂
烟 ____________ ________
雾 ____________ ________
碘酒 _______ ________
食盐水 ________ ______
有色玻璃 ______________ ________
微小尘埃(固)
微小水滴(液)
空气(气)
空气(气)
碘(固)
酒精(液)
食盐(固)
水(液)
金属氧化物(固)
玻璃(固)
三、分散系及其分类
2.分散系的分类及其依据
(1)按分散质和分散系的状态不同,共有 种分散系。
9
三、分散系及其分类
(2)当分散剂是水或者其他液体时,根据分散质粒子直径的大小,分散系可分为三类:
①分散质粒子直径小于1 nm的分散系是 ;
②分散质粒子直径大于100 nm的分散系是 ;
③分散质粒子直径在1~100 nm之间的分散系是 。
溶液
浊液
胶体
三、分散系及其分类
【归纳总结】
(1)溶液、浊液、胶体三种分散系本质的区别是分散质粒子的大小不同。
(2)分散系都是混合物而不是纯净物。
三、分散系及其分类
例2 下列分散系中,分散质微粒直径最大的是
A.新制氢氧化铜悬浊液
B.淀粉溶液
C.溴的四氯化碳溶液
D.豆浆
解析 A为浊液,B、D为胶体,C为溶液,答案选A。
√
三、分散系及其分类
例3 根据气象台报道,近年来每到春季,沿海一些城市经常出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A.溶液 B.悬浊液
C.乳浊液 D.胶体
解析 雾是由悬浮在大气中的小液滴构成的,小液滴的直径在1~100 nm之间,所以雾属于胶体。
√
三、分散系及其分类
1.氢氧化铁胶体的制备
(1)制备实验:在小烧杯中加入25 mL ,加热至 ,向沸水中慢慢滴入5~6滴 溶液,继续煮沸至溶液呈 色,停止加热。即可得到氢氧化铁胶体。
(2)反应的化学方程式为 。
蒸馏水
沸腾
氯化铁饱和
红褐
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
四、胶体的制备与性质
例4 下列关于氢氧化铁胶体制备的说法正确的是
A.将氯化铁稀溶液慢慢滴入沸腾的自来水中,继续加热煮沸
B.将氯化铁饱和溶液慢慢滴入沸腾的蒸馏水中,并用玻璃棒搅拌
C.将氢氧化钠溶液慢慢滴入饱和的氯化铁溶液中
D.在沸腾的蒸馏水中慢慢滴入氯化铁饱和溶液,继续煮沸至溶液呈红褐色
解析 制备氢氧化铁胶体时,若选用自来水、氢氧化钠溶液,或用玻璃棒搅拌、长时间加热等,都会容易产生氢氧化铁沉淀,而不能得到氢氧化铁胶体。
√
四、胶体的制备与性质
【特别提示】
制备氢氧化铁胶体时的注意事项
(1)要选用蒸馏水、饱和氯化铁溶液;
(2)不能用玻璃棒搅拌、不能长时间加热。
四、胶体的制备与性质
2.胶体的性质
溶液
浊液
一条光亮的“通路”
散射
加热
加电解质
加入带相反电荷的胶体粒子
四、胶体的制备与性质
3.胶体粒子的带电规律
(1)胶体粒子表面积大,具有很强的吸附作用,可吸附阴离子或阳离子而带电。
(2)金属氢氧化物、金属氧化物的胶粒吸附阳离子,胶粒带正电荷。
(3)非金属氧化物、金属硫化物、硅酸、土壤的胶粒吸附阴离子,胶粒带负电荷。
(4)固体胶粒、蛋白质胶粒、淀粉胶粒等不吸附离子,不带有电荷。
四、胶体的制备与性质
4.溶液、胶体、浊液三类分散系的比较
分散系 溶液 胶体 浊液
分散质粒子种类 分子、离子 较多分子集合体或大分子 大量分子集合体(固体小颗粒或小液滴)
分散质粒子直径 d<1 nm 1 nm
外部特征 均一、透明、稳定 均一、透明、较稳定 不均一、不透明、不稳定
能否透过滤纸 能 能 不能
鉴别方法 无丁达尔效应 有丁达尔效应 静置分层
实例 碘酒、蔗糖溶液、盐酸、酒精溶液 豆浆、云、雾、烟、淀粉溶液、蛋白质溶液 泥浆、油水混合物、氢氧化铁的悬浊液
四、胶体的制备与性质
例5 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是
A.其分子直径比氯离子小
B.在水中形成的分散系属于悬浊液
C.在水中形成的分散系具有丁达尔效应
D.“钴酞菁”分子不能透过滤纸
解析 分散质“钴酞菁”分子的直径(1.3×10-9 m)介于1~100 nm之间(大于氯离子的直径),为胶体粒子,其分散系为胶体,能透过滤纸,具有丁达尔效应。
√
四、胶体的制备与性质
例6 下列事实与胶体性质无关的是
A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.向饱和氯化铁溶液中加入氢氧化钠溶液,会出现红褐色沉淀
C.一束平行光线射入氢氧化铁胶体里,从侧面可以看到一条光亮的通路
D.氢氧化铁胶体中滴入稀硫酸,先看到有红褐色沉淀生成而后溶解
解析 A项是胶体的电泳;
C项是胶体的丁达尔效应;
D项是胶体的聚沉。
√
四、胶体的制备与性质
【归纳总结】
胶体性质的应用
(1)丁达尔效应常用于鉴别溶液和胶体。
(2)胶体的介稳性常用于涂料、颜料、墨水的生产等领域。
(3)电泳现象可用于静电除尘、电泳电镀、分离蛋白质与氨基酸、血清电泳用于诊断疾病等。
(4)胶体聚沉可用于明矾净水、制肥皂、制豆腐和果冻等。
四、胶体的制备与性质
五、课堂小结
1.根据某种共性,可将CO2、SO2归为一类氧化物,下列物质中与它们属于同一类的是
A.CaCO3 B.P2O5 C.CuO D.KMnO4
√
解析 CO2、SO2属于酸性氧化物,CaCO3、KMnO4属于盐,CuO属于碱性氧化物。
六、达标检测
2.判断正误(正确的打“√”,错误的打“×”)
(1)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(2)直径介于1~100 nm之间的粒子称为胶体( )
(3)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( )
(4)丁达尔效应可用来鉴定溶液与胶体( )
(5)可用过滤的方法除去氢氧化铁胶体中的氯化钠( )
(6)胶体久置会聚沉产生沉淀,属于化学变化( )
(7)胶体都带电,通电时可以作定向移动( )
×
×
×
√
×
×
×
六、达标检测
(8)用石膏或盐卤点制豆腐与胶体的性质无关( )
(9)水泥厂、冶金厂等常用高压电除去烟尘,是因为烟尘微粒带电荷( )
(10)清晨的阳光穿过茂密的树木枝叶时会观察到丁达尔效应( )
×
√
√
六、达标检测
3.下列分散系中,分散质微粒直径介于10-9~10-7 m之间的是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
√
解析 溶液中分散质微粒直径小于10-9 m,
胶体分散质微粒直径介于10-9~10-7 m之间,
悬浊液分散质微粒直径大于10-7 m,
乳浊液分散质微粒直径大于10-7 m。
六、达标检测
4.下列分散系不属于胶体的是
A.淀粉溶液 B.有色玻璃
C.烟 D.碘酒
√
解析 碘酒属于溶液,淀粉溶液属于胶体。
六、达标检测
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质粒子直径在1~100 nm之间
B.都是混合物
C.都是无色、透明的溶液
D.都呈红褐色
√
解析 氯化铁溶液与氢氧化铁胶体两种分散系,都属于混合物;
氯化铁溶液为棕黄色,其分散质粒子直径小于1 nm;
氢氧化铁胶体为红褐色,其分散质粒子直径在1~100 nm之间。
六、达标检测
请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类中的树状分类法的有关知识,在①HIO3、②NaIO3、③KOH、④I2O5、⑤NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是______(填序号)。
6.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40 mg·kg-1
储藏方法 密封、避光、防潮
食用方法 烹调时待食品熟后加入碘盐
化合物
②⑤
六、达标检测
解析 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。
六、达标检测
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾_____溶于水(填“能”或“不能”),化学性质:碘酸钾在受热时________。
解析 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
能
易分解
六、达标检测
