第二章 海水中的重要元素——钠和氯 章末复习(共27张PPT)
文档属性
| 名称 | 第二章 海水中的重要元素——钠和氯 章末复习(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 359.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:14:30 | ||
图片预览






文档简介
(共27张PPT)
章末复习
第二章 海水中的重要元素——钠和氯
一、宏观辨识与微观探析
化学是人类在认识物质、改造物质、应用物质的长期实践中逐步探索发现而形成的一门科学,其研究重点是在原子分子水平上认识物质的结构、组成、性质和变化规律,并据此改变或创造物质。如从钠原子的结构认识金属钠具有强还原性,从氯原子的结构认识氯气具有强氧化性,从氯水中含有的微粒种类认识氯水的性质;在研究物质性质的实验中,常通过观察宏观实验现象进行验证,并分析推理书写反应化学方程式,从微观的角度揭示物质变化的本质。
以物质的量为核心,把宏观的物质(气、固、溶液)的相关量经过计算转换成物质的量,然后通过分析物质微观的构成,计算出某种微粒数目。即通过物质的量这一物理量,借助阿伏加德罗常数、摩尔质量、气体摩尔体积和物质的量浓度,可以把物质的宏观量与构成物质的微观粒子的数量联系起来。
例1 (高考组合)设NA为阿伏加德罗常数的值。下列叙述正确的是
A.22.4 L(标准状况)氩气含有的质子数为18NA(2018·全国卷Ⅰ,10B)
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2 NA(2017·全国卷Ⅱ,8C)
C.标准状况下,2.24 L CCl4含有的氯原子数为0.4NA(2016·全国卷Ⅰ,8D改编)
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA(2017·浙江选考,22B)
√
解析 氩气是单原子分子,1 mol Ar含18 mol质子,A项正确;
标准状况下,2.24 L该混合气体中含有的分子数为0.1NA,B项错误;
标准状况下,CCl4为液态,C项错误;
溶剂水中也含有氧原子,D项错误。
【思维启迪】
分析“物质状态”→气体所处条件是否为标准状况→计算物质的量→分析物质的微观构成→计算微粒数目。
例2 利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol钠与水反应产生H2的量
解析 光解0.02 mol H2O可产生0.02 mol H2,则生成H2的质量为0.04 g,在标准状况下的体积为0.448 L,含有的氢原子数为2.408×1022,故A、B、C错误。
√
例3 现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。
回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
36 g·mol-1
(2)混合气体中碳原子的个数:______。(用NA表示阿伏加德罗常数的值)
0.4NA
解析 1个CO分子和1个CO2分子中都含有1个碳原子,则混合气体中碳原子的物质的量为0.4 mol,碳原子数为0.4NA。
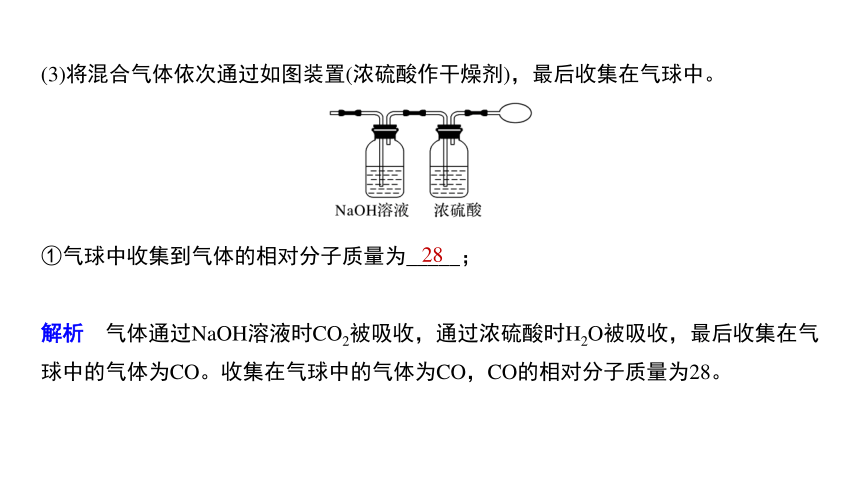
(3)将混合气体依次通过如图装置(浓硫酸作干燥剂),最后收集在气球中。
①气球中收集到气体的相对分子质量为_____;
28
解析 气体通过NaOH溶液时CO2被吸收,通过浓硫酸时H2O被吸收,最后收集在气球中的气体为CO。收集在气球中的气体为CO,CO的相对分子质量为28。
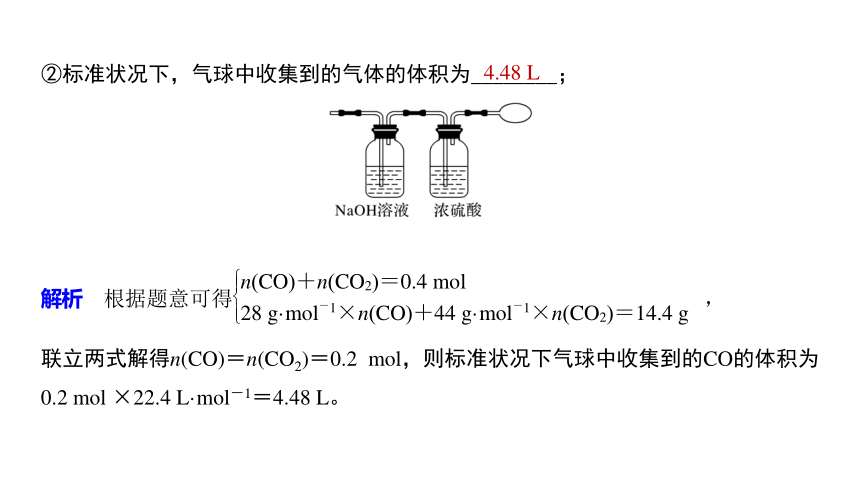
②标准状况下,气球中收集到的气体的体积为________;
联立两式解得n(CO)=n(CO2)=0.2 mol,则标准状况下气球中收集到的CO的体积为0.2 mol ×22.4 L·mol-1=4.48 L。
4.48 L
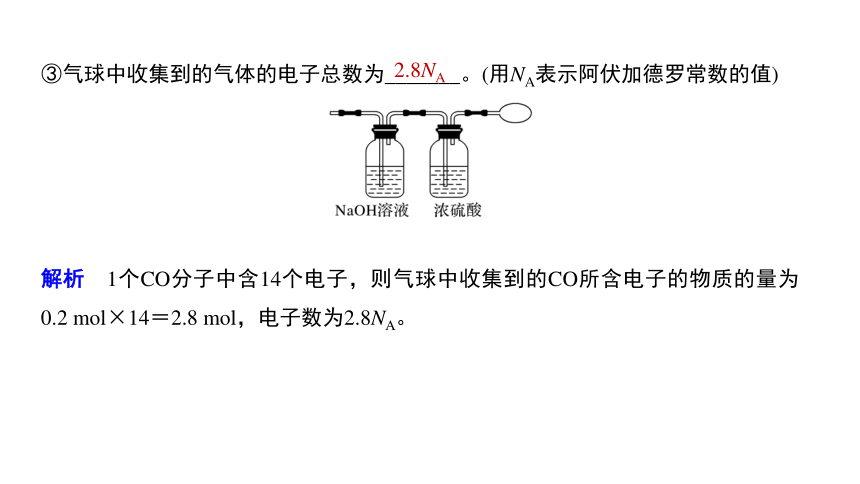
③气球中收集到的气体的电子总数为_______。(用NA表示阿伏加德罗常数的值)
解析 1个CO分子中含14个电子,则气球中收集到的CO所含电子的物质的量为0.2 mol×14=2.8 mol,电子数为2.8NA。
2.8NA
二、科学探究与创新意识
化学是一门以实验为基础的学科。实验探究是学习和研究元素化合物性质的基本方法。如实验探究钠与氧气的反应,钠与水的反应,过氧化钠与水的反应,碳酸钠、碳酸氢钠的性质;实验探究氯气的制取与性质,氯水的成分与性质,氯离子的检验等。要学会根据物质的类别和核心元素的化合价预测物质的性质,设计实验方案并完成实验,分析处理实验信息给出结论,展示交流实验探究成果,提出进一步探究或改进实验的设想。在实验探究物质性质的过程中,培养科学探究的思维品质和创新意识。
例4 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃酸过多 碳酸钠可与硫酸反应 Ⅰ对,Ⅱ对,有
B 将Na2O2加入酚酞溶液中,酚酞变红色 过氧化钠与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠保存在煤油中以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用作航天员的供氧剂 过氧化钠能和CO2、H2O反应生成氧气 Ⅰ对,Ⅱ对,有
√
解析 碳酸钠溶液具有较强的碱性,不可用于治疗胃酸过多,A项错误;
Na2O2与水反应生成NaOH,酚酞变红,但又迅速被Na2O2氧化漂白而褪色,B项错误;
常温下钠在空气中生成的氧化物为氧化钠,C项错误;
过氧化钠可以消耗CO2、H2O,产生O2,因此可用作航天员的供氧剂,D项正确。
例5 某实验小组用如图装置制备家用消毒液,并探究其性质。反应停止后,取洗气瓶中无色溶液5 mL分别进行了如下实验:
操作 现象
a.测溶液pH,并向其中滴加2滴酚酞 pH=13,溶液变红,5 min后褪色
b.向其中逐滴加入盐酸 溶液逐渐变成黄绿色
(1)写出利用上述装置制备消毒液涉及反应的化学方程式:______________________
____________________、_________________________________。
Cl2+2NaOH===NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 现象
取___________________ NaOH溶液,向其中滴加2滴酚酞 溶液变红,30 min后褪色
获得结论:此实验小组制备的消毒液具有______性。
5 mL、pH=13
漂白
解析 酚酞在强碱性溶液中红色会褪去,但同样体积、同pH值的氢氧化钠溶液,滴加2滴酚酞溶液变红,30 min后褪色,而消毒液,pH=13,溶液变红,5 min后褪色,褪色时间短,说明此实验小组制备的消毒液具有漂白性。
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
①操作b中溶液变成黄绿色的原因:______________________________(用离子方程式表示)。
②有人认为由操作b获得上述结论并不严谨。需要进一步确认此结论的实验方案是______________________________________________________________________。
操作 现象
a.测溶液pH,并向其中滴加2滴酚酞 pH=13,溶液变红,5 min后褪色
b.向其中逐滴加入盐酸 溶液逐渐变成黄绿色
ClO-+Cl-+2H+===Cl2↑+H2O
取洗气瓶中溶液5 mL,向其中逐滴加入稀H2SO4,观察溶液是否逐渐变为黄绿色
解析 该小组操作b中,使用的盐酸,盐酸中有H+和Cl-,向NaClO和NaCl的混合溶液中加入盐酸,酸性增强同时Cl-浓度也增大,因此无法判断到底是酸性增强导致NaClO稳定性下降还是Cl-浓度增大导致的,故加的酸应排除氯离子干扰,因此需向溶液中加入H2SO4,如溶液变为黄绿色,则说明消毒液稳定性下降,和溶液的Cl-发生反应生成氯气。离子方程式为2H++ClO-+Cl-===Cl2↑+H2O。
【思维启迪】
利用已有知识采用科学方法去探究未知问题,是学习化学的重要方法和手段。要将科学探究这一方法融入平时学习中,能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验、调查等方法进行实验探究;勤于实践,善于合作,敢于质疑,勇于创新。
三、科学态度与社会责任
学习化学要具有科学严谨的态度,要具有实验安全意识。在探究金属钠、氯气性质的一系列的实验中,要遵循实验规则,实验操作要严格规范,要熟知活泼金属钠的使用注意事项,钠与水反应实验因操作不当可能产生的危险,氯气有毒要进行尾气处理等。
熟知钠的重要化合物(如过氧化钠、碳酸钠、碳酸氢钠等)和含氯物质(如氯气、盐酸、漂白粉、“84”消毒液等)在日常生活和农业生产中的重要用途,认识化学科学对社会发展的重大贡献;了解碱的生产历史,并能从生态文明建设的角度认识侯氏制碱法的重要意义,从而增强探索未知崇尚真理的科学探究意识和造福人类的社会责任意识。
例6 根据所给的信息和标志,判断下列说法错误的是
A B C D
《神农本草经》记载,麻黄能“止咳逆上气” 碳酸氢钠药片
古代中国人已用麻黄治疗咳嗽 该药是抗酸药,服用时喝些醋能提高药效 看到有该标志的丢弃物,应远离并报警 贴有该标志的物品是可回收物
解析 碳酸氢钠易与醋酸反应,若与醋酸同服,会降低药效。
√
【视野拓展】
生活中的化学知识到处可见。现将日常生活中常见的化学问题列举如下:无铅汽油、可降解饭盒、无磷洗衣粉、含氟牙膏的使用,旧电池的回收,食用含碘盐,明矾净水及各种消毒剂的使用,钢铁腐蚀等。当今的环境问题主要包括:温室效应、酸雨、臭氧层被破坏、光化学烟雾、白色污染、赤潮、水华、重金属及其盐的污染、沙漠化等。
例7 用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用具有强氧化性的高效消毒剂二氧化氯(ClO2)。二氧化氯极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是___________________
________________________________。
2NaClO3+4HCl(浓)
===2ClO2↑+Cl2↑+2NaCl+2H2O
解析 根据原子守恒可知,一定还有水和氯化钠生成,反应的化学方程式是2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O。
(2)浓盐酸在上述反应中显示出来的性质是____(填字母)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
B
解析 根据方程式可知,盐酸中氯元素的化合价从-1价升高到0价,失去电子,作还原剂。同时还有氯化钠生成,所以盐酸还起酸性的作用。
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的_____倍。
解析 71 g氯气的物质的量是1 mol,在反应中得到2 mol电子。而71 g二氧化氯的物质的量约是1.052 mol,在反应中得到5.26 mol电子,其消毒的效率(以单位质量得到电子数表示)是氯气的2.63倍。
2.63
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是_____________________________。
和欧洲的方法相比,我国这一方法的主要优点是_________________。
解析 由原子守恒可知,另外一种生成物是氯化钠,反应的化学方程式是2NaClO2+Cl2===2NaCl+2ClO2。由于生成的二氧化氯中不含氯气杂质,和欧洲的方法相比,我国这一方法的主要优点是对环境污染较小。
2NaClO2+Cl2===2NaCl+2ClO2
对环境的污染较小
例8 (2019·日照青山学校月考)已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:
__________________________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_______(写出方法);
如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?
________________________________(写出化学方程式)。
解析 NaHCO3固体受热容易分解生成Na2CO3,Na2CO3(固体)中混有NaHCO3(固体)可以通过加热的方法除去;如果NaHCO3(溶液)中混有Na2CO3(溶液),可以在溶液中通入二氧化碳气体,Na2CO3+H2O+CO2===2NaHCO3。
加热
Na2CO3+H2O+CO2===2NaHCO3
章末复习
第二章 海水中的重要元素——钠和氯
一、宏观辨识与微观探析
化学是人类在认识物质、改造物质、应用物质的长期实践中逐步探索发现而形成的一门科学,其研究重点是在原子分子水平上认识物质的结构、组成、性质和变化规律,并据此改变或创造物质。如从钠原子的结构认识金属钠具有强还原性,从氯原子的结构认识氯气具有强氧化性,从氯水中含有的微粒种类认识氯水的性质;在研究物质性质的实验中,常通过观察宏观实验现象进行验证,并分析推理书写反应化学方程式,从微观的角度揭示物质变化的本质。
以物质的量为核心,把宏观的物质(气、固、溶液)的相关量经过计算转换成物质的量,然后通过分析物质微观的构成,计算出某种微粒数目。即通过物质的量这一物理量,借助阿伏加德罗常数、摩尔质量、气体摩尔体积和物质的量浓度,可以把物质的宏观量与构成物质的微观粒子的数量联系起来。
例1 (高考组合)设NA为阿伏加德罗常数的值。下列叙述正确的是
A.22.4 L(标准状况)氩气含有的质子数为18NA(2018·全国卷Ⅰ,10B)
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2 NA(2017·全国卷Ⅱ,8C)
C.标准状况下,2.24 L CCl4含有的氯原子数为0.4NA(2016·全国卷Ⅰ,8D改编)
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA(2017·浙江选考,22B)
√
解析 氩气是单原子分子,1 mol Ar含18 mol质子,A项正确;
标准状况下,2.24 L该混合气体中含有的分子数为0.1NA,B项错误;
标准状况下,CCl4为液态,C项错误;
溶剂水中也含有氧原子,D项错误。
【思维启迪】
分析“物质状态”→气体所处条件是否为标准状况→计算物质的量→分析物质的微观构成→计算微粒数目。
例2 利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol钠与水反应产生H2的量
解析 光解0.02 mol H2O可产生0.02 mol H2,则生成H2的质量为0.04 g,在标准状况下的体积为0.448 L,含有的氢原子数为2.408×1022,故A、B、C错误。
√
例3 现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。
回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
36 g·mol-1
(2)混合气体中碳原子的个数:______。(用NA表示阿伏加德罗常数的值)
0.4NA
解析 1个CO分子和1个CO2分子中都含有1个碳原子,则混合气体中碳原子的物质的量为0.4 mol,碳原子数为0.4NA。
(3)将混合气体依次通过如图装置(浓硫酸作干燥剂),最后收集在气球中。
①气球中收集到气体的相对分子质量为_____;
28
解析 气体通过NaOH溶液时CO2被吸收,通过浓硫酸时H2O被吸收,最后收集在气球中的气体为CO。收集在气球中的气体为CO,CO的相对分子质量为28。
②标准状况下,气球中收集到的气体的体积为________;
联立两式解得n(CO)=n(CO2)=0.2 mol,则标准状况下气球中收集到的CO的体积为0.2 mol ×22.4 L·mol-1=4.48 L。
4.48 L
③气球中收集到的气体的电子总数为_______。(用NA表示阿伏加德罗常数的值)
解析 1个CO分子中含14个电子,则气球中收集到的CO所含电子的物质的量为0.2 mol×14=2.8 mol,电子数为2.8NA。
2.8NA
二、科学探究与创新意识
化学是一门以实验为基础的学科。实验探究是学习和研究元素化合物性质的基本方法。如实验探究钠与氧气的反应,钠与水的反应,过氧化钠与水的反应,碳酸钠、碳酸氢钠的性质;实验探究氯气的制取与性质,氯水的成分与性质,氯离子的检验等。要学会根据物质的类别和核心元素的化合价预测物质的性质,设计实验方案并完成实验,分析处理实验信息给出结论,展示交流实验探究成果,提出进一步探究或改进实验的设想。在实验探究物质性质的过程中,培养科学探究的思维品质和创新意识。
例4 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃酸过多 碳酸钠可与硫酸反应 Ⅰ对,Ⅱ对,有
B 将Na2O2加入酚酞溶液中,酚酞变红色 过氧化钠与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠保存在煤油中以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用作航天员的供氧剂 过氧化钠能和CO2、H2O反应生成氧气 Ⅰ对,Ⅱ对,有
√
解析 碳酸钠溶液具有较强的碱性,不可用于治疗胃酸过多,A项错误;
Na2O2与水反应生成NaOH,酚酞变红,但又迅速被Na2O2氧化漂白而褪色,B项错误;
常温下钠在空气中生成的氧化物为氧化钠,C项错误;
过氧化钠可以消耗CO2、H2O,产生O2,因此可用作航天员的供氧剂,D项正确。
例5 某实验小组用如图装置制备家用消毒液,并探究其性质。反应停止后,取洗气瓶中无色溶液5 mL分别进行了如下实验:
操作 现象
a.测溶液pH,并向其中滴加2滴酚酞 pH=13,溶液变红,5 min后褪色
b.向其中逐滴加入盐酸 溶液逐渐变成黄绿色
(1)写出利用上述装置制备消毒液涉及反应的化学方程式:______________________
____________________、_________________________________。
Cl2+2NaOH===NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 现象
取___________________ NaOH溶液,向其中滴加2滴酚酞 溶液变红,30 min后褪色
获得结论:此实验小组制备的消毒液具有______性。
5 mL、pH=13
漂白
解析 酚酞在强碱性溶液中红色会褪去,但同样体积、同pH值的氢氧化钠溶液,滴加2滴酚酞溶液变红,30 min后褪色,而消毒液,pH=13,溶液变红,5 min后褪色,褪色时间短,说明此实验小组制备的消毒液具有漂白性。
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
①操作b中溶液变成黄绿色的原因:______________________________(用离子方程式表示)。
②有人认为由操作b获得上述结论并不严谨。需要进一步确认此结论的实验方案是______________________________________________________________________。
操作 现象
a.测溶液pH,并向其中滴加2滴酚酞 pH=13,溶液变红,5 min后褪色
b.向其中逐滴加入盐酸 溶液逐渐变成黄绿色
ClO-+Cl-+2H+===Cl2↑+H2O
取洗气瓶中溶液5 mL,向其中逐滴加入稀H2SO4,观察溶液是否逐渐变为黄绿色
解析 该小组操作b中,使用的盐酸,盐酸中有H+和Cl-,向NaClO和NaCl的混合溶液中加入盐酸,酸性增强同时Cl-浓度也增大,因此无法判断到底是酸性增强导致NaClO稳定性下降还是Cl-浓度增大导致的,故加的酸应排除氯离子干扰,因此需向溶液中加入H2SO4,如溶液变为黄绿色,则说明消毒液稳定性下降,和溶液的Cl-发生反应生成氯气。离子方程式为2H++ClO-+Cl-===Cl2↑+H2O。
【思维启迪】
利用已有知识采用科学方法去探究未知问题,是学习化学的重要方法和手段。要将科学探究这一方法融入平时学习中,能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验、调查等方法进行实验探究;勤于实践,善于合作,敢于质疑,勇于创新。
三、科学态度与社会责任
学习化学要具有科学严谨的态度,要具有实验安全意识。在探究金属钠、氯气性质的一系列的实验中,要遵循实验规则,实验操作要严格规范,要熟知活泼金属钠的使用注意事项,钠与水反应实验因操作不当可能产生的危险,氯气有毒要进行尾气处理等。
熟知钠的重要化合物(如过氧化钠、碳酸钠、碳酸氢钠等)和含氯物质(如氯气、盐酸、漂白粉、“84”消毒液等)在日常生活和农业生产中的重要用途,认识化学科学对社会发展的重大贡献;了解碱的生产历史,并能从生态文明建设的角度认识侯氏制碱法的重要意义,从而增强探索未知崇尚真理的科学探究意识和造福人类的社会责任意识。
例6 根据所给的信息和标志,判断下列说法错误的是
A B C D
《神农本草经》记载,麻黄能“止咳逆上气” 碳酸氢钠药片
古代中国人已用麻黄治疗咳嗽 该药是抗酸药,服用时喝些醋能提高药效 看到有该标志的丢弃物,应远离并报警 贴有该标志的物品是可回收物
解析 碳酸氢钠易与醋酸反应,若与醋酸同服,会降低药效。
√
【视野拓展】
生活中的化学知识到处可见。现将日常生活中常见的化学问题列举如下:无铅汽油、可降解饭盒、无磷洗衣粉、含氟牙膏的使用,旧电池的回收,食用含碘盐,明矾净水及各种消毒剂的使用,钢铁腐蚀等。当今的环境问题主要包括:温室效应、酸雨、臭氧层被破坏、光化学烟雾、白色污染、赤潮、水华、重金属及其盐的污染、沙漠化等。
例7 用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用具有强氧化性的高效消毒剂二氧化氯(ClO2)。二氧化氯极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是___________________
________________________________。
2NaClO3+4HCl(浓)
===2ClO2↑+Cl2↑+2NaCl+2H2O
解析 根据原子守恒可知,一定还有水和氯化钠生成,反应的化学方程式是2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O。
(2)浓盐酸在上述反应中显示出来的性质是____(填字母)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
B
解析 根据方程式可知,盐酸中氯元素的化合价从-1价升高到0价,失去电子,作还原剂。同时还有氯化钠生成,所以盐酸还起酸性的作用。
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的_____倍。
解析 71 g氯气的物质的量是1 mol,在反应中得到2 mol电子。而71 g二氧化氯的物质的量约是1.052 mol,在反应中得到5.26 mol电子,其消毒的效率(以单位质量得到电子数表示)是氯气的2.63倍。
2.63
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是_____________________________。
和欧洲的方法相比,我国这一方法的主要优点是_________________。
解析 由原子守恒可知,另外一种生成物是氯化钠,反应的化学方程式是2NaClO2+Cl2===2NaCl+2ClO2。由于生成的二氧化氯中不含氯气杂质,和欧洲的方法相比,我国这一方法的主要优点是对环境污染较小。
2NaClO2+Cl2===2NaCl+2ClO2
对环境的污染较小
例8 (2019·日照青山学校月考)已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:
__________________________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_______(写出方法);
如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?
________________________________(写出化学方程式)。
解析 NaHCO3固体受热容易分解生成Na2CO3,Na2CO3(固体)中混有NaHCO3(固体)可以通过加热的方法除去;如果NaHCO3(溶液)中混有Na2CO3(溶液),可以在溶液中通入二氧化碳气体,Na2CO3+H2O+CO2===2NaHCO3。
加热
Na2CO3+H2O+CO2===2NaHCO3
