第三节 物质的量 第1课时 精品课件(共32张PPT)
文档属性
| 名称 | 第三节 物质的量 第1课时 精品课件(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 586.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:22:34 | ||
图片预览











文档简介
(共32张PPT)
第1课时 物质的量 摩尔质量
第二章 海水中的重要元素——钠和氯 第三节 物质的量
一、导入新课
水是大家非常熟悉的物质,它是由水分子构成的。一滴水(约0.05mL)大约含有17万亿亿个水分子。如果一个个去数一滴水含有的水分子,即使分秒不停,一个人一生也无法完成这项工作。
那么,怎样才能既科学又方便地知道一定质量或体积的水含有多少个水分子呢?
1.物质的量
(1)国际单位制(SI)中的七个基本单位
物理量 _____ 质量 _____ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) _________ 秒(s) 安(A) 开(K) ________ 坎(cd)
长度
时间
千克(kg)
摩(mol)
二、物质的量、阿伏加德罗常数
(2)物质的量及其单位
①物质的量是表示含有 的集合体的物理量,用符号 表示。
②物质的量的单位——摩尔
一定数目粒子
n
mol
0.012 kg
分子
原子
离子
二、物质的量、阿伏加德罗常数
(3)判断正误(正确的打“√”,错误的打“×”)
①物质的量可以理解为物质的数量( )
②物质的量表示物质所含指定粒子集体数目的多少( )
③物质的量描述对象是分子、原子等微观粒子( )
④摩尔是国际单位制中七个基本物理量之一( )
⑤1 mol氢中含有2 mol氢原子和2 mol电子( )
×
√
√
×
×
二、物质的量、阿伏加德罗常数
【归纳总结】
物质的量概念的多角度理解
(1)专有化:物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。
(2)微观化:物质的量的单位是摩尔,只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不适合表示宏观物质的数量。
(3)具体化:在使用物质的量表示物质时,必须具体指明粒子的种类。如1 mol H2表示1摩尔氢分子,1 mol H表示1摩尔氢原子,1 mol H+表示1摩尔氢离子。而1 mol氢的表述是错误的,因为“氢”是元素名称,是宏观物质名称,不是微观粒子名称。
(4)集体化:微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可是小数。例:5 mol H2O、0.5 mol H2O。
二、物质的量、阿伏加德罗常数
2.阿伏加德罗常数
(1)已知1个12C的实际质量为1.993 3×10-23 g,则12 g 12C所含碳原子个数约为_______,碳原子的物质的量为 。
(2)阿伏加德罗常数的基准量为 ,近似值为 。
(3)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 ,单位是 。
(4)物质的量、阿伏加德罗常数与粒子数之间的关系:n= 。
6.02×
1023
1摩尔
0.012 kg 12C中所含的原子个数
6.02×1023
NA
mol-1
二、物质的量、阿伏加德罗常数
解析 物质的量是含有一定数目粒子集合体的物理量,其单位是摩尔,使用摩尔所指的对象是微粒,而微粒种类繁多,需要指明其名称;
构成物质的粒子除原子外,还有分子、离子等;
0.012 kg 12C(1 mol)所含的碳原子数即为阿伏加德罗常数,约为6.02×1023。
例1 下列说法中错误的是
A.物质的量是表示含有一定数目粒子的集体
B.使用摩尔作单位时必须指明微粒的名称
C.1 mol 任何物质都含有阿伏加德罗常数个原子
D.0.012 kg 12C约含有6.02×1023个碳原子
√
二、物质的量、阿伏加德罗常数
【易错警示】
阿伏加德罗常数(NA)是一个物理量,其单位是mol-1(不是纯数值),其基准量为0.012 kg 12C中所含的碳原子数,近似数值为6.02×1023。
二、物质的量、阿伏加德罗常数
例2 a mol硫酸中含有b个氧原子,则阿伏加德罗常数可以表示为
√
二、物质的量、阿伏加德罗常数
1.计算填表
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23 ________ ___
Al 4.485×10-23 ________ ___
通过上表计算结果,可得出的结论是_______________________________________
。
17.999 8
26.999 7
18
27
6.02×1023个微粒(1摩尔)的质量(以克为单位
时),在数值上(近似)等于其相对分子(或原子)质量
三、摩尔质量
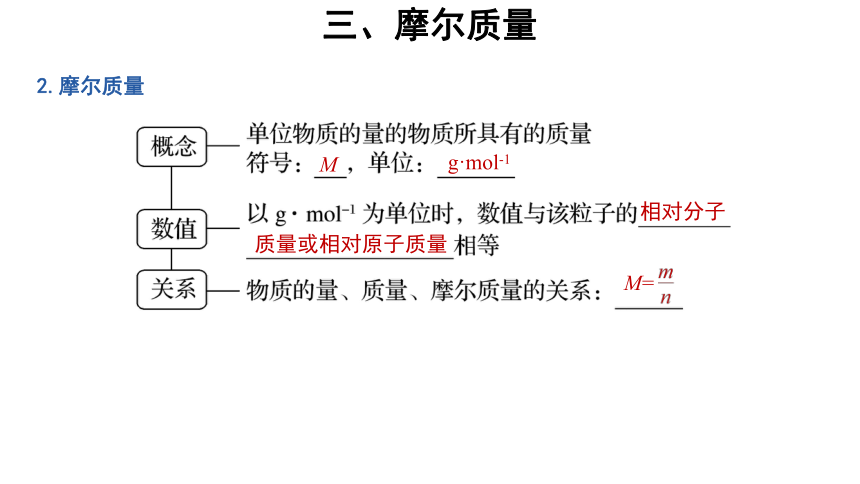
2.摩尔质量
M
g·mol-1
相对分子
质量或相对原子质量
M=
三、摩尔质量
例3 下列有关摩尔质量的描述或应用正确的是
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于 g
解析 A项中质量的单位为“g”;
B项单位应为“g·mol-1”;
C项没有指出以“g·mol-1”为单位,也没有指出在数值上相等;
D项正确。
√
三、摩尔质量
【归纳总结】
摩尔质量概念的理解
(1)等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
(2)确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
三、摩尔质量
例4 计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为__________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(4)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为
___________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
三、摩尔质量
【思维启迪】
摩尔质量的计算方法
(1)已知任意状态物质的质量时:M= (定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:M= ×12 g·mol-1。
三、摩尔质量
1.基本关系式
(1)n= (n表示物质的量,N表示粒子数)。关系式中NA的单位是 。
(2)M= (M为摩尔质量,m为物质的质量)。
在M、n和m中,已知任意两项求第三项;若M的单位是 时,则m的单位是
。
mol-1
g·mol-1
g
三、关于物质的量的简单计算
2.恒等关系式
三、关于物质的量的简单计算
解析 2.3 g钠(0.1 mol)变为Na+失去的电子数为0.1NA;
19.6 g磷酸的物质的量为19.6 g÷98 g·mol-1=0.2 mol,与0.2NA个硫酸分子的物质的量相同,二者含有的氧原子数也相同;
28 g氮气的物质的量为28 g÷28 g·mol-1=1 mol,含有2NA个氮原子;
NA个氧分子质量为32 g,NA个氢分子质量为2 g,则其质量比为16∶1。
例5 设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.2.3 g钠由原子变成离子时,失去的电子数为 0.2NA
B.0.2NA个硫酸分子与19.6 g磷酸(H3PO4)含有相同的氧原子数
C.28 g氮气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8∶1
√
三、关于物质的量的简单计算
例6 在14.2 g硫酸钠中:
(1)含有的Na+的数目是____________;
(2)含有的 的质量是__________;
(3)含氧原子的物质的量是________。
1.204×1023
9.6 g
0.4 mol
三、关于物质的量的简单计算
解析 由硫酸钠的化学式可得如下关系式:
(1)n(Na+)=2n(Na2SO4)=0.2 mol,
N(Na+)=0.2 mol×6.02×1023 mol-1=1.204×1023;
(3)n(O)=4n(Na2SO4)=0.4 mol。
三、关于物质的量的简单计算
方法二 在关系式中,系数比等于粒子个数比,若都扩大为原来的6.02×1023倍,则化学计量数之比就等于物质的量之比:
而在一个关系式中,等量的某一物质,可用不同的单位来表示。如2 mol Na+,可用质量2×23 g来表示,也可用离子个数2×6.02×1023来表示。在计算时,为方便计算,通常是化学计量数反映的量与该物质(已知量或待求量)的题给单位相同。如:本题中已知量硫酸钠是14.2 g,那么化学计量数反映的1 mol的Na2SO4就用“142 g”来计算;
三、关于物质的量的简单计算
(1)中求Na+的个数,化学计量数反映的2 mol Na+就用“2×6.02×1023”来计算;以此类推,有如下计算式:
三、关于物质的量的简单计算
【思维拓展】
(1)物质的量是物质的质量和微粒数目之间计算的桥梁,已知物质的质量求其微粒数目或已知物质的微粒数目求其质量都是先转换成物质的量,再计算微粒数目或质量。
(2)要注意描述的微粒与所求微粒之间的数量关系。
如:Na2SO4 ~ 2Na+ ~ ~ 4O
1 mol 2 mol 1 mol 4 mol
H2O~ 2H ~O~ 原子 ~ 质子 ~ 电子 ~ 中子
1 mol 2 mol 1 mol 3 mol 10 mol 10 mol 8 mol
(3)要注意物质的量、阿伏加德罗常数、摩尔质量的单位的区别,在计算过程中,一定要带着单位,否则容易出现错误。
三、关于物质的量的简单计算
学习小结
四、课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)物质的量是衡量物质数量的基本物理量( )
(2)摩尔是用来描述微观粒子的物理量( )
(3)摩尔质量实际上就是相对原子质量( )
(4)两种不同粒子的摩尔质量一定不同( )
(5)1 mol氧中含有6.02×1023个氧原子( )
(6)1 mol任何物质都含有6.02×1023个分子( )
(7)硫酸根离子的摩尔质量是96 g·mol-1( )
(8)3 mol OH-的质量是51 g( )
×
×
×
×
×
×
√
√
五、达标检测
(9)49 g硫酸中含有1 mol氢原子( )
(10)0.5 mol水中含有的原子数目为1.5NA( )
√
√
五、达标检测
2.比较1 mol氧气和1 mol一氧化碳,下列说法正确的是
A.质量相同 B.分子总数相同
C.原子总数不同 D.氧原子总数相同
√
解析 氧气和一氧化碳的物质的量相同时:它们含有的分子总数相同;二者都是双原子分子,它们含有的原子总数也相同,但含有的氧原子总数不相同;二者的摩尔质量不同,它们的质量不相同。
五、达标检测
3.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
硫酸的物质的量=0.5 mol÷4=0.125 mol。
五、达标检测
4.已知0.25 mol甲烷中所含原子数为a,则阿伏加德罗常数可表示为
√
五、达标检测
5.20 g A物质和14 g B物质恰好完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为
A.100 g·mol-1 B.108 g·mol-1
C.55 g·mol-1 D.96 g·mol-1
√
解析 物质E的质量=20 g+14 g-8.8 g-3.6 g=21.6 g,
其摩尔质量=21.6 g÷0.2 mol=108 g·mol-1。
五、达标检测
解析 计算确定相关粒子的物质的量:
水分子中所含氢原子的物质的量=18 g÷18 g·mol-1×2=2 mol,
氩气所含原子的物质的量=1 mol×1=1 mol,
碳酸钠所含钠离子的物质的量=53 g÷106 g·mol-1×2=1 mol,
硝酸所含氧原子的物质的量=0.5 mol×3=1.5 mol。
6.用NA代表阿伏加德罗常数,下列说法中正确的是
A.18 g水中含有的氢原子数目为NA
B.1 mol氩气分子所含的原子数目为2NA
C.53 g碳酸钠中含有的钠离子为0.5NA
D.0.5 mol硝酸中含有的氧原子为1.5NA
√
五、达标检测
第1课时 物质的量 摩尔质量
第二章 海水中的重要元素——钠和氯 第三节 物质的量
一、导入新课
水是大家非常熟悉的物质,它是由水分子构成的。一滴水(约0.05mL)大约含有17万亿亿个水分子。如果一个个去数一滴水含有的水分子,即使分秒不停,一个人一生也无法完成这项工作。
那么,怎样才能既科学又方便地知道一定质量或体积的水含有多少个水分子呢?
1.物质的量
(1)国际单位制(SI)中的七个基本单位
物理量 _____ 质量 _____ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) _________ 秒(s) 安(A) 开(K) ________ 坎(cd)
长度
时间
千克(kg)
摩(mol)
二、物质的量、阿伏加德罗常数
(2)物质的量及其单位
①物质的量是表示含有 的集合体的物理量,用符号 表示。
②物质的量的单位——摩尔
一定数目粒子
n
mol
0.012 kg
分子
原子
离子
二、物质的量、阿伏加德罗常数
(3)判断正误(正确的打“√”,错误的打“×”)
①物质的量可以理解为物质的数量( )
②物质的量表示物质所含指定粒子集体数目的多少( )
③物质的量描述对象是分子、原子等微观粒子( )
④摩尔是国际单位制中七个基本物理量之一( )
⑤1 mol氢中含有2 mol氢原子和2 mol电子( )
×
√
√
×
×
二、物质的量、阿伏加德罗常数
【归纳总结】
物质的量概念的多角度理解
(1)专有化:物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。
(2)微观化:物质的量的单位是摩尔,只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不适合表示宏观物质的数量。
(3)具体化:在使用物质的量表示物质时,必须具体指明粒子的种类。如1 mol H2表示1摩尔氢分子,1 mol H表示1摩尔氢原子,1 mol H+表示1摩尔氢离子。而1 mol氢的表述是错误的,因为“氢”是元素名称,是宏观物质名称,不是微观粒子名称。
(4)集体化:微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可是小数。例:5 mol H2O、0.5 mol H2O。
二、物质的量、阿伏加德罗常数
2.阿伏加德罗常数
(1)已知1个12C的实际质量为1.993 3×10-23 g,则12 g 12C所含碳原子个数约为_______,碳原子的物质的量为 。
(2)阿伏加德罗常数的基准量为 ,近似值为 。
(3)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 ,单位是 。
(4)物质的量、阿伏加德罗常数与粒子数之间的关系:n= 。
6.02×
1023
1摩尔
0.012 kg 12C中所含的原子个数
6.02×1023
NA
mol-1
二、物质的量、阿伏加德罗常数
解析 物质的量是含有一定数目粒子集合体的物理量,其单位是摩尔,使用摩尔所指的对象是微粒,而微粒种类繁多,需要指明其名称;
构成物质的粒子除原子外,还有分子、离子等;
0.012 kg 12C(1 mol)所含的碳原子数即为阿伏加德罗常数,约为6.02×1023。
例1 下列说法中错误的是
A.物质的量是表示含有一定数目粒子的集体
B.使用摩尔作单位时必须指明微粒的名称
C.1 mol 任何物质都含有阿伏加德罗常数个原子
D.0.012 kg 12C约含有6.02×1023个碳原子
√
二、物质的量、阿伏加德罗常数
【易错警示】
阿伏加德罗常数(NA)是一个物理量,其单位是mol-1(不是纯数值),其基准量为0.012 kg 12C中所含的碳原子数,近似数值为6.02×1023。
二、物质的量、阿伏加德罗常数
例2 a mol硫酸中含有b个氧原子,则阿伏加德罗常数可以表示为
√
二、物质的量、阿伏加德罗常数
1.计算填表
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23 ________ ___
Al 4.485×10-23 ________ ___
通过上表计算结果,可得出的结论是_______________________________________
。
17.999 8
26.999 7
18
27
6.02×1023个微粒(1摩尔)的质量(以克为单位
时),在数值上(近似)等于其相对分子(或原子)质量
三、摩尔质量
2.摩尔质量
M
g·mol-1
相对分子
质量或相对原子质量
M=
三、摩尔质量
例3 下列有关摩尔质量的描述或应用正确的是
A.1 mol OH-的质量为17 g·mol-1
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于 g
解析 A项中质量的单位为“g”;
B项单位应为“g·mol-1”;
C项没有指出以“g·mol-1”为单位,也没有指出在数值上相等;
D项正确。
√
三、摩尔质量
【归纳总结】
摩尔质量概念的理解
(1)等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
(2)确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
三、摩尔质量
例4 计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为__________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(4)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为
___________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
三、摩尔质量
【思维启迪】
摩尔质量的计算方法
(1)已知任意状态物质的质量时:M= (定义式)。
(2)已知一个分子的质量时:M=m(分子)×NA。
(3)已知一个分子的质量和一个12C原子的质量时:M= ×12 g·mol-1。
三、摩尔质量
1.基本关系式
(1)n= (n表示物质的量,N表示粒子数)。关系式中NA的单位是 。
(2)M= (M为摩尔质量,m为物质的质量)。
在M、n和m中,已知任意两项求第三项;若M的单位是 时,则m的单位是
。
mol-1
g·mol-1
g
三、关于物质的量的简单计算
2.恒等关系式
三、关于物质的量的简单计算
解析 2.3 g钠(0.1 mol)变为Na+失去的电子数为0.1NA;
19.6 g磷酸的物质的量为19.6 g÷98 g·mol-1=0.2 mol,与0.2NA个硫酸分子的物质的量相同,二者含有的氧原子数也相同;
28 g氮气的物质的量为28 g÷28 g·mol-1=1 mol,含有2NA个氮原子;
NA个氧分子质量为32 g,NA个氢分子质量为2 g,则其质量比为16∶1。
例5 设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.2.3 g钠由原子变成离子时,失去的电子数为 0.2NA
B.0.2NA个硫酸分子与19.6 g磷酸(H3PO4)含有相同的氧原子数
C.28 g氮气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8∶1
√
三、关于物质的量的简单计算
例6 在14.2 g硫酸钠中:
(1)含有的Na+的数目是____________;
(2)含有的 的质量是__________;
(3)含氧原子的物质的量是________。
1.204×1023
9.6 g
0.4 mol
三、关于物质的量的简单计算
解析 由硫酸钠的化学式可得如下关系式:
(1)n(Na+)=2n(Na2SO4)=0.2 mol,
N(Na+)=0.2 mol×6.02×1023 mol-1=1.204×1023;
(3)n(O)=4n(Na2SO4)=0.4 mol。
三、关于物质的量的简单计算
方法二 在关系式中,系数比等于粒子个数比,若都扩大为原来的6.02×1023倍,则化学计量数之比就等于物质的量之比:
而在一个关系式中,等量的某一物质,可用不同的单位来表示。如2 mol Na+,可用质量2×23 g来表示,也可用离子个数2×6.02×1023来表示。在计算时,为方便计算,通常是化学计量数反映的量与该物质(已知量或待求量)的题给单位相同。如:本题中已知量硫酸钠是14.2 g,那么化学计量数反映的1 mol的Na2SO4就用“142 g”来计算;
三、关于物质的量的简单计算
(1)中求Na+的个数,化学计量数反映的2 mol Na+就用“2×6.02×1023”来计算;以此类推,有如下计算式:
三、关于物质的量的简单计算
【思维拓展】
(1)物质的量是物质的质量和微粒数目之间计算的桥梁,已知物质的质量求其微粒数目或已知物质的微粒数目求其质量都是先转换成物质的量,再计算微粒数目或质量。
(2)要注意描述的微粒与所求微粒之间的数量关系。
如:Na2SO4 ~ 2Na+ ~ ~ 4O
1 mol 2 mol 1 mol 4 mol
H2O~ 2H ~O~ 原子 ~ 质子 ~ 电子 ~ 中子
1 mol 2 mol 1 mol 3 mol 10 mol 10 mol 8 mol
(3)要注意物质的量、阿伏加德罗常数、摩尔质量的单位的区别,在计算过程中,一定要带着单位,否则容易出现错误。
三、关于物质的量的简单计算
学习小结
四、课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)物质的量是衡量物质数量的基本物理量( )
(2)摩尔是用来描述微观粒子的物理量( )
(3)摩尔质量实际上就是相对原子质量( )
(4)两种不同粒子的摩尔质量一定不同( )
(5)1 mol氧中含有6.02×1023个氧原子( )
(6)1 mol任何物质都含有6.02×1023个分子( )
(7)硫酸根离子的摩尔质量是96 g·mol-1( )
(8)3 mol OH-的质量是51 g( )
×
×
×
×
×
×
√
√
五、达标检测
(9)49 g硫酸中含有1 mol氢原子( )
(10)0.5 mol水中含有的原子数目为1.5NA( )
√
√
五、达标检测
2.比较1 mol氧气和1 mol一氧化碳,下列说法正确的是
A.质量相同 B.分子总数相同
C.原子总数不同 D.氧原子总数相同
√
解析 氧气和一氧化碳的物质的量相同时:它们含有的分子总数相同;二者都是双原子分子,它们含有的原子总数也相同,但含有的氧原子总数不相同;二者的摩尔质量不同,它们的质量不相同。
五、达标检测
3.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
硫酸的物质的量=0.5 mol÷4=0.125 mol。
五、达标检测
4.已知0.25 mol甲烷中所含原子数为a,则阿伏加德罗常数可表示为
√
五、达标检测
5.20 g A物质和14 g B物质恰好完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为
A.100 g·mol-1 B.108 g·mol-1
C.55 g·mol-1 D.96 g·mol-1
√
解析 物质E的质量=20 g+14 g-8.8 g-3.6 g=21.6 g,
其摩尔质量=21.6 g÷0.2 mol=108 g·mol-1。
五、达标检测
解析 计算确定相关粒子的物质的量:
水分子中所含氢原子的物质的量=18 g÷18 g·mol-1×2=2 mol,
氩气所含原子的物质的量=1 mol×1=1 mol,
碳酸钠所含钠离子的物质的量=53 g÷106 g·mol-1×2=1 mol,
硝酸所含氧原子的物质的量=0.5 mol×3=1.5 mol。
6.用NA代表阿伏加德罗常数,下列说法中正确的是
A.18 g水中含有的氢原子数目为NA
B.1 mol氩气分子所含的原子数目为2NA
C.53 g碳酸钠中含有的钠离子为0.5NA
D.0.5 mol硝酸中含有的氧原子为1.5NA
√
五、达标检测
