第一章 物质及其变化 章末复习(共38张PPT)
文档属性
| 名称 | 第一章 物质及其变化 章末复习(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 878.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:31:36 | ||
图片预览







文档简介
(共38张PPT)
第一章 物质及其变化 章末复习
在学习本章知识的过程中,既能从宏观的角度认识物质的元素组成、性质表现及其实际应用;又能从微观的角度了解物质的构成,预测或解释物质的性质及其变化的实质,促进“宏观辨识与微观探析”化学核心素养的发展。
一、宏观辨识与微观探析
知识要点 宏观辨识 微观探析
物质的组成与分类 物质由一种或多种元素组成 构成物质的微粒有分子、原子、离子
胶体的性质不同于其他分散系 胶体与其他分散系的本质区别是分散质粒子大小不同
溶液中的离子反应 酸、碱、盐在水溶液中的性质 酸、碱、盐在水溶液中的电离及存在状态
离子反应发生的条件(宏观现象) 离子浓度发生改变(反应实质)
氧化还原反应 氧化还原反应相关概念的识别与判断 氧化还原反应的特征(化合价变化)与实质(电子转移)
设计实验探究验证物质的氧化性或还原性 由核心元素化合价的升降预测物质的性质
物质性质的应用 实际应用过程中产生的现象和出现的问题 用变化的实质进行分析解释
一、宏观辨识与微观探析
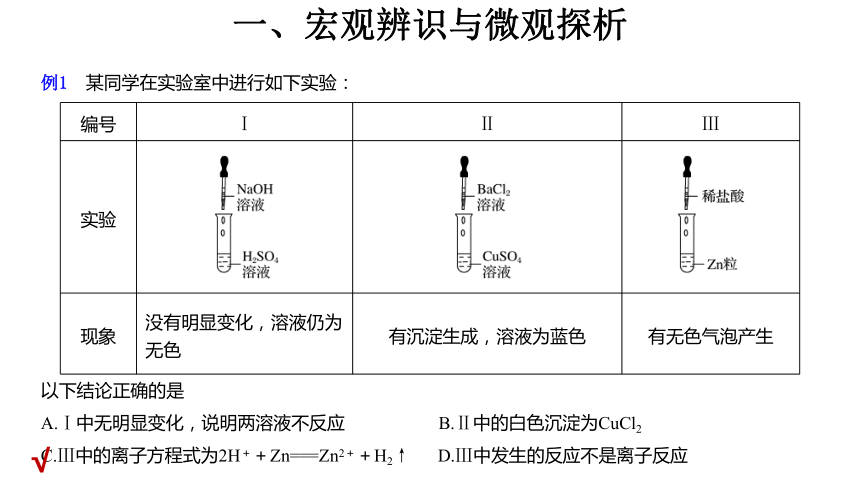
例1 某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有沉淀生成,溶液为蓝色 有无色气泡产生
以下结论正确的是
A.Ⅰ中无明显变化,说明两溶液不反应 B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn===Zn2++H2↑ D.Ⅲ中发生的反应不是离子反应
√
一、宏观辨识与微观探析
解析 硫酸溶液和氢氧化钠溶液反应没有明显现象,A项错误;
氯化钡溶液和硫酸铜溶液反应生成硫酸钡沉淀和氯化铜,故B项错误;
锌和盐酸反应生成氯化锌和氢气,反应的离子方程式为Zn+2H+===Zn2++H2↑,C项正确;
有离子参与反应,是离子反应,D项错误。
一、宏观辨识与微观探析
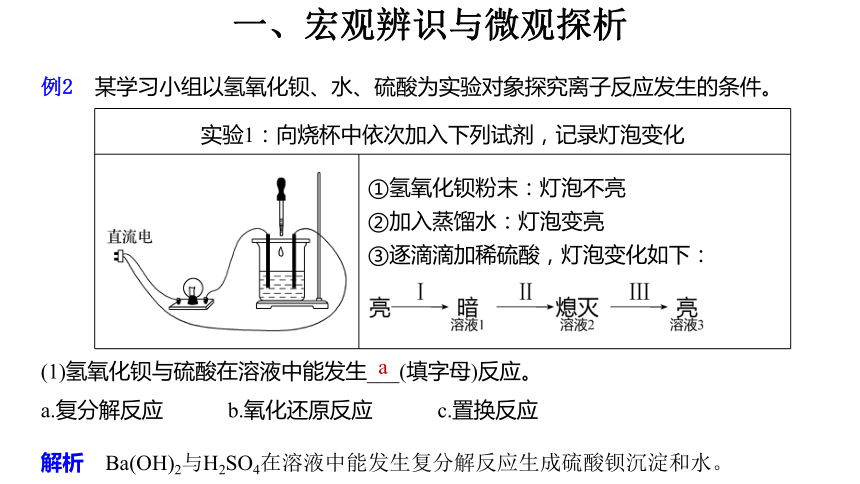
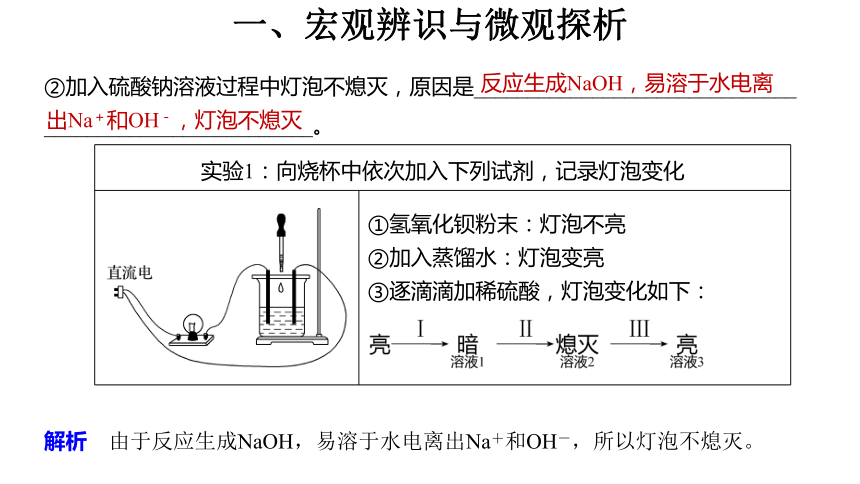
例2 某学习小组以氢氧化钡、水、硫酸为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
(1)氢氧化钡与硫酸在溶液中能发生___(填字母)反应。
a.复分解反应 b.氧化还原反应 c.置换反应
a
解析 Ba(OH)2与H2SO4在溶液中能发生复分解反应生成硫酸钡沉淀和水。
一、宏观辨识与微观探析
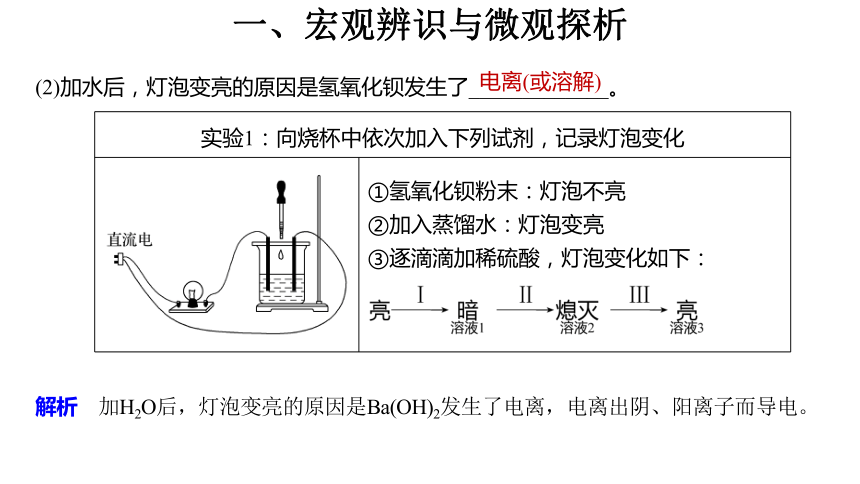
(2)加水后,灯泡变亮的原因是氢氧化钡发生了_____________。
电离(或溶解)
解析 加H2O后,灯泡变亮的原因是Ba(OH)2发生了电离,电离出阴、阳离子而导电。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因______________________________
________________。
BaSO4↓+2H2O
解析 由于Ba(OH)2与H2SO4在溶液中能发生复分解反应生成硫酸钡沉淀和水,离子浓度降低,导电性减弱,反应的离子方程式为Ba2++2OH-+2H++ ===
BaSO4↓+2H2O。
一、宏观辨识与微观探析
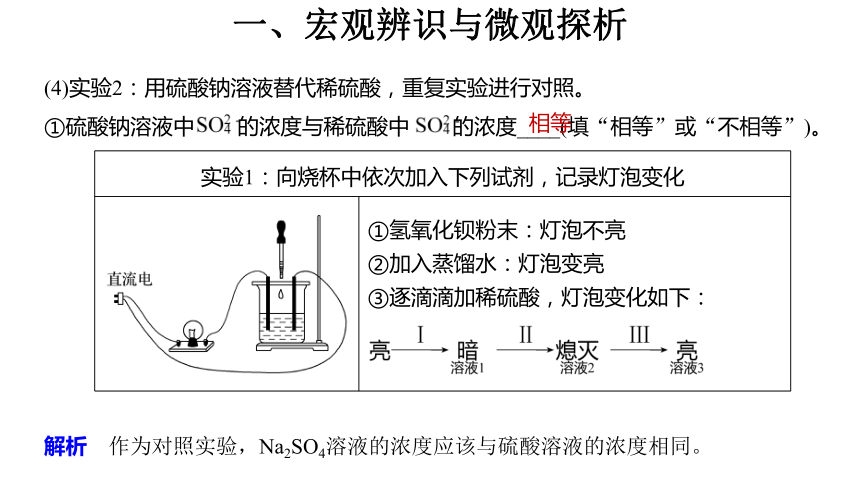
(4)实验2:用硫酸钠溶液替代稀硫酸,重复实验进行对照。
①硫酸钠溶液中 的浓度与稀硫酸中 的浓度____(填“相等”或“不相等”)。
解析 作为对照实验,Na2SO4溶液的浓度应该与硫酸溶液的浓度相同。
相等
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
②加入硫酸钠溶液过程中灯泡不熄灭,原因是______________________________
_________________________。
反应生成NaOH,易溶于水电离
出Na+和OH-,灯泡不熄灭
解析 由于反应生成NaOH,易溶于水电离出Na+和OH-,所以灯泡不熄灭。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
【思维启迪】
“宏观辨识与微观探析”即宏观与微观相结合,能依据感觉到的宏观实验现象(如本题中的灯泡变化),从微观的角度去揭示现象的本质(如本题中发生的离子反应,溶液中离子浓度的变化等)。
一、宏观辨识与微观探析
例3 已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
(1)该反应中,化合价升高的反应物是____,化合价没有发生变化的反应物是______。
解析 将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,说明高锰酸钾能把Cl-氧化为氯气,高锰酸根离子被还原为Mn2+;根据得失电子守恒及原子守恒可得配平后的化学方程式为2KMnO4+10KCl+8H2SO4===2MnSO4+6K2SO4+5Cl2↑+8H2O。由上述可知,该反应中,KCl中氯元素的化合价升高,H2SO4中元素化合价没有发生变化。
KCl
H2SO4
一、宏观辨识与微观探析
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):________________
_________________________________________。
(3)上述反应中,氧化剂是________,在反应中______(填“得到”或“失去”)电子发生______反应。
解析 高锰酸钾中锰元素的化合价由+7价变为+2价,为氧化剂。
2KMnO4+10KCl
+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
KMnO4
得到
还原
一、宏观辨识与微观探析
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。此现象说明NaBiO3具有_________。写出该反应的离子方程式:_____________________________________
___________________。(提示:NaBiO3为黄色或棕色粉末,不溶于冷水,在该反应中转化为Bi3+)
强氧化性
5Bi3++5Na++7H2O
解析 在反应后的溶液中加入NaBiO3,溶液又显紫红色,说明Mn2+又被氧化为 ,说明NaBiO3具有强氧化性,根据得失电子守恒、原子守恒和电荷守恒,得该反应的离子方程式为5NaBiO3+2Mn2++14H+=== +5Bi3++5Na++7H2O。
一、宏观辨识与微观探析
【思维启迪】
一、宏观辨识与微观探析
本章利用电离、离子反应、氧化还原反应等概念对常见的化学反应进行分类和分析说明,特别是化学反应的类别随分类标准的不同而不同,电解质在水溶液中发生电离,离子反应引起溶液中离子浓度的改变,氧化还原反应中元素的化合价发生变化、电子发生转移等,都较好地体现了“变化观念与平衡思想”中“变化观念”的化学核心素养。
二、变化观念与平衡思想
二、变化观念与平衡思想
例4 过氧化氢(H2O2)中氧的化合价为-1价,其水溶液俗称双氧水,它具有氧化性,可用于医疗中的杀菌消毒。结合下列涉及H2O2的A~F反应,回答相关问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(1)上述反应不属于氧化还原反应的是____(填字母,下同)。
A
二、变化观念与平衡思想
解析 反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素化合价均不变,所以是非氧化还原反应,B、C、D、E、F各反应都涉及元素化合价的变化,都是氧化还原反应。
二、变化观念与平衡思想
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(2)H2O2仅体现还原性的反应是___。
解析 B中过氧化氢中的氧元素化合价升高,失电子发生氧化反应,只体现还原性。
B
二、变化观念与平衡思想
解析 C中H2O2中的O元素的化合价既升高又降低,H2O2既体现还原性又体现氧化性。
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(3)H2O2既体现氧化性又体现还原性的反应是____。
C
二、变化观念与平衡思想
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是__________________。
Ag2O>H2O2>K2CrO4
二、变化观念与平衡思想
解析 反应Ag2O+H2O2===2Ag+O2↑+H2O中,氧化银作氧化剂,H2O2作还原剂,则氧化性:Ag2O>H2O2。反应3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O中,H2O2作氧化剂,K2CrO4为氧化产物,则氧化性:H2O2>K2CrO4。故氧化性强弱顺序为Ag2O>H2O2>K2CrO4。
二、变化观念与平衡思想
【思维启迪】
本题以医用杀菌消毒剂过氧化氢(双氧水)的系列反应为载体,考查氧化还原反应的相关概念,并根据氧化还原反应比较物质的氧化性强弱。这类题目的解答方法是从元素的化合价“变化”入手,理清相关概念之间的关系。
二、变化观念与平衡思想
例5 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是______。
解析 由H2O2→O2,可知氧元素的化合价升高,H2O2作还原剂。
H2O2
(2)该反应中,发生还原反应的过程是________→_________。
H2CrO4
Cr(OH)3
解析 所给物质中H2CrO4中铬元素的化合价降低,作氧化剂,发生还原反应,则发生还原反应的过程为H2CrO4―→Cr(OH)3。
二、变化观念与平衡思想
(3)写出该反应的化学方程式,用双线桥法标出电子转移的方向和数目:
__________________________________________。
解析 根据得失电子守恒、原子守恒和质量守恒,可得该反应的化学方程式,并用双线桥法标出电子转移的方向和数目,可表示为:
二、变化观念与平衡思想
(4)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是_____(填字母)。
A.2Fe3++SO2+2H2O===2Fe2++ +4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++2I-===2Fe2++I2
C
二、变化观念与平衡思想
解析 在氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。已知还原性:SO2>I->H2O2>Fe2+>Cl-;A项,若反应2Fe3++SO2+2H2O===2Fe2++ +4H+可以发生,则还原性:SO2>Fe2+,正确;
B项,若反应I2+SO2+2H2O===H2SO4+2HI可以发生,则还原性:SO2>I-,正确;
C项,若反应H2O2+H2SO4===SO2↑+O2↑+2H2O可以发生,则还原性:H2O2>SO2,错误;
D项,若反应2Fe3++2I-===2Fe2++I2可以发生,则还原性:I->Fe2+,正确。
二、变化观念与平衡思想
在研究物质的性质及其变化时,要具有证据意识,即遵循科学依据提出可能的假设,通过实验或分析推理进行验证,建立观点、结论和证据之间的逻辑关系,形成有序的认知方法,建立相应的思维模型并能运用模型解释化学现象,揭示现象的本质和规律。
“证据推理与模型认知”在本章的体现:根据物质类别、元素化合价预测物质的性质,并设计实验进行验证;运用化学流程或实验事实等推断离子或物质;相关知识应用的思维模型,如离子方程式的书写及其正误判断,离子在溶液中能否大量共存,氧化还原反应相关概念的辨析,氧化还原反应方程式的配平等。
三、证据推理与模型认知
例6 下列化学反应的离子方程式正确的是
A.用醋酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B.氧化亚铁与稀盐酸反应:FeO+2H+===Fe3++H2O
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++ ===BaSO4↓+H2O
D.实验室制CO2:CaCO3+2H+===Ca2++H2O+CO2↑
解析 醋酸为弱电解质,不能拆写成离子的形式,A项错误;
稀硫酸与Ba(OH)2溶液反应的离子方程式中的H+、OH-、H2O前面均需要配化学计量数2,C项错误。
√
三、证据推理与模型认知
【思维模型】
书写化学方程式并配平→分析反应物和产物是否易溶于水易电离→易溶于水易电离的物质拆写成离子形式→删去不参加离子反应的离子→比对题给的离子方程式→判断正误。
三、证据推理与模型认知
例7 某溶液的溶质可能由下列离子组成:Cl-、 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤。
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生。
(3)将(1)中沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
依据以上实验可以推断,原溶液中一定含有_________________;一定没有________;可能含有_____。
H+、Ba2+
Cl-
三、证据推理与模型认知
三、证据推理与模型认知
【思维模型】
三、证据推理与模型认知
例8 有一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展如图所示的实验:
已知:①步骤Ⅰ中固体全部溶解,溶液呈蓝色,且无气泡产生。
②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是___________________(填化学式)。
Cu(NO3)2、Na2SO4
三、证据推理与模型认知
(2)原固体中一定不含有的物质是_________(填化学式),原因是_______________
____________________。
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式:_________________________
___________________。
(4)步骤Ⅲ所得蓝色溶液中一定含有的溶质是_______________________________
_________(填化学式)。
NaHCO3
向固体中加入
稀盐酸时无气泡产生
Ag++Cl-===AgCl↓
HNO3、NaNO3、Ba(NO3)2、
Cu(NO3)2
三、证据推理与模型认知
解析 由步骤Ⅰ中得到蓝色溶液和不产生气泡可知,原固体一定含有Cu(NO3)2,一定不含NaHCO3;步骤Ⅱ中加入Ba(NO3)2溶液有白色沉淀生成,说明一定含有Na2SO4;步骤Ⅲ中加入AgNO3溶液有白色沉淀生成,不能说明一定含有NaCl,因步骤Ⅰ中加入了过量稀盐酸,引入了Cl-,故原溶液中一定含有Cu(NO3)2、Na2SO4,一定不含NaHCO3,不能确定是否含有NaCl。步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式为Ba2++ ===BaSO4↓,Ag++Cl-===AgCl↓,由于加入的稀盐酸与Ba(NO3)2溶液均过量,但加入的AgNO3溶液的量不确定,所以步骤Ⅲ得到的蓝色溶液中一定含有HNO3、NaNO3、Ba(NO3)2、Cu(NO3)2。
三、证据推理与模型认知
再 见
第一章 物质及其变化 章末复习
在学习本章知识的过程中,既能从宏观的角度认识物质的元素组成、性质表现及其实际应用;又能从微观的角度了解物质的构成,预测或解释物质的性质及其变化的实质,促进“宏观辨识与微观探析”化学核心素养的发展。
一、宏观辨识与微观探析
知识要点 宏观辨识 微观探析
物质的组成与分类 物质由一种或多种元素组成 构成物质的微粒有分子、原子、离子
胶体的性质不同于其他分散系 胶体与其他分散系的本质区别是分散质粒子大小不同
溶液中的离子反应 酸、碱、盐在水溶液中的性质 酸、碱、盐在水溶液中的电离及存在状态
离子反应发生的条件(宏观现象) 离子浓度发生改变(反应实质)
氧化还原反应 氧化还原反应相关概念的识别与判断 氧化还原反应的特征(化合价变化)与实质(电子转移)
设计实验探究验证物质的氧化性或还原性 由核心元素化合价的升降预测物质的性质
物质性质的应用 实际应用过程中产生的现象和出现的问题 用变化的实质进行分析解释
一、宏观辨识与微观探析
例1 某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化,溶液仍为无色 有沉淀生成,溶液为蓝色 有无色气泡产生
以下结论正确的是
A.Ⅰ中无明显变化,说明两溶液不反应 B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn===Zn2++H2↑ D.Ⅲ中发生的反应不是离子反应
√
一、宏观辨识与微观探析
解析 硫酸溶液和氢氧化钠溶液反应没有明显现象,A项错误;
氯化钡溶液和硫酸铜溶液反应生成硫酸钡沉淀和氯化铜,故B项错误;
锌和盐酸反应生成氯化锌和氢气,反应的离子方程式为Zn+2H+===Zn2++H2↑,C项正确;
有离子参与反应,是离子反应,D项错误。
一、宏观辨识与微观探析
例2 某学习小组以氢氧化钡、水、硫酸为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
(1)氢氧化钡与硫酸在溶液中能发生___(填字母)反应。
a.复分解反应 b.氧化还原反应 c.置换反应
a
解析 Ba(OH)2与H2SO4在溶液中能发生复分解反应生成硫酸钡沉淀和水。
一、宏观辨识与微观探析
(2)加水后,灯泡变亮的原因是氢氧化钡发生了_____________。
电离(或溶解)
解析 加H2O后,灯泡变亮的原因是Ba(OH)2发生了电离,电离出阴、阳离子而导电。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因______________________________
________________。
BaSO4↓+2H2O
解析 由于Ba(OH)2与H2SO4在溶液中能发生复分解反应生成硫酸钡沉淀和水,离子浓度降低,导电性减弱,反应的离子方程式为Ba2++2OH-+2H++ ===
BaSO4↓+2H2O。
一、宏观辨识与微观探析
(4)实验2:用硫酸钠溶液替代稀硫酸,重复实验进行对照。
①硫酸钠溶液中 的浓度与稀硫酸中 的浓度____(填“相等”或“不相等”)。
解析 作为对照实验,Na2SO4溶液的浓度应该与硫酸溶液的浓度相同。
相等
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
②加入硫酸钠溶液过程中灯泡不熄灭,原因是______________________________
_________________________。
反应生成NaOH,易溶于水电离
出Na+和OH-,灯泡不熄灭
解析 由于反应生成NaOH,易溶于水电离出Na+和OH-,所以灯泡不熄灭。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 ①氢氧化钡粉末:灯泡不亮
②加入蒸馏水:灯泡变亮
③逐滴滴加稀硫酸,灯泡变化如下:
一、宏观辨识与微观探析
【思维启迪】
“宏观辨识与微观探析”即宏观与微观相结合,能依据感觉到的宏观实验现象(如本题中的灯泡变化),从微观的角度去揭示现象的本质(如本题中发生的离子反应,溶液中离子浓度的变化等)。
一、宏观辨识与微观探析
例3 已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
(1)该反应中,化合价升高的反应物是____,化合价没有发生变化的反应物是______。
解析 将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,说明高锰酸钾能把Cl-氧化为氯气,高锰酸根离子被还原为Mn2+;根据得失电子守恒及原子守恒可得配平后的化学方程式为2KMnO4+10KCl+8H2SO4===2MnSO4+6K2SO4+5Cl2↑+8H2O。由上述可知,该反应中,KCl中氯元素的化合价升高,H2SO4中元素化合价没有发生变化。
KCl
H2SO4
一、宏观辨识与微观探析
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):________________
_________________________________________。
(3)上述反应中,氧化剂是________,在反应中______(填“得到”或“失去”)电子发生______反应。
解析 高锰酸钾中锰元素的化合价由+7价变为+2价,为氧化剂。
2KMnO4+10KCl
+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
KMnO4
得到
还原
一、宏观辨识与微观探析
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。此现象说明NaBiO3具有_________。写出该反应的离子方程式:_____________________________________
___________________。(提示:NaBiO3为黄色或棕色粉末,不溶于冷水,在该反应中转化为Bi3+)
强氧化性
5Bi3++5Na++7H2O
解析 在反应后的溶液中加入NaBiO3,溶液又显紫红色,说明Mn2+又被氧化为 ,说明NaBiO3具有强氧化性,根据得失电子守恒、原子守恒和电荷守恒,得该反应的离子方程式为5NaBiO3+2Mn2++14H+=== +5Bi3++5Na++7H2O。
一、宏观辨识与微观探析
【思维启迪】
一、宏观辨识与微观探析
本章利用电离、离子反应、氧化还原反应等概念对常见的化学反应进行分类和分析说明,特别是化学反应的类别随分类标准的不同而不同,电解质在水溶液中发生电离,离子反应引起溶液中离子浓度的改变,氧化还原反应中元素的化合价发生变化、电子发生转移等,都较好地体现了“变化观念与平衡思想”中“变化观念”的化学核心素养。
二、变化观念与平衡思想
二、变化观念与平衡思想
例4 过氧化氢(H2O2)中氧的化合价为-1价,其水溶液俗称双氧水,它具有氧化性,可用于医疗中的杀菌消毒。结合下列涉及H2O2的A~F反应,回答相关问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(1)上述反应不属于氧化还原反应的是____(填字母,下同)。
A
二、变化观念与平衡思想
解析 反应前后各元素化合价不变的化学反应是非氧化还原反应,A中各元素化合价均不变,所以是非氧化还原反应,B、C、D、E、F各反应都涉及元素化合价的变化,都是氧化还原反应。
二、变化观念与平衡思想
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(2)H2O2仅体现还原性的反应是___。
解析 B中过氧化氢中的氧元素化合价升高,失电子发生氧化反应,只体现还原性。
B
二、变化观念与平衡思想
解析 C中H2O2中的O元素的化合价既升高又降低,H2O2既体现还原性又体现氧化性。
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(3)H2O2既体现氧化性又体现还原性的反应是____。
C
二、变化观念与平衡思想
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4===MnO2+H2SO4
F.H2O2+2Fe2++2H+===2Fe3++2H2O
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是__________________。
Ag2O>H2O2>K2CrO4
二、变化观念与平衡思想
解析 反应Ag2O+H2O2===2Ag+O2↑+H2O中,氧化银作氧化剂,H2O2作还原剂,则氧化性:Ag2O>H2O2。反应3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O中,H2O2作氧化剂,K2CrO4为氧化产物,则氧化性:H2O2>K2CrO4。故氧化性强弱顺序为Ag2O>H2O2>K2CrO4。
二、变化观念与平衡思想
【思维启迪】
本题以医用杀菌消毒剂过氧化氢(双氧水)的系列反应为载体,考查氧化还原反应的相关概念,并根据氧化还原反应比较物质的氧化性强弱。这类题目的解答方法是从元素的化合价“变化”入手,理清相关概念之间的关系。
二、变化观念与平衡思想
例5 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是______。
解析 由H2O2→O2,可知氧元素的化合价升高,H2O2作还原剂。
H2O2
(2)该反应中,发生还原反应的过程是________→_________。
H2CrO4
Cr(OH)3
解析 所给物质中H2CrO4中铬元素的化合价降低,作氧化剂,发生还原反应,则发生还原反应的过程为H2CrO4―→Cr(OH)3。
二、变化观念与平衡思想
(3)写出该反应的化学方程式,用双线桥法标出电子转移的方向和数目:
__________________________________________。
解析 根据得失电子守恒、原子守恒和质量守恒,可得该反应的化学方程式,并用双线桥法标出电子转移的方向和数目,可表示为:
二、变化观念与平衡思想
(4)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是_____(填字母)。
A.2Fe3++SO2+2H2O===2Fe2++ +4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++2I-===2Fe2++I2
C
二、变化观念与平衡思想
解析 在氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。已知还原性:SO2>I->H2O2>Fe2+>Cl-;A项,若反应2Fe3++SO2+2H2O===2Fe2++ +4H+可以发生,则还原性:SO2>Fe2+,正确;
B项,若反应I2+SO2+2H2O===H2SO4+2HI可以发生,则还原性:SO2>I-,正确;
C项,若反应H2O2+H2SO4===SO2↑+O2↑+2H2O可以发生,则还原性:H2O2>SO2,错误;
D项,若反应2Fe3++2I-===2Fe2++I2可以发生,则还原性:I->Fe2+,正确。
二、变化观念与平衡思想
在研究物质的性质及其变化时,要具有证据意识,即遵循科学依据提出可能的假设,通过实验或分析推理进行验证,建立观点、结论和证据之间的逻辑关系,形成有序的认知方法,建立相应的思维模型并能运用模型解释化学现象,揭示现象的本质和规律。
“证据推理与模型认知”在本章的体现:根据物质类别、元素化合价预测物质的性质,并设计实验进行验证;运用化学流程或实验事实等推断离子或物质;相关知识应用的思维模型,如离子方程式的书写及其正误判断,离子在溶液中能否大量共存,氧化还原反应相关概念的辨析,氧化还原反应方程式的配平等。
三、证据推理与模型认知
例6 下列化学反应的离子方程式正确的是
A.用醋酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B.氧化亚铁与稀盐酸反应:FeO+2H+===Fe3++H2O
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++ ===BaSO4↓+H2O
D.实验室制CO2:CaCO3+2H+===Ca2++H2O+CO2↑
解析 醋酸为弱电解质,不能拆写成离子的形式,A项错误;
稀硫酸与Ba(OH)2溶液反应的离子方程式中的H+、OH-、H2O前面均需要配化学计量数2,C项错误。
√
三、证据推理与模型认知
【思维模型】
书写化学方程式并配平→分析反应物和产物是否易溶于水易电离→易溶于水易电离的物质拆写成离子形式→删去不参加离子反应的离子→比对题给的离子方程式→判断正误。
三、证据推理与模型认知
例7 某溶液的溶质可能由下列离子组成:Cl-、 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤。
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生。
(3)将(1)中沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
依据以上实验可以推断,原溶液中一定含有_________________;一定没有________;可能含有_____。
H+、Ba2+
Cl-
三、证据推理与模型认知
三、证据推理与模型认知
【思维模型】
三、证据推理与模型认知
例8 有一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展如图所示的实验:
已知:①步骤Ⅰ中固体全部溶解,溶液呈蓝色,且无气泡产生。
②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是___________________(填化学式)。
Cu(NO3)2、Na2SO4
三、证据推理与模型认知
(2)原固体中一定不含有的物质是_________(填化学式),原因是_______________
____________________。
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式:_________________________
___________________。
(4)步骤Ⅲ所得蓝色溶液中一定含有的溶质是_______________________________
_________(填化学式)。
NaHCO3
向固体中加入
稀盐酸时无气泡产生
Ag++Cl-===AgCl↓
HNO3、NaNO3、Ba(NO3)2、
Cu(NO3)2
三、证据推理与模型认知
解析 由步骤Ⅰ中得到蓝色溶液和不产生气泡可知,原固体一定含有Cu(NO3)2,一定不含NaHCO3;步骤Ⅱ中加入Ba(NO3)2溶液有白色沉淀生成,说明一定含有Na2SO4;步骤Ⅲ中加入AgNO3溶液有白色沉淀生成,不能说明一定含有NaCl,因步骤Ⅰ中加入了过量稀盐酸,引入了Cl-,故原溶液中一定含有Cu(NO3)2、Na2SO4,一定不含NaHCO3,不能确定是否含有NaCl。步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式为Ba2++ ===BaSO4↓,Ag++Cl-===AgCl↓,由于加入的稀盐酸与Ba(NO3)2溶液均过量,但加入的AgNO3溶液的量不确定,所以步骤Ⅲ得到的蓝色溶液中一定含有HNO3、NaNO3、Ba(NO3)2、Cu(NO3)2。
三、证据推理与模型认知
再 见
