第1节 原子结构 第1课时 优秀课件(共36张PPT)
文档属性
| 名称 | 第1节 原子结构 第1课时 优秀课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:37:21 | ||
图片预览










文档简介
(共36张PPT)
第1课时 原子结构
第一章 原子结构与性质 第一节 原子结构
温故知新
温故知新
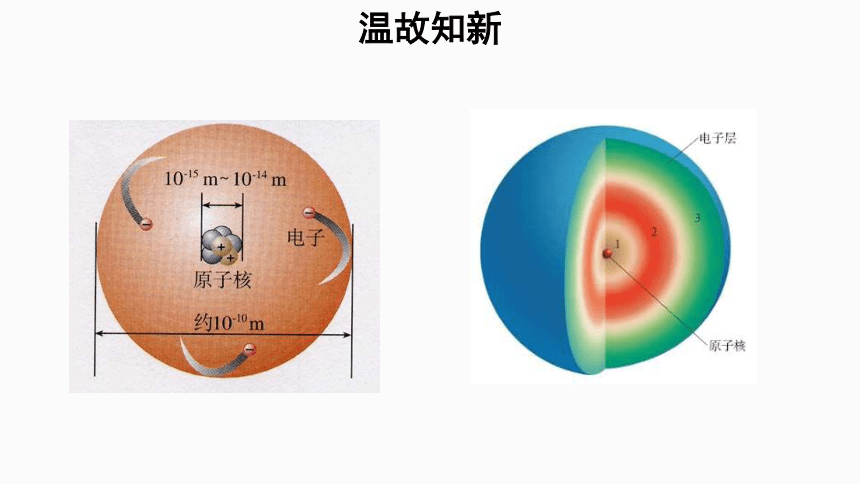
在之前的学习中,我们已经了解了原子的结构:
原子是由原子核和核外电子组成的;
原子核是由带单位正电荷的质子和电中性的中子组成的;
核外电子围绕原子核分层排布;
温故知新
在之前的学习中,我们已经了解了原子的结构:
在多个电子的原子中,电子分别在能量不同的区域运动,分别用K、L、M、N……来表示从内到外的电子层。
原子最外层最多有8个电子(K层最多为2个电子)
那你是否好奇过:
核外电子的围绕着原子核在做怎样的运动?
它们的运动有规律性么?
电子这么小,肉眼无法直接看到,人们是怎样研究它的运动规律的?
【思维启迪】
温故知新
那你是否好奇过:
同一个电子层上有多个电子,它们在空间的分布有特征么?
如何刻画这种特征?
为何原子最外层最多有8个电子,比如第三层最多可以容纳2×32=18个电子,但是钾的M层填8了个电子后,下个电子填入了N层?
【思维启迪】
温故知新
不可再分
实心小球
不可再分
实心小球
各种各样
电子
实心小球
质子
原子核
预言中子
电子
轨道
能量
人类对于原子结构的探索,对于微观粒子的运动规律进行了长期的思考与探索
温故知新
【科学史话】
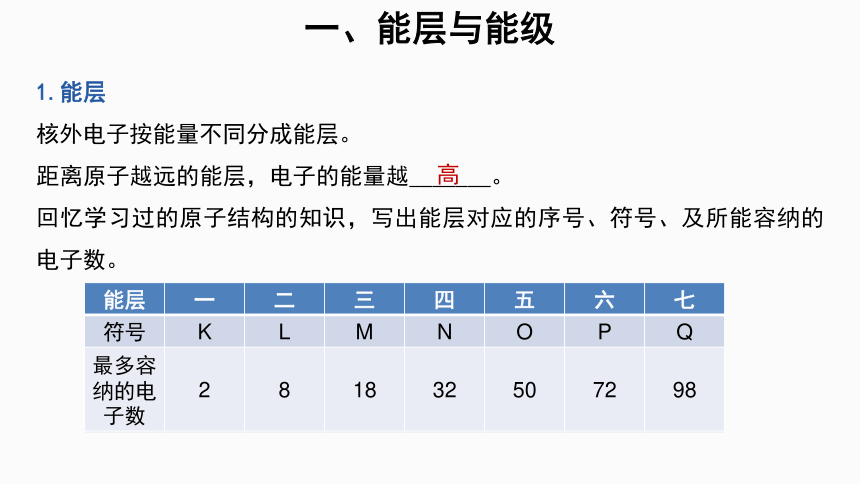
1.能层
核外电子按能量不同分成能层。
距离原子越远的能层,电子的能量越_______。
回忆学习过的原子结构的知识,写出能层对应的序号、符号、及所能容纳的电子数。
一、能层与能级
能层 一 二 三 四 五 六 七
符号
最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多容纳的电子数 2 8 18 32 50 72 98
高
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(1)同一能层中的不同能级,如何用符号进行区分表示?它们的能量关系如何?
(2)一个能层的能级数与能层序数间存在什么关系?一个能层最多可容纳的电子数与能层序数间存在什么关系?你能否推导容纳电子数与能级序数之间的关系?
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(3)以s、p、d、f 为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
(4)第五层最多可容纳多少个电子?它们分别容纳在几个能级中,各能级最多容纳多少个电子?(只要求到f 能级)
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(1)同一能层中的不同能级,如何用符号进行区分表示?它们的能量关系如何?
同一能层的不同能级用符号s、p、d、f 表示,字母前加上对应能层数的阿拉伯数字,如1s、2s等。
能量关系满足E(ns) < E(np) < E(nd) < E(nf)
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(2)一个能层的能级数与能层序数间存在什么关系?一个能层最多可容纳的电子数与能层序数间存在什么关系?你能否推导容纳电子数与能级序数之间的关系?
能层数 = 该能层序数(n)
一个能层最多可容纳的电子数 = 2n2
推导可能用到的求和公式:1+3+5+…………+(2n-1) = n2
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(3)以s、p、d、f 为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
以s、p、d、f 为符号的能级分别最多可容纳2、6、10、14个电子
3d、4d、5d能级所容纳的最多电子数相同?
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(4)第五层最多可容纳多少个电子?它们分别容纳在几个能级中,各能级最多容纳多少个电子?(只要求到f 能级)
第5层最多可容纳50个电子。它们分别容纳在5个能级中。
5s、5p、5d、5f 最多可容纳2、6、10、14个电子
二、基态与激发态 原子光谱
发光现象与原子结构有密切的关系,二者有怎么样密切的联系呢?
二、基态与激发态 原子光谱
1.基态与激发态
基态原子是__________________的原子。
基态原子___________,电子跃迁到较高能级,变为激发态原子。
电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量。
光是电子跃迁释放能量的重要形式。
处于最低能量状态
吸收能量
二、基态与激发态 原子光谱
2.原子光谱
连续光谱
线状光谱(原子光谱)
电子从激发态跃迁到基态,以光的形式释放能量并被记录下来,就形成了发射光谱。
电子从基态跃迁到激发态,以光的形式吸收能量并被记录下来,就形成了吸收光谱。
他们总称为原子光谱。
二、基态与激发态 原子光谱
2.原子光谱
氢原子光谱测定示意图
二、基态与激发态 原子光谱
3.电子跃迁过程与光谱形成
电子在不同的轨道之间跃迁时会吸收或放出相应的能量(若以光的形式,则对应不同颜色的光)
E
吸收光谱
发射光谱
【深度思考】
三、构造原理与电子排布式
Fe的吸收光谱
Fe的发射光谱
(1)下图是Fe的吸收光谱和发射光谱
对比二者,它们之间有何联系?
【深度思考】
三、构造原理与电子排布式
发射光谱是线状谱,由暗背景和不连续的彩色亮线(某些波长的光被释放)组成;
吸收光谱是线状谱和连续彩色谱叠加,由彩色亮背景(来自于光源)和不连续的暗线(光源中某些波长的光被吸收)组成;
发射光谱中的彩色亮线与吸收光谱中的暗线恰好处于完全相同的位置。
电子在两个能级之间的跃迁往返时,经历了两个恰好相反的过程,过程中也就必然吸收或放出同样多的能量,对应的光的波长相同。故在吸收光谱和发射光谱相同位置一定出现线状谱。
【深度思考】
三、构造原理与电子排布式
(2)下图是Li、He、Hg的吸收光谱和发射光谱
通过对比,你能得出什么结论?这样的结论可以进一步推广么?
【深度思考】
三、构造原理与电子排布式
①这些元素的发射光谱和吸收光谱与Fe一样,也呈现了“互补关系”,
进而我们可以大胆推测,所有元素的发射谱和吸收谱之间都呈现这种关系
②三种元素,加上之前的Fe,他们的线状谱出现的位置、数量完全不同。进而我们可以大胆推测,所有元素的发射谱和吸收谱都有自己的特征位置、数量。
不同的原子具有不同的结构,能级各不相同,因此电子跃迁时发射或吸收光的频率(与波长成反比)也必定不同,故每种元素在光谱中都会形成“特征谱线”。
【深度思考】
三、构造原理与电子排布式
(3)不同元素发射光谱和吸收光谱的不同,能怎样利用这种特性呢?
①鉴定元素:在一个未知体系中,我们可以得到它的光谱,通过跟单种元素的比对,就能确定是否存在某种元素。例如人类通过测定太阳光谱,就得知了太阳大气中含He、Na等
②制作霓虹灯:霓虹灯灯管中装载的气体不同,在高压电的激发下发出的光的颜色就不同。如Ne的电子吸收能量跃迁后,很快又会放出能量会到较低能级,所发出的光的波长恰好位于可见光区域中的红色波段,所以我们看到红光。
三、构造原理与电子排布式
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
三、构造原理与电子排布式
2.电子排布式
依照构造原理,写出3、5、10、13、18号元素基态原子的电子排布式,与书后周期表所给排布对照。
原子序数 元素符号 排布式
3 Li
5 B
10 Ne
13 Al
18 Ar
1s22s1
1s22s22p1
1s22s22p6
1s22s22p63s23p1
1s22s22p63s23p6
三、构造原理与电子排布式
2.电子排布式
依照构造原理,写出19、20、21、24、29号元素基态原子的电子排布式, 与书后周期表所给排布对照。
原子序数 元素符号 排布式
19 K 1s22s22p63s23p64s1
20 Ca 1s22s22p63s23p64s2
21 Sc 1s22s22p63s23p63d14s2
24 Cr 1s22s22p63s23p63d54s1
29 Cu 1s22s22p63s23p63d104s1
三、构造原理与电子排布式
“三步法”书写电子排布式
书写电子排布式的方法
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。如S的电子排布式是1s22s22p63s23p6
第二步:根据各能级容纳的电子数填充电子
第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s......
(1)为什么K的电子排布式是1s22s22p63s23p64s1而非1s22s22p63s23p63d1
【深度思考】
三、构造原理与电子排布式
按照构造原理,电子是按照3p→4s→3d的的顺序填充的,先填4s而非3d
能级交错:相邻能层的部分能级的能量顺序发生了颠倒,即Ens < E(n-1)d < Enp
(2)随着核电荷数的增加,基态原子的电子排布式越来越长,书写繁琐,
如何精简表达?
【深度思考】
三、构造原理与电子排布式
例:
Al的电子排布式为1s22s22p63s23p1,红色部分我们可用[Ne]表示,因此Al的电子排布就可以简化为[Ne] 3s23p1
V的电子排布式为1s22s22p63s23p63d34s2 ,红色部分我们可用[Ar]表示,因此V的电子排布就可以简化为[Ar] 3d34s2
(3)利用构造原理证明原子最外层不超过8电子
【深度思考】
三、构造原理与电子排布式
当最外层是8电子时,此时已是ns2np6的排布。此时再增加一个电子,若电子排入(n-1)d能级,最外层电子数不变;若无(n-1)d能级,则电子填入(n+1)s能级,此时最外层变为1个电子,原先的最外层变为次外层。
综上,原子的最外层不超过8电子。
(4)为什么Cr的电子排布式是1s22s22p63s23p63d54s1而非1s22s22p63s23p63d44s2
【深度思考】
三、构造原理与电子排布式
这样的排布源于光谱学事实,并不符合构造原理。这也说明构造原理是被理想化的模型。在更长周期的过渡元素中,仍有若干不满足构造原理的例子。
构造原理虽有特例,但运用构造原理仍能得到大量的符合光谱学事实的电子排布,对了解核外电子排布规律仍有重要意义。
Cu和Cr的这种排布恰好使得3d轨道恰好“半满”、“全满”,这是未来学习的洪特规则的特例。
为什么Cu的电子排布式是1s22s22p63s23p63d104s1而非1s22s22p63s23p63d94s2
课堂小结
1.多电子原子中:
E(K) < E(L) < E(M) < E(N) < E(O) < E(P) < E(Q)
E(ns) < E(np) < E(nd) < E(nf)
能层数 = 该能层序数(n)
一个能层最多可容纳的电子数 = 2n2
2.电子在高低能级之间跃迁时会吸收或放出能量,能量以光的形式被记录下来形成原子光谱。
3.构造原理:电子在填充时并非依次先填满每个能层,而是按照构造原理进行填充。相邻能层的部分能级的能量顺序发生了颠倒,如4s < 3d。
(1)原子光谱呈线性反映了核外电子是分层分级排布的( )
(2)电子先填入靠近原子核的能层,后填入远离原子核的能层( )
(3)依据不同元素的原子光谱可以用来鉴别未知元素的种类( )
(4)构造原理能准确的预言人类发现、创造的新元素的电子排布( )
(5)字母代号相同的能级,如4f、5f、6f 它们最大可容纳电子数一定相同( )
【判断正误】
√
×
×
√
课堂练习
√
解析 霓虹灯的颜色主要是由于电子跃迁产生的。B中,氩原子中电子跃迁时只能吸收特定能量的光,而无法吸收除蓝紫色以外的光,这点从原子的吸收光谱也是线状光谱可知。
1. 对充有氩气的霓虹灯管通电,灯管发出蓝紫色光。产生这一现象的主要原因
是( )
A. 电子由能量较高的轨道向能量较低的轨道跃迁时以光的形式辐射能量
B. 电子由能量较低的轨道向能量较高的轨道跃迁时吸收除蓝紫色光以外的光
C. 氩原子获得电子后转变成发出蓝紫色光的物质
D. 在电流的作用下,氩原子与构成灯管的物质发生反应
课堂练习
A
解析 对原子而言,核电荷数=核外电子数,阳离子是失去电子形成的,阴离子是得到电子形成的。四种离子的电子层结构相同,则满足的关系定量表达为a-m = b-n = c+n = d+m。移项后可知D正确。
2. X、Y、Z、R分别代表四种元素,如果aXm+、bYn+、CZn-、dRm-四种离子的电子层结构相同,则下列关系式正确的是( )
A. a - c = m - n
B. a - b = n - m
C. c - d = m + n
D. b - d = n + m
课堂练习
D
第1课时 原子结构
第一章 原子结构与性质 第一节 原子结构
温故知新
温故知新
在之前的学习中,我们已经了解了原子的结构:
原子是由原子核和核外电子组成的;
原子核是由带单位正电荷的质子和电中性的中子组成的;
核外电子围绕原子核分层排布;
温故知新
在之前的学习中,我们已经了解了原子的结构:
在多个电子的原子中,电子分别在能量不同的区域运动,分别用K、L、M、N……来表示从内到外的电子层。
原子最外层最多有8个电子(K层最多为2个电子)
那你是否好奇过:
核外电子的围绕着原子核在做怎样的运动?
它们的运动有规律性么?
电子这么小,肉眼无法直接看到,人们是怎样研究它的运动规律的?
【思维启迪】
温故知新
那你是否好奇过:
同一个电子层上有多个电子,它们在空间的分布有特征么?
如何刻画这种特征?
为何原子最外层最多有8个电子,比如第三层最多可以容纳2×32=18个电子,但是钾的M层填8了个电子后,下个电子填入了N层?
【思维启迪】
温故知新
不可再分
实心小球
不可再分
实心小球
各种各样
电子
实心小球
质子
原子核
预言中子
电子
轨道
能量
人类对于原子结构的探索,对于微观粒子的运动规律进行了长期的思考与探索
温故知新
【科学史话】
1.能层
核外电子按能量不同分成能层。
距离原子越远的能层,电子的能量越_______。
回忆学习过的原子结构的知识,写出能层对应的序号、符号、及所能容纳的电子数。
一、能层与能级
能层 一 二 三 四 五 六 七
符号
最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多容纳的电子数 2 8 18 32 50 72 98
高
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(1)同一能层中的不同能级,如何用符号进行区分表示?它们的能量关系如何?
(2)一个能层的能级数与能层序数间存在什么关系?一个能层最多可容纳的电子数与能层序数间存在什么关系?你能否推导容纳电子数与能级序数之间的关系?
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(3)以s、p、d、f 为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
(4)第五层最多可容纳多少个电子?它们分别容纳在几个能级中,各能级最多容纳多少个电子?(只要求到f 能级)
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(1)同一能层中的不同能级,如何用符号进行区分表示?它们的能量关系如何?
同一能层的不同能级用符号s、p、d、f 表示,字母前加上对应能层数的阿拉伯数字,如1s、2s等。
能量关系满足E(ns) < E(np) < E(nd) < E(nf)
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(2)一个能层的能级数与能层序数间存在什么关系?一个能层最多可容纳的电子数与能层序数间存在什么关系?你能否推导容纳电子数与能级序数之间的关系?
能层数 = 该能层序数(n)
一个能层最多可容纳的电子数 = 2n2
推导可能用到的求和公式:1+3+5+…………+(2n-1) = n2
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(3)以s、p、d、f 为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
以s、p、d、f 为符号的能级分别最多可容纳2、6、10、14个电子
3d、4d、5d能级所容纳的最多电子数相同?
2.能级
阅读书中第6页至第7页关于能级的内容,回答下列问题
一、能层与能级
(4)第五层最多可容纳多少个电子?它们分别容纳在几个能级中,各能级最多容纳多少个电子?(只要求到f 能级)
第5层最多可容纳50个电子。它们分别容纳在5个能级中。
5s、5p、5d、5f 最多可容纳2、6、10、14个电子
二、基态与激发态 原子光谱
发光现象与原子结构有密切的关系,二者有怎么样密切的联系呢?
二、基态与激发态 原子光谱
1.基态与激发态
基态原子是__________________的原子。
基态原子___________,电子跃迁到较高能级,变为激发态原子。
电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将释放能量。
光是电子跃迁释放能量的重要形式。
处于最低能量状态
吸收能量
二、基态与激发态 原子光谱
2.原子光谱
连续光谱
线状光谱(原子光谱)
电子从激发态跃迁到基态,以光的形式释放能量并被记录下来,就形成了发射光谱。
电子从基态跃迁到激发态,以光的形式吸收能量并被记录下来,就形成了吸收光谱。
他们总称为原子光谱。
二、基态与激发态 原子光谱
2.原子光谱
氢原子光谱测定示意图
二、基态与激发态 原子光谱
3.电子跃迁过程与光谱形成
电子在不同的轨道之间跃迁时会吸收或放出相应的能量(若以光的形式,则对应不同颜色的光)
E
吸收光谱
发射光谱
【深度思考】
三、构造原理与电子排布式
Fe的吸收光谱
Fe的发射光谱
(1)下图是Fe的吸收光谱和发射光谱
对比二者,它们之间有何联系?
【深度思考】
三、构造原理与电子排布式
发射光谱是线状谱,由暗背景和不连续的彩色亮线(某些波长的光被释放)组成;
吸收光谱是线状谱和连续彩色谱叠加,由彩色亮背景(来自于光源)和不连续的暗线(光源中某些波长的光被吸收)组成;
发射光谱中的彩色亮线与吸收光谱中的暗线恰好处于完全相同的位置。
电子在两个能级之间的跃迁往返时,经历了两个恰好相反的过程,过程中也就必然吸收或放出同样多的能量,对应的光的波长相同。故在吸收光谱和发射光谱相同位置一定出现线状谱。
【深度思考】
三、构造原理与电子排布式
(2)下图是Li、He、Hg的吸收光谱和发射光谱
通过对比,你能得出什么结论?这样的结论可以进一步推广么?
【深度思考】
三、构造原理与电子排布式
①这些元素的发射光谱和吸收光谱与Fe一样,也呈现了“互补关系”,
进而我们可以大胆推测,所有元素的发射谱和吸收谱之间都呈现这种关系
②三种元素,加上之前的Fe,他们的线状谱出现的位置、数量完全不同。进而我们可以大胆推测,所有元素的发射谱和吸收谱都有自己的特征位置、数量。
不同的原子具有不同的结构,能级各不相同,因此电子跃迁时发射或吸收光的频率(与波长成反比)也必定不同,故每种元素在光谱中都会形成“特征谱线”。
【深度思考】
三、构造原理与电子排布式
(3)不同元素发射光谱和吸收光谱的不同,能怎样利用这种特性呢?
①鉴定元素:在一个未知体系中,我们可以得到它的光谱,通过跟单种元素的比对,就能确定是否存在某种元素。例如人类通过测定太阳光谱,就得知了太阳大气中含He、Na等
②制作霓虹灯:霓虹灯灯管中装载的气体不同,在高压电的激发下发出的光的颜色就不同。如Ne的电子吸收能量跃迁后,很快又会放出能量会到较低能级,所发出的光的波长恰好位于可见光区域中的红色波段,所以我们看到红光。
三、构造原理与电子排布式
1.构造原理
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
三、构造原理与电子排布式
2.电子排布式
依照构造原理,写出3、5、10、13、18号元素基态原子的电子排布式,与书后周期表所给排布对照。
原子序数 元素符号 排布式
3 Li
5 B
10 Ne
13 Al
18 Ar
1s22s1
1s22s22p1
1s22s22p6
1s22s22p63s23p1
1s22s22p63s23p6
三、构造原理与电子排布式
2.电子排布式
依照构造原理,写出19、20、21、24、29号元素基态原子的电子排布式, 与书后周期表所给排布对照。
原子序数 元素符号 排布式
19 K 1s22s22p63s23p64s1
20 Ca 1s22s22p63s23p64s2
21 Sc 1s22s22p63s23p63d14s2
24 Cr 1s22s22p63s23p63d54s1
29 Cu 1s22s22p63s23p63d104s1
三、构造原理与电子排布式
“三步法”书写电子排布式
书写电子排布式的方法
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。如S的电子排布式是1s22s22p63s23p6
第二步:根据各能级容纳的电子数填充电子
第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s......
(1)为什么K的电子排布式是1s22s22p63s23p64s1而非1s22s22p63s23p63d1
【深度思考】
三、构造原理与电子排布式
按照构造原理,电子是按照3p→4s→3d的的顺序填充的,先填4s而非3d
能级交错:相邻能层的部分能级的能量顺序发生了颠倒,即Ens < E(n-1)d < Enp
(2)随着核电荷数的增加,基态原子的电子排布式越来越长,书写繁琐,
如何精简表达?
【深度思考】
三、构造原理与电子排布式
例:
Al的电子排布式为1s22s22p63s23p1,红色部分我们可用[Ne]表示,因此Al的电子排布就可以简化为[Ne] 3s23p1
V的电子排布式为1s22s22p63s23p63d34s2 ,红色部分我们可用[Ar]表示,因此V的电子排布就可以简化为[Ar] 3d34s2
(3)利用构造原理证明原子最外层不超过8电子
【深度思考】
三、构造原理与电子排布式
当最外层是8电子时,此时已是ns2np6的排布。此时再增加一个电子,若电子排入(n-1)d能级,最外层电子数不变;若无(n-1)d能级,则电子填入(n+1)s能级,此时最外层变为1个电子,原先的最外层变为次外层。
综上,原子的最外层不超过8电子。
(4)为什么Cr的电子排布式是1s22s22p63s23p63d54s1而非1s22s22p63s23p63d44s2
【深度思考】
三、构造原理与电子排布式
这样的排布源于光谱学事实,并不符合构造原理。这也说明构造原理是被理想化的模型。在更长周期的过渡元素中,仍有若干不满足构造原理的例子。
构造原理虽有特例,但运用构造原理仍能得到大量的符合光谱学事实的电子排布,对了解核外电子排布规律仍有重要意义。
Cu和Cr的这种排布恰好使得3d轨道恰好“半满”、“全满”,这是未来学习的洪特规则的特例。
为什么Cu的电子排布式是1s22s22p63s23p63d104s1而非1s22s22p63s23p63d94s2
课堂小结
1.多电子原子中:
E(K) < E(L) < E(M) < E(N) < E(O) < E(P) < E(Q)
E(ns) < E(np) < E(nd) < E(nf)
能层数 = 该能层序数(n)
一个能层最多可容纳的电子数 = 2n2
2.电子在高低能级之间跃迁时会吸收或放出能量,能量以光的形式被记录下来形成原子光谱。
3.构造原理:电子在填充时并非依次先填满每个能层,而是按照构造原理进行填充。相邻能层的部分能级的能量顺序发生了颠倒,如4s < 3d。
(1)原子光谱呈线性反映了核外电子是分层分级排布的( )
(2)电子先填入靠近原子核的能层,后填入远离原子核的能层( )
(3)依据不同元素的原子光谱可以用来鉴别未知元素的种类( )
(4)构造原理能准确的预言人类发现、创造的新元素的电子排布( )
(5)字母代号相同的能级,如4f、5f、6f 它们最大可容纳电子数一定相同( )
【判断正误】
√
×
×
√
课堂练习
√
解析 霓虹灯的颜色主要是由于电子跃迁产生的。B中,氩原子中电子跃迁时只能吸收特定能量的光,而无法吸收除蓝紫色以外的光,这点从原子的吸收光谱也是线状光谱可知。
1. 对充有氩气的霓虹灯管通电,灯管发出蓝紫色光。产生这一现象的主要原因
是( )
A. 电子由能量较高的轨道向能量较低的轨道跃迁时以光的形式辐射能量
B. 电子由能量较低的轨道向能量较高的轨道跃迁时吸收除蓝紫色光以外的光
C. 氩原子获得电子后转变成发出蓝紫色光的物质
D. 在电流的作用下,氩原子与构成灯管的物质发生反应
课堂练习
A
解析 对原子而言,核电荷数=核外电子数,阳离子是失去电子形成的,阴离子是得到电子形成的。四种离子的电子层结构相同,则满足的关系定量表达为a-m = b-n = c+n = d+m。移项后可知D正确。
2. X、Y、Z、R分别代表四种元素,如果aXm+、bYn+、CZn-、dRm-四种离子的电子层结构相同,则下列关系式正确的是( )
A. a - c = m - n
B. a - b = n - m
C. c - d = m + n
D. b - d = n + m
课堂练习
D
