第1节 原电池 第2课时 优秀课件(共24张PPT)
文档属性
| 名称 | 第1节 原电池 第2课时 优秀课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:45:37 | ||
图片预览





文档简介
(共24张PPT)
第四章 化学反应与电能
第一节 原电池(第2课时)
一、导入新课
2.如何设计原电池?
1.原电池的形成条件有哪些?
3.原电池原理有哪些应用?
二、新课讲解
设计原电池
从理论上讲,能自发进行的氧化还原反应均可以设计成原电池,实际设计时应注意以下几点:
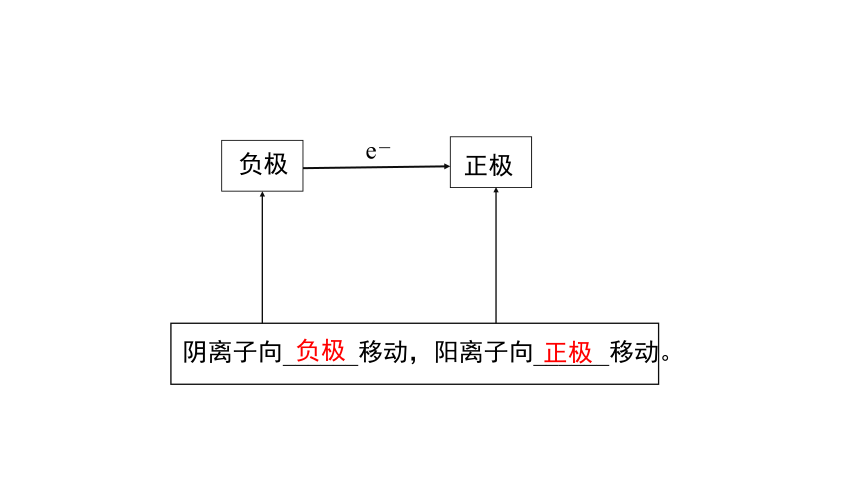
1.外电路
负极(还原性较强的物质) 正极(氧化性较强的物质)。
2.内电路
将两电极浸入电解质溶液中,阴、阳离子作定向运动。
e
_
导线
二、新课讲解
阴离子向______移动,阳离子向______移动。
e
_
负极
正极
负极
正极
二、新课讲解
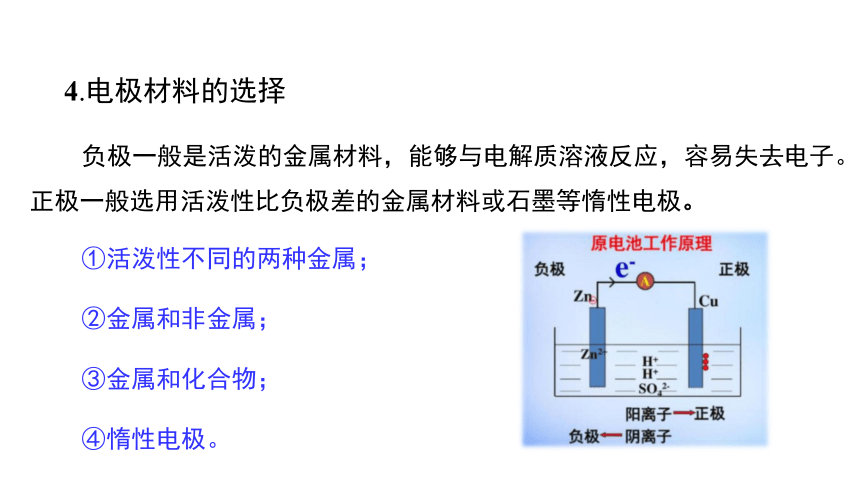
4.电极材料的选择
负极一般是活泼的金属材料,能够与电解质溶液反应,容易失去电子。正极一般选用活泼性比负极差的金属材料或石墨等惰性电极。
①活泼性不同的两种金属;
②金属和非金属;
③金属和化合物;
④惰性电极。
二、新课讲解
5.电解质溶液的选择
电解质溶液是为正极提供放电的物质,因此电解质溶液一般要能够与负极发生反应。若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
二、新课讲解
1.先将已知能自发进行的氧化还原反应拆分为两个半反应。
2.根据原电池的电极反应特点,结合两个半反应,找出正负极材料及电解质溶液。
3.组成闭合回路。
原电池的设计思路 ——“两极一液一连线”。
4.按要求画出原电池装置图。
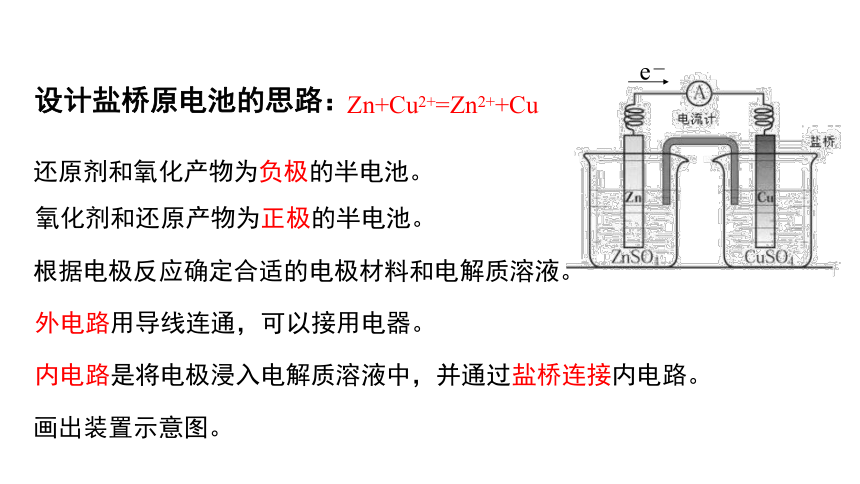
设计步骤
二、新课讲解
设计盐桥原电池的思路:
Zn+Cu2+=Zn2++Cu
还原剂和氧化产物为负极的半电池。
氧化剂和还原产物为正极的半电池。
根据电极反应确定合适的电极材料和电解质溶液。
外电路用导线连通,可以接用电器。
内电路是将电极浸入电解质溶液中,并通过盐桥连接内电路。
画出装置示意图。
e
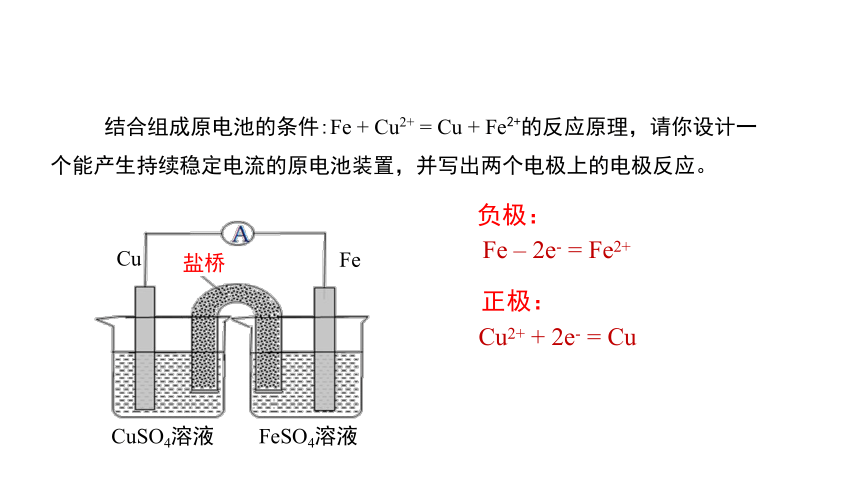
_
二、新课讲解
结合组成原电池的条件:Fe + Cu2+ = Cu + Fe2+的反应原理,请你设计一个能产生持续稳定电流的原电池装置,并写出两个电极上的电极反应。
Fe – 2e- = Fe2+
Cu2+ + 2e- = Cu
正极:
负极:
Cu
Fe
CuSO4溶液
FeSO4溶液
盐桥
二、新课讲解
【例1】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
A.在外电路中,电流由铜电极流向银电极
B.该装置是将电能转化为化学能
C.实验过程中取出盐桥,原电池仍继续工作
D .正极反应为:Ag++e-=Ag
AgNO3溶液 Cu(NO3)2溶液
Ag
Cu
盐桥
D
二、新课讲解
【例2】一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl3 + Cu = 2 FeCl2 + CuCl2,
(1)可以写成:氧化反应:___________________。
还原反应:___________________。
(2)请将此反应设计成带盐桥的原电池,
(3)画出装置图。
盐桥
Cu
FeCl3溶液
A
CuCl2溶液
电流计
C
Cu-2e-=Cu2+
2Fe3++2e-=2Fe2+
二、新课讲解
原电池工作原理的应用
1.形成原电池,可以加快氧化还原反应的速率。
如:如实验室用Zn和稀硫酸反应制H2,常用粗锌,原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了反应速率。
二、新课讲解
【例题】下列制氢气的反应速率最快的是( )
C.粗锌和 1mol/L 盐酸
A.纯锌和1mol/L 硫酸
B.纯锌和18 mol/L 硫酸
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液
D
二、新课讲解
2.比较金属活动性强弱
比较方法
一般做负极的金属比作正极的活泼。
电极质量减少,做负极,较活泼。
有气体生成、电极质量不断增加或不变为正极,较不活泼。
二、新课讲解
【例1】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,a为负极,c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
B
二、新课讲解
【例2】下列叙述中,可以说明金属甲比乙活泼性强的是( )
C.将甲乙作电极组成原电池时甲是负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
B.在氧化–还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
C
二、新课讲解
3.设计化学电源
寻求和制造干电池和蓄电池等化学能源
4.保护金属设备:被保护金属作正极。
将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
利用原电池原理设计新型化学电池
5.解释某些化学现象。
二、新课讲解
请同学们阅读课本中P95中的,化学方程式中的变化与守恒,体会化学方程式的变化与守恒思想。
三、课堂小结
原电池
原电池的设计思路
原电池原理的应用
外电路
内电路
闭合电路
加快反应速率
比较金属活动性顺序
保护金属设备
解释某些现象
四、随堂练习
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。 ( )
(4)石墨棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+=2Ag+Cu2+能以原电池的形式来实现。 ( )
(6)NaOH+HCl=NaCl+H2O可自发进行,可设计成原电池。 ( )
(7)Zn-Cu-稀硫酸原电池中,正极“半电池”可为Cu-稀硫酸,负极“半电池”可为Zn-ZnSO4溶液。 ( )
(8)CaO+H2O===Ca(OH)2是放热反应,可设计成原电池。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
√
×
×
×
×
×
四、随堂练习
2.在Cu-Zn原电池中,200 mLH2SO4 溶液的浓度为0.125 mol/L , 若工作一段时间后,从装置中共收集到 0.168 L升气体,则流过导线的电子为___mol,溶液的pH变____。(溶液体积变化忽略不计)
0.2
解得:
y =0.015 (mol)
x =0.015 (mol)
=
=3.75× 10﹣ 4(mol/L )
∴pH =-lg3.75 ×10-4
=4 -lg3.75
答:……
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e- =H2↑
得:
2 2 22.4
x y 0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+ —— 2e——H2↑
大
0.015
四、随堂练习
3.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生氧化反应;铜电极发生还原反应,电极反应是2H++2e-===H2↑
D.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
A
四、随堂练习
4.分析下图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
B
再 见
第四章 化学反应与电能
第一节 原电池(第2课时)
一、导入新课
2.如何设计原电池?
1.原电池的形成条件有哪些?
3.原电池原理有哪些应用?
二、新课讲解
设计原电池
从理论上讲,能自发进行的氧化还原反应均可以设计成原电池,实际设计时应注意以下几点:
1.外电路
负极(还原性较强的物质) 正极(氧化性较强的物质)。
2.内电路
将两电极浸入电解质溶液中,阴、阳离子作定向运动。
e
_
导线
二、新课讲解
阴离子向______移动,阳离子向______移动。
e
_
负极
正极
负极
正极
二、新课讲解
4.电极材料的选择
负极一般是活泼的金属材料,能够与电解质溶液反应,容易失去电子。正极一般选用活泼性比负极差的金属材料或石墨等惰性电极。
①活泼性不同的两种金属;
②金属和非金属;
③金属和化合物;
④惰性电极。
二、新课讲解
5.电解质溶液的选择
电解质溶液是为正极提供放电的物质,因此电解质溶液一般要能够与负极发生反应。若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
二、新课讲解
1.先将已知能自发进行的氧化还原反应拆分为两个半反应。
2.根据原电池的电极反应特点,结合两个半反应,找出正负极材料及电解质溶液。
3.组成闭合回路。
原电池的设计思路 ——“两极一液一连线”。
4.按要求画出原电池装置图。
设计步骤
二、新课讲解
设计盐桥原电池的思路:
Zn+Cu2+=Zn2++Cu
还原剂和氧化产物为负极的半电池。
氧化剂和还原产物为正极的半电池。
根据电极反应确定合适的电极材料和电解质溶液。
外电路用导线连通,可以接用电器。
内电路是将电极浸入电解质溶液中,并通过盐桥连接内电路。
画出装置示意图。
e
_
二、新课讲解
结合组成原电池的条件:Fe + Cu2+ = Cu + Fe2+的反应原理,请你设计一个能产生持续稳定电流的原电池装置,并写出两个电极上的电极反应。
Fe – 2e- = Fe2+
Cu2+ + 2e- = Cu
正极:
负极:
Cu
Fe
CuSO4溶液
FeSO4溶液
盐桥
二、新课讲解
【例1】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池如图所示.以下有关该原电池的叙述正确的是( )
A.在外电路中,电流由铜电极流向银电极
B.该装置是将电能转化为化学能
C.实验过程中取出盐桥,原电池仍继续工作
D .正极反应为:Ag++e-=Ag
AgNO3溶液 Cu(NO3)2溶液
Ag
Cu
盐桥
D
二、新课讲解
【例2】一个完整的氧化还原反应可以拆分,写成两个“半反应”式,一个是“氧化反应”式,一个是“还原反应”式。如氧化还原反应:2FeCl3 + Cu = 2 FeCl2 + CuCl2,
(1)可以写成:氧化反应:___________________。
还原反应:___________________。
(2)请将此反应设计成带盐桥的原电池,
(3)画出装置图。
盐桥
Cu
FeCl3溶液
A
CuCl2溶液
电流计
C
Cu-2e-=Cu2+
2Fe3++2e-=2Fe2+
二、新课讲解
原电池工作原理的应用
1.形成原电池,可以加快氧化还原反应的速率。
如:如实验室用Zn和稀硫酸反应制H2,常用粗锌,原因是粗锌中的杂质和锌、稀硫酸形成原电池,增大了反应速率。
二、新课讲解
【例题】下列制氢气的反应速率最快的是( )
C.粗锌和 1mol/L 盐酸
A.纯锌和1mol/L 硫酸
B.纯锌和18 mol/L 硫酸
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液
D
二、新课讲解
2.比较金属活动性强弱
比较方法
一般做负极的金属比作正极的活泼。
电极质量减少,做负极,较活泼。
有气体生成、电极质量不断增加或不变为正极,较不活泼。
二、新课讲解
【例1】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,a为负极,c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为 ( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
B
二、新课讲解
【例2】下列叙述中,可以说明金属甲比乙活泼性强的是( )
C.将甲乙作电极组成原电池时甲是负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出
B.在氧化–还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
C
二、新课讲解
3.设计化学电源
寻求和制造干电池和蓄电池等化学能源
4.保护金属设备:被保护金属作正极。
将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
利用原电池原理设计新型化学电池
5.解释某些化学现象。
二、新课讲解
请同学们阅读课本中P95中的,化学方程式中的变化与守恒,体会化学方程式的变化与守恒思想。
三、课堂小结
原电池
原电池的设计思路
原电池原理的应用
外电路
内电路
闭合电路
加快反应速率
比较金属活动性顺序
保护金属设备
解释某些现象
四、随堂练习
(1)原电池是把化学能转化为电能的一种装置。 ( )
(2)原电池正极发生氧化反应,负极发生还原反应。 ( )
(3)不能自发进行的氧化还原反应,通过原电池装置可以实现。 ( )
(4)石墨棒不能用来作原电池的电极。 ( )
(5)反应Cu+2Ag+=2Ag+Cu2+能以原电池的形式来实现。 ( )
(6)NaOH+HCl=NaCl+H2O可自发进行,可设计成原电池。 ( )
(7)Zn-Cu-稀硫酸原电池中,正极“半电池”可为Cu-稀硫酸,负极“半电池”可为Zn-ZnSO4溶液。 ( )
(8)CaO+H2O===Ca(OH)2是放热反应,可设计成原电池。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
√
×
×
×
×
×
四、随堂练习
2.在Cu-Zn原电池中,200 mLH2SO4 溶液的浓度为0.125 mol/L , 若工作一段时间后,从装置中共收集到 0.168 L升气体,则流过导线的电子为___mol,溶液的pH变____。(溶液体积变化忽略不计)
0.2
解得:
y =0.015 (mol)
x =0.015 (mol)
=
=3.75× 10﹣ 4(mol/L )
∴pH =-lg3.75 ×10-4
=4 -lg3.75
答:……
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e- =H2↑
得:
2 2 22.4
x y 0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+ —— 2e——H2↑
大
0.015
四、随堂练习
3.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生氧化反应;铜电极发生还原反应,电极反应是2H++2e-===H2↑
D.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
A
四、随堂练习
4.分析下图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
B
再 见
