第二节 化学平衡 第1课时 优秀课件(共24张PPT)
文档属性
| 名称 | 第二节 化学平衡 第1课时 优秀课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 469.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:50:02 | ||
图片预览








文档简介
(共24张PPT)
第1课时 化学平衡状态
第二章 化学反应速率与化学平衡 第二节 化学平衡
导入新课
在19世纪后期,人们发现炼铁高炉排出的高炉气中含有相当量的CO。有人认为是CO与铁矿石的接触时间不长所造成的。英国人耗巨资建成一个高大的炼铁高炉,以增加CO和铁矿石的接触时间,结果发现CO的含量仍然没有减少,你知道这是为什么吗?
一、可逆反应
1.概念:
在相同条件下,既能向正反应方向进行又能向逆反应方向进行的化学反应。
2.特征:
(1)可逆反应分为方向相反的两个反应:正反应和逆反应。
(2)正、逆反应在相同条件下是同时进行的。
(3)反应物和生成物共存于同一体系中,反应物的转化率小于100%。
(4)能量转化类型相反:若正反应放热,则逆反应吸热。
【课堂练习】
1.对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中
D
【解析】因为此反应是可逆反应,在一定条件下可同时向正、逆反应方向进行,向正反应方向进行时使SO3中含18O,向逆反应方向(含有18O的SO3分解)就可能使SO2中含有18O,所以D正确。
一、可逆反应
【课堂练习】
2.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.c(Z)=0.3 mol·L-1 B.c(X2)=0.2 mol·L-1
C.c(Y2)=0.4 mol·L-1 D.c(X2)+c(Y2)+c(Z)=0.55 mol·L-1
A
【解析】假设则完全转化时,X2(g)、Y2(g)、Z(g)的浓度范围分别为0~0.2 mol·L-1、0~0.4 mol·L-1 、0~0.4 mol·L-1;该反应是总体积不变的反应,反应达到平衡时,不论X2、Y2、Z怎么变化,总物质的量不会改变,物质的总浓度也不会改变,即c(X2)+c(Y2)+c(Z)=0.6 mol·L-1。
一、可逆反应
二、化学平衡状态
【交流讨论】
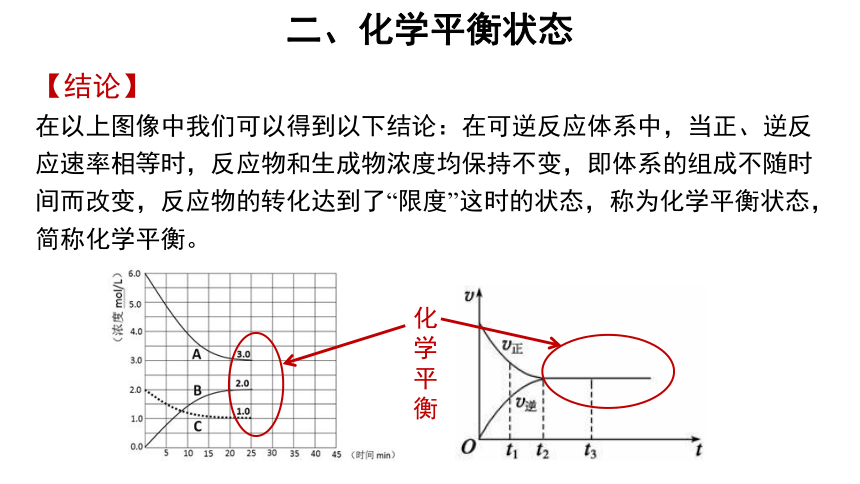
1. 在一定条件下体积不变的密闭容器中充入2mol/LN2 和6mol/LH2 进行合成氨的反应,反应物和生成物的浓度随时间的变化以及反应速率如图所示
图2
图1
观察图片,交流讨论以下问题:
(1)随着反应的进行,反应物和生成物的浓度如何变化?正逆反应速率如何变化?
(2))当反应进行足够长时间后,反应物和生成物的浓度是否发生变化?正逆反应速率是否发生变化?
(3)当反应进行足够长时间后,是否意味着反应就停止了?
【交流讨论】
在相同条件下,向容器中充入4mol/L的NH3,发生反应2NH3 N2 +3H2 ,反应物和生成物的浓度随时间的变化如图所示
观察图片,交流讨论以下问题
(1)图中最终状态和图1是否相同?
(2)正逆反应速率是否相等?
二、化学平衡状态
在以上图像中我们可以得到以下结论:在可逆反应体系中,当正、逆反应速率相等时,反应物和生成物浓度均保持不变,即体系的组成不随时间而改变,反应物的转化达到了“限度”这时的状态,称为化学平衡状态,简称化学平衡。
【结论】
化学平衡
二、化学平衡状态
1.定义:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分浓度保持不变的状态。
2.特征
逆
等
动
定
变
研究对象必须是可逆反应;
正反应速率和逆反应速率相等,即同一物质的消耗速率和生成速相等;
化学平衡是动态平衡,即当反应达到平衡时,正反应和逆反应都仍在继续进行
在平衡体系中,各组成成分的含量保持不变;
改变影响平衡的条件,平衡会发生移动,达到新的平衡
二、化学平衡状态
【交流讨论】
从化学平衡的特征中你能找到判断可逆反应是否达到化学平衡的标志吗?
定义:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分浓度保持不变的状态。
化学平衡
二、化学平衡状态
【方法总结】判断化学平衡的标志
1.直接标志:
(1)速率关系:正逆反应速率相等。即 V正=V逆
对于同一物质而言,该物质的生成速率等于它的消耗速率;对于不同物质而言,速率之比等于化学方程式中的化学计量数之比,但必须是不同方向的速率。
二、化学平衡状态
【课堂练习】
3、一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( )
A、单位时间内生成n mol A2同时生成n molAB
B、单位时间内生成2n mol AB 同时生成n mol B2
C、单位时间内生成n mol A2 同时生成n mol B2
D、单位时间内生成n mol A2 同时消耗n mol B2
BD
【解析】根据反应速率之比等于化学计量系数之比可知vA:vB:vC=1:1:2,BD选项是不同方向速率相等,AB是同一方向。
二、化学平衡状态
【课堂练习】
4、一定条件下,反应N2+3H2 2NH3达到平衡的标志是 ( )
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
AC
【解析】AC是不同方向,BD是相同方向。
二、化学平衡状态
【方法总结】判断化学平衡的标志
1.直接标志:
(1)速率关系:正逆反应速率相等。即 V正=V逆
(2)含量关系:反应混合物各组分的浓度、质量分数、物质的量、物质的量分数、体积分数、分子数之比保持不变。
口诀:速率相等、组分不变
二、化学平衡状态
2.间接标志:
以反应mA(g)+nB (g) pC(g)为例
①混合气体的总压强、总体积、总物质的量、平均相对分子质量不随时间改变而改变(适用于m+n≠p的反应)
②混合气体的密度不随时间改变而改变
(适用于恒温恒压m+n≠p的反应)
3.特殊标志:
①对于有色物质参加反应,如果体系颜色不变,反应达到平衡
②对于吸热或放热反应,如果体系温度不变,反应达到平衡
二、化学平衡状态
【课堂练习】
5.在一定温度下的恒容密闭容器中,表明反应A(s)+2B(g) C(g)+D(g)已达平衡的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.反应物的相对分子质量不变 D.气体的总物质的量不变
B
【解析】该反应是反应前后气体体积没有变化的反应,容器中的压强始终不发生变化,恒温恒容下,气体质量会变,密度会变,密度不变时,达到化学平衡状态;相对分子质量是物质的本身性质,不随反应变化而变化; 反应前后气体的总物质的量相等,始终保持不变;
二、化学平衡状态
课堂小结
课堂检测
1.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
【解析】平衡状态就是一个可逆反应在该条件下所能达到的最大限度;反应达到平衡时,v正=v逆≠0,各物质的浓度保持不变但不一定相等,且当外界条件发生改变时,这种状态也会发生改变。
2.在一定量的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol·L-1,H2为0.6 mol·L-1
B.N2为0.15 mol·L-1
C.N2、H2均为0.18 mol·L-1
D.NH3为0.4 mol·L-1
B
【解析】解答时,应注意两点:(1)可逆反应既可向正反应方向进行,同时又可向逆反应方向进行;(2)可逆反应不能进行到底,只能反应到一定程度达到平衡状态,平衡时各物质的物质的量都大于零。
课堂检测
3.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
C
【解析】如用N2、H2、NH3分别表示同一正反应速率时,应有如下关系,v正(N2)︰v正(H2)︰v正(NH3)=1︰3︰2。达到平衡时:v正(H2)︰v逆(NH3)=3︰2,v正(N2)︰v逆(NH3)=1︰2,v正(N2)︰v逆(H2)=1︰3,选项A只表示一个方向,选项B、D不符合计量数关系,选项C符合要求。
课堂检测
4.一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.N2 、H2和NH3的物质的量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2
B
【解析】平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2不能作为判断是否达到平衡状态的依据。
课堂检测
5.在一定温度下的定容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变 ②混合气体的密度不变 ③C(g)的物质的量浓度不变 ④容器内A、C、D三种气体的浓度之比为2︰1︰1 ⑤单位时间内生成n mol C,同时生成n mol D ⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③④ C.②③⑥ D.①③⑥
C
课堂检测
6.可逆反应:2NO2 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2︰2︰1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
A
课堂检测
再 见
第1课时 化学平衡状态
第二章 化学反应速率与化学平衡 第二节 化学平衡
导入新课
在19世纪后期,人们发现炼铁高炉排出的高炉气中含有相当量的CO。有人认为是CO与铁矿石的接触时间不长所造成的。英国人耗巨资建成一个高大的炼铁高炉,以增加CO和铁矿石的接触时间,结果发现CO的含量仍然没有减少,你知道这是为什么吗?
一、可逆反应
1.概念:
在相同条件下,既能向正反应方向进行又能向逆反应方向进行的化学反应。
2.特征:
(1)可逆反应分为方向相反的两个反应:正反应和逆反应。
(2)正、逆反应在相同条件下是同时进行的。
(3)反应物和生成物共存于同一体系中,反应物的转化率小于100%。
(4)能量转化类型相反:若正反应放热,则逆反应吸热。
【课堂练习】
1.对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中
D
【解析】因为此反应是可逆反应,在一定条件下可同时向正、逆反应方向进行,向正反应方向进行时使SO3中含18O,向逆反应方向(含有18O的SO3分解)就可能使SO2中含有18O,所以D正确。
一、可逆反应
【课堂练习】
2.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.c(Z)=0.3 mol·L-1 B.c(X2)=0.2 mol·L-1
C.c(Y2)=0.4 mol·L-1 D.c(X2)+c(Y2)+c(Z)=0.55 mol·L-1
A
【解析】假设则完全转化时,X2(g)、Y2(g)、Z(g)的浓度范围分别为0~0.2 mol·L-1、0~0.4 mol·L-1 、0~0.4 mol·L-1;该反应是总体积不变的反应,反应达到平衡时,不论X2、Y2、Z怎么变化,总物质的量不会改变,物质的总浓度也不会改变,即c(X2)+c(Y2)+c(Z)=0.6 mol·L-1。
一、可逆反应
二、化学平衡状态
【交流讨论】
1. 在一定条件下体积不变的密闭容器中充入2mol/LN2 和6mol/LH2 进行合成氨的反应,反应物和生成物的浓度随时间的变化以及反应速率如图所示
图2
图1
观察图片,交流讨论以下问题:
(1)随着反应的进行,反应物和生成物的浓度如何变化?正逆反应速率如何变化?
(2))当反应进行足够长时间后,反应物和生成物的浓度是否发生变化?正逆反应速率是否发生变化?
(3)当反应进行足够长时间后,是否意味着反应就停止了?
【交流讨论】
在相同条件下,向容器中充入4mol/L的NH3,发生反应2NH3 N2 +3H2 ,反应物和生成物的浓度随时间的变化如图所示
观察图片,交流讨论以下问题
(1)图中最终状态和图1是否相同?
(2)正逆反应速率是否相等?
二、化学平衡状态
在以上图像中我们可以得到以下结论:在可逆反应体系中,当正、逆反应速率相等时,反应物和生成物浓度均保持不变,即体系的组成不随时间而改变,反应物的转化达到了“限度”这时的状态,称为化学平衡状态,简称化学平衡。
【结论】
化学平衡
二、化学平衡状态
1.定义:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分浓度保持不变的状态。
2.特征
逆
等
动
定
变
研究对象必须是可逆反应;
正反应速率和逆反应速率相等,即同一物质的消耗速率和生成速相等;
化学平衡是动态平衡,即当反应达到平衡时,正反应和逆反应都仍在继续进行
在平衡体系中,各组成成分的含量保持不变;
改变影响平衡的条件,平衡会发生移动,达到新的平衡
二、化学平衡状态
【交流讨论】
从化学平衡的特征中你能找到判断可逆反应是否达到化学平衡的标志吗?
定义:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分浓度保持不变的状态。
化学平衡
二、化学平衡状态
【方法总结】判断化学平衡的标志
1.直接标志:
(1)速率关系:正逆反应速率相等。即 V正=V逆
对于同一物质而言,该物质的生成速率等于它的消耗速率;对于不同物质而言,速率之比等于化学方程式中的化学计量数之比,但必须是不同方向的速率。
二、化学平衡状态
【课堂练习】
3、一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( )
A、单位时间内生成n mol A2同时生成n molAB
B、单位时间内生成2n mol AB 同时生成n mol B2
C、单位时间内生成n mol A2 同时生成n mol B2
D、单位时间内生成n mol A2 同时消耗n mol B2
BD
【解析】根据反应速率之比等于化学计量系数之比可知vA:vB:vC=1:1:2,BD选项是不同方向速率相等,AB是同一方向。
二、化学平衡状态
【课堂练习】
4、一定条件下,反应N2+3H2 2NH3达到平衡的标志是 ( )
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成
AC
【解析】AC是不同方向,BD是相同方向。
二、化学平衡状态
【方法总结】判断化学平衡的标志
1.直接标志:
(1)速率关系:正逆反应速率相等。即 V正=V逆
(2)含量关系:反应混合物各组分的浓度、质量分数、物质的量、物质的量分数、体积分数、分子数之比保持不变。
口诀:速率相等、组分不变
二、化学平衡状态
2.间接标志:
以反应mA(g)+nB (g) pC(g)为例
①混合气体的总压强、总体积、总物质的量、平均相对分子质量不随时间改变而改变(适用于m+n≠p的反应)
②混合气体的密度不随时间改变而改变
(适用于恒温恒压m+n≠p的反应)
3.特殊标志:
①对于有色物质参加反应,如果体系颜色不变,反应达到平衡
②对于吸热或放热反应,如果体系温度不变,反应达到平衡
二、化学平衡状态
【课堂练习】
5.在一定温度下的恒容密闭容器中,表明反应A(s)+2B(g) C(g)+D(g)已达平衡的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.反应物的相对分子质量不变 D.气体的总物质的量不变
B
【解析】该反应是反应前后气体体积没有变化的反应,容器中的压强始终不发生变化,恒温恒容下,气体质量会变,密度会变,密度不变时,达到化学平衡状态;相对分子质量是物质的本身性质,不随反应变化而变化; 反应前后气体的总物质的量相等,始终保持不变;
二、化学平衡状态
课堂小结
课堂检测
1.下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
A
【解析】平衡状态就是一个可逆反应在该条件下所能达到的最大限度;反应达到平衡时,v正=v逆≠0,各物质的浓度保持不变但不一定相等,且当外界条件发生改变时,这种状态也会发生改变。
2.在一定量的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.N2为0.2 mol·L-1,H2为0.6 mol·L-1
B.N2为0.15 mol·L-1
C.N2、H2均为0.18 mol·L-1
D.NH3为0.4 mol·L-1
B
【解析】解答时,应注意两点:(1)可逆反应既可向正反应方向进行,同时又可向逆反应方向进行;(2)可逆反应不能进行到底,只能反应到一定程度达到平衡状态,平衡时各物质的物质的量都大于零。
课堂检测
3.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
C
【解析】如用N2、H2、NH3分别表示同一正反应速率时,应有如下关系,v正(N2)︰v正(H2)︰v正(NH3)=1︰3︰2。达到平衡时:v正(H2)︰v逆(NH3)=3︰2,v正(N2)︰v逆(NH3)=1︰2,v正(N2)︰v逆(H2)=1︰3,选项A只表示一个方向,选项B、D不符合计量数关系,选项C符合要求。
课堂检测
4.一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.N2 、H2和NH3的物质的量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2
B
【解析】平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2不能作为判断是否达到平衡状态的依据。
课堂检测
5.在一定温度下的定容容器中,发生反应:2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的压强不变 ②混合气体的密度不变 ③C(g)的物质的量浓度不变 ④容器内A、C、D三种气体的浓度之比为2︰1︰1 ⑤单位时间内生成n mol C,同时生成n mol D ⑥单位时间内生成n mol D,同时生成2n mol A
A.①②⑤ B.②③④ C.②③⑥ D.①③⑥
C
课堂检测
6.可逆反应:2NO2 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2︰2︰1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
A
课堂检测
再 见
