第二节 化学平衡 第2课时 优秀课件(共23张PPT)
文档属性
| 名称 | 第二节 化学平衡 第2课时 优秀课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 571.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:51:08 | ||
图片预览




文档简介
(共23张PPT)
第2课时 化学平衡常数
第二章 化学反应速率与化学平衡 第二节 化学平衡
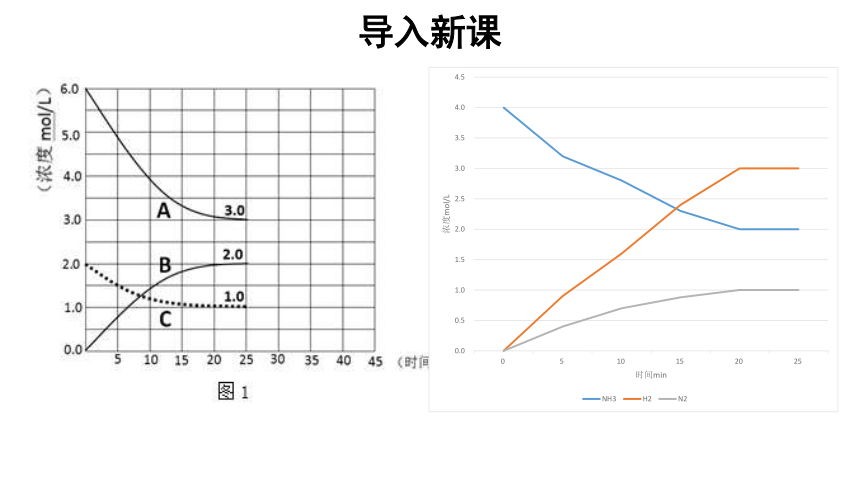
导入新课
一、化学平衡常数
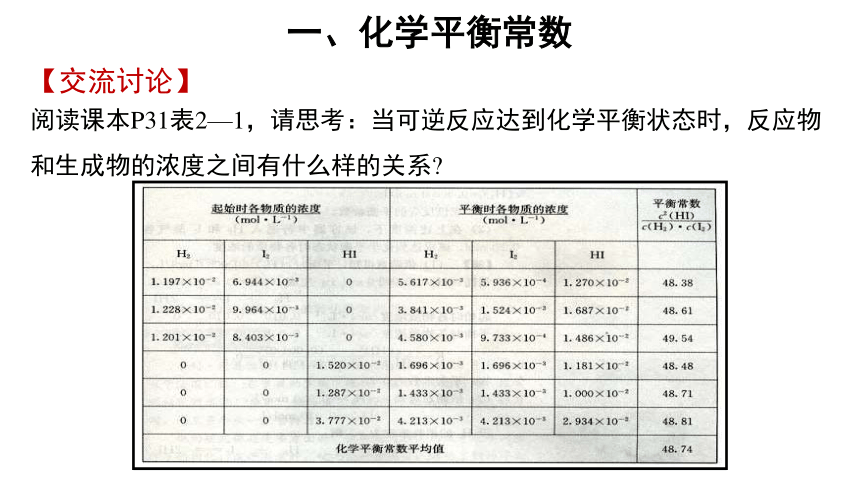
【交流讨论】
阅读课本P31表2—1,请思考:当可逆反应达到化学平衡状态时,反应物和生成物的浓度之间有什么样的关系
1.定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值。
2.数学表达式:
对于一般的可逆反应,mA(g)+nB(g) pC(g)+qD(g),当在一定温度
下达到平衡时,K=
一、化学平衡常数
【交流讨论】
写出下列反应的平衡常数的表达式
Cr2O72- (aq)+H2O(l) 2CrO2- (aq)+2H+(aq)
Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g)
N2(g)+3H2(g) 2NH3(g) K1
1/2N2(g)+3/2H2(g) NH3(g) K2
2NH3(g) N2(g)+3H2(g) K3
K1 K2 K3有什么关系,由以上平衡常数的表达式可以得出什么结论
K1=K22 、K2·K3=1 、K1·K32=1
3、注意事项:
①化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,且不出现固体或纯液体的浓度。
②化学平衡常数表达式与化学方程式的书写方式有关。
一、化学平衡常数
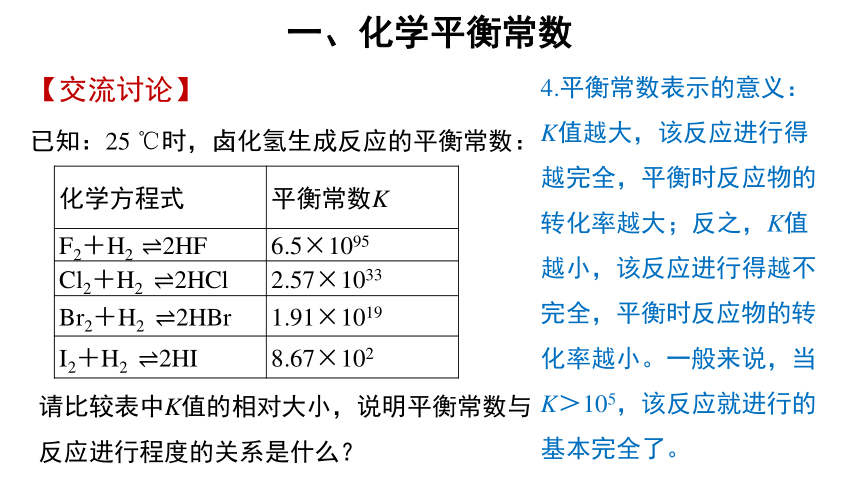
已知:25 ℃时,卤化氢生成反应的平衡常数:
化学方程式 平衡常数K
F2+H2 2HF 6.5×1095
Cl2+H2 2HCl 2.57×1033
Br2+H2 2HBr 1.91×1019
I2+H2 2HI 8.67×102
请比较表中K值的相对大小,说明平衡常数与反应进行程度的关系是什么?
【交流讨论】
4.平衡常数表示的意义:
K值越大,该反应进行得越完全,平衡时反应物的转化率越大;反之,K值越小,该反应进行得越不完全,平衡时反应物的转化率越小。一般来说,当K>105,该反应就进行的基本完全了。
一、化学平衡常数
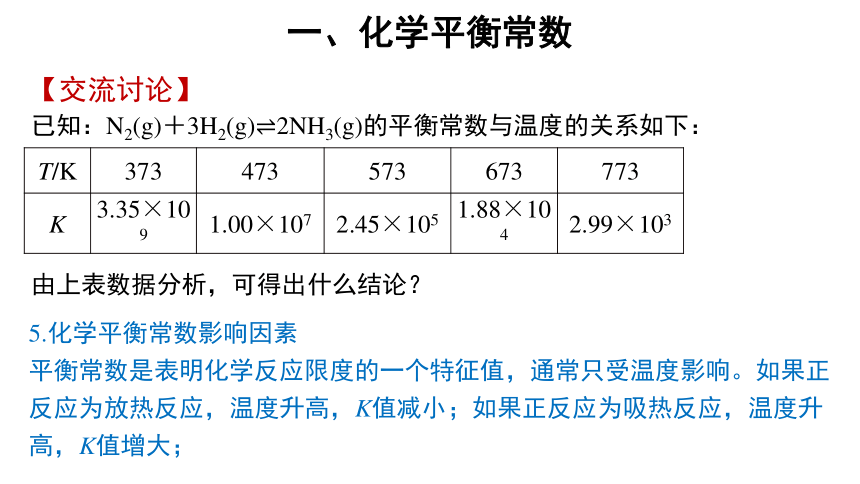
已知:N2(g)+3H2(g) 2NH3(g)的平衡常数与温度的关系如下:
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
【交流讨论】
由上表数据分析,可得出什么结论?
5.化学平衡常数影响因素
平衡常数是表明化学反应限度的一个特征值,通常只受温度影响。如果正反应为放热反应,温度升高,K值减小;如果正反应为吸热反应,温度升高,K值增大;
一、化学平衡常数
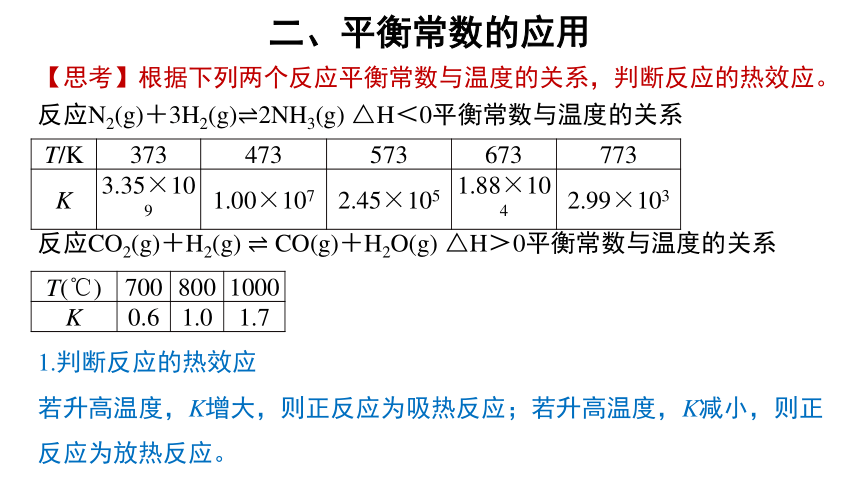
二、平衡常数的应用
1.判断反应的热效应
若升高温度,K增大,则正反应为吸热反应;若升高温度,K减小,则正反应为放热反应。
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
反应N2(g)+3H2(g) 2NH3(g) △H<0平衡常数与温度的关系
T(℃) 700 800 1000
K 0.6 1.0 1.7
反应CO2(g)+H2(g) CO(g)+H2O(g) △H>0平衡常数与温度的关系
【思考】根据下列两个反应平衡常数与温度的关系,判断反应的热效应。
【交流讨论】思考任意时刻的浓度幂之积的比值与平衡常数有何关系?
任意时刻的浓度幂之积的比值称为浓度商,用Q表示,如
mA(g)+nB(g) pC(g)+qD(g),Q=
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
Q<K:可逆反应向正反应方向进行。
二、平衡常数的应用
三、化学平衡常数的有关计算
【交流讨论】阅读教材【例题1】、【例题2】,思考什么是“三段式”计算法?找出“三段式”计算法模型。
aA(g) + bB(g) cC(g) + dD(g)
起始浓度/mol·L-1 n1 n2 0 0
变化浓度/mol·L-1 x bx /a cx /a dx/a
平衡浓度/mol·L-1 n1-x n2-bx /a cx /a dx/a
平衡常数K=
特点:①“三段”指起始量、变化量、平衡量;
②变化量与化学方程式中各物质系数成比例;
③这里的变量可指物质的量、浓度、气体的分压等。
【课堂练习】
1.恒温下,在容积为2 L的恒容密闭容器A中通入1 mol N2与1 mol H2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4 mol。
(1)计算此温度时该反应的K值为________。
(2)若在此温度下,向另一容积为1 L的恒容密闭容器B中按物质的量分别为2 mol、1 mol、1 mol充入N2、H2、NH3,此时,该反应是否处于平衡状态________(填“是”或“否”),此时若没有达到平衡,反应向________(填“正反应”或“逆反应”)方向进行。
【答案】(1)12.5 (2)否;正反应
三、化学平衡常数的有关计算
【解析】
K= = =12.5 。
(2)c(N2)=2 mol·L-1,c(H2)=1 mol·L-1,c(NH3)=1 mol·L-1,Qc= =【课堂练习】
三、化学平衡常数的有关计算
2.已知:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同温度下,K值如下:
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)若500 ℃时进行上述反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
(2)方程式中的a______(填“大于”“小于”或“等于”)0。
【课堂练习】
【答案】 (1)1 mol·L-1 (2)大于
三、化学平衡常数的有关计算
【解析】 (1)设500 ℃时,CO的平衡浓度为x mol·L-1,则
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/mol·L-1 2 0
变化/mol·L-1 x x
平衡/mol·L-1 2-x x
则K=c(CO)/c(CO2) =x/2-x=1,解得x=1。
故CO的平衡浓度为1 mol·L-1。
(2)由表格中数据可知,温度越高K值越大,推知温度升高平衡向正反应方向移动,故此反应的正反应为吸热反应,即a大于0。
【课堂练习】
三、化学平衡常数的有关计算
【课堂练习】
3.H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=________。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH________0(填“>”“<”或“=”)。
【答案】 (1)2.5 2.8×10-3 (2)> >
三、化学平衡常数的有关计算
【解析】 (1) H2S(g) + CO2(g) COS(g)+ H2O(g)
起始/mol 0.40 0.10 0 0
变化/mol x x x x
平衡/mol 0.40-x 0.10-x x x
由题意得:x/(0.40-x)+(0.10-x)+x+x=0.02,解得:x=0.01
H2S的平衡转化率α1=0.01 mol/0.40 mol×100%=2.5%。
K=c(COS)·c(H2O))/c(H2S)·c(CO2) =1/351 ≈ 2.8×10-3。
(2)温度升高,水的平衡物质的量分数增大,说明升温平衡右移,则H2S的转化率增大,故α2>α1。温度升高,平衡向吸热反应方向移动,故ΔH>0。
【课堂练习】
三、化学平衡常数的有关计算
课堂小结
课堂检测
1.在某温度下,可逆反应aA(g)+bB(g) cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A. 正、逆反应的平衡常数数值相同,符号相反
B. 升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D. 该反应的K=
【解析】反应吸热放热未知,K值变化不能确定;K越大,说明该反应的进行程度越大,转化率越高。
C
2.在淀粉—KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
下列说法正确的是( )
A. 反应I2(aq)+I-(aq) I3-(aq)的ΔH>0
B. 其他条件不变,升高温度,溶液中c(I3-)减小
C. 该反应的平衡常数表达式为K=
D. 25 ℃时,向溶液中加入少量KI固体,平衡常数K大于689
B
【解析】根据题中提供的数据知温度升高,平衡常数减小,正反应为放热反应,H<0;其他条件不变,升高温度,K值减小,溶液中c(I3-)减小;平衡常数只与温度有关,25 ℃时,向溶液中加入少量KI固体,平衡常数不变。
课堂检测
3.某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时c(SO2)=c(O2)=6 mol·L-1,平衡时测得c(O2)=4.5 mol·L-1,则下列叙述中正确的是( )
A. SO2的转化率为60%
B. SO3的产率为60%
C. 平衡时总压强与起始压强之比为7∶8
D. 平衡时v(SO2)∶v(O2)∶v(SO3)=3∶3∶1
C
课堂检测
4.一定条件下,在密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
(1)求反应在该温度下的平衡常数。
(2)若将平衡时体系的压强增大1倍,
试利用平衡常数及有关计算判断
反应向哪个方向进行。
【答案】K=400/21 反应向正反应方向进行
【解析】 2SO2(g)+O2(g) 2SO3(g)
起始浓度/(mol·L-1) 0.4 1 0
变化浓度/(mol·L-1) 0.32 0.16 0.32
平衡浓度/(mol·L-1) 0.08 0.84 0.32
(2)压强增大1倍,即体积缩小1倍,各组分的浓度增大1倍,
Q课堂检测
5. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)正反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,各物质的平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
T(℃) 700 800 1000
K 0.6 1.0 1.7
【答案】c(CO)·c(H2O)/c(CO2)·c(H2) 吸热 800
课堂检测
再 见
第2课时 化学平衡常数
第二章 化学反应速率与化学平衡 第二节 化学平衡
导入新课
一、化学平衡常数
【交流讨论】
阅读课本P31表2—1,请思考:当可逆反应达到化学平衡状态时,反应物和生成物的浓度之间有什么样的关系
1.定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值。
2.数学表达式:
对于一般的可逆反应,mA(g)+nB(g) pC(g)+qD(g),当在一定温度
下达到平衡时,K=
一、化学平衡常数
【交流讨论】
写出下列反应的平衡常数的表达式
Cr2O72- (aq)+H2O(l) 2CrO2- (aq)+2H+(aq)
Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g)
N2(g)+3H2(g) 2NH3(g) K1
1/2N2(g)+3/2H2(g) NH3(g) K2
2NH3(g) N2(g)+3H2(g) K3
K1 K2 K3有什么关系,由以上平衡常数的表达式可以得出什么结论
K1=K22 、K2·K3=1 、K1·K32=1
3、注意事项:
①化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,且不出现固体或纯液体的浓度。
②化学平衡常数表达式与化学方程式的书写方式有关。
一、化学平衡常数
已知:25 ℃时,卤化氢生成反应的平衡常数:
化学方程式 平衡常数K
F2+H2 2HF 6.5×1095
Cl2+H2 2HCl 2.57×1033
Br2+H2 2HBr 1.91×1019
I2+H2 2HI 8.67×102
请比较表中K值的相对大小,说明平衡常数与反应进行程度的关系是什么?
【交流讨论】
4.平衡常数表示的意义:
K值越大,该反应进行得越完全,平衡时反应物的转化率越大;反之,K值越小,该反应进行得越不完全,平衡时反应物的转化率越小。一般来说,当K>105,该反应就进行的基本完全了。
一、化学平衡常数
已知:N2(g)+3H2(g) 2NH3(g)的平衡常数与温度的关系如下:
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
【交流讨论】
由上表数据分析,可得出什么结论?
5.化学平衡常数影响因素
平衡常数是表明化学反应限度的一个特征值,通常只受温度影响。如果正反应为放热反应,温度升高,K值减小;如果正反应为吸热反应,温度升高,K值增大;
一、化学平衡常数
二、平衡常数的应用
1.判断反应的热效应
若升高温度,K增大,则正反应为吸热反应;若升高温度,K减小,则正反应为放热反应。
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
反应N2(g)+3H2(g) 2NH3(g) △H<0平衡常数与温度的关系
T(℃) 700 800 1000
K 0.6 1.0 1.7
反应CO2(g)+H2(g) CO(g)+H2O(g) △H>0平衡常数与温度的关系
【思考】根据下列两个反应平衡常数与温度的关系,判断反应的热效应。
【交流讨论】思考任意时刻的浓度幂之积的比值与平衡常数有何关系?
任意时刻的浓度幂之积的比值称为浓度商,用Q表示,如
mA(g)+nB(g) pC(g)+qD(g),Q=
Q>K:可逆反应向逆反应方向进行;
Q=K:可逆反应处于平衡状态;
Q<K:可逆反应向正反应方向进行。
二、平衡常数的应用
三、化学平衡常数的有关计算
【交流讨论】阅读教材【例题1】、【例题2】,思考什么是“三段式”计算法?找出“三段式”计算法模型。
aA(g) + bB(g) cC(g) + dD(g)
起始浓度/mol·L-1 n1 n2 0 0
变化浓度/mol·L-1 x bx /a cx /a dx/a
平衡浓度/mol·L-1 n1-x n2-bx /a cx /a dx/a
平衡常数K=
特点:①“三段”指起始量、变化量、平衡量;
②变化量与化学方程式中各物质系数成比例;
③这里的变量可指物质的量、浓度、气体的分压等。
【课堂练习】
1.恒温下,在容积为2 L的恒容密闭容器A中通入1 mol N2与1 mol H2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4 mol。
(1)计算此温度时该反应的K值为________。
(2)若在此温度下,向另一容积为1 L的恒容密闭容器B中按物质的量分别为2 mol、1 mol、1 mol充入N2、H2、NH3,此时,该反应是否处于平衡状态________(填“是”或“否”),此时若没有达到平衡,反应向________(填“正反应”或“逆反应”)方向进行。
【答案】(1)12.5 (2)否;正反应
三、化学平衡常数的有关计算
【解析】
K= = =12.5 。
(2)c(N2)=2 mol·L-1,c(H2)=1 mol·L-1,c(NH3)=1 mol·L-1,Qc= =
三、化学平衡常数的有关计算
2.已知:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同温度下,K值如下:
温度/℃ 500 700 900
K 1.00 1.47 2.40
(1)若500 ℃时进行上述反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
(2)方程式中的a______(填“大于”“小于”或“等于”)0。
【课堂练习】
【答案】 (1)1 mol·L-1 (2)大于
三、化学平衡常数的有关计算
【解析】 (1)设500 ℃时,CO的平衡浓度为x mol·L-1,则
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/mol·L-1 2 0
变化/mol·L-1 x x
平衡/mol·L-1 2-x x
则K=c(CO)/c(CO2) =x/2-x=1,解得x=1。
故CO的平衡浓度为1 mol·L-1。
(2)由表格中数据可知,温度越高K值越大,推知温度升高平衡向正反应方向移动,故此反应的正反应为吸热反应,即a大于0。
【课堂练习】
三、化学平衡常数的有关计算
【课堂练习】
3.H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=________。
(2)在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH________0(填“>”“<”或“=”)。
【答案】 (1)2.5 2.8×10-3 (2)> >
三、化学平衡常数的有关计算
【解析】 (1) H2S(g) + CO2(g) COS(g)+ H2O(g)
起始/mol 0.40 0.10 0 0
变化/mol x x x x
平衡/mol 0.40-x 0.10-x x x
由题意得:x/(0.40-x)+(0.10-x)+x+x=0.02,解得:x=0.01
H2S的平衡转化率α1=0.01 mol/0.40 mol×100%=2.5%。
K=c(COS)·c(H2O))/c(H2S)·c(CO2) =1/351 ≈ 2.8×10-3。
(2)温度升高,水的平衡物质的量分数增大,说明升温平衡右移,则H2S的转化率增大,故α2>α1。温度升高,平衡向吸热反应方向移动,故ΔH>0。
【课堂练习】
三、化学平衡常数的有关计算
课堂小结
课堂检测
1.在某温度下,可逆反应aA(g)+bB(g) cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A. 正、逆反应的平衡常数数值相同,符号相反
B. 升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D. 该反应的K=
【解析】反应吸热放热未知,K值变化不能确定;K越大,说明该反应的进行程度越大,转化率越高。
C
2.在淀粉—KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
下列说法正确的是( )
A. 反应I2(aq)+I-(aq) I3-(aq)的ΔH>0
B. 其他条件不变,升高温度,溶液中c(I3-)减小
C. 该反应的平衡常数表达式为K=
D. 25 ℃时,向溶液中加入少量KI固体,平衡常数K大于689
B
【解析】根据题中提供的数据知温度升高,平衡常数减小,正反应为放热反应,H<0;其他条件不变,升高温度,K值减小,溶液中c(I3-)减小;平衡常数只与温度有关,25 ℃时,向溶液中加入少量KI固体,平衡常数不变。
课堂检测
3.某温度下,在密闭容器中进行SO2的催化氧化反应。若起始时c(SO2)=c(O2)=6 mol·L-1,平衡时测得c(O2)=4.5 mol·L-1,则下列叙述中正确的是( )
A. SO2的转化率为60%
B. SO3的产率为60%
C. 平衡时总压强与起始压强之比为7∶8
D. 平衡时v(SO2)∶v(O2)∶v(SO3)=3∶3∶1
C
课堂检测
4.一定条件下,在密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
(1)求反应在该温度下的平衡常数。
(2)若将平衡时体系的压强增大1倍,
试利用平衡常数及有关计算判断
反应向哪个方向进行。
【答案】K=400/21 反应向正反应方向进行
【解析】 2SO2(g)+O2(g) 2SO3(g)
起始浓度/(mol·L-1) 0.4 1 0
变化浓度/(mol·L-1) 0.32 0.16 0.32
平衡浓度/(mol·L-1) 0.08 0.84 0.32
(2)压强增大1倍,即体积缩小1倍,各组分的浓度增大1倍,
Q
5. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)正反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,各物质的平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
T(℃) 700 800 1000
K 0.6 1.0 1.7
【答案】c(CO)·c(H2O)/c(CO2)·c(H2) 吸热 800
课堂检测
再 见
