第二节 反应热的计算 第2课时 优秀课件(共24张PPT)
文档属性
| 名称 | 第二节 反应热的计算 第2课时 优秀课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:54:25 | ||
图片预览








文档简介
(共24张PPT)
第2课时 反应热的计算
第一章 化学反应的热效应 第二节 反应热的计算
一、导入新课
在生产中对于燃料的燃烧、反应条件的控制以及“废热”的利用,需要进行反应热的计算。
二、根据热化学方程式进行计算
1.葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800 kJ·mol-1;葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。
计算:(1)100 g葡萄糖在人体中完全氧化时所产生的热量;
(2)生成18 g水时放出的热量。
【解析】:(1)n(C6H12O6)=m(C6H12O6)/M(C6H12O6)=100 g/180 g·mol-1=0.556 mol
1 mol C6H12O6完全燃烧放出2800 kJ的热量
0.556 mol C6H12O6完全燃烧放出的热量为0.556 mol×2 800 kJ·mol-1=1557 kJ。
(2)18 g水为1 mol,生成6 mol水放热为2 800 kJ,生成1 mol水放热为2800 kJ×1/6=466.67 kJ。
【例题讲解】
二、根据热化学方程式进行计算
【小结】1.热化学方程式的性质:
①热化学方程式可以进行方向改变,方向改变时,反应热数值不变,符号相反。
②热化学方程式中物质的化学计量数和反应热可以同时改变倍数。
③热化学方程式可以叠加,叠加时,物质和反应物同时叠加。
aA(g) + bB(g) = cC(g) + dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) |Q|
则n(A)/a= n(B)/b=n(C)/c=n(D)/d=|Q|/|ΔH|
2.计算依据:反应热的绝对值与各物质的物质的量成正比,依据热化学方程式中的ΔH求反应热。
二、根据热化学方程式进行计算
【例题讲解】
2.25℃、101kPa 时,使1.0钠与足量的氯气反应,生成氯化钠晶体并放出17.87 kJ的热量,求生成4.6 g NaCl的反应热。
【解析】设生成1 mol NaCl的反应热为x。
则1.0 g : 23 g/mol = -17.87 kJ : x x = -411 kJ/mol
钠与氯气的热化学方程式:Na(s)+1/2 Cl2(g) = NaCl(s) ΔH= -411 kJ/mol
4.6 g NaCl的物质的量:4.6g÷23g/mol = 0.2mol
设生成4.6gNaCl的反应热为y
Na(s)+1/2 Cl2(g) = NaCl(s) ΔH= -411kJ/mol
1 mol 411 kJ
0.2 mol y
y=82.2 kJ
三、根据盖斯定律进行计算
3.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ· mol-1、
-1411.0 kJ·mol-1和-1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ· mol-1 B.+44.2 kJ·mol-1
C.-330 kJ· mol-1 D.+330 kJ· mol-1
A
【解析】 由题意可知
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411.0 kJ·mol-1①
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.8 kJ·mol-1②
将上述两个热化学方程式相减①-②,
C2H4(g)-C2H5OH(l)=-H2O(l) ΔH=-1411.0 kJ·mol-1+1366.8 kJ·mol-1=-44.2 kJ·mol-1,整理得:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1。
【例题讲解】
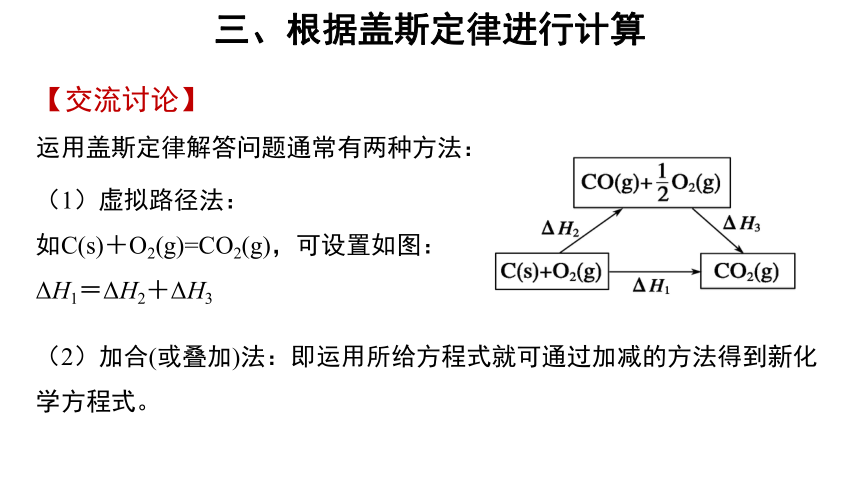
【交流讨论】
运用盖斯定律解答问题通常有两种方法:
(2)加合(或叠加)法:即运用所给方程式就可通过加减的方法得到新化学方程式。
(1)虚拟路径法:
如C(s)+O2(g)=CO2(g),可设置如图:
ΔH1=ΔH2+ΔH3
三、根据盖斯定律进行计算
三、根据盖斯定律进行计算
【例题讲解】
4.用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中,1 mol Cu与1 mol H2O2完全反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于( )
A.-417.91 kJ·mol-1 B.-319.68 kJ·mol-1
B.+546.69 kJ·mol-1 D.-448.46 kJ·mol-1
【解析】 将已知的三个热化学方程式依次编号为①②③,根据盖斯定律,由①+②×1/2+③得热化学方程式Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1。
B
四、根据燃烧热计算
【例题讲解】
5.乙醇的燃烧热ΔH=-1366.8 kJ·mol-1,在25℃、101kPa 时,1kg乙醇充分燃烧后放出多少热量?
【解析】C2H5OH的摩尔质量是46g/mol
1 kg C2H5OH的物质的量=1000g÷46g·mol-1= 21.74 mol
1 kg C2H5OH燃烧后放出热量=1366.8 kJ·mol-1 ×21.74 mol = 29714.23 kJ
四、根据燃烧热计算
【例题讲解】
6.能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)=CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)=CH3OH(l) ΔH=+127.4 kJ·mol-1
C.CO(g)+2H2(g)=CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)=CH3OH(g) ΔH=+127.4 kJ·mol-1
A
四、根据燃烧热计算
【例题讲解】
【解析】 根据题给三种物质的燃烧热可以写出:
H2(g)+1/2 O2(g) = H2O(l) ΔH1=-285.8 kJ·mol-1①
CO(g)+1/2 O2(g) = CO2(g) ΔH2=-282.5 kJ·mol-1②
CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(l) ΔH3=-726.7 kJ·mol-1③
运用盖斯定律进行计算,即①×2+②-③可得:
CO(g)+2H2(g) = CH3OH(l) ΔH=2ΔH1+ΔH2-ΔH3
=2×(-285.8 kJ·mol-1)+(-282.5 kJ·mol-1)-(-726.7 kJ·mol-1)
=-127.4 kJ·mol-1。
五、根据化学键的变化
利用反应物和生成物的键能和计算:
ΔH=反应物的键能和-生成物的键能和
7.化学反应的本质是旧化学健的断裂和新化学键的形成。已知某些化学键的键能数据如下:
则下列热化学方程式不正确的是( )
A.1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
C.1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
化学键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 243 431
C
五、根据化学键的变化
【例题讲解】
解析:1/2H2(g)+1/2Cl2(g)=HCl(g)
ΔH=(436 kJ·mol-1+243 kJ·mol-1)/2-431 kJ·mol-1=-91.5 kJ·mol-1
五、根据化学键的变化
【例题讲解】
8.已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/kJ·mol-1 460 360 436 431 176 347
A.+412 kJ·mol-1 B.-412 kJ·mol-1 C.+236 kJ·mol-1 D.-236 kJ·mol-1
C
【解析】ΔH=4×360 kJ·mol-1+2×436 kJ·mol-1-(2×176 kJ·mol-1+4×431 kJ·mol-1)=+236 kJ·mol-1。
六、反应热大小的比较
【例题讲解】
9.比较下列各组热化学方程式中ΔH的大小。
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+2(1)O2(g)=CO(g) ΔH2 ΔH1 ΔH2;
②H2(g)+1/2O2(g)=H2O(l)ΔH3 2H2(g)+O2(g)=2H2O(l) ΔH4 ΔH3 ΔH4;
③S(s)+O2(g)=SO2(g) ΔH5 S(g)+O2(g)=SO2(g) ΔH6 ΔH5_____ΔH6
<
>
>
【解析】对于①,1 mol C(s)完全燃烧显然比不完全燃烧放出的热量多,对于②,ΔH4=2ΔH3<0,所以ΔH3>ΔH4;
对于③,可以用盖斯定律法:将两式相减得:S(s)=S(g) ΔH=ΔH5-ΔH6>0(固态硫变为气态硫是吸热过程),所以ΔH5>ΔH6 。
六、反应热大小的比较
【交流讨论】比较方法
(1)比较ΔH的大小时,必须把反应热的“+“-”与反应热的数值看作一个整体进行比较;比较反应放出或吸收的热量时只比较数值的大小;比较“燃烧热”“中和热”时,只需比较数值的大小。
(2)反应物的状态、化学计量数不同,则ΔH不同。
(3)ΔH是带符号进行比较的,所有吸热反应的ΔH均比放热反应的ΔH大。放热反应的ΔH<0,放热越多,ΔH越小,但|ΔH|越大。
(4)同一物质,状态不同,反应热亦不同。
(5)对于可逆反应,因反应不能进行到底,实际反应过程中放出或吸收的能量要小于热化学方程式中反应热的数值
七、课堂小结
八、课堂检测
1.已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g H2O(l),并放出114.3 kJ热量,则混合气体中CO的物质的量为( )
A.0.22 mol B.0.15 mol C.0.1 mol D.0.05 mol
C
【解析】
设当生成5.4 g H2O时放出的热量为x
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1
18 g 285.83 kJ
5.4 g x
解得x=85.75 kJ
所以CO燃烧放出的热量为114.3 kJ-85.75 kJ=28.55 kJ。
设CO的物质的量为y,
CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1
1 mol 282.9 kJ
y 28.55 kJ
解得:y=0.1 mol。
八、课堂检测
2.根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
A
【解析】 假设已知三个方程式分别为①、②、③,则①、②相比可知①为H2S完全燃烧的热化学方程式,故放出热量比②多,即Q1>Q2;②、③相比H2O的状态不同,因为等量的水,H2O(l)比H2O(g)能量低,故放出热量Q2>Q3,则有Q1>Q2>Q3。
八、课堂检测
3.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(s,红)+5O2(g) = 2P2O5(s) ΔH1 ②4P(s,白)+5O2(g) = 2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
【解析】由反应①减去反应②可得,4P(s,红)=4P(s,白)
ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2。
B
八、课堂检测
4.白磷与氧气可发生如下反应:P4(白磷,s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
【解析】 反应热ΔH=反应物键能和-生成物总键能和
=6a kJ·mol-1+5d kJ·mol-1-(4c kJ·mol-1+12b kJ·mol-1)
=(6a+5d-4c-12b) kJ·mol-1
八、课堂检测
5.发射卫星时可用气态肼(N2H4)为燃料和二氧化氮(NO2)为氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1①
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1②
1/2 H2(g)+1/2 F2(g)=HF(g) ΔH=-269 kJ·mol-1③
H2(g)+1/2 O2(g) =H2O(g) ΔH=-242 kJ·mol-1④
(1)肼和二氧化氮反应的热化学方程式为
________________________________________ 。
(2)有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大,试写出肼和氟气反应的热化学方程式:_______________________________________________________________。
2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g) ΔH=-1153.7 kJ·mol-1
N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH=-1135 kJ·mol-1
【解析】结合盖斯定律可得反应:(1)②×2-① (2)②+③×4-④×2
八、课堂检测
再 见
第2课时 反应热的计算
第一章 化学反应的热效应 第二节 反应热的计算
一、导入新课
在生产中对于燃料的燃烧、反应条件的控制以及“废热”的利用,需要进行反应热的计算。
二、根据热化学方程式进行计算
1.葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800 kJ·mol-1;葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。
计算:(1)100 g葡萄糖在人体中完全氧化时所产生的热量;
(2)生成18 g水时放出的热量。
【解析】:(1)n(C6H12O6)=m(C6H12O6)/M(C6H12O6)=100 g/180 g·mol-1=0.556 mol
1 mol C6H12O6完全燃烧放出2800 kJ的热量
0.556 mol C6H12O6完全燃烧放出的热量为0.556 mol×2 800 kJ·mol-1=1557 kJ。
(2)18 g水为1 mol,生成6 mol水放热为2 800 kJ,生成1 mol水放热为2800 kJ×1/6=466.67 kJ。
【例题讲解】
二、根据热化学方程式进行计算
【小结】1.热化学方程式的性质:
①热化学方程式可以进行方向改变,方向改变时,反应热数值不变,符号相反。
②热化学方程式中物质的化学计量数和反应热可以同时改变倍数。
③热化学方程式可以叠加,叠加时,物质和反应物同时叠加。
aA(g) + bB(g) = cC(g) + dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) |Q|
则n(A)/a= n(B)/b=n(C)/c=n(D)/d=|Q|/|ΔH|
2.计算依据:反应热的绝对值与各物质的物质的量成正比,依据热化学方程式中的ΔH求反应热。
二、根据热化学方程式进行计算
【例题讲解】
2.25℃、101kPa 时,使1.0钠与足量的氯气反应,生成氯化钠晶体并放出17.87 kJ的热量,求生成4.6 g NaCl的反应热。
【解析】设生成1 mol NaCl的反应热为x。
则1.0 g : 23 g/mol = -17.87 kJ : x x = -411 kJ/mol
钠与氯气的热化学方程式:Na(s)+1/2 Cl2(g) = NaCl(s) ΔH= -411 kJ/mol
4.6 g NaCl的物质的量:4.6g÷23g/mol = 0.2mol
设生成4.6gNaCl的反应热为y
Na(s)+1/2 Cl2(g) = NaCl(s) ΔH= -411kJ/mol
1 mol 411 kJ
0.2 mol y
y=82.2 kJ
三、根据盖斯定律进行计算
3.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ· mol-1、
-1411.0 kJ·mol-1和-1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ· mol-1 B.+44.2 kJ·mol-1
C.-330 kJ· mol-1 D.+330 kJ· mol-1
A
【解析】 由题意可知
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411.0 kJ·mol-1①
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.8 kJ·mol-1②
将上述两个热化学方程式相减①-②,
C2H4(g)-C2H5OH(l)=-H2O(l) ΔH=-1411.0 kJ·mol-1+1366.8 kJ·mol-1=-44.2 kJ·mol-1,整理得:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1。
【例题讲解】
【交流讨论】
运用盖斯定律解答问题通常有两种方法:
(2)加合(或叠加)法:即运用所给方程式就可通过加减的方法得到新化学方程式。
(1)虚拟路径法:
如C(s)+O2(g)=CO2(g),可设置如图:
ΔH1=ΔH2+ΔH3
三、根据盖斯定律进行计算
三、根据盖斯定律进行计算
【例题讲解】
4.用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中,1 mol Cu与1 mol H2O2完全反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于( )
A.-417.91 kJ·mol-1 B.-319.68 kJ·mol-1
B.+546.69 kJ·mol-1 D.-448.46 kJ·mol-1
【解析】 将已知的三个热化学方程式依次编号为①②③,根据盖斯定律,由①+②×1/2+③得热化学方程式Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1。
B
四、根据燃烧热计算
【例题讲解】
5.乙醇的燃烧热ΔH=-1366.8 kJ·mol-1,在25℃、101kPa 时,1kg乙醇充分燃烧后放出多少热量?
【解析】C2H5OH的摩尔质量是46g/mol
1 kg C2H5OH的物质的量=1000g÷46g·mol-1= 21.74 mol
1 kg C2H5OH燃烧后放出热量=1366.8 kJ·mol-1 ×21.74 mol = 29714.23 kJ
四、根据燃烧热计算
【例题讲解】
6.能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ·mol-1、282.5 kJ·mol-1、726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)=CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)=CH3OH(l) ΔH=+127.4 kJ·mol-1
C.CO(g)+2H2(g)=CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)=CH3OH(g) ΔH=+127.4 kJ·mol-1
A
四、根据燃烧热计算
【例题讲解】
【解析】 根据题给三种物质的燃烧热可以写出:
H2(g)+1/2 O2(g) = H2O(l) ΔH1=-285.8 kJ·mol-1①
CO(g)+1/2 O2(g) = CO2(g) ΔH2=-282.5 kJ·mol-1②
CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(l) ΔH3=-726.7 kJ·mol-1③
运用盖斯定律进行计算,即①×2+②-③可得:
CO(g)+2H2(g) = CH3OH(l) ΔH=2ΔH1+ΔH2-ΔH3
=2×(-285.8 kJ·mol-1)+(-282.5 kJ·mol-1)-(-726.7 kJ·mol-1)
=-127.4 kJ·mol-1。
五、根据化学键的变化
利用反应物和生成物的键能和计算:
ΔH=反应物的键能和-生成物的键能和
7.化学反应的本质是旧化学健的断裂和新化学键的形成。已知某些化学键的键能数据如下:
则下列热化学方程式不正确的是( )
A.1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
C.1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
化学键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 243 431
C
五、根据化学键的变化
【例题讲解】
解析:1/2H2(g)+1/2Cl2(g)=HCl(g)
ΔH=(436 kJ·mol-1+243 kJ·mol-1)/2-431 kJ·mol-1=-91.5 kJ·mol-1
五、根据化学键的变化
【例题讲解】
8.已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/kJ·mol-1 460 360 436 431 176 347
A.+412 kJ·mol-1 B.-412 kJ·mol-1 C.+236 kJ·mol-1 D.-236 kJ·mol-1
C
【解析】ΔH=4×360 kJ·mol-1+2×436 kJ·mol-1-(2×176 kJ·mol-1+4×431 kJ·mol-1)=+236 kJ·mol-1。
六、反应热大小的比较
【例题讲解】
9.比较下列各组热化学方程式中ΔH的大小。
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+2(1)O2(g)=CO(g) ΔH2 ΔH1 ΔH2;
②H2(g)+1/2O2(g)=H2O(l)ΔH3 2H2(g)+O2(g)=2H2O(l) ΔH4 ΔH3 ΔH4;
③S(s)+O2(g)=SO2(g) ΔH5 S(g)+O2(g)=SO2(g) ΔH6 ΔH5_____ΔH6
<
>
>
【解析】对于①,1 mol C(s)完全燃烧显然比不完全燃烧放出的热量多,对于②,ΔH4=2ΔH3<0,所以ΔH3>ΔH4;
对于③,可以用盖斯定律法:将两式相减得:S(s)=S(g) ΔH=ΔH5-ΔH6>0(固态硫变为气态硫是吸热过程),所以ΔH5>ΔH6 。
六、反应热大小的比较
【交流讨论】比较方法
(1)比较ΔH的大小时,必须把反应热的“+“-”与反应热的数值看作一个整体进行比较;比较反应放出或吸收的热量时只比较数值的大小;比较“燃烧热”“中和热”时,只需比较数值的大小。
(2)反应物的状态、化学计量数不同,则ΔH不同。
(3)ΔH是带符号进行比较的,所有吸热反应的ΔH均比放热反应的ΔH大。放热反应的ΔH<0,放热越多,ΔH越小,但|ΔH|越大。
(4)同一物质,状态不同,反应热亦不同。
(5)对于可逆反应,因反应不能进行到底,实际反应过程中放出或吸收的能量要小于热化学方程式中反应热的数值
七、课堂小结
八、课堂检测
1.已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g H2O(l),并放出114.3 kJ热量,则混合气体中CO的物质的量为( )
A.0.22 mol B.0.15 mol C.0.1 mol D.0.05 mol
C
【解析】
设当生成5.4 g H2O时放出的热量为x
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1
18 g 285.83 kJ
5.4 g x
解得x=85.75 kJ
所以CO燃烧放出的热量为114.3 kJ-85.75 kJ=28.55 kJ。
设CO的物质的量为y,
CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1
1 mol 282.9 kJ
y 28.55 kJ
解得:y=0.1 mol。
八、课堂检测
2.根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
A
【解析】 假设已知三个方程式分别为①、②、③,则①、②相比可知①为H2S完全燃烧的热化学方程式,故放出热量比②多,即Q1>Q2;②、③相比H2O的状态不同,因为等量的水,H2O(l)比H2O(g)能量低,故放出热量Q2>Q3,则有Q1>Q2>Q3。
八、课堂检测
3.已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(s,红)+5O2(g) = 2P2O5(s) ΔH1 ②4P(s,白)+5O2(g) = 2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
【解析】由反应①减去反应②可得,4P(s,红)=4P(s,白)
ΔH=ΔH1-ΔH2=+18.39 kJ·mol-1×4=+73.56 kJ·mol-1,故ΔH1>ΔH2。
B
八、课堂检测
4.白磷与氧气可发生如下反应:P4(白磷,s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
【解析】 反应热ΔH=反应物键能和-生成物总键能和
=6a kJ·mol-1+5d kJ·mol-1-(4c kJ·mol-1+12b kJ·mol-1)
=(6a+5d-4c-12b) kJ·mol-1
八、课堂检测
5.发射卫星时可用气态肼(N2H4)为燃料和二氧化氮(NO2)为氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1①
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1②
1/2 H2(g)+1/2 F2(g)=HF(g) ΔH=-269 kJ·mol-1③
H2(g)+1/2 O2(g) =H2O(g) ΔH=-242 kJ·mol-1④
(1)肼和二氧化氮反应的热化学方程式为
________________________________________ 。
(2)有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大,试写出肼和氟气反应的热化学方程式:_______________________________________________________________。
2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g) ΔH=-1153.7 kJ·mol-1
N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH=-1135 kJ·mol-1
【解析】结合盖斯定律可得反应:(1)②×2-① (2)②+③×4-④×2
八、课堂检测
再 见
