第三节 盐类的水解 第1课时 课件(共21张PPT)
文档属性
| 名称 | 第三节 盐类的水解 第1课时 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 666.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-16 13:57:27 | ||
图片预览





文档简介
(共21张PPT)
第三节 盐类的水解(第1课时)
第三章 水溶液中的离子反应与平衡
一、导入新课
C5H8NO4Na
NaCl
Na2CO3
NaHCO3
“碱”
Na2CO3 NaHCO3溶液呈碱性
一、导入新课
溶液的酸碱性与c(H+)、c(OH-)有什么关系?
酸性: c(H+) > c(OH-)
中性: c(H+) = c(OH-)
碱性: c(H+) < c(OH-)
复习回顾
Na2CO3、 NaHCO3溶液呈碱性
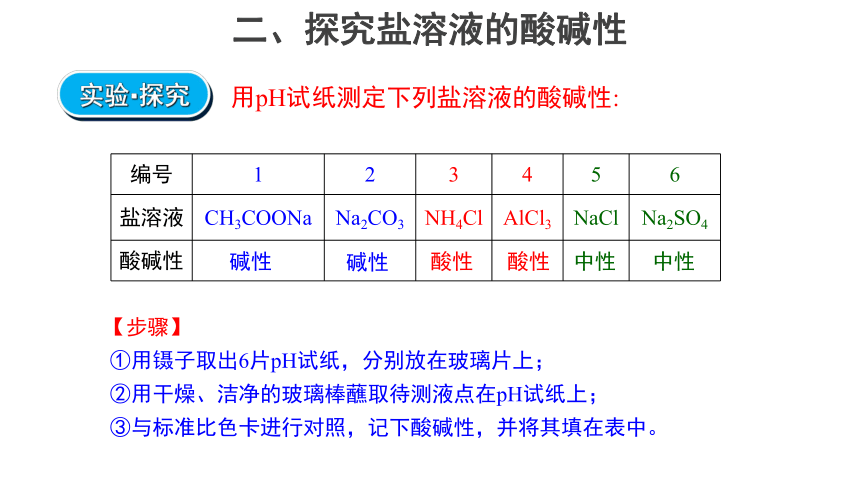
二、探究盐溶液的酸碱性
用pH试纸测定下列盐溶液的酸碱性:
编号 1 2 3 4 5 6
盐溶液 CH3COONa Na2CO3 NH4Cl AlCl3 NaCl Na2SO4
酸碱性
中性
中性
酸性
酸性
碱性
碱性
【步骤】
①用镊子取出6片pH试纸,分别放在玻璃片上;
②用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上;
③与标准比色卡进行对照,记下酸碱性,并将其填在表中。
实验·探究
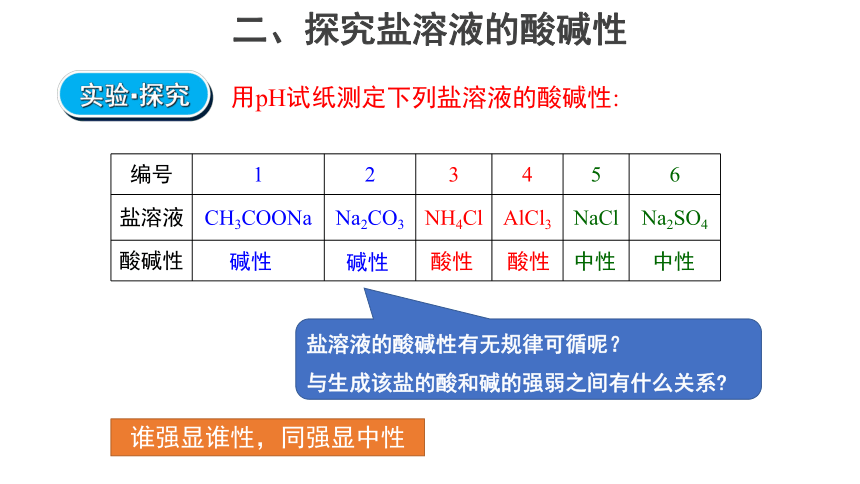
二、探究盐溶液的酸碱性
用pH试纸测定下列盐溶液的酸碱性:
编号 1 2 3 4 5 6
盐溶液 CH3COONa Na2CO3 NH4Cl AlCl3 NaCl Na2SO4
酸碱性
中性
中性
酸性
酸性
碱性
碱性
实验·探究
谁强显谁性,同强显中性
盐溶液的酸碱性有无规律可循呢?
与生成该盐的酸和碱的强弱之间有什么关系
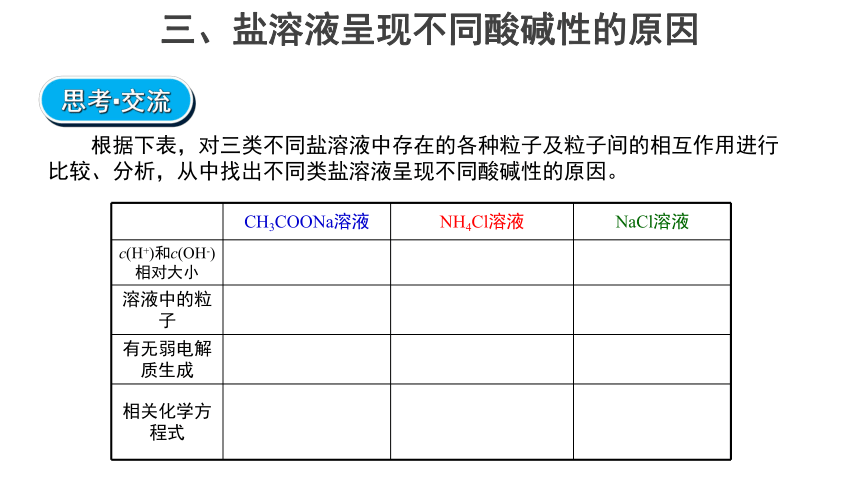
三、盐溶液呈现不同酸碱性的原因
思考·交流
根据下表,对三类不同盐溶液中存在的各种粒子及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
CH3COONa溶液 NH4Cl溶液 NaCl溶液
c(H+)和c(OH-)相对大小
溶液中的粒子
有无弱电解质生成
相关化学方程式
三、盐溶液呈现不同酸碱性的原因
CH3COONa溶液为什么显碱性
(1)CH3COONa溶液中存在哪些电离过程?有哪些离子?
(2)电离出的离子间是否会发生离子反应?若能试着用离子方程式表示这一反应的过程。
(3)结果对水的电离平衡有何影响?对溶液的酸碱性有何影响?
思考·交流
三、盐溶液呈现不同酸碱性的原因
CH3COONa = CH3COO- + Na+
分析CH3COONa水溶液中的有关变化
H2O H+ + OH-
CH3COOH
+
c(OH-)>c(H+)
CH3COO- + H2O CH3COOH + OH-
CH3COONa + H2O CH3COOH + NaOH
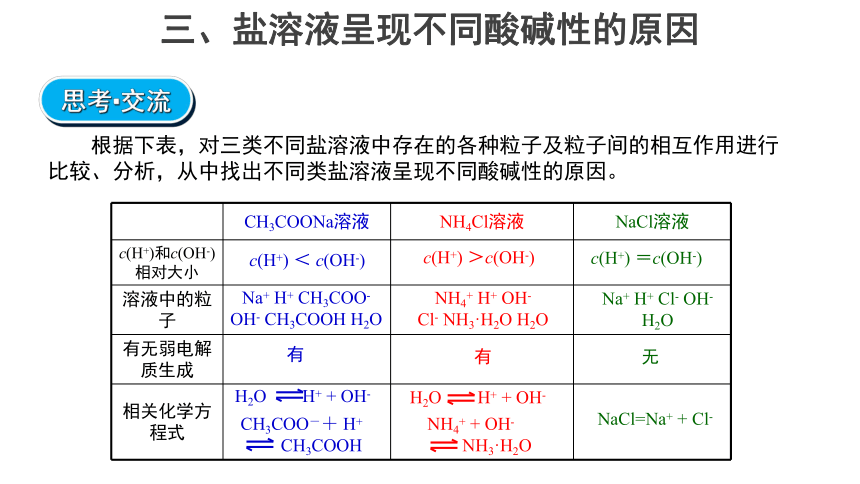
三、盐溶液呈现不同酸碱性的原因
思考·交流
根据下表,对三类不同盐溶液中存在的各种粒子及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
CH3COONa溶液 NH4Cl溶液 NaCl溶液
c(H+)和c(OH-)相对大小
溶液中的粒子
有无弱电解质生成
相关化学方程式
c(H+) =c(OH-)
c(H+) >c(OH-)
Na+ H+ CH3COO-
OH- CH3COOH H2O
NH4+ H+ OH-
Cl- NH3·H2O H2O
H2O H+ + OH-
CH3COO-+ H+
CH3COOH
H2O H+ + OH-
NH4+ + OH-
NH3·H2O
Na+ H+ Cl- OH- H2O
NaCl=Na+ + Cl-
有
无
c(H+) < c(OH-)
有
四、盐类的水解
在溶液中,盐电离出来的弱酸阴离子或弱碱阳离子跟水所电离出来的H+或OH-结合生成弱电解质(弱酸、弱碱)的反应。
1.定义:
思考·交流
什么是盐类的水解?
哪些盐会水解
盐类水解的本质?
盐类水解的特点是什么?
四、盐类的水解
盐
H2O
弱酸阴离子
或
弱碱阳离子
H+ + OH-
弱酸
弱碱
盐溶液呈碱性
盐溶液呈酸性
C(OH-)>C(H+ )
C(H+ ) > C(OH-)
盐类的水解的原理
四、盐类的水解
各类盐溶液性质比较
盐类 实例 能否水解 引起水解的离子 对水的电离平衡的影响 溶液的酸碱性
强碱弱酸盐 Na2CO3
强酸弱碱盐 AlCl3
强酸强碱盐 NaCl
CO32-
能
能
不能
Al3+
无
促进水的电离
促进水的电离
无
碱性
酸性
中性
交流·研讨
四、盐类的水解
2.实质:
盐与水反应生成弱电解质,促进水的电离
3.特点 :
微弱
可逆
吸热
四、盐类的水解
弱酸弱碱盐能否水解?若能水解,弱酸弱碱盐溶液的酸碱性如何确定?说明理由。
交流·研讨
弱酸弱碱盐能水解,其溶液的酸碱性由弱酸根和弱碱根水解程度的相对强弱来决定。
四、盐类的水解
4.水解的规律:
有弱才水解,无弱不水解,
谁强显谁性,同强显中性,都弱都水解,越弱越水解。
Na2CO3溶液显碱性,是如何水解的?
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
思考·交流
四、盐类的水解
书写盐类水解方程式时需要注意:
⑴一般盐类水解程度很小,要用“ ”号连接, 不标“↑”或“↓”。
⑵多元弱酸盐的水解分步写,以第一步为主;多元弱碱阳离子的水解一步写完。
⑶能彻底水解的离子组,由于水解趋于完全,书写时要用“ ”并且要标“↑”和“↓”。
四、盐类的水解
盐的水解也是离子反应,在认识水解反应原理的基础上,你对复分解类离子反应发生的条件有无新的认识?
生成沉淀、气体、弱电解质(弱酸、弱碱和水)
思考·交流
五、课堂小结
一、探究盐溶液的酸碱性
二、盐溶液呈现不同酸碱性的原因
三、盐类的水解
定义
实质
特点
规律
方程式的书写
六、课堂练习
1.有关盐类的水解,下列叙述正确的是( )
A. 盐的电离平衡被破坏
B. 水的电离平衡被破坏
C. 没有中和反应发生
D. 溶液的pH值一定变大
B
六、课堂练习
2.能使水的电离平衡向电离方向移动,并使溶液中的c (H+)>c(OH-)的措施( )
A. 向纯水中加入几滴稀盐酸
B. 将水加热煮沸
C. 向水中加入碳酸钠
D. 向水中加入氯化铵
D
再 见
第三节 盐类的水解(第1课时)
第三章 水溶液中的离子反应与平衡
一、导入新课
C5H8NO4Na
NaCl
Na2CO3
NaHCO3
“碱”
Na2CO3 NaHCO3溶液呈碱性
一、导入新课
溶液的酸碱性与c(H+)、c(OH-)有什么关系?
酸性: c(H+) > c(OH-)
中性: c(H+) = c(OH-)
碱性: c(H+) < c(OH-)
复习回顾
Na2CO3、 NaHCO3溶液呈碱性
二、探究盐溶液的酸碱性
用pH试纸测定下列盐溶液的酸碱性:
编号 1 2 3 4 5 6
盐溶液 CH3COONa Na2CO3 NH4Cl AlCl3 NaCl Na2SO4
酸碱性
中性
中性
酸性
酸性
碱性
碱性
【步骤】
①用镊子取出6片pH试纸,分别放在玻璃片上;
②用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上;
③与标准比色卡进行对照,记下酸碱性,并将其填在表中。
实验·探究
二、探究盐溶液的酸碱性
用pH试纸测定下列盐溶液的酸碱性:
编号 1 2 3 4 5 6
盐溶液 CH3COONa Na2CO3 NH4Cl AlCl3 NaCl Na2SO4
酸碱性
中性
中性
酸性
酸性
碱性
碱性
实验·探究
谁强显谁性,同强显中性
盐溶液的酸碱性有无规律可循呢?
与生成该盐的酸和碱的强弱之间有什么关系
三、盐溶液呈现不同酸碱性的原因
思考·交流
根据下表,对三类不同盐溶液中存在的各种粒子及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
CH3COONa溶液 NH4Cl溶液 NaCl溶液
c(H+)和c(OH-)相对大小
溶液中的粒子
有无弱电解质生成
相关化学方程式
三、盐溶液呈现不同酸碱性的原因
CH3COONa溶液为什么显碱性
(1)CH3COONa溶液中存在哪些电离过程?有哪些离子?
(2)电离出的离子间是否会发生离子反应?若能试着用离子方程式表示这一反应的过程。
(3)结果对水的电离平衡有何影响?对溶液的酸碱性有何影响?
思考·交流
三、盐溶液呈现不同酸碱性的原因
CH3COONa = CH3COO- + Na+
分析CH3COONa水溶液中的有关变化
H2O H+ + OH-
CH3COOH
+
c(OH-)>c(H+)
CH3COO- + H2O CH3COOH + OH-
CH3COONa + H2O CH3COOH + NaOH
三、盐溶液呈现不同酸碱性的原因
思考·交流
根据下表,对三类不同盐溶液中存在的各种粒子及粒子间的相互作用进行比较、分析,从中找出不同类盐溶液呈现不同酸碱性的原因。
CH3COONa溶液 NH4Cl溶液 NaCl溶液
c(H+)和c(OH-)相对大小
溶液中的粒子
有无弱电解质生成
相关化学方程式
c(H+) =c(OH-)
c(H+) >c(OH-)
Na+ H+ CH3COO-
OH- CH3COOH H2O
NH4+ H+ OH-
Cl- NH3·H2O H2O
H2O H+ + OH-
CH3COO-+ H+
CH3COOH
H2O H+ + OH-
NH4+ + OH-
NH3·H2O
Na+ H+ Cl- OH- H2O
NaCl=Na+ + Cl-
有
无
c(H+) < c(OH-)
有
四、盐类的水解
在溶液中,盐电离出来的弱酸阴离子或弱碱阳离子跟水所电离出来的H+或OH-结合生成弱电解质(弱酸、弱碱)的反应。
1.定义:
思考·交流
什么是盐类的水解?
哪些盐会水解
盐类水解的本质?
盐类水解的特点是什么?
四、盐类的水解
盐
H2O
弱酸阴离子
或
弱碱阳离子
H+ + OH-
弱酸
弱碱
盐溶液呈碱性
盐溶液呈酸性
C(OH-)>C(H+ )
C(H+ ) > C(OH-)
盐类的水解的原理
四、盐类的水解
各类盐溶液性质比较
盐类 实例 能否水解 引起水解的离子 对水的电离平衡的影响 溶液的酸碱性
强碱弱酸盐 Na2CO3
强酸弱碱盐 AlCl3
强酸强碱盐 NaCl
CO32-
能
能
不能
Al3+
无
促进水的电离
促进水的电离
无
碱性
酸性
中性
交流·研讨
四、盐类的水解
2.实质:
盐与水反应生成弱电解质,促进水的电离
3.特点 :
微弱
可逆
吸热
四、盐类的水解
弱酸弱碱盐能否水解?若能水解,弱酸弱碱盐溶液的酸碱性如何确定?说明理由。
交流·研讨
弱酸弱碱盐能水解,其溶液的酸碱性由弱酸根和弱碱根水解程度的相对强弱来决定。
四、盐类的水解
4.水解的规律:
有弱才水解,无弱不水解,
谁强显谁性,同强显中性,都弱都水解,越弱越水解。
Na2CO3溶液显碱性,是如何水解的?
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
思考·交流
四、盐类的水解
书写盐类水解方程式时需要注意:
⑴一般盐类水解程度很小,要用“ ”号连接, 不标“↑”或“↓”。
⑵多元弱酸盐的水解分步写,以第一步为主;多元弱碱阳离子的水解一步写完。
⑶能彻底水解的离子组,由于水解趋于完全,书写时要用“ ”并且要标“↑”和“↓”。
四、盐类的水解
盐的水解也是离子反应,在认识水解反应原理的基础上,你对复分解类离子反应发生的条件有无新的认识?
生成沉淀、气体、弱电解质(弱酸、弱碱和水)
思考·交流
五、课堂小结
一、探究盐溶液的酸碱性
二、盐溶液呈现不同酸碱性的原因
三、盐类的水解
定义
实质
特点
规律
方程式的书写
六、课堂练习
1.有关盐类的水解,下列叙述正确的是( )
A. 盐的电离平衡被破坏
B. 水的电离平衡被破坏
C. 没有中和反应发生
D. 溶液的pH值一定变大
B
六、课堂练习
2.能使水的电离平衡向电离方向移动,并使溶液中的c (H+)>c(OH-)的措施( )
A. 向纯水中加入几滴稀盐酸
B. 将水加热煮沸
C. 向水中加入碳酸钠
D. 向水中加入氯化铵
D
再 见
